Investigamos los factores del síndrome de apneas-hipopneas durante el sueño (SAHS) que activan los mecanismos de riesgo cardiovascular, a través del estudio de las concentraciones plasmáticas del fragmento N-terminal del precursor del péptido natriurético cerebral (NTproBNP) y de la proteína C reactiva de alta sensibilidad (PCRas), así como el efecto que sobre ellos tiene el tratamiento con presión positiva continua de la vía aérea nasal (CPAPn).
Pacientes y métodosSe estudió a 42 pacientes con SAHS (leve-moderado en 15 casos y grave en 27), comparados con 14 personas sin SAHS. No tomaban fármacos ni presentaban diabetes, hipertensión, dislipemia importante o enfermedad cardiovascular, que se descartó tanto clínicamente como por ecocardiografía y tomografía computarizada por emisión de fotón cínico-esfuerzo con 99mTc-tetrofosmina. En los pacientes con SAHS grave se estudiaron los efectos de 6 meses con CPAPn.
ResultadosAjustando por edad, índice de masa corporal y tabaquismo, las medias de los biomarcadores no fueron significativamente más altas en los pacientes con SAHS grave que en aquéllos con SAHS leve-moderado o en los controles. Sin embargo, en los pacientes con SAHS el principal factor que influyó en las concentraciones de NTproBNP fue el porcentaje de tiempo con saturación arterial de oxígeno nocturna menor del 90% (r=0,37; p=0,017), sin que se encontrara ningún predictor de los valores séricos de la PCRas. La aplicación de CPAPn hizo descender, pero no significativamente, las concentraciones de los biomarcadores.
ConclusionesMientras que la hipoxemia nocturna en el SAHS es la responsable de las variaciones en los valores del NTproBNP, derivado de la afectación cardíaca, el SAHS no parece estar asociado con el biomarcador inflamatorio PCRas, cuando se excluye a los pacientes con alteraciones cardíacas, factores de riesgo cardiovascular o en tratamiento farmacológico.
In this study, we assessed factors associated with cardiovascular risk in patients with sleep apnea-hypopnea syndrome (SAHS) through analysis of plasma concentrations of N-terminal prohormone brain natriuretic peptide (NTproBNP) and high-sensitivity C-reactive protein (hsCRP). In addition, we analyzed the effect of nasal continuous positive airway pressure (nCPAP) on these markers.
Patients and methodsForty-two patients with SAHS (mild to moderate in 15 cases and severe in 27) were compared with 14 individuals without SAHS. The participants were not receiving drug treatment and they did not have diabetes, hypertension, marked dyslipidemia, or cardiovascular disease, which was ruled out both clinically and by echocardiography and 99mTc-tetrofosmin scintigraphy at rest and during exercise. The effects of nCPAP in patients with severe SAHS were analyzed after 6 months of treatment.
ResultsFollowing adjustment for age, body mass index, and smoking habit, the mean concentrations of markers were not significantly higher in patients with severe SAHS than in those with mild-to-moderate SAHS or in control subjects. Nevertheless, in patients with SAHS the main factor influencing NTproBNP concentrations was the percentage of time with a nocturnal arterial oxygen saturation of less then 90% (r=0.37, P=.017). No variables predictive of hsCRP concentration were identified. The concentrations of the markers were reduced by nCPAP, but the differences were not statistically significant.
ConclusionsWhile nocturnal hypoxemia in SAHS is responsible for variations in the plasma concentration of NTproBNP (as a result of cardiovascular changes), SAHS appears not to be associated with the inflammatory marker hsCRP when patients with heart disease, cardiovascular risk factors, or those receiving pharmacologic treatment are excluded.
El síndrome de apneas-hipopneas durante el sueño (SAHS) se asocia a un incremento de la morbimortalidad cardiovascular1. Sin embargo, muchos factores de riesgo del SAHS, como el sexo masculino, la edad avanzada y, en particular, la obesidad, son compartidos con la enfermedad cardiovascular, lo que hace difícil reconocer el papel del SAHS como un factor de riesgo independiente. Cuando estos factores se tienen en cuenta, tal incremento del riesgo es menor2. Actualmente sólo está bien establecida la asociación con la hipertensión arterial sistémica3. Sin embargo, las alteraciones cardiovasculares son las complicaciones más importantes. Es creciente la evidencia de que el SAHS afecta a la función ventricular izquierda4. Los pacientes con insuficiencia cardíaca diastólica y trastornos respiratorios del sueño presentan una peor disfunción diastólica que aquéllos sin dichos trastornos. Fung et al5 mostraron que el 36,8% de los pacientes con SAHS presentaba disfunción diastólica. Además, Arias et al6 publicaron que el SAHS puede afectar a la función ventricular diastólica izquierda independientemente de otros posibles factores.
Estudios clínicos han demostrado que el péptido natriurético tipo B (BNP) y su precursor, el proBNP, son biomarcadores de disfunción ventricular izquierda y de su pronóstico7,8, facilitan el diagnóstico de insuficiencia cardíaca9 y pueden usarse para sospechar la presencia de isquemia miocárdica silente10 y otros fenómenos isquémicos agudos11. El proBNP se segrega sobre todo en el ventrículo y, en este proceso, se desdobla en BNP (77–108) fisiológicamente activo y en el fragmento Nterminal o NTproBNP (1–76), que, aunque deriven de un precursor común, son muy diferentes en muchos aspectos. El NTproBNP no es biológicamente activo y, por lo tanto, no activa los mecanismos de aclaramiento, por lo que su vida media es aproximadamente de 60-120 min y es mucho más estable que el BNP, lo que viene a implicar una menor variación en un mismo paciente. Además, puede recogerse en tubos de muestra sin ningún requisito y su análisis tiene más sensibilidad que el del BNP en determinados procesos12.
Por otra parte, la proteína C reactiva (PCR) es un marcador no específico de inflamación. Varios estudios indican que es un importante predictor de riesgo en la arteriosclerosis y la enfermedad coronaria13. También se ha publicado que sus valores están elevados en pacientes con SAHS14 y que se correlacionan de forma positiva con la gravedad de éste15. Si la obesidad y el SAHS se consideran procesos inflamatorios, como se evidencia por las elevadas concentraciones de marcadores séricos de inflamación sistémica, es importante plantearse si en los pacientes con obesidad central los valores altos de PCR serían consecuencia de la obesidad o del SAHS16.
Los objetivos de este estudio han sido los siguientes: evaluar si los títulos de NTproBNP y PCR están elevados en pacientes con SAHS, ya que desde el punto de vista fisiopatológico éste puede provocar disfunción ventricular izquierda y se asocia a procesos inflamatorios; determinar los factores o predictores asociados a estos incrementos; identificar los factores que son variables independientes de las concentraciones de NTproBNP y PCR, y comprobar si el tratamiento consigue que desciendan los valores de estos biomarcadores, lo que permitiría mejorar tanto la afectación ventricular como la respuesta inflamatoria y, de este modo, disminuir el riesgo de mortalidad cardiovascular en estos pacientes. Está por determinar si los mecanismos de riesgo cardiovascular en el SAHS se activan como consecuencia del índice de apneas-hipopneas, de la magnitud de la hipoxemia o del número de microdespertares (arousals).
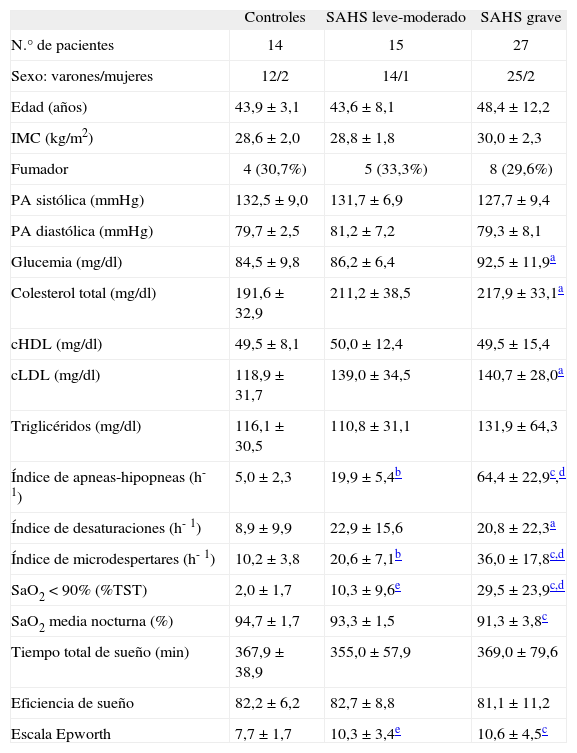
Pacientes y métodosPacientesSe admitió de forma consecutiva a 42 pacientes con nuevo diagnóstico de SAHS y a 14 controles (tabla I). Todos los pacientes con SAHS procedían de nuestra Unidad de Sueño, adonde se les había remitido desde las consultas por sospecha de dicho síndrome, que se diagnosticó mediante polisomnografía. Después de conseguir la población de estudio, se buscó a individuos sanos del personal de nuestro hospital, emparejados con aquéllos por edad, sexo e índice de masa corporal (IMC), sin síntomas de SAHS, se les examinó mediante polisomnografía convencional y se les clasificó como controles según el índice de apneas-hipopneas (IAH). A todos se les realizó anamnesis completa, con encuesta sobre hábitos tabáquicos. Antes de entrar en el estudio firmaron un consentimiento informado. El estudio fue aprobado por el comité ético del hospital.
Características de los sujetos estudiados
| Controles | SAHS leve-moderado | SAHS grave | |
| N.° de pacientes | 14 | 15 | 27 |
| Sexo: varones/mujeres | 12/2 | 14/1 | 25/2 |
| Edad (años) | 43,9 ±3,1 | 43,6 ±8,1 | 48,4 ± 12,2 |
| IMC (kg/m2) | 28,6 ±2,0 | 28,8 ± 1,8 | 30,0 ± 2,3 |
| Fumador | 4 (30,7%) | 5 (33,3%) | 8 (29,6%) |
| PA sistólica (mmHg) | 132,5 ± 9,0 | 131,7 ±6,9 | 127,7 ± 9,4 |
| PA diastólica (mmHg) | 79,7 ± 2,5 | 81,2 ±7,2 | 79,3 ± 8,1 |
| Glucemia (mg/dl) | 84,5 ± 9,8 | 86,2 ± 6,4 | 92,5 ± 11,9a |
| Colesterol total (mg/dl) | 191,6 ±32,9 | 211,2 ±38,5 | 217,9 ± 33,1a |
| cHDL (mg/dl) | 49,5 ±8,1 | 50,0 ± 12,4 | 49,5 ± 15,4 |
| cLDL (mg/dl) | 118,9 ±31,7 | 139,0 ±34,5 | 140,7 ± 28,0a |
| Triglicéridos (mg/dl) | 116,1 ±30,5 | 110,8 ±31,1 | 131,9 ±64,3 |
| Índice de apneas-hipopneas (h-1) | 5,0 ± 2,3 | 19,9 ± 5,4b | 64,4 ± 22,9c,d |
| Índice de desaturaciones (h-1) | 8,9 ± 9,9 | 22,9 ± 15,6 | 20,8 ± 22,3a |
| Índice de microdespertares (h-1) | 10,2 ±3,8 | 20,6 ± 7,1b | 36,0 ± 17,8c,d |
| SaO2 < 90% (%TST) | 2,0 ± 1,7 | 10,3 ± 9,6e | 29,5 ± 23,9c,d |
| SaO2 media nocturna (%) | 94,7 ± 1,7 | 93,3 ± 1,5 | 91,3 ±3,8c |
| Tiempo total de sueño (min) | 367,9 ± 38,9 | 355,0 ±57,9 | 369,0 ± 79,6 |
| Eficiencia de sueño | 82,2 ± 6,2 | 82,7 ± 8,8 | 81,1 ± 11,2 |
| Escala Epworth | 7,7 ± 1,7 | 10,3 ± 3,4e | 10,6 ±4,5c |
Los valores se expresan como media ± desviación estándar o número de pacientes (porcentaje) para datos paramétricos o categorías, respectivamente. cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; IMC: índice de masa corporal; PA: presión arterial; SAHS: síndrome de apneas-hipopneas durante el sueño; SaO2: saturación arterial de oxígeno; SaO2 < 90%: porcentaje de tiempo en que la SaO2 fue < 90%; TST: tiempo total de sueño.
El criterio de inclusión para los pacientes con SAHS fue un IAH de 10 h-1 o mayor, y para los controles sanos, un IAH menor de 10 h-1 y puntuación en la escala de somnolencia de Epworth (ESE) menor de 10. Los criterios de exclusión para los 2 grupos estudiados fueron los siguientes: a) no estar dispuesto o inhabilitado para someterse a los procedimientos diagnósticos; b) uso actual de medicación; c) enfermedad pulmonar obstructiva o restrictiva; d) hipoxemia o hipercapnia diurnas; e) alteraciones del ritmo cardíaco; f) historia médica de hipertensión (presión arterial ≥ 140/80 mmHg) y/o dislipemia moderada-grave (colesterol ≥ 239 mg/dl; triglicéridos ≥ 400 mg/dl); g) diabetes mellitus; h) obesidad mórbida (IMC ≥ 40 kg/m5); i) cualquier grado de disfunción hepática o renal, y j) fracción de eyección del ventrículo izquierdo inferior al 50%, cardiopatía isquémica o valvular, miocardiopatía, enfermedad pericárdica o accidente cerebrovascular, diagnosticados por anamnesis y exploración física, electrocardiograma, radiografía torácica, ecocardiograma, ergometría convencional y gammagrafía en reposo y máximo esfuerzo con 99mTc-tetrofosmina. Los criterios para retirar del estudio a los pacientes admitidos fueron: a) agravamiento de la clínica que hiciera cambiar el tratamiento; b) ingreso hospitalario, y c) media de cumplimiento del tratamiento con presión positiva continua de la vía aérea nasal (CPAPn) menor de 4 h.
A todos los sujetos incluidos en el estudio se les efectuaron las exploraciones y los procedimientos diagnósticos protocolizados. A los que cumplían los 9 primeros criterios y dieron su consentimiento se les realizaron ecocardiograma, ergometría y gammagrafía con 99mTc-tetrofosmina para descartar a aquellos que presentaran alteraciones cardíacas de cualquier grado (valvulopatías, miocardiopatías, disfunciones ventriculares, derrame pericárdico, insuficiencia cardíaca o isquemia miocárdica silente). Finalmente se practicó una polisomnografía a los miembros del grupo objeto de estudio.
Para la polisomnografía diagnóstica completa se utilizó un polisomnógrafo Medicid 4 (Neuronic, Zaragoza, España). Los estadios de sueño y los eventos respiratorios se analizaron manualmente siguiendo los criterios estándar internacionales17,18. Un IAH igual o mayor de 10 y menor de 20 definía el SAHS leve; igual o mayor de 20 e inferior a 30, SAHS moderado, e igual o mayor de 30, SAHS grave. De los 42 pacientes, 15 se diagnosticaron de SAHS leve-moderado y 27 de SAHS grave. Se empleó la versión española validada de la ESE para cuantificar subjetivamente el grado de somnolencia19. Después de la polisomnografía se les extrajo una muestra de sangre venosa a las 8.00 h para realizar múltiples determinaciones, entre ellas las concentraciones de proBNP y PCRas.
En este estudio prospectivo, los pacientes con SAHS grave y síntomas diurnos recibieron CPAPn efectiva con equipos SoloTM CPAP System de Respironics (Respironics, California, Estados Unidos) durante 6 meses, tras efectuar una polisomnografía de titulación durante toda una noche, en la que inicialmente la CPAPn se colocó a 4 cmH2O; una vez aparecidos los eventos respiratorios, se subió la presión 1 cm cada 2–5 min, hasta alcanzar la presión óptima que los normalizara y mejorara la arquitectura del sueño, lo que se comprobó también en la fase REM y en supino. Después de 2–3 h se redujo paulatinamente la presión hasta conseguir la mínima presión efectiva. Los pacientes recibieron instrucciones detalladas sobre el uso de la CPAPn y se corroboró el cumplimiento objetivo mediante contador horario.
Durante este tiempo se mantuvo contacto con los pacientes para resolver cualquier posible problema o efectos no deseados (particularmente fugas), se aseguró que la mascarilla era apropiada y se comprobó mensualmente que no había variaciones en cuanto al IMC, tabaco o aparición de nuevos signos clínicos. El cumplimiento se consideró aceptable si el paciente utilizaba la CPAPn como mínimo 4 h por noche durante un 75% o más de las noches. Al cabo de 6 meses se les realizó de nuevo la ESE y se obtuvo una nueva muestra de sangre, en las mismas condiciones que la primera.
Análisis del propéptido natriurético cerebral N-terminal y de la proteína C reactiva de alta sensibilidadTodos los sujetos se acostaron a las 23.00 h y se les despertó a las 8.00. Las muestras de sangre venosa periférica se tomaron a las 8.00, antes de levantarse, después del registro de polisomnografía, en tubos estándar (Li¿ y NH+4 heparina) y se almacenaron a −80 °C hasta su análisis. Las concentraciones de NTproBNP se determinaron mediante el método de inmunoanálisis Elecsys proBNP para el analizador Roche Elecsys 2010 (Roche Diagnosis, Mannheim, Alemania). Este inmunoanálisis de electroquimioluminiscencia ECLIA contiene anticuerpos monoclonales que reconocen los epítopes situados en el tramo N-terminal (1–76) del proBNP (1–108), por medio de una técnica en sándwich de 2 pasos con micropartículas recubiertas de estreptavidina, que permite detectar concentraciones de como mínimo 5,0 pg/ml. La precisión intraanálisis fue del 1,8%, y el factor de conversión: pg/ml × 0,118 = pmol/l.
Las concentraciones plasmáticas de la PCRas se midieron con una prueba inmunoturbidimétrica potenciada con micropartículas de látex (Tinaquant test) en el analizador automático Roche/Hitachi 717 (Boehringer-Mannheim, Mannheim, Alemania), que permite un límite de detección de 0,003 mg/dl. Los coeficientes de variación intra e interanálisis fueron del 1,3 y el 5,7%, respectivamente. Al comparar este tipo de determinación de PCRas con un método nefelométrico se obtuvo un coeficiente de correlación de 0,996. El factor de conversión fue: mg/dl × 0,01 = g/l.
Análisis estadísticoLos resultados de las variables cuantitativas se expresan como media y desviación estándar, y los de las cualitativas como porcentaje. La significación de las diferencias entre grupos se analizó con la prueba de la U de Mann–Whitney, mientras que la prueba de la χ2 se usó para comparar proporciones. El supuesto de normalidad de los grupos de variables se comprobó con la prueba de Kolmogorov-Smirnov. Las concentraciones de NTproBNP y PCRas entre los 3 grupos se evaluaron mediante el análisis de la variancia (ANOVA) y se aplicó la corrección de Bonferroni para múltiples comparaciones. El grado de correlación se analizó con el coeficiente de Pearson. Para valorar la fuerza relativa de asociación de las concentraciones de NTproBNP y PCRas con los posibles factores contribuyentes, se aplicó un análisis de regresión múltiple de los pacientes con SAHS como grupo único. Se aplicó la prueba de la t de Student para datos emparejados en las comparaciones de los biomarcadores antes y después del tratamiento con CPAPn. Los análisis estadísticos se realizaron con el programa SPSS versión 14.0 (SPSS Inc., Chicago, IL, EE.UU.). Se consideraron significativos los valores de p < 0,05.
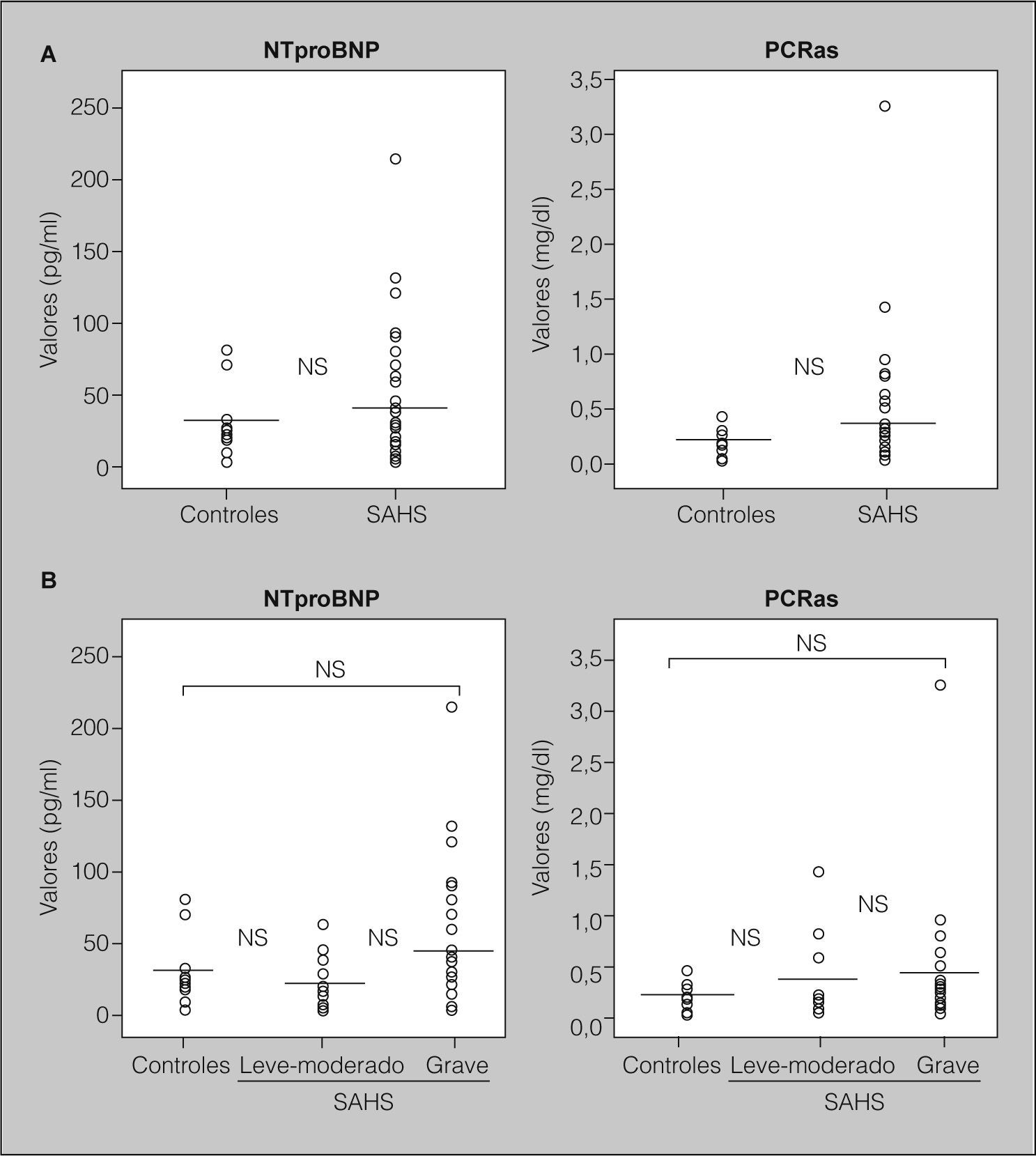
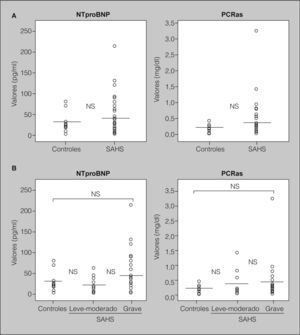
ResultadosDespués de ajustar por IMC, edad y hábito tabáquico, las concentraciones medias de NTproBNP no fueron significativamente diferentes entre los 3 grupos (ANOVA, p = 0,174). Los valores séricos de NTproBNP no fueron significativamente más altos en los pacientes con SAHS (media ± desviación estándar: 38,28 ± 43,71 pg/ml) que en los controles (31,7 ± 25,1 pg/ml; p = 0,597) (fig. 1A). Tampoco los títulos de NTproBNP fueron significativamente más elevados en los pacientes con SAHS grave (46,50 ± 51,70 pg/ml) que en los controles (31,7 ± 25,1 pg/ml; p = 0,321) o que en pacientes con SAHS levemoderado (23,49 ± 16,34 pg/ml; p = 0,103) (fig. 1B).
Valores séricos de propéptido natriurético cerebral N-terminal (NTproBNP) y de proteína C reactiva de alta sensibilidad (PCRas). A) Concentraciones séricas de NTproBNP y PCRas en controles (n = 14) y pacientes con síndrome de apneas-hipopneas durante el sueño (SAHS; n = 42). B) Concentraciones séricas de NTproBNP y PCRas en controles (n = 14) y pacientes con SAHS leve-moderado (n = 15) y pacientes con SAHS grave (n = 27). NS: diferencias no significativas. Las líneas que cruzan las columnas de puntos representan los valores de la media.
Tampoco las concentraciones de PCRas fueron significativamente diferentes entre los 3 grupos (ANOVA, p = 0,491). No fueron significativamente más altas en los pacientes con SAHS (0,39 ± 0,56 mg/dl) que en los controles (0,20 ± 0,12 mg/dl; p = 0,235) (fig. 1A). Tampoco fueron significativamente más elevadas en pacientes con SAHS grave (0,39 ± 0,61 mg/dl) que en los controles (0,20 ± 0,12 mg/dl; p = 0,257) o que en pacientes con SAHS leve-moderado (0,37 ± 0,47 mg/dl; p = 0,894) (fig. 1B).
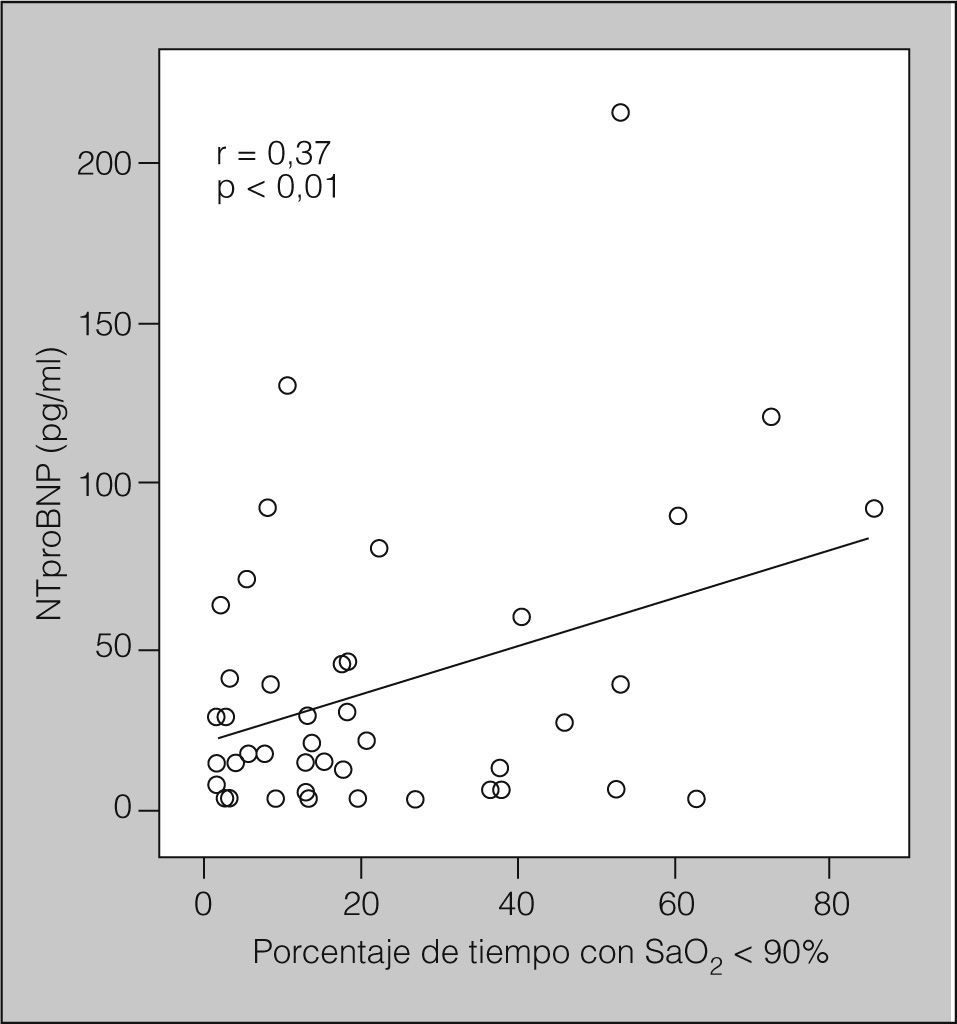
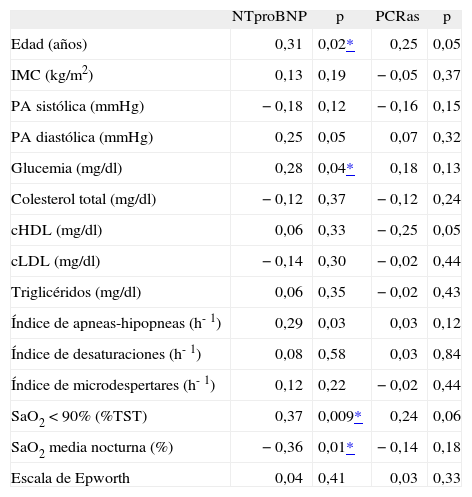
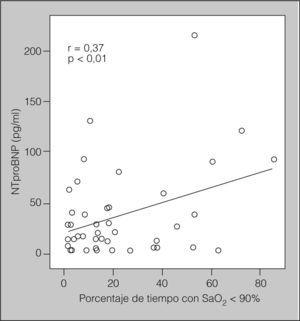
En la tabla II se muestran los resultados de aplicar el coeficiente de correlación de Pearson entre las concentraciones de NTproBNP o PCR y edad, IMC, presión arterial sistólica y diastólica, variables metabólicas, variables polisomnográficas y puntuaciones de la ESE en pacientes con SAHS. Las concentraciones del NTproBNP se correlacionaron positivamente con la edad, la glucemia, el IAH y el porcentaje de tiempo con saturación arterial de oxígeno por debajo del 90% (r = 0,37; p < 0,01) (fig. 2), y de forma negativa con la SaO2 media nocturna. Curiosamente, las concentraciones de PCRas no se correlacionaron con ninguna variable.
Coeficientes de correlación entre los valores de propéptido natriurético cerebral N-terminal (NTproBNP) o de proteína C reactiva de alta sensibilidad (PCRas) y edad, índice de masa corporal (IMC), presión arterial (PA), variables metabólicas, variables polisomnográficas y escala de Epworth en pacientes con síndrome de apneas-hipopneas durante el sueño (n = 42)
| NTproBNP | p | PCRas | p | |
| Edad (años) | 0,31 | 0,02* | 0,25 | 0,05 |
| IMC (kg/m2) | 0,13 | 0,19 | −0,05 | 0,37 |
| PA sistólica (mmHg) | −0,18 | 0,12 | −0,16 | 0,15 |
| PA diastólica (mmHg) | 0,25 | 0,05 | 0,07 | 0,32 |
| Glucemia (mg/dl) | 0,28 | 0,04* | 0,18 | 0,13 |
| Colesterol total (mg/dl) | −0,12 | 0,37 | −0,12 | 0,24 |
| cHDL (mg/dl) | 0,06 | 0,33 | −0,25 | 0,05 |
| cLDL (mg/dl) | −0,14 | 0,30 | −0,02 | 0,44 |
| Triglicéridos (mg/dl) | 0,06 | 0,35 | −0,02 | 0,43 |
| Índice de apneas-hipopneas (h-1) | 0,29 | 0,03 | 0,03 | 0,12 |
| Índice de desaturaciones (h-1) | 0,08 | 0,58 | 0,03 | 0,84 |
| Índice de microdespertares (h-1) | 0,12 | 0,22 | −0,02 | 0,44 |
| SaO2 < 90% (%TST) | 0,37 | 0,009* | 0,24 | 0,06 |
| SaO2 media nocturna (%) | −0,36 | 0,01* | −0,14 | 0,18 |
| Escala de Epworth | 0,04 | 0,41 | 0,03 | 0,33 |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; SaO2: saturación arterial de oxígeno; SaO2 < 90%: porcentaje de tiempo en que la SaO2 fue < 90%; TST: tiempo total de sueño.
Además, al correlacionar el IMC con el resto de las variables, se encontró una asociación positiva con el IAH (r = 0,60; p2 = 0,0001), el índice de microdespertares (r = 0,46; p2 = 0,001) y el porcentaje de tiempo con SaO2 por debajo del 90% (r = 0,37; p2 = 0,008), y negativa con la SaO2 media nocturna (r = −0,37; p2 = 0,0001).
Los coeficientes de correlación de Pearson entre las concentraciones de NTproBNP o PCRas y la edad, IMC, presión arterial, variables metabólicas, variables polisomnográficas y ESE en los controles mostraron que las concentraciones de PCRas no se correlacionaron de forma significativa con ninguna de estas variables y sólo los valores de NTproBNP se asociaron negativamente con el IMC (p = 0,0006).
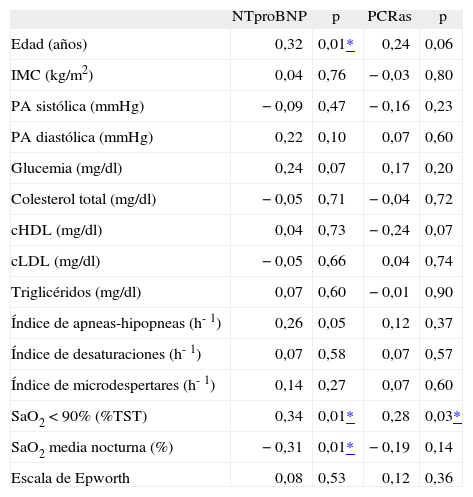
Se calcularon también los coeficientes de correlación de Pearson entre las mismas variables en la totalidad de los sujetos (tabla III). Las concentraciones de la PCRas se correlacionaron de forma significativa con el porcentaje de tiempo con SaO2 por debajo del 90% (r = 0,27; p2 = 0,049), del mismo modo que lo hicieron los valores del NTproBNP (r = 0,34; p2 = 0,012), que además se correlacionaron negativamente con la SaO2 media nocturna (r = −0,31; p2 = 0,02).
Coeficientes de correlación entre los valores de propéptido natriurético cerebral N-terminal (NTproBNP) o de proteína C reactiva de alta sensibilidad (PCRas) y edad, índice de masa corporal (IMC), presión arterial (PA), variables metabólicas, variables polisomnográficas y escala de Epworth en todos los sujetos (n = 56)
| NTproBNP | p | PCRas | p | |
| Edad (años) | 0,32 | 0,01* | 0,24 | 0,06 |
| IMC (kg/m2) | 0,04 | 0,76 | −0,03 | 0,80 |
| PA sistólica (mmHg) | −0,09 | 0,47 | −0,16 | 0,23 |
| PA diastólica (mmHg) | 0,22 | 0,10 | 0,07 | 0,60 |
| Glucemia (mg/dl) | 0,24 | 0,07 | 0,17 | 0,20 |
| Colesterol total (mg/dl) | −0,05 | 0,71 | −0,04 | 0,72 |
| cHDL (mg/dl) | 0,04 | 0,73 | −0,24 | 0,07 |
| cLDL (mg/dl) | −0,05 | 0,66 | 0,04 | 0,74 |
| Triglicéridos (mg/dl) | 0,07 | 0,60 | −0,01 | 0,90 |
| Índice de apneas-hipopneas (h-1) | 0,26 | 0,05 | 0,12 | 0,37 |
| Índice de desaturaciones (h-1) | 0,07 | 0,58 | 0,07 | 0,57 |
| Índice de microdespertares (h-1) | 0,14 | 0,27 | 0,07 | 0,60 |
| SaO2 < 90% (%TST) | 0,34 | 0,01* | 0,28 | 0,03* |
| SaO2 media nocturna (%) | −0,31 | 0,01* | −0,19 | 0,14 |
| Escala de Epworth | 0,08 | 0,53 | 0,12 | 0,36 |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; SaO2: saturación arterial de oxígeno; SaO2 < 90%: porcentaje de tiempo en que la SaO2 fue < 90%; TST: tiempo total de sueño.
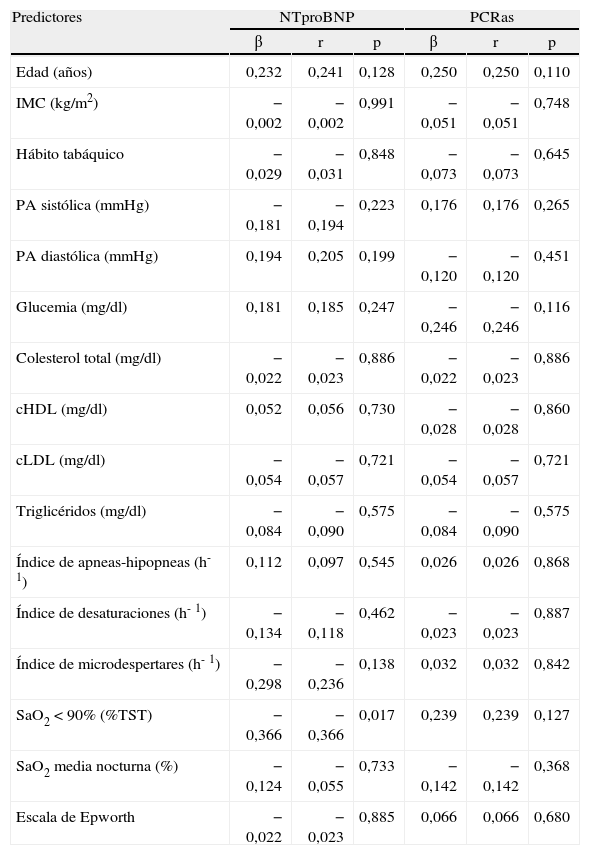
Para determinar los predictores independientes de las variaciones de las concentraciones del NTproBNP y la PCRas en pacientes con SAHS, se llevó a cabo un análisis de regresión múltiple paso a paso y se estableció la inclusión en el modelo de las siguientes variables independientes: edad, IMC, hábito tabáquico, presión arterial, variables metabólicas, IAH, índice de microdespertares, índice de desaturaciones, porcentaje de tiempo con SaO2 por debajo del 90%, SaO2 media nocturna y ESE. El predictor más potente de las variaciones en las concentraciones del NTproBNP fue el porcentaje de tiempo con SaO2 por debajo del 90% (p = 0,017), que fue el responsable del 37% de la variancia.
Curiosamente, no hubo ningún predictor potente de las variaciones en los valores de la PCRas. En otro modelo en el que excluimos el porcentaje de tiempo con SaO2 por debajo del 90%, el predictor más potente de las concentraciones plasmáticas del NTproBNP fue la SaO2 media nocturna (p = 0,021), responsable del 36% de la variancia. Una vez más, no hubo ningún predictor de las variaciones en las concentraciones de la PCRas en este modelo (tabla IV).
Análisis de regresión múltiple paso a paso entre predictores independientes de los valores séricos de propéptido natriurético cerebral N-terminal (NTproBNP) y de proteína C reactiva de alta sensibilidad (PCRas) en pacientes con síndrome de apneas-hipopneas durante el sueño
| Predictores | NTproBNP | PCRas | ||||
| β | r | p | β | r | p | |
| Edad (años) | 0,232 | 0,241 | 0,128 | 0,250 | 0,250 | 0,110 |
| IMC (kg/m2) | −0,002 | −0,002 | 0,991 | −0,051 | −0,051 | 0,748 |
| Hábito tabáquico | −0,029 | −0,031 | 0,848 | −0,073 | −0,073 | 0,645 |
| PA sistólica (mmHg) | −0,181 | −0,194 | 0,223 | 0,176 | 0,176 | 0,265 |
| PA diastólica (mmHg) | 0,194 | 0,205 | 0,199 | −0,120 | −0,120 | 0,451 |
| Glucemia (mg/dl) | 0,181 | 0,185 | 0,247 | −0,246 | −0,246 | 0,116 |
| Colesterol total (mg/dl) | −0,022 | −0,023 | 0,886 | −0,022 | −0,023 | 0,886 |
| cHDL (mg/dl) | 0,052 | 0,056 | 0,730 | −0,028 | −0,028 | 0,860 |
| cLDL (mg/dl) | −0,054 | −0,057 | 0,721 | −0,054 | −0,057 | 0,721 |
| Triglicéridos (mg/dl) | −0,084 | −0,090 | 0,575 | −0,084 | −0,090 | 0,575 |
| Índice de apneas-hipopneas (h-1) | 0,112 | 0,097 | 0,545 | 0,026 | 0,026 | 0,868 |
| Índice de desaturaciones (h-1) | −0,134 | −0,118 | 0,462 | −0,023 | −0,023 | 0,887 |
| Índice de microdespertares (h-1) | −0,298 | −0,236 | 0,138 | 0,032 | 0,032 | 0,842 |
| SaO2 < 90% (%TST) | −0,366 | −0,366 | 0,017 | 0,239 | 0,239 | 0,127 |
| SaO2 media nocturna (%) | −0,124 | −0,055 | 0,733 | −0,142 | −0,142 | 0,368 |
| Escala de Epworth | −0,022 | −0,023 | 0,885 | 0,066 | 0,066 | 0,680 |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; IMC: índice de masa corporal; PA: presión arterial; SAHS: síndrome de apneas-hipopneas durante el sueño; SaO2: saturación arterial de oxígeno; SaO2 < 90%: porcentaje de tiempo en que la SaO2 fue < 90%; TST: tiempo total de sueño.
Finalmente, se estudiaron las mismas variables como predictores de NTproBNP y PCRas en el total de los grupos (n = 56) mediante un análisis de regresión lineal, en que el porcentaje de tiempo con SaO2 por debajo del 90% se identificó como el predictor más potente de las concentraciones del NTproBNP (p = 0,012), siendo responsable del 34% de la variancia, y también de las concentraciones de la PCRas (p = 0,036), donde fue el responsable del 28% de la variancia.
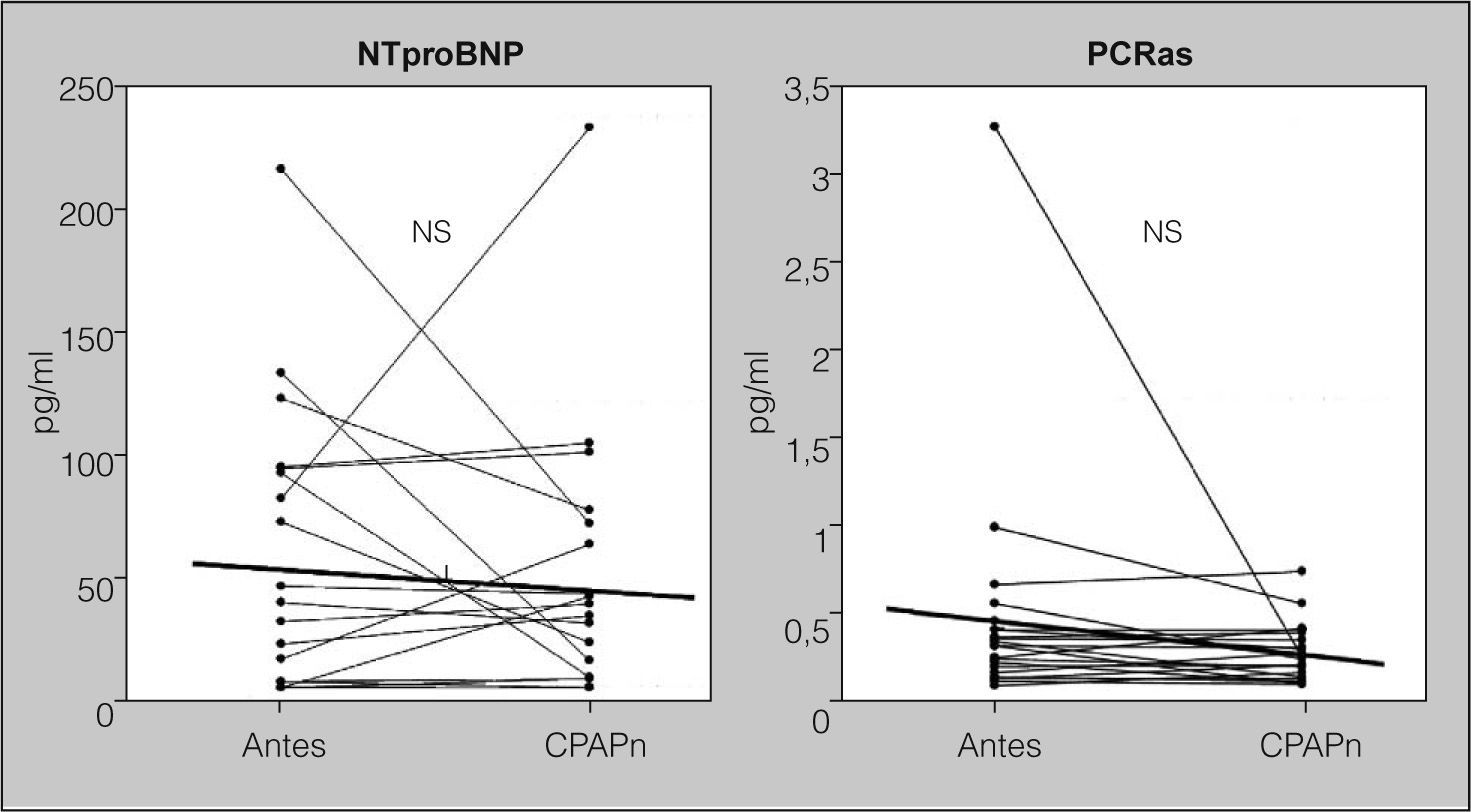
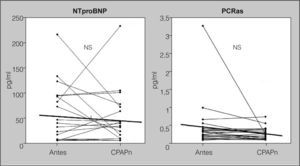
Efectos de la presión positiva continua de la vía aérea nasalEn los pacientes con SAHS grave, el IMC no cambió significativamente y no se detectaron enfermedades infecciosas o cardiovasculares nuevas durante los 6 meses de tratamiento con CPAPn. La media de presión de CPAPn fue 7,76 ± 1,57 cmH2O y la media de uso nocturno, de 6,30 ± 1,33 h. El IAH en la polisomnografía de titulación de CPAPn descendió significativamente de 64,4 ± 22,9 a 6,8 ±1,1 (p < 0,001), y también descendió la puntuación de la ESE, que pasó de 10,6 ± 4,5 antes del tratamiento a 6,3 ± 1,4 después de éste (p < 0,001). Se excluyó del estudio a 6 pacientes porque su media de cumplimiento era inferior a 4 h (n = 21). El tratamiento con CPAPn no redujo significativamente los valores de NTproBNP (pasaron de 51,86 ± 12,42 a 43,44 ± 11,71 pg/ml; p = 0,53) ni los de PCRas (pasaron de 0,41 ± 0,50 a 0,22 ± 0,03 mg/dl; p = 0,21) (fig. 3).
Efecto de la presión positiva continua de la vía aérea nasal (CPAPn) sobre los valores de propéptido natriurético cerebral N-terminal (NTproBNP) y de proteína C reactiva de alta sensibilidad (PCRas), en pacientes con grave síndrome de apneas-hipopneas durante el sueño (n = 21) que fueron tratados durante 6 meses. No se apreciaron cambios significativos en los valores de NTproBNP y PCRas antes y después del tratamiento. NS: no significativo. Las líneas que cruzan las columnas de puntos representan los valores de la media.
La principal aportación de este estudio es que los valores basales de NTproBNP y PCRas no difirieron significativamente entre los pacientes con SAHS cuando se agruparon de acuerdo con el IAH. También demuestra que no está clara la asociación con marcadores inflamatorios como la PCR, después de excluir la presencia de isquemia miocárdica silente no diagnosticada y otras alteraciones cardíacas, y la excesiva influencia de reconocidos factores de riesgo que afectan a la secreción de los biomarcadores. En pacientes con SAHS, no obstante, las concentraciones del NTproBNP se relacionaron con la gravedad de la desaturación de la oxihemoglobina, independientemente de los posibles factores de confusión tales como la edad, el IMC, el hábito tabáquico, la presión arterial, la glucemia, los lípidos y otras variables polisomnográficas. Si bien esta relación indica las nocivas consecuencias hemodinámicas de la desaturación nocturna, el tratamiento con CPAPn no suprimió significativamente la elevación del NTproBNP en estos pacientes, lo que hace difícil que pueda establecerse una relación causal entre el SAHS y el riesgo cardiovascular.
Estudios previos han aportado datos sobre la relación entre el SAHS y la función ventricular izquierda20–22, así como sobre los procesos inflamatorios asociados con el SAHS14,15, pero la presencia de obesidad moderada-grave y potenciales factores de confusión han podido influir en el resultado de algunos de ellos. La obesidad también incrementa la probabilidad de desarrollar factores de riesgo para presentar cardiopatía, especialmente la hipertensión arterial, la hipercolesterolemia y la diabetes.
La disfunción ventricular izquierda puede formar parte de una enfermedad coronaria, de la hipertensión arterial, de valvulopatías, de miocardiopatías primarias o de la diabetes mellitus. Por lo tanto, se apuntó la hipótesis de que el SAHS pudiera ser también una causa independiente de esta alteración. Varios estudios han descrito que la disfunción diastólica asintomática es común en pacientes con SAHS grave5,6,20, pero la ecocardiografía, actualmente la prueba de referencia de este diagnóstico, presenta dificultades técnicas debidas a la obesidad en estos pacientes y a la limitada disponibilidad en los centros de atención primaria. Si la disfunción diastólica no se trata y progresa, la potencial mortalidad es alta. Además, la insuficiencia cardíaca diastólica es una entidad frecuente pero de diagnóstico difícil y asociada al SAHS. La determinación de la concentración del NTproBNP puede mejorar la capacidad de los clínicos para detectar alteraciones cardíacas en el SAHS. El BNP y el proBNP son específicamente secretados por los ventrículos en respuesta al volumen de expansión o a la presión de llenado, pero también a la hipoxia miocárdica. Nosotros hemos encontrado que las concentraciones de NTproBNP no difieren significativamente según la gravedad de los grupos de pacientes con SAHS, estratificados de acuerdo con el IAH, lo que confirma los hallazgos de publicaciones previas de Svatikova et al23 y Tasci et al24, cuando se excluyeron conocidos factores que pueden afectar a la secreción cardíaca de NTproBNP. Sin embargo, la magnitud de la hipoxia nocturna parece ser el factor más potente de los que intervienen en las variaciones de las concentraciones de NTproBNP en pacientes con SAHS. Estos resultados pueden ser compatibles con la noción de que la hipoxia miocárdica aguda, aun en ausencia de disfunción ventricular, activa la expresión del gen cardíaco del BNP y aumenta las concentraciones de BNP y proBNP, como publicaron Goetze et al25,26.
Por otra parte, hay evidencia de una correlación entre el NTproBNP y las cifras de glucemia, que puede ser un rasgo más de la obesidad27 que del SAHS en sí mismo, pero también de la edad28, puesto que puede afectar a la secreción de proBNP por influir dichas cifras en las características del miocardio ventricular.
Los valores de NTproBNP en los controles con sobrepeso u obesidad se correlacionaron negativamente de forma significativa con el IMC, lo que confirma la asociación ya descrita entre IMC alto y concentración baja de BNP en individuos obesos sanos29. Por lo tanto, debemos considerar si la elevación de las concentraciones de NTproBNP puede tener considerablemente reducido el punto de corte sérico significativo en individuos obesos o con sobrepeso, infraestimando el valor predictivo de este biomarcador.
El presente estudio contradice además los hallazgos de Shamsuzzaman et al14, Yokoe et al15 y Can et al30, que publicaron que las concentraciones de la PCR se asocian independientemente a la gravedad del SAHS. Una posible causa de la falta de diferencias significativas en nuestro trabajo es que los pacientes y los controles de las anteriores publicaciones eran mucho más obesos16,31 que los nuestros. Recientemente Ryan et al32 han comprobado que la PCR se asocia de forma independiente a la obesidad. Además, el impacto del tratamiento con CPAPn sobre los valores séricos de la PCR no está todavía claro33.
Por otra parte, en los estudios anteriores la hipoxia secundaria a la apnea pudo ser más grave34 que en el nuestro, y dichos estudios no aportan información detallada respecto a las comorbilidades y la medicación utilizada, que podría afectar a las concentraciones circulantes de PCR. A diferencia de estos trabajos, nosotros no encontramos una correlación significativa del IMC, la presión arterial, variables metabólicas o de polisomnografía y los valores de PCR. Además, el análisis de regresión múltiple por pasos reveló que estas variables no fueron factores que se asociaran al incremento de las concentraciones de la PCR en pacientes con SAHS, aunque el tamaño de nuestra muestra tal vez sea demasiado pequeño para detectar diferencias sutiles en este biomarcador. Cuando examinamos las variables continuas en el total de los sujetos estudiados, observamos diferencias en las correlaciones realizadas con la PCR, aunque con una gran dispersión.
Ryan et at35 han señalado el papel potencial de la somnolencia en la mediación del proceso inflamatorio en el SAHS. No obstante, sus datos no les permiten determinar si la somnolencia es causa o efecto de la elevación de las citocinas proinflamatorias. Además, el tratamiento con CPAPn, si bien tuvo un efecto significativo sobre el factor nuclear κB dependiente de genes (principalmente el factor de necrosis tumoral alfa, asociado también a la somnolencia diurna excesiva), no tuvo ningún efecto sobre el resto de los marcadores inflamatorios estudiados. En este estudio, los pacientes con SAHS y los controles se agruparon según el IAH, y se encontraron diferencias significativas en el grado de somnolencia de los grupos con SAHS. En nuestra muestra, las puntuaciones de la ESE no fueron significativamente diferentes entre los grupos con SAHS.
Más aún, contrariamente a lo publicado por Tasci et al24 y Yokoe et al15, quienes demostraron una reducción significativa de los valores de NTproBNP y PCR en pacientes con SAHS grave, nosotros no encontramos cambios significativos en las concentraciones de proBNP ni de PCR en pacientes con SAHS grave. Sin embargo, nuestro estudio mostró un descenso ulterior, pero no significativo, de los valores del NTproBNP y la PCR después de 6 meses de tratamiento con CPAPn, más tiempo que en el trabajo de Pepperell et al36, lo cual puede atribuirse a una reducción de la irritabilidad ventricular37. Los efectos de la CPAPn sobre las concentraciones del NTproBNP y la PCR deberían evaluarse en un estudio a gran escala y controlado con placebo.
Nuestros hallazgos tienen implicaciones a la hora de estratificar a los pacientes con SAHS principalmente en función de los factores de riesgo cardiovascular. Esto implica que el impacto del SAHS sobre la enfermedad cardiovascular, como reflejan las concentraciones del NTproBNP, puede variar de forma considerable dependiendo del grado de desaturación nocturna de la oxihemoglobina. Por el contrario, los valores absolutos del IAH y su relación con las alteraciones en la arquitectura del sueño pueden tener un impacto considerablemente menor sobre el conjunto del perfil del riesgo cardiovascular de los pacientes, como refleja el estrés inflamatorio (PCR) y hemodinámico (NTproBNP). En nuestra opinión, el diferente efecto de la desaturación nocturna y de la frecuencia de los períodos de apnea-hipopnea sobre el NTproBNP indica que los perfiles de riesgo cardiovascular divergen dependiendo de si la expresión fenotípica del SAHS se caracteriza predominantemente por la fragmentación del sueño o por la desaturación nocturna grave. Nuestros resultados pudieran también explicarse por las discrepancias en la literatura médica respecto a la inadecuada caracterización de los grupos heterogéneos de pacientes con SAHS, así como por la modulación de las respuestas hemodinámica e inflamatoria debida a los factores de confusión.
En conclusión, hemos demostrado que la gravedad de la hipoxemia nocturna en el SAHS se relaciona con los valores del NTproBNP, pero no con las concentraciones séricas de la PCR, y que, aunque no puede descartarse un efecto a largo plazo, estos marcadores no disminuyen de forma significativa con la CPAPn a corto plazo. Por consiguiente, si bien el SAHS no podría considerarse un factor de riesgo cardiovascular principal, puede exacerbar reconocidas alteraciones cardiovasculares asociadas a hipoxemia nocturna, la cual es una importante causa de las variaciones en los valores plasmáticos de NTproBNP en pacientes con SAHS.
Nuestro estudio presenta ciertas limitaciones. En primer lugar, se excluyó a participantes con enfermedad cardiovascular conocida o enfermedades y factores que predispongan a ella, por lo que es posible que se excluyera a pacientes con SAHS más predispuestos a presentar enfermedad cardiovascular, que además se reflejaría en concentraciones séricas más elevadas de estos biomarcadores. Este hecho hace más difícil encontrar diferencias significativas entre grupos. Además, al no ser los individuos tan obesos como en los trabajos citados, la desaturación asociada a las apneas es menor, como se deduce del tiempo con SaO2 por debajo del 90%, que es inferior en nuestro trabajo, lo que pudiera hacer que el efecto de la CPAP en la disminución de los biomarcadores no llegara a ser significativa, a pesar de corregir la hipoxemia. Otra explicación sería que nuestros pacientes con SAHS fuesen menos sintomáticos que en algunas publicaciones y, por este motivo, el tratamiento resultó menos eficaz.
Con todo, la limitación más importante del estudio, debido a los numerosos criterios de exclusión aplicados, es el reducido tamaño muestral, que no permite evitar el error tipo II, aunque nuestros resultados coinciden con las últimas publicaciones al respecto, que discrepan de las anteriores en lo referente a la PCR, puesto que también han controlado los importantes factores de confusión.
AgradecimientosLos autores dan las gracias a las Dras. María Victoria Rodríguez y María Luisa Hernández por su apoyo y asesoramiento en las pruebas de laboratorio utilizadas en este proyecto.