La disfunción primaria del injerto pulmonar (DPIP) continúa siendo la principal causa de mortalidad perioperatoria y precoz en los receptores de un trasplante pulmonar (TP)1. La DPIP es una lesión pulmonar aguda, que acontece en el período perioperatorio inmediato como consecuencia de una serie de eventos inherentes al TP. Se expresa clínicamente por hipoxemia intensa y en la radiografía se aprecia un patrón de infiltrado alveolar (edema pulmonar), lo que obliga a mantener al paciente intubado y ventilado con un alto aporte de oxígeno y óxido nítrico. Este hecho favorece la infección pulmonar, la sepsis y el posterior fracaso multiorgánico del paciente trasplantado2.
La DPIP se ha relacionado casi exclusivamente con las lesiones de isquemia que acontecen durante la preservación del pulmón y la posterior reperfusión, una vez implantado. El mecanismo de lesión pulmonar por isquemia-reperfusión es extremadamente complejo y aún no está dilucidado del todo. Es el resultado de la interacción entre potentes mediadores y distintos tipos celulares3,4. Entre estos mediadores, las interleucinas (IL), y en especial la IL-8, parecen desempeñar un papel importante en el desarrollo de la DPIP.
Sin embargo, el TP es un proceso complejo, por lo que cabría pensar que su éxito o fracaso podría estar condicionado por otros factores, y entre éstos se encontraría el donante. Fisher et al5 han comprobado que las concentraciones elevadas de IL-8 en el lavado broncoalveolar (BAL) de donantes de pulmón óptimos se correlacionan significativamente con la DPIP; es decir, podría haber un estado de “inflamación subclínica”—y, por lo tanto, sin expresión radiológica o gasométrica— que condicionara la posterior evolución del paciente trasplantado.
El objetivo de nuestro estudio es comprobar el papel que las concentraciones de IL-8 en el BAL del donante de pulmón tienen en el desarrollo de la DPIP.
Pacientes y métodoPacientesSe ha estudiado prospectivamente a 20 pacientes que recibieron un trasplante bipulmonar secuencial en el Hospital Universitario La Fe de Valencia, en el período comprendido entre noviembre de 2005 y diciembre de 2006.
Todos los donantes pulmonares reunieron criterios para ser considerados óptimos según la normativa internacional6. La técnica de explante se realizó siguiendo el protocolo de la Unidad de Trasplante Pulmonar del Hospital Universitario La Fe de Valencia, y para la preservación pulmonar se utilizó una solución baja en potasio a 4 °C.
Inmediatamente antes del implante pulmonar se realizó un BAL mediante la instilación de 20 ml de suero fisiológico en ambos bronquios principales. Todas las muestras obtenidas se procesaron y almacenaron a −80 °C para su posterior análisis.
Durante el postoperatorio inmediato se recogieron los valores gasométricos —cociente presión arterial de oxígeno/fracción inspiratoria de oxígeno (PaO2/ FiO2)— a las 6, 24 y 48 h del implante, así como el tiempo de intubación del receptor. Los pacientes con un cociente PaO2/FiO2 inferior a 300 durante las primeras 48 h se clasificaron como pacientes que habían desarrollado DPIP, tras excluir rechazo agudo, obstrucción de la anastomosis venosa, edema pulmonar cardiogénico o neumonía.
Determinación de interleucina-8Todas las muestras se procesaron y guardaron a −80 °C para su posterior análisis. La determinación de IL-8 se realizó mediante enzimoinmunoanálisis ELISA (R&D System, Inc., Minneapolis, MN, EE.UU.).
Variables sometidas a estudio- • Variables del donante: sexo, edad, causa de muerte, tabaquismo, tiempo de intubación (días), cociente PaO2/ FiO2, soporte inotrópico, cultivo bacteriológico y concentraciones de IL-8 en BAL.
- • Variables del receptor: sexo, edad, cociente PaO2/ FiO2 a las 6, 24 y 48 h, tiempo de intubación (h) y DPIP.
Se describieron las características de donantes y receptores usando los estadísticos centrales y de dispersión habituales (mediana y rango intercuartílico [RIC]). La posible asociación entre las variables de los donantes y las concentraciones de IL-8 se evaluó mediante la r de Spearman y el test de Mann-Whitney, según las variables fueran continuas o categóricas. Se empleó la regresión logística para el análisis multivariante. En todos los análisis realizados se consideraron significativos los valores de p<0,05.
ResultadosDonantesQuince donantes fueron varones y 5 mujeres. La mediana de la edad fue de 35 años (RIC: 23,5–51,25). La causa de la muerte cerebral fue traumática en 9 casos y no traumática en 11. Siete donantes eran fumadores activos en el momento de la donación. El tiempo de ventilación asistida fue de un día (RIC: 1–2). La mediana del cociente PaO2/FiO2 fue de 459,5 (RIC: 427–510,25). Trece precisaron de soporte inotrópico para mantener la estabilidad hemodinámica. En 18 ocasiones se aislaron gérmenes en el BAL. La mediana de concentración de IL-8 obtenida en el BAL fue de 49,01 ng/ml (RIC: 7,86–94,05).
ReceptoresDiez pacientes eran varones y 10 mujeres. La mediana de la edad fue de 48,43 años (RIC: 25,4–56,81). La enfermedad pulmonar que determinó el trasplante fue de etiología séptica en 8 casos y no séptica en los 12 restantes. Como hemos comentado, en todos los casos se realizó un trasplante bipulmonar secuencial, con un tiempo de isquemia para el primer pulmón de 210 min (RIC: 176,25–228,75) y para el segundo pulmón de 300 min (RIC: 273,75–333,73). Los valores del cociente PaO2/FiO2 a las 6, 24 y 48 h del implante fue de 329 (RIC: 190,25–435), 363,5 (RIC: 249–434,75) y 370,5 (RIC: 243,25–418,25), respectivamente.
Relación de la IL-8 con las características clínicas del donante, el tiempo de intubación del receptor y el desarrollo de DPIP
No se encontró asociación alguna entre las características clínicas del donante y los valores de IL-8 obtenidos en el BAL (tabla 1).
Tabla 1. Concentraciones de interleucina-8 (IL-8) en el lavado broncoalveolar y características clínicas de los donantes (n=20)
| Características | IL-8 (ng/ml): mediana (RIC) | p |
| Variables categóricasa | ||
| Varones (n=15) | 24,48 (4–79,09) | 0,445 |
| Mujeres (n=5) | 79,09 (31,58–162,74) | |
| No fumador (n=13) | 79,09 (16,42–87,54) | 0,211 |
| Fumador (n=7) | 9 (2,74–60,43) | |
| Muerte cerebral traumática (n=9) | 24,48 (1,99–79,09) | 0,456 |
| Muerte cerebral no traumática (n=11) | 60,43 (9–96) | |
| Soporte inotrópico (n=13) | 37,6 (6,18–87,54) | 0,817 |
| Sin soporte initrópico (n=7) | 60,43 (2,7–79,09) | |
| BALC positive (n=18) | 42,45 (3,68–83,31) | 0,674 |
| BALC negativo (n=2) | 58,34 (37,6–79,09) | |
| Variables continuasb | ||
| Edad | 0,202 | |
| Tiempo de intubación | 0,615 | |
| Cociente PaO2/FiO2 | 0,186 |
BALC: cultivo bacteriológico del lavado broncoalveolar; FiO 2: fracción inspiratoria de oxígeno; PaO 2: presión arterial de oxígeno; RIC: rango intercuartílico.
a Test de la U de Mann-Whitney.
b Test de Spearman.
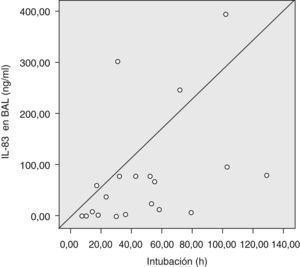
El tiempo de intubación del receptor fue de 39,5 h (RIC: 19,25–68,5) y su correlación con los valores de IL-8 resultó positiva, ya que, cuanto mayor era la concentración de IL-8 en el BAL, más tiempo de ventilación asistida precisó el paciente (test de Spearman, p=0,007; r=0,583) (fig. 1).
Figura 1. Concentración de interleucina-8 (IL-8) en el lavado broncoalveolar (BAL) del donante y tiempo de intubación del receptor (test de Spearman, r=0,538; p=0,007).
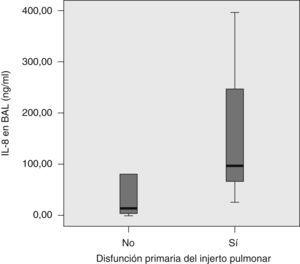
Desarrollaron DPIP 5 pacientes, de los que 2 fallecieron en el postoperatorio inmediato (tabla 2). Estos pacientes habían recibido el órgano de donantes en los que las concentraciones de IL-8 en el BAL eran significativamente mayores que las de los donantes de pulmones trasplantados a pacientes que no presentaron dicho cuadro clínico (test de Mann-Whitney, p=0,003) (fig. 2).
Figura 2. Concentración de interleucina-8 (IL-8) en el lavado broncoalveolar (BAL) del donante y disfunción primaria del injerto pulmonar (test de la U de Mann-Whitney, p=0,032).
Tabla 2. Concentraciones de interleucina-8 (IL-8) en el lavado broncoalveolar del donante y desarrollo de disfunción primaria del injerto en el trasplante bipulmonar (DPIP)
| Receptores (n=20) | IL-8 (ng/ml): mediana (RIC) | p * |
| DPIP (n=5) | 96 (45,99–320,33) | 0,039 |
| Sin DPIP (n=15) | 12,9 (2,74–79,09) |
RIC: rango intercuartílico.
* Test de la U de Mann-Whitney.
Según el análisis multivariante mediante el modelo de regresión logística binaria, la concentración de IL-8 obtenida en el LAB fue la única variable que entró en regresión, aunque limitó la significación (p=0,07). La ecuación de regresión obtenida fue: −5,079+(BAL×13,16).
DiscusiónEn nuestro trabajo hemos comprobado que las concentraciones elevadas de IL-8 en el BAL del donante condicionan un mayor tiempo de ventilación asistida en el paciente trasplantado y favorecen el desarrollo de DPIP.
La obtención de órganos para la realización de un trasplante, sobre todo el pulmón, es un serio problema. En la actualidad los criterios para la selección del donante pulmonar se basan en una serie de datos clínicos como la edad, la presencia de tabaquismo, gasometría arterial, hallazgos tanto radiológicos como broncoscópicos y el examen físico del pulmón en el momento del explante. Sin embargo, la mayoría de estos criterios no se han evaluado rigurosamente y se basan más en impresiones clínicas que en una evidencia clínica sólida7. Aunque donantes pulmonares marginales pueden conducir a resultados aceptables6, no es menos cierto que la DPIP continúa siendo un grave problema a pesar de la utilización de donantes clasificados como óptimos8.
La DPIP se ha relacionado casi exclusivamente con las lesiones de isquemia que acontecen durante la preservación del pulmón y la posterior reperfusión, una vez implantado. El mecanismo de lesión pulmonar por isquemia-reperfusión es extremadamente complejo y aún no está dilucidado del todo. Es el resultado de la interacción entre potentes mediadores y distintos tipos celulares3,4. Entre estos mediadores, las IL, y en especial la IL-8, potente mediador proinflamatorio en la activación y reclutamiento de los neutrófilos en el lugar en que se produce un proceso inflamatorio agudo, parecen desempeñar un papel importante en el desarrollo de la DPIP. En este sentido, se ha podido comprobar que en el período post-TP inmediato los valores elevados de citocinas proinflamatorias se correlacionan significativamente con la aparición de DPIP9–11.
Sin embargo, el TP es un proceso complejo, por lo que cabría pensar que su éxito o fracaso podría estar condicionado por otros factores, y entre éstos estaría el donante. Innumerables trabajos han estudiado el impacto de las características del donante en los resultados del TP6. Sin embargo, son escasos los dedicados al estudio del estado biológico del pulmón del donante y de su impacto en la DPIP.
Algunos autores han encontrado una correlación significativa entre la concentración sanguínea de determinadas citocinas y la depleción hormonal que acontece en la muerte cerebral12. Igualmente se ha observado, en pacientes con traumatismo craneal aislado, la existencia de una lesión pulmonar aguda caracterizada histológicamente por una infiltración pulmonar de neutrófilos en todo superponible a lo que acontece en la DPIP, lo que ha llevado a algún autor a cuestionar el estado inflamatorio del pulmón en donantes de órganos13. Fisher et al5 comprobaron que concentraciones elevadas de IL-8 en el BAL de donantes pulmonares óptimos —12 analizados antes del explante y 15 con el injerto sometido a isquemia— determinaron el desarrollo posterior de la DPIP. En un estudio reciente Kaneda el at14 han descrito un modelo de predicción de mortalidad perioperatoria en el que el cociente IL-6/IL-10, obtenido mediante análisis de ARN mensajero a partir de biopsias del pulmón donante, condicionó la mortalidad. En nuestro trabajo los valores elevados de IL-8 en el BAL condicionaron el tiempo en que el paciente necesitó ventilación mecánica asistida. Igualmente, los pacientes que presentaron DPIP mostraron concentraciones significativamente mayores de IL-8.
En conclusión, en nuestra limitada experiencia, coincidimos con Fisher et al5 en que en determinados donantes clasificados como óptimos puede haber lesiones pulmonares subclínicas, cuya expresión sería la elevación de las concentraciones de IL-8 en el BAL, las cuales se agravarían tras la isquemia y posterior reperfusión del injerto. Este hecho podría explicar, al menos en parte, que, a pesar del esfuerzo encaminado a conseguir una preservación pulmonar ideal15, la DPIP continúe condicionando los resultados en el TP, por lo que es necesario desarrollar nuevas estrategias que permitan una evaluación biológica del donante pulmonar antes del implante14 y opciones terapéuticas que minimicen el efecto de la cascada inflamatoria en el período inmediatamente posterior al trasplante16.
Autor para correspondencia.
José Padilla
Dirección: jpadilla@comv.es