Determinar los factores predictores de mortalidad hospitalaria durante un ingreso por exacerbación de la enfermedad pulmonar obstructiva crónica (EPOC) en una unidad de cuidados respiratorios intermedios (UCRI).
MetodologíaEstudio prospectivo observacional de 2 años de duración en el que se incluyeron todos los ingresos en una UCRI por exacerbación de la EPOC. Se analizaron diferentes variables sociodemográficas, funcionales, clínicas y la actividad física.
ResultadosDurante este periodo evaluamos 102 episodios (90,1% varones), con una edad media de 69,4±10,6. El APACHE II (Acute Physiology and Chronic Health Evaluation Score) fue de 19,6±5,0 y el 9,5% presentaban fallo de otro órgano no respiratorio. El 75,3% recibieron ventilación mecánica no invasiva y esta fracasó en el 11,6% de ellos. La duración de la estancia en la UCRI y en el hospital fue de 3,5±2,1 y 8,0±5,3 días, respectivamente. La mortalidad durante el episodio de hospitalización fue de 6,9% y un 12,7% a los 90 días del alta hospitalaria. El análisis multivariante identificó un modelo predictivo con un estadístico C de 0,867, basado en el número de ingresos por exacerbación durante el año previo (p=0,048), la frecuencia respiratoria (FR) a las 2 horas del ingreso en la UCRI (p=0,048) y la puntuación obtenida en la escala multidimensional ADO (p=0,024).
ConclusionesEl número de ingresos por exacerbación de la EPOC durante el año previo, la FR a las 2 horas del ingreso en la UCRI y la escala multidimensional ADO nos permitirían identificar los pacientes susceptibles de fallecer durante un ingreso por descompensación de la EPOC en la UCRI.
The aim of our study was to investigate the mortality predictive factors after a severe exacerbations of COPD admitted to a Spanish respiratory intermediate care unit (IRCU).
Patients and methodsProspective observational 2 years study, where we included all episodes of acute exacerbations of COPD with hypercapnic respiratory failure admitted in an IRCU. We analyzed different sociodemographic, functional and clinical variables including physical activity.
ResultsWe collected data from 102 consecutive episodes admitted to IRCU (90.1% men). Mean age was 69.4±10.6. The mean APACHE II was 19.6±5.0 and 9.5% presented a failure of other non respiratory organ. Non invasive ventilation was applied in 75.3% of the episodes and this treatment failed in 11.6% of them. The duration of stay in the IRCU was 3.5±2.1 days and 8.0±5.3 days in the hospital. The hospital mortality rate was 6.9%, and another 12.7% after 90 days of discharged. In order to predict hospital mortality, multivariant statistics identified a model with AUC of 0.867, based in 3 variables: the number of previous year admission for COPD exacerbation (p=0,048), the respiratory rate after 2hours of treatment in the IRCU (p=0.0484) and the severity of the disease established with ADO score (p=0.0241).
ConclusionsThe number of previous year admission for COPD exacerbation, the severity of the disease established with ADO score, the respiratory rate after 2hours of treatment, allow us to identified what patients with a COPD exacerbation admitted in a IRCU can die during this episode.
La exacerbación grave de la enfermedad pulmonar obstructiva crónica (EPOC) se ha asociado a un incremento de la mortalidad1 en estos pacientes. Inicialmente este aumento de la mortalidad se atribuía a la gravedad basal de la enfermedad, sin embargo, varios estudios recientes han observado una relación independiente entre el número de exacerbaciones previas2,3 y la mortalidad. Además, el grado de severidad de la propia exacerbación se relaciona con diferentes tasas de supervivencia durante el proceso de hospitalización, de forma que los pacientes ingresados con insuficiencia respiratoria hipercápnica1, con acidosis respiratoria o que requieran intubación e ingreso en unidades de cuidados intensivos (UCI) presentan tasas de mortalidad superiores: 21-50%4–9. Durante la última década hemos asistido a un uso cada vez mayor de la ventilación mecánica no invasiva (VMNI)10 y su utilización se ha asociado a un descenso de la mortalidad11,12 con un menor número de intubaciones orotraqueales (IOT).
La información disponible sobre los pacientes con EPOC ingresados en las unidades de cuidados respiratorios intermedios (UCRI) o áreas de monitorización es limitada. Los sujetos generalmente ingresan en estas unidades por una insuficiencia respiratoria hipercápnica que requiere soporte ventilatorio. Actualmente carecemos de herramientas específicas que, de forma sencilla, nos permitan clasificar y establecer el pronóstico individual de cada paciente durante el ingreso. Escalas pronósticas más complejas, como el Acute Physiology and Chronic Health Evaluation (APACHE II) y el SAPS (Symplified Acute Physiology Score), que miden la gravedad del enfermo al ingreso y que son ampliamente utilizadas en las UCI, parecen no correlacionarse bien con la mortalidad en pacientes con EPOC ingresados en las UCI neumológicas13,14.
El objetivo de nuestro estudio es conocer los factores predictores de mortalidad hospitalaria en pacientes ingresados por un episodio de exacerbación de EPOC en la UCRI.
Pacientes y métodoSitio y diseño del estudioEstudio prospectivo, observacional, de 2 años de duración (15 febrero 2007-14 febrero 2009), realizado en el Hospital de Galdakao-Usansolo, un hospital general docente de 400 camas que atiende un área de 300.000 habitantes. Nuestra UCRI es dependiente del Servicio de Neumología, está ubicada en una estructura independiente adyacente a la sala de hospitalización convencional y dispone de 6 camas dotadas de monitorización múltiple (electrocardiograma continuo, frecuencia cardiaca, tensión arterial, saturación de oxígeno y frecuencia respiratoria). Es atendida por un neumólogo de presencia física durante el turno de mañana y de tarde (8:00 a.m.-9:00 p.m.) y el 50% de las guardias médicas, la otra mitad queda atendida por cardiólogos. El personal de enfermería está cualificado y su actuación está protocolizada.
Población estudiadaSe incluyeron de forma consecutiva todos los pacientes ingresados en la UCRI por exacerbación de la EPOC durante el periodo de estudio y que cumplieron los criterios de ingreso previamente establecidos15. A modo de resumen, estos criterios son: 1) Insuficiencia respiratoria aguda o crónica agudizada que requiera VMNI. 2) Pacientes con proceso respiratorio potencialmente grave que requiera de monitorización no invasiva. Los criterios de exclusión que se han seguido son los siguientes: 1) Pacientes muy graves que no respondan al tratamiento suministrado y cuya muerte es inminente o muy probable. 2) Paciente que se niega a ser tratado con VMNI o que se niega a ingresar en la UCRI, siendo debidamente informados, tanto él como su familia, de los posibles riesgos que asumen. Se definió la EPOC y la exacerbación según los criterios de la ATS (American Thoracic Society) y GOLD (Global Initiative for Chronic Obstructive Lung Disease)16.
Variables recogidasAl ingreso del paciente en la UCRI, se registró la siguiente información: 1) variables sociodemográficas; 2) variables clínicas, entre ellas la disnea, medida mediante la escala Medical Research Council (MRC)17 en situación estable, previa al ingreso. Esta escala estratifica la disnea en 5 grupos: GRADO I: ausencia de disnea excepto al realizar ejercicios intensos. GRADO II: dificultad para respirar al caminar deprisa en llano o subir pendientes ligeras (poco pronunciadas). GRADO III: incapacidad de mantener el paso de otras personas de su edad o tiene que parar para respirar en llano a su paso. GRADO IV: tiene que pararse para recuperar la respiración después de caminar 100 m o después de caminar unos pocos minutos en llano. GRADO V: la disnea le impide salir de casa o aparece con actividades como vestirse o desvestirse. 3) Enfermedades crónicas coexistentes mediante el índice de comorbilidad de Charlson18; este índice pondera 22 comorbilidades según una puntación preestablecida y la suma de todas ellas se relaciona con el riesgo de fallecimiento al año. 4) La gravedad del episodio a su ingreso, calculada utilizando la escala APACHE II19, para ello se usó el valor más grave obtenido en las primeras 24 horas del ingreso en la UCRI. Esta escala se basa en 2 componentes (el primero recoge 12 variables fisiológicas, el segundo recoge la edad, el estado de salud previo del paciente y el tipo de ingreso) y permite predecir la mortalidad hospitalaria mediante una fórmula de regresión logística. 5) La escala Sequential Organ Failure Assessment (SOFA)20 permite cuantificar el fallo multiorgánico basándose en los parámetros de 6 órganos mayores (sistema renal, neurológico, hepático, cardiovascular, pulmonar y hematológico) y se relaciona con la mortalidad en la UCI. Se obtuvo la puntuación de esta escala SOFA al ingreso en la UCRI y además para evaluar el grado de disfunción de los órganos no respiratorios eliminamos el impacto de la disfunción pulmonar en la puntuación final del SOFA. 6) Se analizaron otros parámetros analíticos como la glucosa, la albúmina y el hematocrito al ingreso (se consideraron cifras normales un hematocrito entre 39 y 49% para los varones y entre 36 y 48% para las mujeres, los valores inferiores se etiquetaron como anemia y los superiores como poliglobulia). 7) La gravedad de la EPOC mediante una espirometría en situación estable, realizada durante el año previo al ingreso o en el plazo de 3 meses tras el alta hospitalaria en situación de estabilidad clínica. Al realizar el análisis final de los datos, también se calculó la gravedad del paciente EPOC mediante la escala multidimensional ADO21. Esta escala, publicada en el año 2009, evalúa la gravedad de la EPOC en función de 3 parámetros: la edad, el nivel de obstrucción analizado mediante el porcentaje del FEV1 y la disnea del paciente medida por la escala MRC, asignando una puntuación total de 0-10 a cada paciente, y predice el riesgo de fallecer por la enfermedad en los 3 años siguientes. Se definió fracaso de la VMNI por la muerte del paciente o la necesidad de IOT y como criterios de IOT se establecieron los siguientes: parada cardiorrespiratoria, presencia de respiración jadeante, inestabilidad hemodinámica, agitación psicomotora grave o aspiración. Aun presentando criterios clínicos de IOT, era el médico quien tomaba la decisión de intubar. Para evaluar los resultados se registraron el porcentaje de pacientes que recibieron ventilación mecánica invasiva (VMI) e IOT por fallo de la VMNI, y la tasa de mortalidad en el hospital.
Análisis estadísticoEn el análisis descriptivo se usaron tanto medias y desviaciones estándares para variables cuantitativas (por ejemplo: edad, APACHE II) como frecuencias y porcentajes para las cualitativas (por ejemplo: número de ingresos previos). Para medir la asociación entre las variables categóricas y el porcentaje de pacientes fallecidos se usó el test de la Chi-cuadrado o el test exacto de Fisher. Este solo se ha utilizado en el caso de que ambas variables fueran dicotómicas y las frecuencias esperadas fueran menores de 5. En el resto de las situaciones se aplicó el test de la Chi-cuadrado. En cambio, para la comparación de medias de las variables del ingreso se utilizó la t de Student (o U de Mann-Withney en caso de que no pudiese asumirse normalidad). En el análisis multivariante se desarrollaron modelos de regresión logística para la predicción de mortalidad hospitalaria. Finalmente, se valoró el área bajo la curva (ABC) junto con su intervalo de confianza al 95%. Todos los cálculos estadísticos se realizaron mediante el programa SAS System v. 9.1. El nivel de significación se asumió cuando p<0,05.
ResultadosDurante el periodo del estudio se incluyeron 102 episodios consecutivos con el diagnóstico de EPOC exacerbada (91% varones) con una edad media de 69,4±10,6 años (tabla 1). El 56,6% tuvieron un índice de Charlson mayor de 2 sin incluir su EPOC. Las patologías asociadas más frecuentemente fueron la insuficiencia cardiaca (IC) (48,5%) y la hipertensión arterial sistémica (50,5%).
Características de los pacientes con enfermedad pulmonar obstructiva crónica ingresados.
| Variables | Valores perdidos | Total |
| N (%) | 102 (100) | |
| Edad media (DS) | 0 | 69,4 (10,6) |
| Sexo: varones | 0 | 92 (90,1) |
| Fumador activo | 0 | 37 (36,3) |
| Paquetes/año (DS) | 0 | 54,1 (27,1) |
| Disnea basal (MRC) | ||
| I | 1 | 4 (4,0) |
| II | 8 (7,9) | |
| III | 40 (39,6) | |
| IV/V | 44 (43,5) | |
| IMC medio | ||
| > 20 | 7 | 8 (8,5) |
| 20-24 | 13 (13,8) | |
| 25-29 | 27 (28,7) | |
| 30-34 | 22 (23,4) | |
| ≥ 35 | 25 (26,6) | |
| Índice de Charlsona | ||
| 0 | 0 | 18 (17,7) |
| 1 | 26 (25,6) | |
| 2 | 29 (28,4) | |
| ≥ 3 | 29 (28,4) | |
| N.° ingresos año previo | ||
| 0 | 0 | 48 (47,1) |
| 1 | 24 (23,5) | |
| ≥ 2 | 30 (29,4) | |
| FEV1-% sobre teórico (DS) | 5 | 42,4 (13,5) |
| Puntuación escala multidimensional ADO (DS) | 5 | 5,2 (1,6) |
| Variables ingreso en UCRI | ||
| FR (DS) | 2 | 28,7 (7,1) |
| pH (DS) | 0 | 7,28 (0,09) |
| pCO2(DS) | 0 | 72,0 (20,7) |
| pO2(DS) | 0 | 53,3 (16,6) |
| Glasgow (DS) | 2 | 14,5 (1,5) |
| Glucemia | ||
| < 110 | 0 | 19 (18,6) |
| 110-200 | 62 (60,8) | |
| 200-250 | 14 (13,7) | |
| > 250 | 7 (6,9) | |
| Albúmina (DS) | 17 | 4,0 (0,5) |
| Hematocrito | 0 | 16 (15,8) |
| < 39 (< 36 en mujeres) | ||
| 39-49 (36-48 en mujeres) | 52 (51,5) | |
| >49 (> 48 en mujeres) | 33 (32,7) | |
| APACHE II (DS) | 1 | 19,0 (5,2) |
| SOFA (DS) | 2 | 6,6 (1,5) |
| SOFA (DS)b | 2 | 3,5 (1,6) |
| 0 | 37 (50,0) | |
| 1 | 20 (27,0) | |
| 2 | 10 (13,5) | |
| ≥ 3 | 7 (9,5) | |
Las variables numéricas expresan el número (N) y el porcentaje (%) que presentan sobre el total de pacientes ingresados (n=102 pacientes). La edad, los paquetes/año, volumen espiratorio forzado en el primer segundo (FEV1), frecuencia respiratoria (FR), pH, pCO2, pO2, escala de Glasgow, albúmina, puntuación de APACHE II, SOFA y la escala multidimensional para la valoración de la EPOC (ADO) se describen como media y desviación estándar (DS). El índice de masa corporal (IMC) se detalla como media y DS, y también categorizado.
MRC: Medical Research Council.
El 87,0% de los sujetos presentaron una disnea basal III/V o superior, medida según la escala MRC, y un 29,4% habían presentado dos o más ingresos por exacerbación el año anterior. Su índice de masa corporal (IMC) medio era 30,1±6,8 y el FEV1 medio fue de 1.460,2±554,5ml (45,0±16,3% respecto del teórico). Un 49% de los casos disponían de oxigenoterapia crónica domiciliaria (OCD). El 31,4% fueron diagnosticados de síndrome apnea-hipopnea del sueño (SAHS) severo previamente al ingreso o tras nuestra sospecha, durante los 3 meses posteriores al mismo (de ellos, 15 recibían VMNI con sistema bipresión, 2 disponían de CPAP y 4 OCD antes de la hospitalización). Además de los pacientes con SAHS, otros 18 pacientes (17,6%) eran tratados con VMNI domiciliaria. Según la escala ADO, la puntuación media de los ingresados fue 5,2±1,6.
Respecto a la severidad del episodio de exacerbación: el APACHE II en las primeras 24 horas del ingreso en la UCRI fue de 19,6±5,0. El 50% de los pacientes sufrían disfunción de otro órgano no respiratorio según la escala SOFA y un 9,5% fallo de otro órgano no respiratorio. El 75,3% de nuestros pacientes recibieron VMNI. Se observó fracaso de la ventilación en 9 pacientes (11,6% de los ventilados), de los cuales 5 (45,5%) fueron trasladados a la UCI, donde recibieron IOT y VMI, no falleciendo ninguno de estos durante el episodio de hospitalización. El 23,5% de los pacientes presentaron alguna complicación durante el ingreso, siendo las más frecuentes la descompensación diabética (6,9%), las arritmias (3,9%) y cardiopatía isquémica en forma de angor o infarto agudo de miocardio (2,9%). La duración de la estancia en la UCRI fue de 3,5±2,1 días y la estancia hospitalaria total fue de 8,0±5,3 días, con una mediana de 6 días. La mortalidad durante el episodio de hospitalización fue de 6,9%, y un 12,7% a los 90 días del alta hospitalaria. Se prescribió VMNI al alta en 8 nuevos pacientes (7,9%). No hubo diferencias estadísticamente significativas entre los pacientes que presentaban SAHS y los que no la presentaban.
En la tabla 2 se enumeran las variables que en el análisis univariante presentaron una asociación estadísticamente significativa con la mortalidad hospitalaria: la disnea basal, el número de ingresos por agudización de su EPOC durante el año previo y la clasificación de la EPOC mediante la escala multidimensional ADO, la evolución de la FR y de la puntuación de la escala Glasgow. No encontramos relación entre el Índice de Charlson y la mortalidad hospitalaria, ni analizando por separado los pacientes con comorbilidades cardiovasculares, diabetes mellitus o cardiopatía isquémica.
Variables asociadas a la mortalidad hospitalaria: análisis univariante.
| Variables | Valores perdidos | Fallecidos | Vivos | Total | p |
| N (%) | 7 (6,9) | 95 (93,1) | 102 (100) | ||
| N.° ingresos año previo | 0 | ||||
| 0-1 | 2 (28,7) | 70 (73,7) | 94 (93,1) | 0,0005 | |
| ≥ 2 | 5 (71,4) | 25 (26,6) | 30 (29,49 | ||
| SAHS | 0 | 0 (0) | 32 (34,4) | 32 (31,4) | 0,007 |
| ADO (DS) | 5 | 6,7 (1,5) | 5,1 (1,6) | 5,2 (1,6) | 0,01 |
| Disnea basal (escala MRC) | 1 | 0,01 | |||
| I | 1 (14,3) | 3 (3,2) | 4 (4,0) | ||
| II | 0 (0) | 8 (8,5) | 8 (7,9) | ||
| III | 1 (14,3) | 39 (41,5) | 40 (39,6) | ||
| IV-V | 5 (71,4) | 44 (46,8) | 44 (43,5) | ||
| FR 2 h del ingreso (DS) | 7 | 28,5 (10,4) | 24,4 (5,7) | 24,7 (6,2) | 0,41 |
| FR 4-6 h del ingreso (DS) | 11 | 28,1 (8,9) | 22,4 (5,1) | 24 (6,1) | 0,04 |
| Glasgow 4-6 h del ingreso (DS) | 16 | 10,8 (4,8) | 14,7 (1,1) | 14,5 (1,8) | < 0,001 |
Las variables numéricas expresan el número (N) y el porcentaje (%) que presentan sobre el total de pacientes ingresados (n=102 pacientes). La frecuencia respiratoria (FR) y la puntuación del Glasgow se describen como media y desviación estándar (DS). La relación con la mortalidad de las siguientes variables no era estadísticamente significativa: edad, sexo, ser fumador activo, número de paquetes/año, índice de masa corporal, índice de Charlson, FEV1, FR, pH, PCO2, pO2 y Glasgow al ingreso en la unidad de cuidados respiratorios intermedios (UCRI), albúmina, hematocrito, puntuación de APACHE II y de SOFA.
ADO: escalas multidimensionales para la valoración de la EPOC18; MRC: Medical Research Council; SAHS: síndrome de apnea hipopnea del sueño.
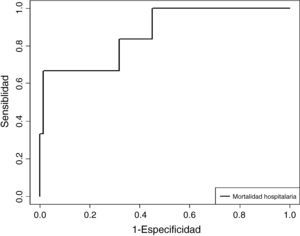
El análisis multivariante (tabla 3) identificó 3 variables relacionadas con la mortalidad hospitalaria: el número de ingresos por exacerbación durante el año previo (p=0,048), la frecuencia respiratoria a las 2 horas del ingreso en la UCRI (p=0,024) y la puntuación obtenida en la escala multidimensional ADO (p=0,048). El modelo predictivo alcanzó un ABC de 0,867 (fig. 1).
Variables relacionadas con la mortalidad hospitalaria y a los 90 días tras un ingreso por exacerbación de la enfermedad pulmonar obstructiva crónica en la unidad de cuidados respiratorios intermedios. Análisis de regresión logística multivariante.
| Variables | Mortalidad hospitalaria | ||
| EPOC ingresados en la UCRI | OR | IC 95% | p |
| Número de ingresos durante el año previo | |||
| 0-1 | 1 | ||
| ≥ 2 | 9,10 | (1,02-81,12) | 0,048 |
| Escala ADOa | 2,84 | (1,15-7,05) | 0,0241 |
| Frecuencia respiratoria 2 horas del ingreso en la UCRIb | 2,25 | (1,01-5,05) | 0,0484 |
| Área bajo la curva | 0,867 | (0,703-1) | < 0,0001 |
Para realizar el análisis multivariante se han analizado todas las variables que resultaron estadísticamente significativas o con una p ≤ 0,50 en el análisis univariante y que se detallan en la tabla 2.
Curva ROC del modelo predictivo para calcular la mortalidad hospitalaria, basado en el número de ingresos por exacerbación durante el año previo, la puntuación de la escala multidimensional ADO y la frecuencia respiratoria a las 2 horas del ingreso en la unidad de cuidados respiratorios intermedios (AUC: 0,867).
Este es el primer estudio realizado en una UCRI española que analiza conjuntamente variables clínico-fisiológicas medidas durante un ingreso por exacerbación de la EPOC y parámetros relacionados con la afectación multisistémica y la gravedad de la propia enfermedad. Los resultados de este estudio apuntan la necesidad de realizar una evaluación multidimensional simple, incluso en el subgrupo tan específico de pacientes con EPOC descompensada y que ingresan en la UCRI. La principal fortaleza del trabajo es que identifica 3 variables sencillas que nos proporcionan una visión global de la situación basal del paciente y de la gravedad del episodio actual que conjuntamente consiguen una capacidad predictiva de mortalidad hospitalaria muy alta (estadístico C: 0,867). Otra de las ventajas que ofrecía este modelo, si se comparaba con otras escalas pronósticas1,4, es que se basaba en datos simples y fáciles de disponer, permitiendo realizar una predicción del curso de la enfermedad en las primeras horas del ingreso. A diferencia de otros trabajos realizados en la UCRI22–26, no incluimos pacientes con neumonía, IC o tromboembolismo pulmonar (TEP) como causa de ingreso de los pacientes EPOC, porque la respuesta al tratamiento y el pronóstico de estas enfermedades es diferente de la exacerbación de la EPOC.
Cada una de las variables del modelo ha sido estudiada previamente en pacientes con EPOC y se ha relacionado con el pronóstico de dicha enfermedad. Los ingresos previos por agudización grave de la enfermedad se han mostrado como una variable independiente de mortalidad tanto en pacientes EPOC estables5 como en ingresados por una nueva exacerbación3. Además, se observa una relación lineal, es decir, a mayor número de hospitalizaciones por agudización, mayor riesgo de muerte3,5. En nuestro estudio, la presencia de 2 o más ingresos hospitalarios durante el año previo multiplicaba por nueve la posibilidad de fallecer durante el episodio analizado (OR=9,1, IC del 95%: 1,02-81,12). Por otro lado, se sabe que el 80% de los pacientes EPOC fallecidos tuvieron algún ingreso durante el último año de vida27. No está claro cuál sería el mecanismo por el cual la exacerbación impactaría en el curso general de la enfermedad, pero parece que aumentaría la respuesta inflamatoria local y sistémica y que el grado de esta inflamación estaría en relación con la presencia de gérmenes patógenos28, aunque aún queda por definir durante cuánto tiempo persiste este efecto.
La FR medida a las 2 horas ha sido otra de las variables previamente relacionadas con la mortalidad en pacientes ventilados tanto en planta de neumología11 como en la UCI29. Esta variable podría estar indicando una respuesta al tratamiento suministrado (farmacológico o de soporte ventilatorio) y por lo tanto sería la respuesta al tratamiento y no solo la gravedad inicial la que nos permitirá establecer el pronóstico de estos pacientes. Esto explicaría por qué ninguna variable gasométrica ni fisiológica (FR, frecuencia cardíaca, tensión arterial) se asoció con la mortalidad en nuestro estudio ni en otros con pacientes similares6,11,30. La subpoblación de pacientes EPOC que ingresaron en la UCRI estaba muy evolucionada, es decir, la mayoría presentaban PCO2 elevadas y Ph alterados y como los valores de estas variables se movían en un rango tan reducido, no permitieron discriminar cuáles de los pacientes podían fallecer durante la hospitalización. Los estudios que afirmaban la relación del Ph31, pO2/FiO21,5 y PCO232,33 con la mortalidad eran estudios realizados en pacientes EPOC ingresados por una exacerbación, pero no en una subpoblación tan evolucionada como la nuestra, sino que incluían tanto pacientes ingresados en planta de neumología (con y sin insuficiencia respiratoria) como pacientes ingresados en la UCI e intubados, con lo cual el rango de los valores del Ph, PCO2 y pO2/FiO2 era más amplio.
Desde el año 2005 se han publicado varios modelos multidimensionales para evaluar el pronóstico de la EPOC21,34–36. Todas estas escalas se derivaron de pacientes en estado estable y, aunque se sabe que su puntuación varía durante las exacerbaciones37,38, no se han utilizado para evaluar el pronóstico durante un episodio de agudización. Connors et al publicaron en 19961 el estudio multicéntrico más numeroso de pacientes ingresados por una exacerbación de la EPOC e insuficiencia respiratoria hipercápnica, con una mortalidad hospitalaria de 11%. Crearon un modelo matemático para calcular la mortalidad del paciente reagudizado basado en la albúmina al ingreso, IMC, edad, Acute Physiology Score (APS) III, pO2/ FiO2, IC como causa de descompensación y el estado funcional del paciente, consiguiendo un ABC de 0,75. Sin embargo, su modelo es complejo y no ha logrado adherencia en la práctica clínica diaria. La escala ADO21, publicada recientemente y basada en la edad, disnea y obstrucción del paciente, no había sido utilizada previamente para valorar pacientes agudizados. Las escalas pronósticas de gravedad utilizadas en las UCI e intermedios (APACHE II, SAPS) han presentado resultados divergentes cuando se estudiaron pacientes con EPOC4,29,30,39,40. Según Agarwal et al14, los pacientes EPOC obtendrían una mayor puntuación en la escala APACHE II debido a su edad, con respecto a otros pacientes con insuficiencia respiratoria, que no se correspondería con la mortalidad observada. En nuestro trabajo no hallamos relación estadísticamente significativa entre el APACHE II y la mortalidad hospitalaria13, ni tampoco con las variables analíticas estudiadas: glucosa, hematocrito, albúmina. La glucemia se había relacionado previamente con el fracaso de la VMNI41, hallazgo que confirmaron Chakrabarti et al24 en su artículo, sin embargo en su muestra de 88 pacientes, 11 presentaban neumonía, y en esta patología sí se han relacionado los valores de la glucemia42 con la mortalidad, lo que pudiera estar condicionando sus resultados y explicar las diferencias con nuestros hallazgos. Por otro lado, Baker et al43 realizan un estudio retrospectivo de todos los pacientes EPOC ingresados durante un periodo de un año, y toman el valor más elevado de la glucosa durante la hospitalización, no el valor inicial al ingreso, por lo que estas diferencias en la metodología empleada pudieran explicar las diferencias en los resultados. La albúmina44 y el hematocrito45 se han relacionado con la supervivencia en pacientes estables. Por otro lado, en pacientes EPOC tratados con ventilación invasiva e ingresados en la UCI, la albúmina se ha relacionado con la mortalidad hospitalaria6 y a medio plazo33, pero en nuestra cohorte de pacientes no hemos podido confirmar este hallazgo.
Las principales limitaciones de nuestro estudio son: 1) El número total de fallecidos de la cohorte estudiada es escaso, pero el elevado estadístico C alcanzado por nuestro modelo utilizando tan pocos casos da mucha consistencia a las 3 variables predictoras incluidas. 2) Los datos solo corresponden a un hospital, por lo que los resultados podrían no ser generalizables. 3) Además, esta muestra podía considerarse heterogénea, porque incluimos pacientes monitorizados y ventilados, pero esta circunstancia se da también en otros artículos de pacientes EPOC ingresados en la UCRI23–27. A diferencia de ellos, y a modo de reducir esta heterogenicidad, hemos excluido los pacientes EPOC ingresados por otras causas: neumonía, sepsis, TEP, IC. 4) El IMC de nuestros pacientes es elevado, pero es una tendencia cada vez mayor entre pacientes con EPOC en países europeos, principalmente mediterráneos y Norteamérica46,47. Directamente ligado con este IMC, el porcentaje de pacientes de nuestra muestra que ha sido diagnosticado de SAHS es elevado. En un estudio de prevalencia de nuestra región publicado en el 200142, el 32,2% de los varones entre 60 y 70 años presentaban un IAH superior a 10 y este porcentaje aumentaba en función del IMC y la edad. Nuestros pacientes presentaban un IMC y una edad superior a los de la muestra de Duran et al48, por lo que consideramos que esta prevalencia sería similar a la población de nuestro entorno con edad e IMC similar.
Como conclusión, decir que en los pacientes ingresados por una exacerbación hipercápnica de la EPOC en la UCRI, la presencia de 2 o más ingresos previos por reagudización, la puntuación de la escala multidimensional ADO y la respuesta al tratamiento suministrado en las primeras horas, evaluado por medio de la FR a las 2 horas del ingreso en la UCRI, nos permiten identificar de forma sencilla, rápida y con una probabilidad aproximada del 90% a los pacientes que pueden fallecer durante dicha agudización. Sin embargo, debido a las limitaciones de nuestro trabajo, realizado en un solo centro con una n relativamente pequeña y poca mortalidad observada, este modelo debe ser validado en posteriores estudios.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.