La enfermedad pulmonar obstructiva crónica (EPOC) es un trastorno que causa gran morbilidad y mortalidad en todo el mundo1, aunque el número de estudios descriptivos sobre su prevalencia es relativamente escaso2.
Se considera que la epidemiología y distribución de la EPOC en la población general, tanto en el ámbito internacional como en España en particular, son todavía asignaturas pendientes3. En nuestro país se han realizado diversos estudios epidemiológicos de base poblacional, los cuales se han revisado recientemente4. Sin duda, el Estudio Epidemiológico de la EPOC en España (IBERPOC)5,6, realizado bajo los auspicios de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR), ha sido el estudio poblacional más importante e influyente realizado en España, y su metodología ha servido de modelo para la realización de estudios internacionales posteriores7,8.
Pese a la gran aportación de los estudios antes citados al conocimiento de la distribución poblacional de la EPOC, son necesarios una actualización constante y el seguimiento de estas cifras. La epidemiología, o estudio de la distribución y de los determinantes de los sucesos y estados de salud en las poblaciones y en el tiempo, anticipa que la prevalencia de las enfermedades puede variar si los factores contribuyentes se modifican en el espacio y en el tiempo9. Como ocurre con otras enfermedades crónicas relacionadas con el tabaco, la distribución de la EPOC depende fundamentalmente de 2 factores: de los efectos relacionados con la exposición tabáquica acumulada en el tiempo, y del envejecimiento paulatino de la población. Por desgracia, España está a la cabeza de Europa en tabaquismo en adolescentes y ocupa los primeros puestos del mundo por lo que se refiere al consumo de tabaco en mujeres10,11. En este contexto se diseñó el estudio EPIdemiologic Study of COPD in SpAiN (EPI-SCAN), con el objetivo principal de estimar la prevalencia de EPOC en población de 40 a 80 años residente en España, e incluyendo una serie de objetivos secundarios en relación a tendencias, factores de riesgo, variables diagnósticos y valores de referencia (tabla 1). Este manuscrito resume el protocolo del estudio EPI-SCAN.
Tabla 1. Objetivos del estudio EPI-SCAN
| Objetivo principal |
| Estimar la prevalencia de EPOC en población de 40 a 80 años residente en España |
| Objetivos secundarios |
| Describir la prevalencia de tabaquismo en población de 40 a 80 años residente en España según sexo |
| Describir la prevalencia de EPOC por estratos de gravedad |
| Describir la evolución de la prevalencia de EPOC respecto a estudios previos |
| Obtener valores de referencia para la prueba de la marcha y para los marcadores inflamatorios en población sana |
| Evaluar la calidad de vida relacionada con la salud |
| Comparar las 3 cohortes del estudio en función de los parámetros inflamatorios, el cuestionario de actividad diaria London Chest Activity of Daily Living (LCADL) y el cuestionario de exposición profesional |
| Comparar la prevalencia de EPOC en función de los diversos criterios diagnósticos estratificados por gravedad |
| Realizar una valoración multidimensional de la EPOC de acuerdo con el índice BODE (índice de masa corporal, obstrucción al flujo aéreo, disnea y capacidad de ejercicio) |
| Valorar si el tratamiento recibido por los pacientes en los distintos grupos de gravedad se adecua a la normativa internacional |
| Determinar la fiabilidad y reproducibilidad de los parámetros determinados a partir de la prueba de condensado exhalado |
EPI-SCAN es un estudio epidemiológico, observacional, transversal y multicéntrico, de ámbito nacional y base poblacional, con selección de participantes mediante un muestreo en 2 etapas estratificado de acuerdo con las zonas próximas a los centros participantes. Los centros participantes se seleccionaron de acuerdo con 4 zonas geográficas, norte, levante, sur y centro del territorio español, a saber: Barcelona, Burgos, Córdoba, Huesca, Madrid, Oviedo, Sevilla, Valencia, Vic y Vigo.
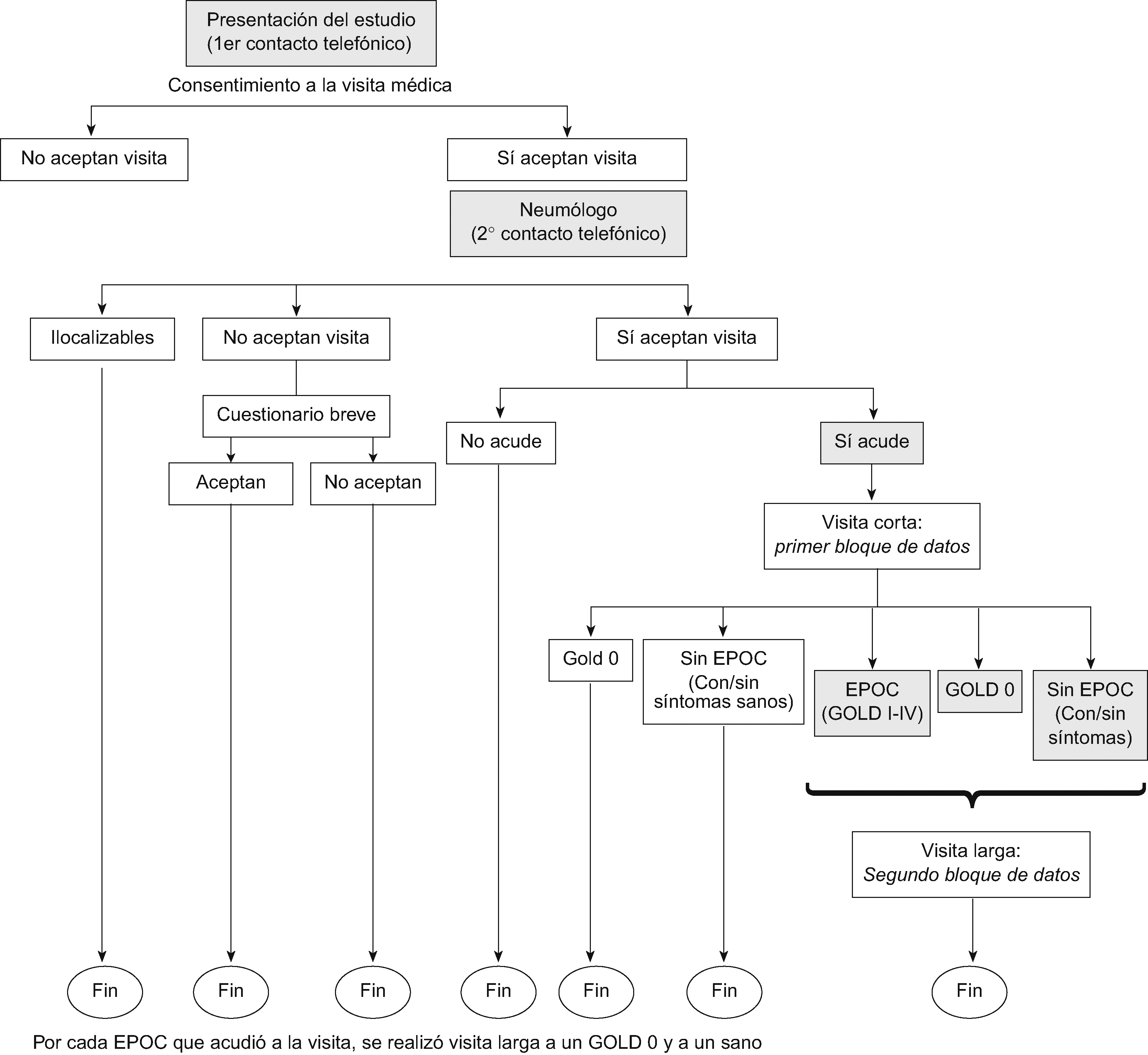
Los criterios de inclusión eran: varones o mujeres de la población general, de 40 a 80 años de edad, residentes en España. Todos los participantes completaron lo que, de acuerdo con el diseño del estudio, se denomina visita corta (fig. 1). Posteriormente, siguiendo la clasificación de la Global Initiative for Chronic Obstructive Lung Disease (GOLD) en vigor durante la fase de discusión del diseño del estudio12, la población se clasificó en 3 cohortes en función de su espirometría y las respuestas a variables previamente definidas: a) con EPOC (o GOLD I–IV), individuos cuyo cociente entre el volumen espiratorio forzado en el primer segundo (FEV1) y la capacidad vital forzada (FVC) tras la prueba broncodilatadora era menor de 0,70 b) GOLD 0, y c) sin EPOC. Este último grupo se subdividió en aquéllos sin síntomas respiratorios que contestaron de forma negativa a la totalidad de las preguntas sobre síntomas respiratorios del cuestionario de la Comunidad Europea del Carbón y del Acero (CECA)13 (tabla 2), y aquéllos con síntomas respiratorios. Cabe destacar que con posterioridad al inicio del estudio la clasificación GOLD ya no menciona el grupo GOLD 01. Sin embargo, creemos que los resultados del estudio EPI-SCAN tendrán la potencialidad de confirmar, o permitir revisar, con mayor nivel de evidencia esta clasificación.
Figura 1. Diseño del estudio. Por cada paciente con EPOC que acudió a la visita, se realizó una visita larga a un participante con nivel 0 de la clasificación de la Global Initiative for Chronic Obstructive Lung Disease (GOLD) o a un participante sano.
Tabla 2. Definición de las cohortes de studio
| Cohorte 1: EPOC (GOLD I-IV) |
| FEV1/FVC<0,70 después de la prueba broncodilatadora |
| Cohorte 2: GOLD 0 |
| FEV1/FVC ≥0,70 después de la prueba broncodilatadora (criterio 26 de CECA) |
| Fumadores (en activo o ex-fumadores) de 10 paquetes/año |
| Tos y/o expectoración al menos 3 meses en el último año (criterios 3 y/o 7 de CECA) |
| Cohorte 3: sin EPOC |
| Individuos sin síntomas respiratorios de acuerdo con el cuestionario CECA |
| FEV1/FVC≥0,70 después de la prueba broncodilatadora (criterio 26 de CECA) |
| Cuestionario CECA negativo (“No” a todas las preguntas) |
| Individuos con síntomas respiratorios de acuerdo con el cuestionario CECA: |
| Individuos no clasificables en ningún grupo anterior |
CECA: Comunidad Europea del Carbón y del Acero; FEV 1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; GOLD: clasificación de la Global Initiative for Chronic Obstructive Lung Disease.
La totalidad de participantes identificados con EPOC en la visita corta completaron también una visita larga en la que se recogieron el resto de variables del estudio relacionadas con los objetivos secundarios. Además, en cada uno de los centros participantes se estudió a un número igual de participantes GOLD 0 y sin EPOC, elegidos consecutivamente y sin alternancia, hasta completar el estudio. El motivo por el que, según el diseño del estudio, se optó por no llevar a cabo la visita larga en todos los participantes fue el de no sobrecargar a toda la población sin EPOC con un exceso de pruebas (fig. 1). El estudio fue autorizado por los comités de ética de la investigación clínica correspondientes, siendo el del Hospital Clínic i Provincial de Barcelona el de referencia. Todos los participantes manifestaron voluntariamente por escrito su consentimiento para realizar las pruebas del estudio.
Selección de los participantesEl muestreo del estudio fue bietápico, poblacional y aleatorio, mediante muestreo telefónico aleatorio. Antes del proceso de muestreo se definieron los códigos postales más próximos a cada hospital/área participante en el estudio. En la primera etapa de muestreo se utilizó una lista de números de teléfono aleatorios y estratificados de acuerdo con los códigos postales. En la segunda etapa, entrevistadores debidamente entrenados de una empresa especializada realizaron, a modo de cribado, una primera llamada telefónica asistida por ordenador, mediante Computer Assisted Telephone Interviewing (CATI), en la que informaron sobre el estudio y solicitaron el consentimiento para recibir una segunda llamada que debía realizar el investigador. En este segundo contacto telefónico, cada investigador debía citar a los participantes para una visita médica en el hospital. A quienes no accedieron se les administraba un breve cuestionario que incluía preguntas sobre datos sociodemográficos y síntomas o diagnósticos respiratorios. Los participantes que finalmente acudieron al hospital constituyeron la muestra final del estudio.
Organización del estudioPara la preparación y asesoramiento del estudio se constituyó un Comité Científico formado por 2 epidemiólogos y 6 neumólogos (véase “Apéndice”). El trabajo de campo se realizó entre los meses de mayo de 2006 y julio de 2007. Participaron en el estudio 11 centros. En cada uno de los hospitales participaron: un neumólogo como coordinador del estudio, de uno a 3 neumólogos o médicos adecuadamente entrenados como investigadores principales, y una enfermera encargada de la extracción y procesamiento de muestras.
Variables y procedimientosCuestionarios. Una vez que el participante aceptaba acudir a la visita con el neumólogo, se llevaba a cabo en el hospital la denominada visita corta. En ella se recogía un primer bloque de datos: sociodemográficos, hábito tabáquico, diagnóstico de enfermedades respiratorias y otras enfermedades, exacerbaciones, escala de disnea, tratamiento para enfermedades respiratorias, cuestionario CECA sobre síntomas respiratorios y un cuestionario de exposición profesional. A continuación se describen brevemente estos instrumentos o medidas.
El cuestionario CECA, elaborado originalmente en inglés, tiene una versión traducida y validada al castellano13. Consta de 6 secciones —tos y expectoración, disnea, silbidos y opresión intratorácica, crisis de asma y tratamiento (inhaladores, supositorios, medicamentos por vía oral o inyección)—, con 26 ítems en total. En estudios poblacionales es el cuestionario de referencia para estudios epidemiológicos de prevalencia de síntomas respiratorios crónicos en población adulta. Con las respuestas obtenidas se pueden delimitar de forma aproximada algunas situaciones como tos crónica, expectoración crónica o disnea, con diferentes grados de gravedad. También permite definir la bronquitis crónica.
Para la caracterización de la disnea se utilizó también la escala de disnea modificada del Medical Research Council (mMRC)14, que indica el grado subjetivo de disnea valorando qué tareas habituales puede desarrollar el paciente sin que aparezca la disnea, desde “sólo en esfuerzos extremos” (mMRC grado 1) hasta “disnea de reposo o durante la realización de las actividades de la vida diaria” (mMRC grado 5).
Respecto a los tratamientos respiratorios, para el total de la muestra y para el grupo de pacientes con diagnóstico conocido de EPOC que recibían tratamiento de acuerdo con éste, se describió el patrón de tratamiento farmacológico: broncodilatadores, antiinflamatorios inhalados, otros (p. ej., vacunas, antibióticos, mucolíticos, etc.) y oxigenoterapia.
Para la medición de las actividades de la vida diaria se utilizó la escala London Chest Activity of Daily Living (LCADL)15, que es un cuestionario específico con 15 ítems y 4 grupos de actividades: autocuidado (4 ítems), domésticas (6 ítems) físicas (2 ítems) y ocio o tiempo libre (3 ítems). Cada ítem puntúa de 0 a 5 el ahogo que se ha tenido en el momento de realizar las diversas tareas. Permite obtener una puntuación para cada grupo de actividades y una puntuación total. El cuestionario LCADL está traducido y validado en español16. Finalmente, se utilizaron 2 cuestionarios de calidad de vida: EuroQoL Five-Dimension Questionnaire (EQ-5D) y St George's Respiratory Questionnaire (SGRQ). El EQ-5D17, un cuestionario genérico de calidad de vida reducido y diseñado a partir del cuestionario EUROQoL18, contiene un sistema descriptivo y una escala visual para la autoevaluación del estado de salud. El sistema descriptivo posee 5 dimensiones (movilidad, cuidado personal, actividades cotidianas, dolor/malestar y ansiedad/ depresión) con 3 opciones de respuesta (“Sin problemas”, “Algunos/moderados problemas” y “Muchos problemas”). La escala visual analógica se presenta en forma de termómetro, cuyos extremos aparecen etiquetados con “peor estado de salud imaginable” y “mejor estado de salud imaginable”, con puntuaciones de 0 a 100, respectivamente. El SGRQ19 es un cuestionario específico de calidad de vida, formado por 50 ítems y 3 dimensiones: síntomas (8 ítems), con escala de respuesta tipo Likert; actividades (16 ítems), e impacto en la vida diaria (26 ítems), estas 2 últimas con respuestas dicotómicas (Sí/No). Se obtiene una puntuación para cada dimensión, así como una puntuación global. Las puntuaciones bajas indican una mejor calidad de vida. En este estudio se utilizó la versión adaptada y validada en población española20.
Espirometría. En todos los centros se realizó a los participantes una espirometría lenta y forzada con un equipo Master Scope CT (VIASYS Healthcare, Hoechberg, Alemania). Se emplearon los criterios de aceptabilidad y reproducibilidad, así como la selección de la maniobra, propuestos en las recomendaciones de la American Thoracic Society/European Respiratory Society (ATS/ERS)21 más recientes, y se utilizaron los valores de referencia europeos22. Las maniobras lentas y forzadas se repitieron 15–30 min después de la inhalación de 200 μg de salbutamol. Siguiendo el criterio de las guías ATS/ERS23, la prueba broncodilatadora se consideró positiva cuando se registró un incremento de la FVC o del FEV1 superior al 200 ml y mayor del 12% con respecto al valor basal.
Como control de calidad del procedimiento, se analizaron las primeras 1.745 exploraciones realizadas, procedentes de todos los centros participantes en el estudio. Se verificó que el 89,1% de las maniobras tenía un inicio adecuado (volumen de extrapolación retrógrada<150 ml o<5% del FVC), que el 85,6% tenía una duración de al menos 6 s y que el 90,6% alcanzaba una meseta teleespiratoria satisfactoria (cambio de volumen<30 ml en el último segundo). De forma global, un 80,3% de las maniobras realizadas cumplía todos los criterios de aceptabilidad. También se comprobó que el 95,3% de las espirometrías cumplía los criterios de reproducibilidad del consenso de la ATS24 para el FEV1 y el 96,4% para la FVC.
Otras mediciones. Todos los participantes asignados a la cohorte EPOC y un número igual de participantes, elegidos consecutivamente, de las cohortes GOLD 0 y sin EPOC (con y sin síntomas respiratorios de acuerdo con el cuestionario CECA) realizaron la denominada visita larga. En ella se registraron las variables correspondientes al segundo bloque de datos: pulsioximetría, prueba de la marcha, recogida de una muestra de condensado de aire exhalado y muestra de sangre.
Prueba de la marcha . Se siguieron las indicaciones establecidas en las guías de la ATS para la realización de la prueba de la marcha de 6 min25. Los investigadores disponían de las instrucciones que debían seguir para la realización de esta prueba de forma correcta y estandarizada. Con objeto de controlar el efecto aprendizaje se llevaron a cabo 2 caminatas con un intervalo de 30 min de reposo. En caso que el participante presentara muchos síntomas en la primera caminata, quedaba a criterio médico la realización de la segunda.
Condensado de aire exhalado . Sólo 2 de los centros participantes contaban con recursos para recoger esta muestra (Hospital Clínic i Provincial de Barcelona y Hospital La Paz). Tras estimar, mediante el cálculo del tamaño muestral, la muestra mínima necesaria para poder obtener conclusiones acerca de su resultado sin sobrecargar de pruebas a todos los participantes, se decidió recoger 44 muestras.
Muestra de sangre . En la visita larga se recogieron 20 ml de sangre de cada participante para determinar las concentraciones de alfa-1-antitripsina, proteína C reactiva, factor de crecimiento tumoral alfa, interleucinas-6 y 8, fibrinógeno, albúmina, nitritos y nitratos. Tanto para las muestras de condensado como para las muestras de sangre se estandarizó el procedimiento de recogida. Cada centro debía mantener las muestras obtenidas a −80 °C. Aproximadamente cada 2 meses se remitían las muestras al laboratorio del Hospital Clínic i Provincial de Barcelona con objeto de centralizar el análisis. El personal de enfermería de cada centro disponía de un manual elaborado por dicho laboratorio para efectuar la extracción y el almacenamiento de forma correcta y estandarizada. Para la prueba de la marcha y para la medición de los marcadores inflamatorios en sangre en población sana se tuvieron en cuenta los criterios de exclusión que se muestran en la tabla 3.
Tabla 3. Criterios de exclusión en la prueba de la marcha y en los marcadores inflamatorios
| Prueba de la marcha | Marcadores inflamatorios |
| Angina inestable durante el mes previo | Infarto agudo de miocardio/angina |
| Infarto agudo de miocardio durante el mes previo | Insuficiencia cardíaca congestiva |
| Frecuencia cardíaca en reposo > 120 lat/min | Neoplasia |
| Presión arterial sistólica > 180 mmHg | Cirrosis hepática |
| Presión arterial diastólica > 100 mmHg | Insuficiencia renal crónica |
| Artritis reumatoide | |
| Enfermedad inflamatoria sistémica que aumente los valores de proteína C reactiva |
El estudio se realizó a través de una página web [ http://episcan.hor-europe.com/frmValida.asp ] especialmente diseñada al efecto, en la que los investigadores disponían de la lista aleatoria de contactos telefónicos que debían realizar y de los campos correspondientes a las variables que había que recoger.
Los investigadores, tras obtener el consentimiento informado de los participantes, recogían las variables del estudio en un cuaderno de recogida de datos en formato papel. Debían trasladar regularmente estos datos al formato electrónico. La duración aproximada de las visitas cortas (primer bloque de datos) fue de 1 h, y la de las visitas largas (primer y segundo bloques de datos), de 2,5 a 3 h.
Determinación del tamaño muestralPara calcular el tamaño muestral del estudio EPI-SCAN se estimó una prevalencia de EPOC del 12%, con una precisión del ±1%. Suponiendo que hubiera un 20% de pérdidas, el número teórico de individuos que había que incluir en el estudio fue de 5.071. Se calculó que el grupo de participantes con diagnóstico de EPOC debía ascender como mínimo a 486. Estimando una prevalencia de sujetos con criterios GOLD 0 del 20%26, se calculó que este grupo debía estar formado por un total de 811 participantes y que los 2.759 restantes debían pertenecer al grupo de población sin EPOC.
Análisis estadísticoLos resultados de las variables continuas se presentarán como media, desviación estándar, mínimo, mediana, máximo y número de casos válidos. Para las variables categóricas se utilizarán el recuento de casos por cada categoría y la frecuencia relativa al total de respuestas. Los datos se analizarán con el paquete estadístico SPSS versión 15.0 (SPSS Inc, Chicago, Illinois, EE.UU) para Windows. En todas las pruebas estadísticas el valor de significación estadística será de 0,05.
En el estudio de la falta de respuesta se compararán las características sociodemográficas y clínicas de quienes no aceptaron participar en el estudio con las de los pacientes incluidos.
La prevalencia de la EPOC, con su intervalo de confianza del 95%, se calculará de acuerdo con varios criterios espirométricos (ERS antigua, ATS antigua y GOLD). La concordancia entre los criterios diagnósticos se evaluará mediante el porcentaje de casos concordantes y el índice kappa. Para conocer el riesgo de presentar EPOC en función del sexo, de la edad y de otras variables que pudieran estar relacionadas, se realizará un análisis multivariante mediante regresión logística, tomando como variable dependiente la presencia de EPOC y como variables independientes la edad, el sexo y las variables que pudieran estar relacionadas con esta enfermedad.
Se efectuará un análisis descriptivo de las características sociodemográficas (sexo, edad, estudios, profesión, tabaquismo) y clínicas (diagnóstico previo de asma, otros diagnósticos respiratorios, enfermedades concomitantes, antecedentes de espirometría, antecedentes de exacerbaciones, síntomas indicativos de EPOC) de la población de estudio. Se describirá el resultado de los parámetros antropométricos (peso, talla, índice de masa corporal), de la escala de disnea (mMRC), de las pruebas complementarias realizadas (pulsioximetría, espirometría forzada y lenta con prueba de broncodilatación, parámetros analíticos, condensado exhalado, prueba de la marcha) y de los cuestionarios de síntomas (CECA) y exposición profesional. Se determinará asimismo el índice de los participantes identificados con EPOC27.
Se compararán los datos sociodemográficos y clínicos de las 3 cohortes del estudio (GOLD I-IV, GOLD 0 y sin EPOC). En las situaciones que se considere de interés, se dividirá la cohorte sin EPOC en sujetos con y sin síntomas respiratorios de acuerdo con el cuestionario CECA. Se compararán las características de los grupos de la muestra obtenida mediante la prueba de la t de Student o ANOVA, según sea necesario, en el caso de las variables continuas, y mediante la prueba de la χ2 en el caso de las variables categóricas. Cuando la prueba ANOVA muestre un valor de significación inferior a 0,05, en las comparaciones post hoc se utilizará la prueba de Bonferroni a un valor de significación de 0,01 para detectar diferencias 2 a 2 y corregir de este modo el nivel de significación observado por el hecho de realizar comparaciones múltiples.
DiscusiónEl estudio EPI-SCAN debe permitir determinar la evolución de la situación epidemiológica de la EPOC en España. En la actualidad los datos más representativos proceden del estudio IBERPOC, cuyo trabajo de campo se llevó a cabo hace más de 10 años5.
El estudio IBERPOC se diseñó para medir la prevalencia y variación de la distribución de la EPOC en España. Se realizó en 7 zonas geográficas (Burgos, Cáceres, Madrid, Manlleu, Oviedo, Sevilla y Vizcaya) con un muestreo de individuos de 40–69 años elegidos aleatoriamente a partir del censo. La prevalencia de EPOC (definida, según criterios antiguos de la ERS28, como cociente FEV1/FVC<88% del teórico en varones y<89% del teórico en mujeres) en 1997 fue del 9,1%, correspondiendo por sexos a un 14,3% en varones y un 3,9% en mujeres. Según el hábito tabáquico, la prevalencia fue del 15% en fumadores, del 12,8% en ex-fumadores y del 4,1% en no fumadores29. El estudio IBERPOC encontró además diferencias muy importantes según el área geográfica, desde sólo el 4,9% en Cáceres hasta un 18% en Manlleu, diferencias posiblemente relacionadas con factores ambientales o laborales no estudiados. Un aspecto muy importante de los resultados del estudio IBERPOC fue el alto grado de infradiagnóstico, pues el 78,2% de los casos confirmados por espirometría no tenía diagnóstico previo de EPOC, así como la asociación independiente entre el diagnóstico de EPOC y vivir en zonas urbanas, sexo masculino, mayor edad, bajo nivel socioeconómico, historia de tabaquismo e historia de síntomas de bronquitis crónica30. IBERPOC estimó que en España 1.228.000 personas de 40–69 años presentaban EPOC y que un 75% de ellas no estaban diagnosticadas29.
Otros estudios realizados en España han obtenido cifras de prevalencia de EPOC muy parecidas a las del IBERPOC, como el llevado a cabo en la comarca catalana del Vallès31, con una muestra a partir del censo de adultos de 20–70 años, en el que la prevalencia de obstrucción al flujo aéreo (según criterios de la British Thoracic Society32 (FEV1<80% y FEV1/FVC<0,7) fue del 7,2% (un 10,4% en varones y un 4,1% en mujeres), superior en personas de mayor edad y en fumadores y ex-fumadores. Estudios locales efectuados en Valencia33, Guipúzcoa34 y Castellón35, todos de base poblacional, también encontraron cifras de prevalencia muy semejantes. Otro estudio realizado en la provincia de Toledo, en personas mayores de 40 años fumadoras o ex-fumadoras, encontró una prevalencia del 16,4% (intervalo de confianza del 95%, 12,9–19,9%)36. Sin embargo, la comparación de resultados de prevalencia entre diferentes estudios, incluso en el mismo ámbito geográfico, no es directa y debe realizarse con cautela. En el resultado final pueden influir sobremanera variaciones en los umbrales de diagnóstico y gravedad37, y también modificaciones sutiles del protocolo como los criterios de inclusión y exclusión, el número de intentos de espirometría forzada o diferencias en la dosis, en la duración o en el fármaco utilizado para obtener los valores espirométricos tras la prueba broncodilatadora38.
Según los últimos datos disponibles, procedentes de la Encuesta Nacional de Salud de 200739, en España fuma el 27,1% de la población adulta. El porcentaje es mayor en varones que en mujeres (el 32,2 frente al 22,1%). Respecto a datos de los años noventa, se observa un ligero descenso en la prevalencia de tabaquismo en varones, pero no se aprecia variación alguna en mujeres. Además, las previsiones indican que la población española llegará a su crecimiento máximo en 2050, cuando tendrá 53 millones de habitantes, y que el envejecimiento máximo se alcanzará alrededor de 206040, con un incremento de la población con riesgo de desarrollar obstrucción irreversible del flujo aéreo. Por este motivo, es lógico suponer que en España se asistirá en los próximos años a una verdadera epidemia de EPOC, definida como un número de casos en el espacio y en el tiempo superior a lo esperado. Así pues, el seguimiento de los factores de riesgo y la generación de nuevos datos epidemiológicos sobre la EPOC deben considerarse una prioridad de investigación en España.
Finalmente, debe destacarse el diseño único del estudio EPI-SCAN, pues la obtención de muestras biológicas en una muestra poblacional seleccionada de forma aleatoria debe permitir investigar variables que puedan estar relacionadas con la susceptibilidad o el pronóstico de la EPOC. En particular, resultará de interés comprobar si los participantes antes denominados GOLD 012 presentan unas características, desde el punto de vista bioquímico y de fenotipo clínico, distintas de los fumadores asintomáticos, y estos datos pueden aportar una visión nueva sobre la clasificación de los pacientes con síntomas pero sin obstrucción al flujo aéreo.
En el protocolo EPI-SCAN se decidió a priori utilizar los valores de referencia europeos22 para dar mayor proyección a los resultados. Sin embargo, como se almacenó cada uno de los valores absolutos, también se podrían presentar resultados con los valores de referencia españoles41 u otros.
En el protocolo EPI-SCAN se decidió a priori utilizar los valores de referencia europeos22 para dar mayor proyección a los resultados. Sin embargo, como se almacenó cada uno de los valores absolutos, también se podrían presentar resultados con los valores de referencia españoles41 u otros.
El estudio EPI-SCAN se plantea además un número importante de objetivos secundarios que permitirán describir tendencias y variables de interés y estratificar la población por niveles de gravedad de la EPOC (tabla 1) al mismo tiempo que sus resultados determinan la prevalencia de la EPOC en población de 40 a 80 años residente en España.
AgradecimientosDebe agradecerse a Mónica Sarmiento, de IMS HEALTH-Health Economics and Outcomes Research, su colaboración en el estudio.
ApéndiceAutor para correspondencia.
J.B. Soriano
Dirección: jbsoriano@caubet-cimera.es