Las estatinas (inhibidores de la hidroxi-metilglutaril-coenzima A-reductasa [HMGCR]) se emplean en pacientes con hipercolesterolemia y, entre sus efectos adversos, recientemente se ha descrito una entidad denominada miopatía autoinmune necrosante (MAN)1–3. Los pacientes con MAN inducida por estatinas presentan debilidad subaguda, proximal y simétrica en las extremidades, concentraciones séricas elevadas de la enzima muscular creatina-cinasa (CK) de curso grave y necrosis histológicamente significativa de las fibras musculares, con inflamación mínima o nula2,3.
Hasta la fecha, ninguna publicación ha descrito la asociación entre la MAN inducida por estatinas y la enfermedad pulmonar intersticial (EPI), y solamente una ha abordado el uso de rituximab en la MAN4. Por consiguiente, el caso que notificamos es el primero que describe una EPI secundaria a una MAN inducida por estatinas, con correlación entre la actividad de la enfermedad muscular, el deterioro funcional pulmonar y la respuesta al rituximab.
Un varón de 52 años de edad refería mialgia, debilidad muscular proximal en las extremidades (fuerza de grado 3) y disnea progresiva (actualmente de grado 2 según la escala de disnea del Medical Research Council modificada) de 3 años de evolución, que se habían iniciado 3 meses después de haber tomado rosuvastatina para el tratamiento de una dislipemia. El paciente también presentaba diabetes mellitus e hipotiroidismo, y no era fumador.
La estatina se suspendió debido a una elevación de las concentraciones de CK (3.000U/l, valores de referencia <150U/l) y aldolasa (19,3U/l, valores de referencia <7,6U/l); sin embargo, los efectos adversos persistieron. La elevación de las concentraciones de CK (7.000U/l) motivó la hospitalización del paciente. La exploración física fue normal y la saturación de oxígeno (SpO2) con aire ambiental del 96%. La electroneuromiografía mostró una miopatía proximal leve. Se efectuó una biopsia del músculo bíceps y el análisis histopatológico indicó un tamaño muscular homogéneo, con necrosis moderada de fibras musculares y sin inflamación significativa (CD4+/CD8+ negativos y CD68+ positivo). El CMH de clase I fue positivo en la superficie de todas las fibras musculares. Otras pruebas analíticas relevaron concentraciones séricas normales de hormonas tiroideas, anticuerpos autoinmunes negativos y negatividad en las serologías de la hepatitis y VIH.
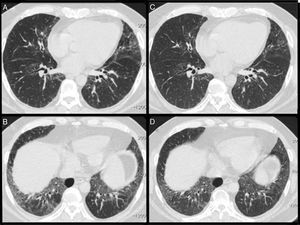
Las pruebas de función pulmonar (PFP) mostraron un patrón restrictivo, con reducción de la capacidad de difusión de monóxido de carbono (DLCO) (tabla 1). La tomografía computarizada (TC) de alta resolución del tórax mostró un patrón de neumonía intersticial inespecífica (fig. 1A y B).
Farmacoterapia, parámetros de función pulmonar y pruebas analíticas durante el curso del tratamiento
| Diagnóstico | Mayo 2013 | Agosto 2013 | Diciembre 2013 | Abril 2014 | Junio 2014 | Agosto 2014 | Noviembre 2014 | |
|---|---|---|---|---|---|---|---|---|
| Farmacoterapia | Sin tratamiento | AZA 150mg PRED 40mg | AZA 200mg PRED 20mg | MMF 1g | CiC iv (5.ª dosis) | 1er mes después de RTX | 3er mes después de RTX | 6.° mes después de RTX |
| FVC, (%) | 2,24 (53) | 3,28 (71) | 2,71 (59) | 2,65 (60) | 2,73 (59) | 2,63 (58) | 2,78 (63) | 2,81 (63) |
| FEV1, (%) | 2,02 (60) | 2,86 (77) | 2,29 (62) | 2,27 (64) | 2,34 (63) | 2,19 (61) | 2,40 (67) | 2,43 (68) |
| TLC, (%) | 3,75 (58) | 4,18 (63) | 4,38 (65) | 4,05 (63) | 3,82 (59) | 4,14 (64) | 4,05 (63) | 4,25 (63) |
| RV, (%) | 1,20 (62) | 0,90 (44) | 1,52 (34) | 1,35 (68) | 1,09 (50) | 1,31 (65) | 1,21 (60) | 1,44 (71) |
| DLCO, (%) | 19,50 (58) | 20,38 (62) | 22,1 (66) | 21,2 (67) | 21,2 (67) | 22 (67) | 18,1 (56) | 20,3 (63) |
| Pins | ND | −88 (72) | −60 (49) | ND | ND | ND | −81 (67) | ND |
| Pexp | ND | 78 (63) | 62 (50) | ND | ND | ND | 70 (68) | ND |
| CK | >7.000 | 90 | 193 | 713 | 1.994 | ND | 744 | 148 |
| Aldolasa | 19,3 | 4,6 | 6,3 | 9,4 | 27,2 | ND | 14,7 | 4,9 |
AZA: azatioprina (∼3mg/kg/día); CiC: ciclofosfamida (750mg/m2); CK: creatin-cinasa; DLCO: capacidad de difusión del monóxido de carbono; FEV1: volumen espiratorio forzado en un segundo; FVC: capacidad vital forzada; MMF: micofenolato mofetilo; ND: no disponible; Pexp: presión espiratoria máxima; Pins: presión inspiratoria máxima; PRED: prednisolona; RTX: rituximab (2 infusiones de 1.000mg, cada 2 semanas); RV: volumen residual; TLC: capacidad pulmonar total.
A y B) La tomografía computarizada de alta resolución mostró elevación del diafragma, opacidades en vidrio esmerilado, engrosamiento interlobular y bronquiectasias por tracción, predominantemente en los lóbulos inferiores, un patrón compatible con neumonía intersticial inespecífica. C y D) Después del tratamiento con rituximab, las imágenes de la TC mostraron una mejoría de las opacidades en vidrio esmerilado.
Se sugirió que podía tratarse de una MAN inducida por estatinas, y el paciente recibió tratamiento con metilprednisolona intravenosa e inmunoglobulinas humanas. Recibió el alta hospitalaria en tratamiento con prednisona (40mg/día) y azatioprina. Los resultados clínicos, analíticos y de las PFP mejoraron de manera gradual en los 3 meses siguientes. La dosis de prednisona se redujo progresivamente hasta 20mg/día, pero la fuerza muscular y la disnea empeoraron, y las concentraciones de CK y aldolasa aumentaron. Se introdujo micofenolato de mofetilo en lugar de la azatioprina, pero tuvo que suspenderse por intolerancia digestiva. A continuación, se introdujo una dosis mensual de ciclofosfamida (CiC) (750mg/m2) pero, tras 6 dosis de CiC, fue necesario mantener las dosis altas de prednisona (tabla 1). Posteriormente se administró rituximab (1.000mg, cada 2 semanas), observándose una disminución de las concentraciones de CK y mejorías en las PFP y la TC (fig. 1C y D).
El rituximab, un anticuerpo monoclonal quimérico frente a la proteína CD20, se ha empleado como fármaco de rescate en el tratamiento de la miositis refractaria y la EPI asociadas al síndrome antisintetasa5. Nuestro paciente mostró una evolución satisfactoria con rituximab, y una posible explicación de esta respuesta podría ser que la disminución de linfocitos B impediría no solamente la producción persistente de autoanticuerpos en la MAN, sino también la presentación del antígeno y la interacción con otros linfocitos T.
Una limitación importante del caso que presentamos es que el anti-HMGCR no se analizó. No obstante, la asociación temporal entre el inicio de los síntomas y la toma de estatinas, la presencia de necrosis significativa sin inflamación en la biopsia muscular y la necesidad de inmunosupresión intensa nos permitieron realizar un diagnóstico de certeza de MAN por estatinas.
Destacamos la importancia de considerar que las estatinas son un posible factor etiológico de EPI. La presencia de EPI se debería descartar activamente en pacientes con MAN inducida por estatinas, y el rituximab parece ser útil en los casos refractarios.