El síndrome de apneas-hipopneas durante el sueño (SAHS) es una enfermedad emergente con importante repercusión cardiovascular. El índice de rendimiento miocárdico (IRM) es un parámetro ecocardiográfico útil en la valoración de la función miocárdica global. El objetivo del estudio ha sido analizar si hay diferencias en el IRM entre pacientes con SAHS y un grupo control.
Pacientes y métodosHemos estudiado a 120 pacientes consecutivos remitidos por sospecha de SAHS a nuestra unidad. Una vez realizado el estudio nocturno y excluidos los hipertensos, cardiópatas o registros inadecuados, analizamos a 54 pacientes y 13 controles de similar edad e índice de masa corporal. Un cardiólogo que desconocía la asignación les realizó un ecocardiograma Doppler. Se midieron parámetros de hipertrofia ventricular, función sistólica, function diastólica y el IRM. Los datos se compararon mediante el test de la χ2 y ANOVA.
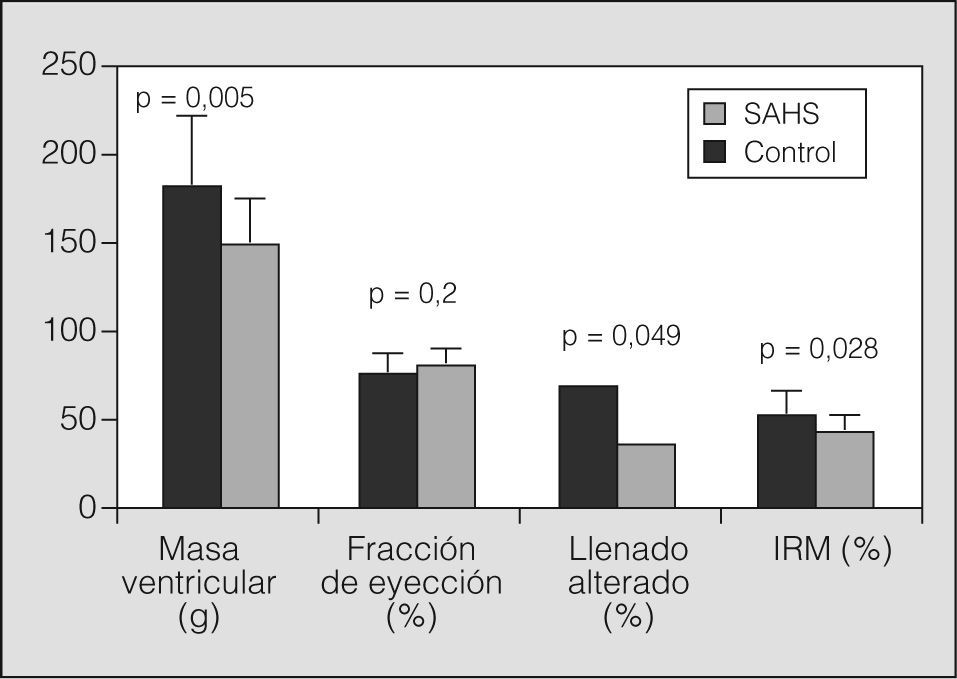
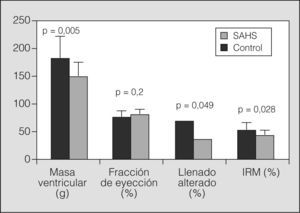
ResultadosLos pacientes con SAHS presentaron mayor masa ventricular que el grupo control (media ± desviación estándar: 183,17±40,5 frente a 149±26 g; p=0,005). No se apreciaron diferencias entre ambos grupos en la función sistólica (un 78,5±8,95 frente al 81,6±7%; p=0,2), pero un mayor porcentaje de pacientes con SAHS tenía alterada la función diastólica (un 71,2 frente al 38,5%; p=0,049). El IRM fue significativamente mayor en el grupo con SAHS (0,54±0,12 frente a 0,46±0,07; p=0,028).
ConclusionesEl SAHS por sí mismo produce hipertrofia ventricular izquierda. La afectación diastólica es importante en este grupo, pero también la presenta un número importante de personas sanas con obesidad. El IRM está incrementado en el SAHS y podría ser útil para identificar a los pacientes con disfunción miocárdica silente antes de su progresión.
Sleep apnea-hypopnea syndrome (SAHS) is an emerging disease with considerable cardiovascular impact. The myocardial performance index (MPI) is an echocardiographic parameter that is useful in the assessment of global myocardial function. The purpose of this study was to identify any differences in the MPI between patients with and without SAHS.
Patients and methodsWe studied 120 consecutive patients referred to our department for suspected SAHS. Following the overnight sleep study and after excluding all patients with hypertension, heart disease, or invalid recordings, 54 patients with SAHS and 13 patients without the disease matched for age and body mass were analyzed. A blinded cardiologist performed Doppler echocardiography, measuring parameters related to ventricular hypertrophy, systolic function, diastolic function, and the MPI. The data were compared by χ2 and analysis of variance.
ResultsMean (SD) ventricular mass was greater in patients with SAHS (183.17 [40.5] g) than in those without that diagnosis (149 [26] g) (P=.005). No differences were observed in systolic function (78.5% [8.95%] vs 81.6% [7%]) (P=.2), although a higher percentage of patients with SAHS had abnormal diastolic function (71.2% vs 38.5%) (P=.049). The MPI was significantly higher in SAHS patients (0.54 [0.12] vs 0.46 [0.07]) (P=.028).
ConclusionsOn its own, SAHS leads to left ventricular hypertrophy. Diastolic involvement is common in these patients, although a large number of healthy individuals who are obese also present it. The MPI is higher in SAHS and could be a useful parameter to identify patients with silent heart disease before it progresses.
El síndrome de apneas-hipopneas durante el sueño (SAHS) es una enfermedad muy prevalente, que afecta Silent Heart Disease in Patients With Sleep Apnea-Hypopnea Syndrome: Usefulness of the Myocardial Performance Index al 4-6% de los varones y al 2-4% de las mujeres de edad media, y cuya prevalencia aumenta con la edad1,2. Se define como un cuadro de somnolencia excesiva, trastornos cognitivos-conductuales, respiratorios, cardíacos, metabólicos o inflamatorios secundarios a episodios repetidos de obstrucción de la vía aérea superior durante el sueño3. Este síndrome presenta importantes consecuencias cardiovasculares4-6 que a la larga son las que condicionan el pronóstico7,8 y entre ellas destaca la insuficiencia cardíaca.
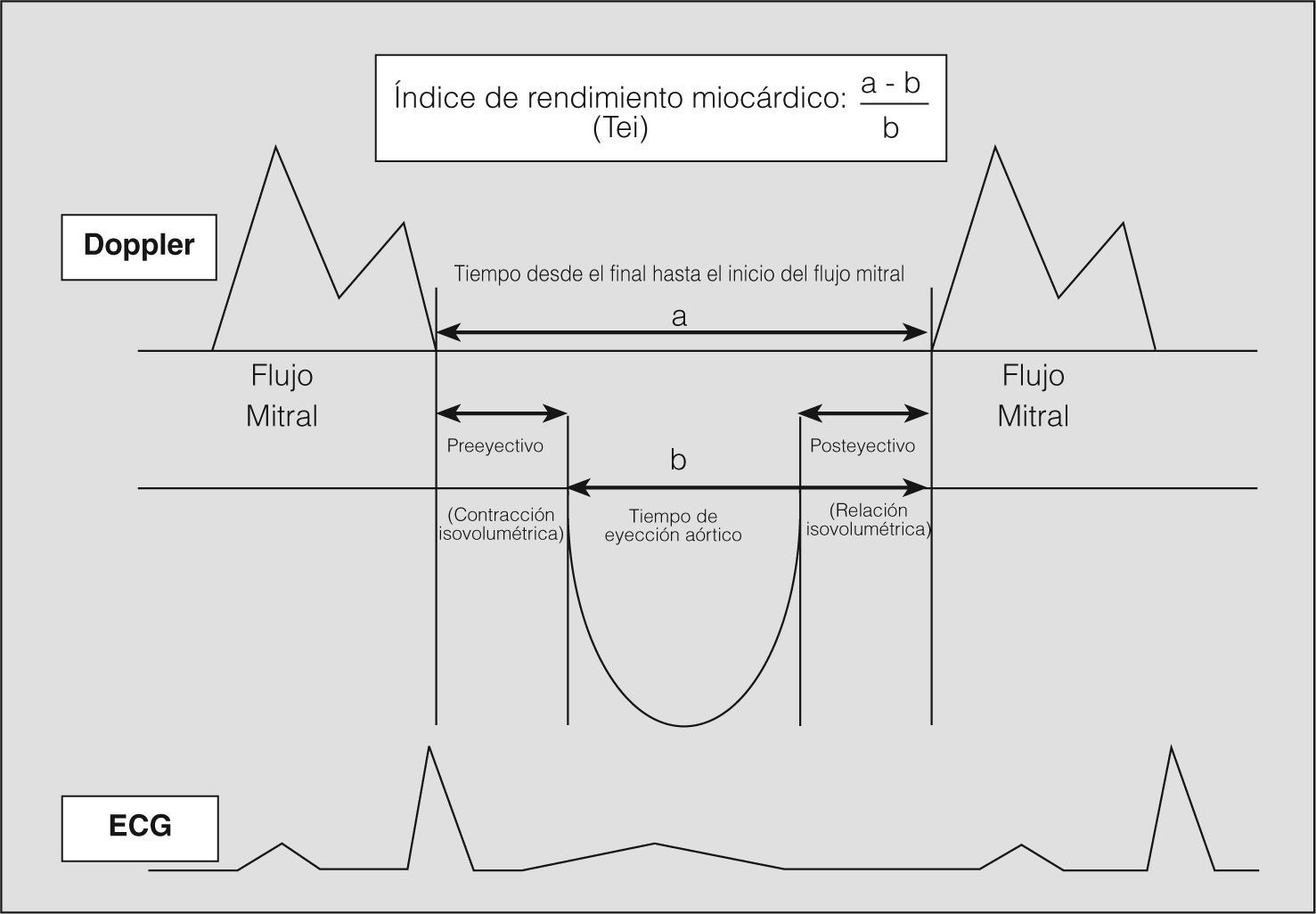
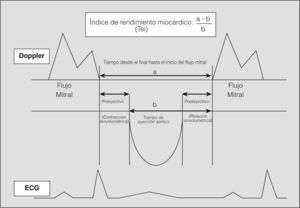
El índice de rendimiento miocárdico (IRM) relaciona la función sistólica y diastólica del ventrículo, es independiente de la frecuencia cardíaca y de la presión sanguínea, y no necesita normalización9. Ante la presencia de disfunción ventricular sistólica y/o diastólica se produce un incremento del valor de este parámetro. Esta combinación de parámetros de función diastólica y sistólica proporciona más información sobre la disfunción ventricular que las medidas aisladas de ambas funciones10,11.
En el presente estudio nos hemos propuesto evaluar el valor del IRM en una población de pacientes con SAHS sin hipertensión arterial, comparados con un grupo control de similar edad e índice de masa corporal (IMC), para obviar estos factores de confusión.
Pacientes y métodosPacientesSe valoró a 105 pacientes consecutivos con diagnóstico de SAHS e indicación de tratamiento con presión positiva continua de la vía aérea (CPAP) en una consulta neumológica específica de sueño. A todos ellos se les solicitó el consentimiento para participar en el estudio, que fue aprobado por el Comité Ético de Investigación Clínica y la Comisión de Investigación hospitalaria.
Estudio nocturnoEl diagnóstico de SAHS se realizó mediante poligrafía respiratoria con un polígrafo EMBLETTA® (ResMed, Inc., San Diego, California, EE.UU.) convenientemente validado frente a la polisomnografía convencional12. Registramos el flujo nasal con un transductor de presión; la saturación de oxígeno y la frecuencia cardíaca mediante pulsioxímetro digital; el ronquido y la cuantificación del número de apneas según la posición del paciente mediante un sensor de posición corporal, y los movimientos toracoabdominales mediante una banda toracoabdominal elástica con sensor piezoeléctrico. Todos los estudios fueron revisados manualmente por el mismo neumólogo.
Se consideró apnea obstructiva la ausencia o reducción superior al 90% de la señal respiratoria durante más de 10 s en presencia de esfuerzo respiratorio, detectado por las bandas toracoabdominales; apnea central, la ausencia o reducción superior al 90% de la señal respiratoria durante más de 10 s en ausencia de esfuerzo respiratorio, detectada por las bandas toracoabdominales, y apnea mixta cuando el evento respiratorio habitualmente comenzaba con un componente central y terminaba en un componente obstructivo3. Se definió la hipopnea como la reducción discernible (> 30% y < 90%) de la amplitud de la señal respiratoria durante más de 10 s, detectada por termistores, cánula nasal o neumotacógrafo, que se acompañaba de una desaturación (> 3%) y/o un microdespertar en el electroencefalograma del registro de la polisomnografía3. Se definió el índice de apneas-hipopneas (IAH) como el número de episodios respiratorios (apneas o hipopneas) acaecidos por hora de registro en cama. No se consideraron válidos los estudios cuando el registro era menor de 4 h o había desconexión de los sensores. Se definió el SAHS como un IAH de 10 o más junto con hipersomnia diurna patológica (Epworth > 10 puntos13).
Cuando la poligrafía se consideró negativa para el diagnóstico de SAHS pero la clínica era muy indicativa de dicho diagnóstico, se remitió al paciente a una unidad de sueño de referencia para la realización de polisomnografía convencional3.
La indicación de tratamiento con CPAP se estableció cuando el IAH era de 30 o más, o cuando era de 10 o más y había otros condicionantes como somnolencia patológica, factores de riesgo cardiovascular o enfermedad cardiovascular conocida3.
Técnica de la ecocardiografía DopplerSe realizó a todos los pacientes un estudio ecocardiográfico Doppler en situación basal, antes del tratamiento y en las 2 primeras semanas desde el diagnóstico. El equipo utilizado fue un HP Sonos 5500® con sonda de 2,5 MHz (Philips, Eindhoven, Holanda). Efectuó todas las exploraciones el mismo ecocardiografista, que desconocía el grupo al que pertenecía el paciente.
Siguiendo las directrices establecidas14, las medidas morfológicas se realizaron en modo M referenciado por un plano paraesternal longitudinal. La fracción de eyección se calculó a partir de esas medidas por el método de Teichholz. Los parámetros de función diastólica se obtuvieron mediante Doppler pulsado entre los bordes de las valvas mitrales en un eje apical de 4 cavidades. El flujo aórtico se obtuvo en el plano valvular aórtico. Cada valor individual fue la media de 3 medidas.
Las variables registradas fueron las siguientes:
- 1.
Parámetros de hipertrofia ventricular izquierda (HVI): masa ventricular izquierda15.
- 2.
Parámetros de función sistólica: fracción de eyección del ventrículo izquierdo.
- 3.
Parámetros de función diastólica: morfología del patrón de llenado ventricular, que se definió como patrón normal o patrón alterado (de forma espontánea o provocado por maniobra de Valsalva).
- 4.
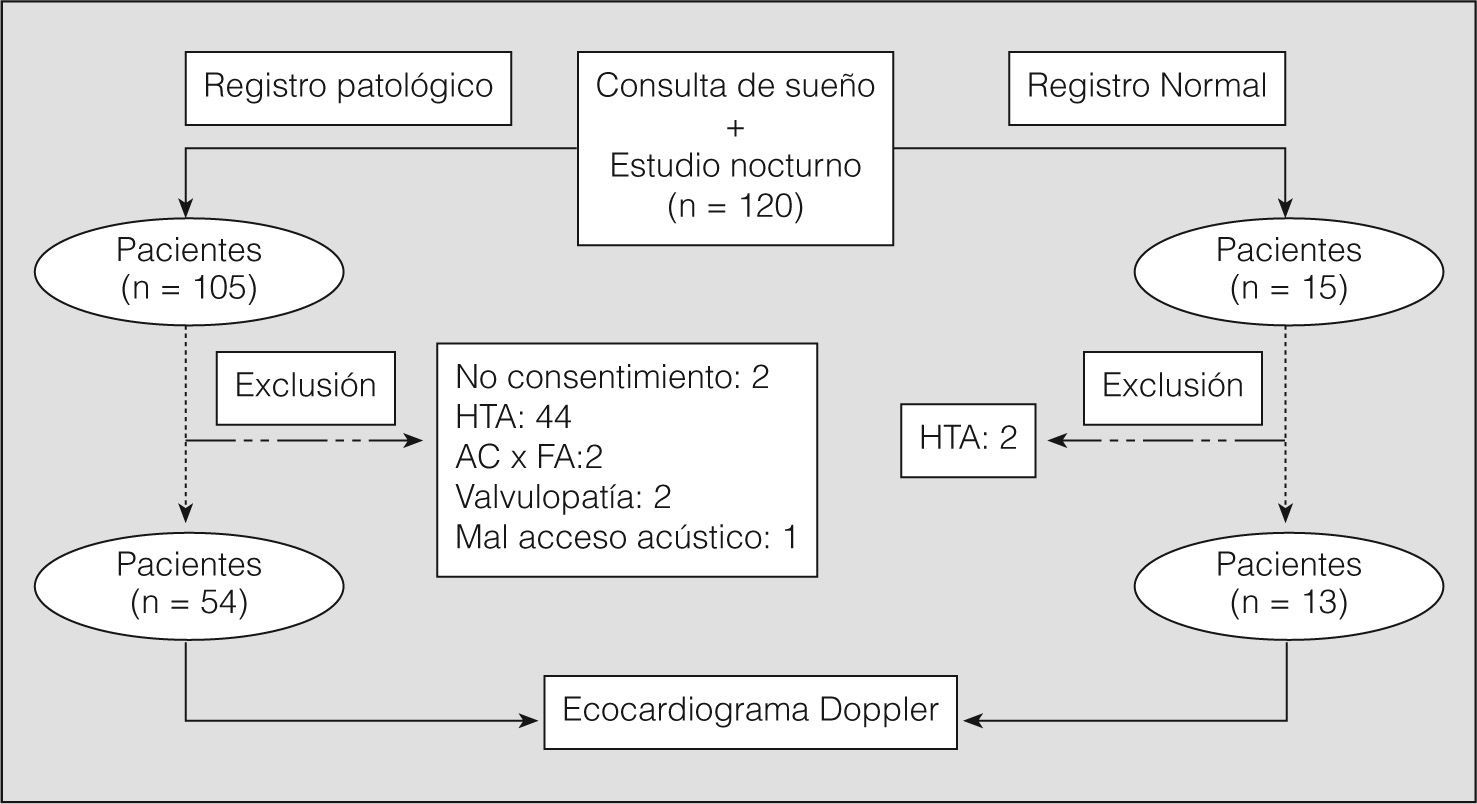
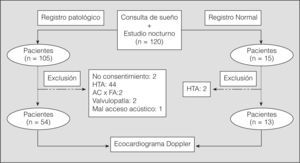
Fueron criterios de exclusión del estudio: falta de consentimiento por parte del paciente, presencia de hipertensión arterial (definida como cifras superiores a 140/90 mmHg en 3 tomas matutinas de presión arterial realizadas en el lugar de control habitual por personal de enfermería experto, o estar recibiendo tratamiento farmacológico)18, pacientes con SAHS en tratamiento previo con CPAP, presencia de fibrilación auricular en el estudio ecocardiográfico, pacientes con enfermedad cardíaca, registros no válidos (< 4 h de registro o problemas de desconexión de los aparatos) y cuando la ventana ecocardiográfica no tuvo suficiente fiabilidad. El análisis final, tras aplicar los criterios de exclusión, se realizó sobre 54 pacientes. En la figura 2 se representa el diseño del estudio, especificando los motivos de exclusión.
Grupo controlEvaluamos a 15 personas consecutivas remitidas a la consulta de sueño, sin antecedentes cardiovasculares y con IMC y edad similares a los pacientes con SAHS, en quienes la poligrafía no fue patológica. Se descartó a 2 por presentar cifras elevadas de presión arterial. El estudio de enfermedad cardíaca se realizó mediante la historia clínica, exploración física, radiología de tórax, electrocardiograma y ecocardiograma Doppler.
Análisis estadísticoLas variables numéricas se han expresado como medias ± desviación estándar y las categóricas en porcentajes. La comparación entre grupos se realizó mediante análisis de la variancia. La significación estadística se estableció en valores de p < 0,05. Se utilizó el paquete estadístico SPSS 12.0© (SPSS Inc.).
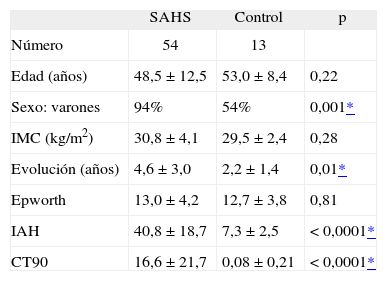
ResultadosPerfil clínico de la población estudiadaLas características clínicas de la población con SAHS y el grupo control fueron similares, a excepción de un mayor porcentaje de varones en la población de pacientes, un mayor tiempo de evolución de los síntomas sospechosos de SAHS (apneas referidas y/o somnolencia diurna) y los valores del estudio poligráfico nocturno (tabla I).
Características clínicas del grupo de pacientes con síndrome de apneas-hipopneas durante el sueño (SAHS) y el grupo control
| SAHS | Control | p | |
| Número | 54 | 13 | |
| Edad (años) | 48,5 ± 12,5 | 53,0 ±8,4 | 0,22 |
| Sexo: varones | 94% | 54% | 0,001* |
| IMC (kg/m2) | 30,8 ±4,1 | 29,5 ± 2,4 | 0,28 |
| Evolución (años) | 4,6 ±3,0 | 2,2 ±1,4 | 0,01* |
| Epworth | 13,0 ±4,2 | 12,7 ±3,8 | 0,81 |
| IAH | 40,8 ± 18,7 | 7,3 ±2,5 | < 0,0001* |
| CT90 | 16,6 ±21,7 | 0,08 ± 0,21 | < 0,0001* |
Los valores se expresan como media ± desviación estándar. CT90: porcentaje de tiempo con una saturación de oxígeno < 90%; IAH: índice de apneas-hipopneas; IMC: índice masa corporal.
A partir de los 3 valores que se obtuvieron de cada medida se calculó la variabilidad intraobservador. En todos los casos el índice de concordancia (valor de kappa) fue mayor de 0,8. El coeficiente de variación de Pearson para las variables morfológicas fue del 1,8% y para las variables Doppler, del 0,9%.
Se observó una diferencia estadísticamente significativa en los parámetros de HVI: los pacientes con SAHS presentaron mayor masa ventricular que los controles (media ± desviación estándar: 183,17 ± 40,5 frente a 149 ±26 g; p = 0,005). En la figura 3 se muestran los resultados del análisis de la función ventricular izquierda: el grupo con SAHS presentó, de forma significativa, un mayor porcentaje de pacientes con función diastólica alterada (el 71,2 frente al 38,5%; p = 0,049), junto a una tendencia a menor función sistólica (el 78,5 ± 8,95 frente al 81,6 ± 7%; p = 0,2). Igualmente se observó una diferencia estadísticamente significativa entre ambos grupos en el IRM, que fue mayor en los pacientes (0,54 ± 0,12 frente a 0,46 ± 0,07; p = 0,028).
DiscusiónEl SAHS es una enfermedad que generalmente se asocia a obesidad, hipertensión arterial y otros factores implicados en la patogenia de la insuficiencia cardíaca19. El Sleep Heart Health Study20 demostró un riesgo relativo de 2,38 para insuficiencia cardíaca en pacientes diagnosticados de SAHS, siendo esta relación mayor que la encontrada para la hipertensión arterial, la cardiopatía isquémica o los accidentes cerebrovasculares. Dadas las implicaciones pronósticas del desarrollo de insuficiencia cardíaca en pacientes con SAHS, se hace necesario un diagnóstico precoz. En este sentido, la ecocardiografía Doppler es una técnica sencilla, de bajo coste, inocua y de alta disponibilidad en el ámbito hospitalario. Su aplicación a los pacientes con SAHS ha permitido la detección tanto de alteraciones estructurales21 como de disfunción sistólica y/o diastólica22,23.
Hedner et al21 documentaron la existencia de HVI en 61 pacientes con SAHS frente a 61 controles. Sin embargo, en su estudio, además de haber diferencias significativas en el peso entre los grupos (el grupo de pacientes tuvo mayor peso que el grupo control), un 50% de los afectados de SAHS presentaba hipertensión arterial y 7 sujetos del grupo control eran hipertensos. Por ello, este factor de confusión sigue persistiendo en su trabajo. En nuestro estudio, donde no existen diferencias significativas en el IMC entre ambos grupos, encontramos que los pacientes con SAHS sin hipertensión arterial presentan HVI, expresada por un aumento significativo del índice de masa ventricular.
En el grupo de pacientes encontramos una tendencia a presentar menor función sistólica que los sujetos sin SAHS, aunque ésta no llega a ser significativa como en otros estudios22,24. Creemos que podría deberse a un tiempo de evolución de la enfermedad más breve en nuestra serie, dato probablemente muy relevante que la mayoría de los autores no reflejan en sus artículos. Probablemente el efecto nocivo que sobre la función ventricular tiene el SAHS esté relacionado con el tiempo que el miocardio está sometido al estrés crónico que supone esta enfermedad.
El análisis de la función diastólica de ambos grupos, expresada por la morfología del patrón de llenado ventricular, pone de manifiesto que los pacientes tienen, de forma significativa, un mayor porcentaje de alteración (el 71,8 frente al 38,5%; p = 0,049). Estos valores son concordantes con los de otros estudios realizados mediante técnicas más complejas como el Doppler tisular24. Estos datos, junto al incremento de la masa ventricular izquierda, son coherentes con los diversos mecanismos fisiopatológicos por los que el SAHS sería capaz de repercutir en el miocardio mediante aumentos de la poscarga ventricular25.
El IRM es un parámetro ecocardiográfico de fácil obtención, que combina parámetros de función sistólica y diastólica, por lo que proporciona una información más global y completa que las medidas de ambas funciones por separado10,11. No obstante, la independencia del IRM de la precarga y de la poscarga, y por tanto de la hipertensión arterial, es relativa26. Actualmente son escasos los estudios que tienen en cuenta este aspecto y excluyen a pacientes con hipertensión arterial diurna27, y de hecho la mayoría de los trabajos analizan a poblaciones de pacientes con SAHS de forma global24,28. En nuestro estudio, además de controlar este factor de confusión, se añade un grupo control con similar edad e IMC, lo que permite excluir otras variables que podrían tener cierta influencia en la función cardíaca diastólica, como la edad y la obesidad. Nuestros resultados demuestran que el grupo con SAHS presenta una elevación significativa del IRM con respecto al grupo control (0,54 ± 0,12 frente a 0,46 ± 0,07; p = 0,028), lo que indica que hay disfunción miocárdica. Como hemos comentado al analizar los resultados de la función diastólica, los repetidos incrementos de poscarga que conlleva el SAHS se acompañan de una hipertrofia compensadora del miocardio. Este mecanismo, similar al originado en la cardiopatía hipertensiva, implica una dificultad para la relajación del músculo cardíaco y, por tanto, una disfunción diastólica. Si el estímulo se perpetúa, la disfunción se establece e incluso progresa, aparece la insuficiencia sistólica y posteriormente la clínica de insuficiencia cardíaca29,30. Dadas las características morfométricas del SAHS, donde son frecuentes los IMC elevados y la hipertensión arterial diurna (entre el 50 y el 80% según estudios)26, el hallazgo de alteración de la relajación ventricular es muy habitual. De hecho, casi un 40% de los sujetos control con similar IMC presentan patrón anómalo, por lo que en principio esta alteración sería insuficiente para pensar en una afectación miocárdica directamente relacionada con el SAHS. Es aquí donde podría desempeñar un papel importante el IRM o índice de Tei, aportando una información más global y completa10,11 del funcionamiento cardíaco. El análisis del IRM permitiría identificar a los pacientes en quienes la disfunción está progresando pero todavía es subclínica, sin que sea evidente la disfunción sistólica.
El presente trabajo tiene una serie de limitaciones. Hubiera sido deseable contar con un mayor número de sujetos en el grupo control, pero no es sencillo encontrar a personas de estas características sin enfermedades que supusieran importantes factores de confusión. El estudio mediante polisomnografía en todos los sujetos aportaría una mayor fiabilidad diagnóstica, pero, dadas la saturación de las unidades de sueño y la situación actual de la poligrafía respiratoria en el diagnóstico del SAHS, creemos que no representa una limitación significativa de nuestros resultados. El registro de 24 h de la presión arterial hubiera permitido identificar a pacientes non-dipper, ya que esto se relaciona con complicaciones cardiovasculares y mayor probabilidad de lesión de órganos31. Sin embargo, los criterios elegidos para definir la hipertensión arterial son los asumidos por la comunidad internacional18 y consideramos que son suficientes para el planteamiento del estudio.
Debemos mencionar que los sujetos incluidos como controles presentaban una puntuación en la escala de Epworth sin diferencias significativas respecto a los pacientes con SAHS (tabla I). En este sentido, hay que tener en cuenta que la propia obesidad puede actuar como una variable de confusión, ya que se ha visto que se relaciona de manera independiente con la aparición de excesiva somnolencia diurna en personas sin SAHS32. Por otra parte, no hay que olvidar que la causa más frecuente de excesiva somnolencia diurna es la insuficiencia de sueño –cuando el número de horas de sueño durante la semana laboral es 2 h inferior a las horas de sueño durante el tiempo de ocio3–, y ésta era la situación más frecuentemente detectada entre los sujetos del grupo control, uno de los principales motivos de su consulta, junto a la necesidad, por causas laborales, de descartar la enfermedad.
Así pues, a la vista de nuestros resultados podríamos concluir que el SAHS por sí mismo conlleva una disfunción miocárdica inicialmente silente. El IRM sería una herramienta útil y de fácil obtención para detectar esta alteración de una forma precoz, cuando todavía es subclínica y previa a una afectación objetiva de la función sistólica.