Lamentablemente, las novedades en tuberculosis (TB) se producen de forma lenta, demasiado lenta. No obstante, han pasado bastantes años desde las últimas Normativas de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) sobre el diagnóstico y el tratamiento de la TB, y durante este período no sólo se han producido avances en el diagnóstico y el tratamiento, especialmente en el campo del diagnóstico, sino que además hemos asistido a un importante cambio demográfico en España motivado por el incremento de la inmigración. En la actualidad el 10% del total de la población española no ha nacido en el país y el 30% de los casos de TB corresponden a pacientes inmigrantes. Por todo ello, nos ha parecido oportuno y necesario revisar nuestras guías para actualizarlas y adaptarlas a la presente configuración social española.
En un esfuerzo de simplificación hemos decidido agrupar en una sola las normativas previas sobre diagnóstico y tratamiento de la TB. Para la elaboración de la presente guía hemos tenido en cuenta la evidencia científica disponible. El grado de recomendación se clasifica como A, B, C y D. El grado A significa que la evidencia científica en que se basa es buena o muy buena (estudios de nivel 1); el B, que es razonablemente buena (estudios de nivel 2); el C, que es escasa (series y casos), y el D, que asienta en opiniones de expertos y consensos.
Agradecemos al Comité Científico de la SEPAR la deferencia y la confianza que han otorgado al grupo de expertos para llevar a cabo la nueva Normativa y esperamos y deseamos que sea de utilidad para mejorar el control de la TB.
DIAGNÓSTICO DE LA INFECCIÓN TUBERCULOSAPrueba de la tuberculina (PT)En España se recomienda emplear el derivado proteico purificado (PPD) de la tuberculina PPD-RT23 con Tween 80, a dosis de 2 UT por 0,1ml, que es la bioequivalente a la dosis recomendada (5 UT) de la tuberculina de patrón internacional, la PPD-S. El principal inconveniente de la tuberculina radica en que la mayoría de las proteínas presentes en el PPD no son específicas de Mycobacterium tuberculosis, sino que las comparte con otras micobacterias. Esto provoca una disminución de la especificidad de la prueba, ya que individuos sensibilizados por exposición previa a otras micobacterias o vacunados contra la TB también responden inmunológicamente al PPD1-3.
Las indicaciones de la PT se señalan en la tabla I. Debe practicarse según la técnica de Mantoux, por vía intradérmica en la cara anterior del antebrazo, lejos de las venas y en piel que no presente lesiones (D). Para tener la seguridad de que la administración de la dosis ha sido intradérmica, deberá aparecer un habón después de la inyección. La lectura se realizará a las 48-72h midiendo en milímetros la induración que se obtenga en la zona de la inyección y haciendo la medición según el diámetro transversal al eje longitudinal del antebrazo. Sólo hay que medir los límites de la induración y, si únicamente hay eritema sin induración, el resultado se registrará como 0mm. En caso de que la lectura no pueda realizarse a las 48-72h, también será válida si se efectúa antes de los 7 días5.
Indicaciones de la prueba de la tuberculina
Convivientes y contactos íntimos de pacientes tuberculososPersonas cuya radiografía de tórax presente imágenes indicativas de tuberculosis inactivaPersonas con sospecha clínica y/o radiológica de presentar enfermedad tuberculosaPersonas que si están infectadas tienen un especial riesgo para el desarrollo de enfermedad tuberculosa
|
Se considerará que una PT es positiva cuando presente una induración igual o mayor de 5mm. En las personas vacunadas contra la TB no se puede discernir con seguridad absoluta si la reacción es debida a infección por M. tuberculosis o es un recuerdo de la vacuna. Sin embargo, a efectos prácticos, en los colectivos con alto riesgo de infección el antecedente de vacunación no debe tenerse en cuenta. En los vacunados se acepta que la respuesta a la PT de 5mm o superior es indicativa de infección por M. tuberculosis: en convivientes y contactos frecuentes de enfermos tuberculosos bacilíferos, en personas cuya radiografía de tórax ofrezca imágenes indicativas de TB inactiva (demostrada con bacteriología y control evolutivo), en infectados por el virus de la inmunodeficiencia humana (VIH), o con factores de riesgo para infección por el VIH, y en silicóticos. Si el vacunado no se encuentra en ninguna de estas circunstancias, se valorará individualmente cada caso teniendo en cuenta —sin que nunca pueda descartarse que se deba a la vacuna antituberculosa— que a mayor diámetro de la induración obtenida, más probabilidad de que la causa de la respuesta a la PT sea la infección tuberculosa natural, en especial si la induración supera los 15mm de diámetro3. Igualmente, la aparición de vesículas o de necrosis tiene que valorarse como indicativa de infección tuberculosa. Por otra parte, los resultados falsos negativos pueden deberse a defectos de la técnica o a enfermedades y situaciones que provoquen inmunodepresión, incluida la TB grave y la pleural. Además, es necesario recordar que tras la infección por M. tuberculosis han de transcurrir de 2 a 12 semanas para que los linfocitos T sensibilizados hayan pasado al torrente circulatorio y puedan reconocer la tuberculina depositada en la dermis. Durante este tiempo, aunque haya infección, puede no obtenerse respuesta a la PT. En general, no se detecta la positividad de una PT hasta pasados los 6 meses de vida.
La capacidad de respuesta a la tuberculina no permanece invariable durante toda la vida, ya que, aunque no llega a desaparecer, puede debilitarse con el tiempo. Este fenómeno se observa en pacientes de edad avanzada que contrajeron la infección en su juventud y en vacunados no infectados por M. tuberculosis. En estos casos puede producirse el denominado efecto de refuerzo (booster), que consiste en la estimulación de la capacidad de respuesta al realizar la PT. Para no confundir el efecto de refuerzo con una conversión de la tuberculina, a los pacientes mayores y vacunados contra la TB que tengan una PT negativa6 hay que realizarles una segunda PT entre 7 y 10 días después, y el resultado de esta segunda PT será el que se tome como definitivo. Conviene remarcar que en un paciente no infectado la práctica repetida de la PT no induce sensibilidad tuberculínica.
A efectos prácticos, se entiende por conversión de la tuberculina la que tiene lugar dentro de un período máximo de 2 años desde que hay constancia de una PT negativa.
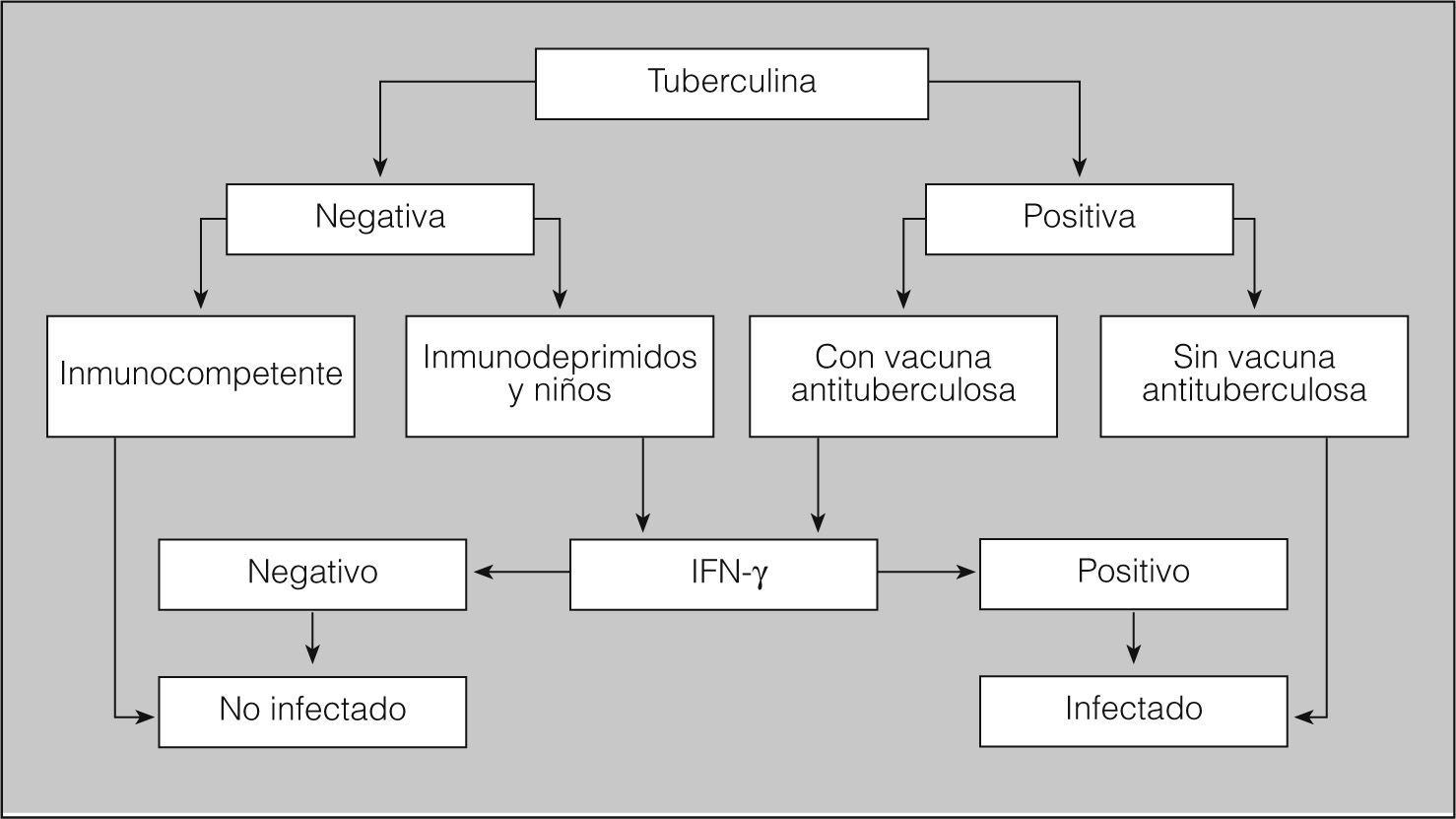
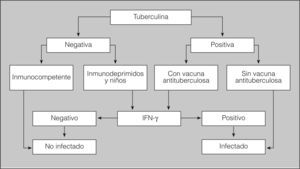
Técnicas in vitro de interferón-gamma (IFN-γ)En los últimos años se han desarrollado diferentes técnicas de laboratorio para el diagnóstico de la infección tuberculosa. Las técnicas se basan en la detección del IFN-γ liberado como respuesta a la estimulación in vitro de las células T sensibilizadas presentes en sangre periférica con antígenos específicos7 de M. tuberculosis. Actualmente se emplean para la estimulación de las células T los antígenos RD1 denominados early secretory antigen target-6 (ESAT-6) y culture fíltrate protein 10 (CFP-10), y el antígeno RD11 RV26548, que están presentes en el complejo M. tuberculosis pero ausentes tanto en la vacuna antituberculosa como en otras micobacterias ambientales (excepto en M. kansasii, M. marinum y M. szulgai). Por lo tanto, estas técnicas discriminan a los individuos infectados por M. tuberculosis de los que han recibido la vacuna antituberculosa y de los expuestos a otras micobacterias9,10 (C). Además, incorporan controles para detectar la anergia y excluir así los falsos negativos. Por otra parte, pueden repetirse inmediatamente, sin que se vean afectadas por el efecto de refuerzo. En la figura 1 se propone un algoritmo de utilización e interpretación de los resultados de la tuberculina en combinación con las técnicas de IFN-γ.
Esta tecnología in vitro presenta algunas ventajas adicionales respecto a la PT10-12: se evita la subjetividad en la interpretación de los resultados; la determinación puede repetirse si es necesario; la obtención de los resultados es rápida; se elimina la visita de lectura; se evita la pérdida de individuos que no acuden a la lectura; es de fácil estandarización y aplicación en el laboratorio; permite la inclusión de controles positivos para identificar a los pacientes anérgicos, y al realizarse en el laboratorio, no en un lugar visible como la PT, se respeta la privacidad del paciente. El inconveniente de la técnica es su mayor coste económico. Se necesitan más estudios para determinar su eficiencia, pero se acepta que en países con elevada prevalencia de TB su empleo es la opción más coste-efectiva.
DIAGNÓSTICO DE LA ENFERMEDAD TUBERCULOSAFactores de riesgo de infección y de enfermedadEn general, para infectarse de TB se requiere un contacto intenso y prolongado con una persona bacilífera. En el contagio influyen factores como la cantidad de bacilos presentes en la expectoración del enfermo, el grado de intimidad, la duración de la exposición, la edad del contacto (mayor riesgo en niños) y el estado inmunológico del mismo.
Los infectados con mayor riesgo de desarrollar la enfermedad son: a) los conversores recientes de la tuberculina (la máxima probabilidad se da en el primer año, es de alrededor del 5-8% en los 2 primeros años y después disminuye progresivamente; en coinfectados por el VIH sin tratamiento antirretroviral aumenta al 5-10% anual); b) los individuos con infección por el VIH y otros inmunodeprimidos (por enfermedades o por tratamientos inmunodepresores, así como por tratamientos biológicos, entre los que cabe destacar, por la importancia que han adquirido, los fármacos contra el factor de necrosis tumoral alfa); c) los que tienen lesiones tuberculosas pulmonares residuales que nunca han sido tratadas, y d) los niños menores de 5 años13. A esta relación aún deberían añadirse las personas con silicosis o pérdida ponderal importante.
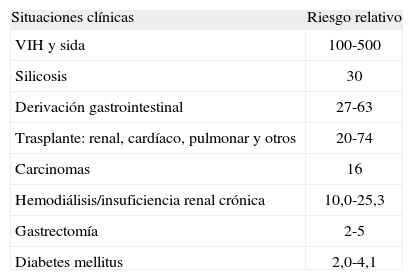
Aunque la TB puede afectar a cualquier persona, hay diversos colectivos que presentan una mayor incidencia, con probabilidades muy variables (tabla II). Se acepta que los colectivos con incidencias anuales superiores a 100/100.000 son los que reúnen factores de riesgo. Estos factores de riesgo ya clásicos podrían también agruparse en 4 grandes categorías14: a) biológicos (enfermedades diversas, VIH y otras inmunodepresiones, deficiencia de vitamina D, factores genéticos); b) conductuales (tabaquismo, alcoholismo, otras toxicomanías); c) sociales (viviendas insalubres, pobreza, problemas sanitarios, instituciones cerradas), y d) ambientales (silicosis, asbestosis).
Riesgo de desarrollar tuberculosis según diversas situaciones clínicas14
| Situaciones clínicas | Riesgo relativo |
| VIH y sida | 100-500 |
| Silicosis | 30 |
| Derivación gastrointestinal | 27-63 |
| Trasplante: renal, cardíaco, pulmonar y otros | 20-74 |
| Carcinomas | 16 |
| Hemodiálisis/insuficiencia renal crónica | 10,0-25,3 |
| Gastrectomía | 2-5 |
| Diabetes mellitus | 2,0-4,1 |
VIH: virus de la inmunodeficiencia humana.
La TB es una enfermedad cuyas manifestaciones clínicas no permiten diferenciarla de otras entidades nosológicas. La mayoría de los casos son de inicio insidioso, poco alarmante y bastante variable, dependiendo de la virulencia del agente causal, la edad, el órgano afectado y el estado inmunitario del huésped. Los síntomas pueden dividirse en 2 grupos:
- 1.
Sistémicos. Los más frecuentes son fiebre, pérdida de apetito y peso, astenia, sudoración nocturna profusa y malestar general.
- 2.
Específicos de órgano. Varían según la localización de la enfermedad:
- –
TB pulmonar. No hay correlación entre la extensión de la enfermedad y la magnitud de los síntomas. El 5% de los pacientes adultos no presenta ningún síntoma15. La primoinfección suele ser subclínica o producir síntomas leves e inespecíficos. El síntoma más frecuente es la tos, que puede ser seca o productiva, con expectoración mucosa, purulenta y hemoptoica, y ocasionalmente hemoptisis franca; puede haber dolor torácico de características pleuríticas. La disnea se presenta en la enfermedad muy extendida y rara vez en la TB miliar. Una forma especial de inicio es la neumonía tuberculosa, que puede presentarse como un cuadro clinicorradiológico similar al de la neumonía bacteriana.
En los pacientes infectados por el VIH los síntomas varían considerablemente; en el paciente con inmunodepresión grave predominan los síntomas sistémicos, y en el resto es similar a la población general.
- –
TB pleural. Puede presentarse como una pleuritis aguda con fiebre alta y dolor torácico de características pleuríticas, pero lo habitual es que se presente como una pleuritis crónica con dolor torácico sordo y/o de características pleuríticas, febrícula, tos seca, deterioro del estado general, pérdida de peso, astenia y disnea progresiva.
- –
TB ganglionar. Si se afecta la cadena ganglionar periférica, aparece una tumefacción indolora bien delimitada, de localización predominantemente cervical y supraclavicular (escrófula). Con la progresión de la enfermedad pueden presentarse signos inflamatorios y trayectos fistulosos con drenaje de material caseoso. Si hay síntomas sistémicos disociados, debe sospecharse infección por el VIH u otras inmunodepresiones.
- –
TB genitourinaria. Los síntomas más frecuentes son la polaquiuria, disuria, hematuria y dolor en flanco, acompañados de piuria con cultivo negativo. La TB genital en las mujeres puede causar infertilidad, dolor pélvico y alteraciones menstruales. En los varones puede producir orquitis y prostatitis o afectar al epidídimo manifestándose como una masa ligeramente dolorosa.
- –
TB ósea. La columna, cadera y rodilla son las más frecuentemente afectadas. El dolor es el síntoma principal. Las alteraciones mecánicas dependen de la localización. La tumefacción es propia de las articulaciones periféricas.
- –
TB del sistema nervioso central. La manifestación más frecuente es la meningitis tuberculosa. Cursa con anorexia, malestar general, cefalea, descenso del nivel de conciencia, rigidez de nuca y vómitos. La afectación del parénquima cerebral (tuberculoma) se manifiesta con convulsiones y signos focales.
- –
TB laríngea. Se manifiesta en forma de cambios de la voz y/o afonía, y a veces odinofagia. Casi siempre se asocia a TB pulmonar.
- –
TB miliar. Es una enfermedad diseminada que puede darse en cualquier paciente, aunque ocurre con mayor frecuencia en aquéllos con infección por el VIH16. Se produce por diseminación hematógena de M. tuberculosis y se presenta con pérdida de peso, anorexia, fiebre, sudación nocturna y mal estado general.
- –
En la enfermedad tuberculosa la manifestación hematológica más frecuente es una leucocitosis leve, con linfocitosis, aunque ocasionalmente pueden aparecer leucopenia o una reacción leucemoide. La anemia es frecuente en casos de enfermedad diseminada o evolución prolongada. Puede haber pancitopenia por afectación directa de la médula ósea. En el estudio bioquímico se puede apreciar hiponatremia e hipocloremia en casos graves y diseminados, por secreción por parte del tejido pulmonar de una sustancia similar a la hormona antidiurética.
RadiologíaTanto la TB pulmonar como la extrapulmonar carecen de signo radiológico patognomónico, aunque en la primera la principal sospecha diagnóstica se basa en una imagen radiológica indicativa. Es una técnica sensible, pero poco específica. Actualmente tiene una gran importancia la tomografía computarizada (TC) de alta resolución para la diferenciación entre lesiones residuales y activas.
- –
TB pulmonar. Casi siempre causa alteraciones en la radiografía de tórax, aunque ésta puede ser normal en la TB endobronquial, en la miliar y en paciente con infección por el VIH e inmunodepresión grave. Se podrían definir 5 patrones radiológicos. El primero, denominado TB primaria, se da más frecuentemente con un estado inmunitario deficiente17,18 (C). En él se aprecia un infiltrado pulmonar, de extensión sublobular y localización subpleural (foco de Ghon), en el lóbulo medio o inferior, y menos frecuentemente en el segmento anterior del lóbulo superior, solo o acompañado de adenopatías hiliares (complejo de Ranke) o mediastínicas asociadas, o bien como adenopatías sin infiltrado, principalmente unilaterales, que en ocasiones pueden producir atelectasias por compresión. También pueden apreciarse derrame pleural y muy raramente cavitación. El segundo patrón, denominado TB progresiva, se manifiesta por una consolidación extensa y cavitación en el foco pulmonar primario o en los segmentos apical o posterior de los lóbulos superiores. El tercero, el de TB posprimaria, se manifiesta por opacidades parenquimatosas heterogéneas y mal definidas, que se distribuyen en más de un segmento, a menudo asociadas con cavitación, que puede ser única o múltiple (su pared puede ser fina y lisa o gruesa y nodular). La localización más frecuente es en los segmentos posterior y apical de los lóbulos superiores o en el apical de los inferiores. La diseminación broncógena se manifiesta como nódulos de entre 5 y 10mm, mal definidos, de distribución lobular o segmentaria a distancia de la cavitación, fundamentalmente en zonas inferiores de los pulmones. El cuarto patrón, el de TB miliar, está formado por innumerables nódulos de 1-3mm no calcificados, que se distribuyen por ambos campos pulmonares, con predominio en los lóbulos inferiores, que son más visibles en el espacio retrocardíaco en la proyección lateral, y que pueden estar acompañados de consolidación, cavitación y adenopatías, calcificadas o no. Por último, el patrón tuberculoma presenta nódulos de diferentes tamaños, por lo general menores de 3cm, de morfología variada y contorno bien definido y liso, aunque en ocasiones pueden ser irregulares y mal definidos, con nódulos satélites circundantes y de localización predominante en los lóbulos superiores.
- –
TB pleural. Muestra, en general, un derrame pleural unilateral, pequeño o moderado, aunque la cantidad de líquido puede llegar a ser importante. En un tercio de los casos hay enfermedad parenquimatosa visible radiológicamente en el mismo hemitórax del derrame.
- –
TB ganglionar. En la afectación de los ganglios internos la localización más frecuente es la paratraqueal derecha, hiliar y mediastínica. En la TC se aprecian adenopatías con una zona central de baja atenuación y realce periférico en forma de anillo con la administración de contraste.
- –
TB genitourinaria. Cuando afecta al riñón, se pueden ver calcificaciones dentro del parénquima renal y deformidades del cáliz renal. Si se afecta el uréter, éste se ve dilatado e irregular. La afectación de la vejiga se manifiesta como engrosamiento de la pared y disminución de la luz. La afectación genital en la mujer produce deformidad y obliteración de la cavidad endometrial, así como obstrucción de las trompas de Falopio.
- –
TB del sistema nervioso central. En la afectación meníngea, la TC puede mostrar una captación intensa y homogénea de contraste en la superficie cortical que se extiende dentro de los hemisferios, mientras que en la resonancia magnética la captación depende del estado de la enfermedad. El tuberculoma se manifiesta en la TC como masas redondeadas o lobuladas que demuestran captación de contraste en anillo.
- –
TB osteoarticular. Habitualmente se observa un margen de destrucción bien definido en la zona anterior del cuerpo vertebral. La progresión de la enfermedad da lugar a colapso anterior del cuerpo vertebral, produciendo la característica giba. El absceso paravertebral semeja una masa en mediastino posterior.
El diagnóstico de certeza de la TB sólo puede conseguirse con técnicas microbiológicas, que lamentablemente no son sensibles al 100%, por lo que en alrededor de un 10-15% de los casos todas estas técnicas serán negativas, a pesar de que se corresponderán con TB. En estos casos, el diagnóstico se basará en la clínica, la epidemiologia y las técnicas de imagen19.
Todas las técnicas microbiológicas son muy específicas, pero su sensibilidad irá estrechamente ligada a la calidad y el procesamiento de la muestra recogida.
Diagnóstico microbiológico convencional de la tuberculosisEl diagnóstico microbiológico convencional de la TB se sustenta en las siguientes técnicas: baciloscopia, cultivo, identificación de especie y antibiograma o pruebas de susceptibilidad19,20.
1. Baciloscopia directa. A pesar de los múltiples avances efectuados en los últimos años en el diagnóstico de la TB, la baciloscopia mediante la técnica de Ziehl-Neelsen continúa siendo la base del diagnóstico y seguimiento de la TB por su sencillez, rapidez, reproducibilidad en todos los ámbitos y bajo coste, y porque detecta los casos contagiosos de la comunidad, lo que constituye la base del diagnóstico y seguimiento de la TB. La tinción de los bacilos va ligada a los ácidos micólicos de la pared micobacteriana, y éstos están presentes en el resto de las micobacterias y no se pierden cuando el bacilo muere. Por lo tanto, una baciloscopia positiva puede corresponderse con M. tuberculosis vivo o muerto (lo que puede dificultar su interpretación en el seguimiento de los enfermos en tratamiento), o con otra micobacteria19,20.
Su principal inconveniente es su moderada sensibilidad, que está condicionada por la localización y el grado de afectación de la enfermedad, la calidad de la muestra y el tiempo que dedica el observador para determinar que una baciloscopia es negativa. La sensibilidad puede incrementarse mediante la concentración de la muestra. Sin embargo, su especificidad es muy elevada, superior al 95%, tan sólo limitada por los falsos positivos que pueden aportar otras micobacterias ambientales o por otras causas técnicas muy infrecuentes. Por consiguiente, una baciloscopia negativa no descarta la TB, pero una baciloscopia positiva prácticamente la confirma en más del 95% de los casos y es indicación de iniciar tratamiento19,20 (D).
La baciloscopia mediante técnica de fluorescencia (auramina) tiene la ventaja de un ahorro importante de tiempo en la lectura de la extensión (3-4 frente a 15-20min en el caso de baciloscopia negativa), por lo que puede estar indicada como cribado en los centros que procesan muchas muestras diarias. De todas formas, la baciloscopia positiva por fluorescencia debe confirmarse con la técnica de Ziehl-Neelsen19,20.
Los datos publicados sobre la sensibilidad de la baciloscopia en los infectados por el VIH evidencian una sensibilidad similar o ligeramente inferior.
2. Cultivo de las micobacterias. La otra técnica básica en el diagnóstico de la TB es el cultivo, único método que puede asegurar con certeza la existencia de TB si se acompaña de identificación, y el único que es completamente válido para evaluar el seguimiento del paciente y garantizar su curación. Además, el cultivo es necesario para realizar las otras 2 técnicas microbiológicas convencionales: la identificación y el antibiograma. Tiene, además, la importante ventaja de una mayor sensibilidad que la baciloscopia. El inconveniente de la larga espera necesaria para obtener el resultado —superior a 2-4 semanas, incluso con los métodos más rápidos— y el complejo procesamiento de la muestra limitan tremendamente su utilidad para la decisión clínica. Con demasiada frecuencia el cultivo sólo confirma diagnósticos, no los realiza como base de la decisión clínica, que suele tomarse basándose en técnicas mucho más rápidas como la baciloscopia y la radiografía. En cualquier caso, en los países industrializados debe realizarse siempre19,20.
Básicamente, hay 2 posibilidades de realizar los cultivos: en medio sólido y en medio líquido. El más utilizado y más barato es el medio sólido, sobre todo los preparados a base de huevo (Lowenstein-Jensen). Sin embargo, debido a las ventajas de una menor demora en obtener los resultados (2-4 frente a 3-8 semanas), la mayor sensibilidad y la posibilidad de automatización, poco a poco se han ido generalizando los medios líquidos, cuyo inconveniente es que tienen mayores tasas de contaminación (el 8-10 frente al 3-5%). En cualquier caso, su demora sigue siendo excesiva para la toma de decisiones clínicas.
Para los hemocultivos de las micobacterias son necesarias técnicas especiales, que estarían indicadas en pacientes muy inmunodeprimidos y febriles.
Aunque el cultivo se ha considerado siempre la técnica de referencia del diagnóstico de la TB, hay que tener presente que algunos casos con baciloscopia positiva pueden tener un cultivo negativo por pérdida de viabilidad de los bacilos o por el proceso de descontaminación de la muestra. Por otra parte, pueden producirse contaminaciones del laboratorio que den lugar a falsos positivos. Todo ello, sin embargo, no invalida el papel principal del cultivo en el diagnóstico y seguimiento de la TB.
3. Identificación de especie. La identificación de especie confirma el diagnóstico de TB al permitir diferenciar el complejo M. tuberculosis del resto de micobacterias. La identificación puede efectuarse por técnicas bioquímicas, por cromatografía y por sondas génicas. La complejidad de algunas técnicas bioquímicas y la demora en obtener los resultados han hecho que en la actualidad, en los países avanzados, se recomiende la identificación mediante técnicas génicas, que pueden aportar un resultado en 2-4h tanto si se realizan en muestra directa (técnicas de mplificación por reacción en cadena de la polimerasa) como a partir de las colonias aisladas (técnicas de hibridación)19,20 (B).
4. Pruebas de susceptibilidad a fármacos. Pueden realizarse sobre medios sólidos, donde el método más utilizado ha sido el de las proporciones, y sobre medios líquidos, que ahorran mucho tiempo (4-8 semanas si se suma la duración del cultivo y de estas pruebas) y son los más recomendados para los países desarrollados. Sin embargo, es necesario destacar que el resultado obtenido no es fiable al 100% y debe interpretarse siempre sobre la base de las características del paciente y la historia terapéutica previa. Están estandarizadas y son relativamente sencillas de realizar para los fármacos de primera línea, como isoniacida, rifampicina, etambutol y estreptomicina, pero no tanto para la piracinamida. En cualquier caso, mientras que el resultado para isoniacida y rifampicina aporta una fiabilidad clínica superior al 90%, para etambutol y estreptomicina es más creíble el resultado sensible (superior al 80%) que el resistente, el cual siempre irá ligado a la resistencia a estos fármacos que exista en la comunidad21,22.
A pesar de que su uso se está generalizando, es necesario destacar que las pruebas de susceptibilidad a fármacos de segunda línea no están completamente estandarizadas y los resultados para muchas de ellas no son del todo fiables. Están más estandarizadas y son de realización más sencilla para fluoroquinolonas y aminoglucósidos (amicacina), si bien todavía no está claramente definida la fiabilidad de sus resultados, que parece mayor para el resultado resistente que para el sensible. Sin embargo, para el resto de los fármacos de segunda línea estas pruebas no están ni siquiera estandarizadas y es conocida la escasa relevancia clínica de su resultado21,22.
Nuevas técnicas de diagnóstico microbiológicoA pesar de las múltiples líneas de investigación desarrolladas en este campo en los últimos 20 años, muy poco se puede incorporar al diagnóstico sistemático de la TB, y prácticamente nada a los países pobres. Tan sólo en los centros que dispongan de ellas habría que resaltar el buen apoyo que pueden aportar las siguientes técnicas19,20 (B):
- 1.
Detección rápida, mediante técnicas moleculares, de resistencia a la rifampicina, pues habitualmente va ligada a una o varias mutaciones del gen rpob. Esta detección, que puede efectuarse en muestra directa y aportar un resultado en pocas horas, también puede realizarse para los genes que codifican la resistencia a isoniacida (katG e inhA), aunque la resistencia a rifampicina casi siempre va ligada a resistencia a isoniacida.
- 2.
Técnicas moleculares de amplificación en muestras directas que han presentado una baciloscopia negativa, para incrementar su sensibilidad. El resultado puede obtenerse en 4h. Sin embargo, es muy probable que su sensibilidad no supere a la del cultivo. En cualquier caso, los resultados positivos deben interpretarse de acuerdo con el grado de sospecha clínica23,24. Por el contrario, una baciloscopia positiva con una técnica de amplificación negativa orienta a que se trata de una micobacteria ambiental23,24.
El hallazgo anatomopatológico típico de la TB es el granuloma necrosante o caseificante con células de Langerhans en muestras de tejido de los órganos afectados. En las formas extrapulmonares es el modo habitual para obtener el diagnóstico. Sin embargo, otras enfermedades (sarcoidosis, lepra, infecciones fúngicas, sífilis, etc.) pueden producir lesiones granulomatosas parecidas, por lo que el diagnóstico exclusivamente histológico sólo se interpreta como probable. Hay que recordar que las muestras histológicas deben remitirse también en fresco a fin de posibilitar el cultivo para micobacterias, así como realizar la tinción de Ziehl-Neelsen para identificar posibles bacilos en ellas (D). En los pacientes con infección por el VIH y/o con un profundo trastorno inmunitario la lesión granulomatosa típica es inusual.
LaboratorioLa elevación de la enzima adenosindesaminasa que se libera a partir de los linfocitos activados contribuye al diagnóstico de la TB pleural, peritoneal y meníngea. Cifras de adenosindesaminasa por encima de 45 U/l en pleuritis y ascitis, y por encima de 8-10 U/l en meninge y pericardio, tienen una elevada sensibilidad y especificidad para TB (C), pero también pueden observarse en otras enfermedades, por lo que se deben interpretar con precaución, en especial en los países con baja prevalencia de TB.
La determinación de IFN-g en suero, pleura o lavado broncoalveolar, a diferencia de la infección, todavía no es determinante para el diagnóstico de la enfermedad.
Recogida de muestrasLas mejores muestras para el diagnóstico de la TB pulmonar son los esputos espontáneos de procedencia bronquial. Se recomienda recoger 3 muestras de días sucesivos, que pueden guardarse en la nevera. Cuando el paciente no expectora, puede intentarse la obtención de esputos tras humidificación con vahos o inducidos con aerosoles de suero fisiológico, aunque con mucha precaución por el riesgo de contagio por los aerosoles contaminados. En niños pueden realizarse 3 aspirados gástricos, pero en adultos que no expectoran el método más recomendado es la broncoscopia (B). Hay que efectuar el estudio microbiológico del broncoaspirado, del lavado broncoalveolar y de las biopsias de posibles lesiones endobronquiales, en los que también debe realizarse el estudio histológico. Igualmente se intentará el estudio de los esputos tras broncoscopia (D).
En los derrames pleurales y en otras afectaciones de serosas deben recogerse muestras de los líquidos para estudios bioquímicos, bacteriológicos y citológicos, así como para la determinación de marcadores específicos como la adenosindesaminasa y, cuando es necesario, realización de biopsia con aguja a ciegas o con pleuroscopia.
En la TB extrapulmonar es a veces necesaria la punción aspirativa citológica con aguja fina o la biopsia quirúrgica para hacer el estudio histológico. Siempre se ha de complementar con la práctica de la baciloscopia, el cultivo y la identificación de micobacterias en la pieza obtenida25,26 (D).
TRATAMIENTO DE LA TUBERCULOSISAtendiendo a las bases bacteriológicas, para obtener la curación de la TB el régimen terapéutico recomendable de los casos iniciales en España es el de 6 meses, con 4 fármacos de primera línea durante los 2 primeros (isoniacida, rifampicina, piracinamida y etambutol) y 2 fármacos (isoniacida y rifampicina) durante los 4 restantes (2HRZE/4HR)27-30 (A). Se entiende por caso inicial el paciente que nunca ha sido tratado (caso nuevo) y el que ha recibido tratamiento previo, pero durante menos de 1 mes. En la silicotuberculosis se recomienda alargar la pauta hasta 9 meses y en la TB del sistema nervioso central hasta 12 meses (D); en este último caso se deben añadir 20-40mg de corticoides en la fase inicial30 (A).
La indicación de añadir etambutol a todos los pacientes se establece por motivos operativos y para cubrir la posibilidad de una elevada resistencia primaria a isoniacida, que no se conoce con exactitud en todas las comunidades autónomas españolas. No obstante, es muy probable que el mismo esquema sin etambutol continúe siendo válido para la mayoría de los pacientes con TB nacidos en España. El etambutol podrá eliminarse de la pauta terapéutica cuando el antibiograma muestre sensibilidad a los fármacos de primera línea.
Se debe tomar la medicación en una única dosis por la mañana y en ayunas, y no ingerir nada hasta pasada media hora. La dosis de etambutol en el niño, especialmente en los menores de 5 años, será de 15mg/kg de peso al día28 (tabla III).
Dosificación de los fármacos antituberculosos
| Fármaco | Dosis diaria |
| Isoniacida (H) | 5mg/kg. En niños: 10-15mg/kg. Máximo: 300mg/día |
| Rifampicina (R) | 10mg/kg. En niños: 10-20mg/kg Máximo: 600mg/día |
| Piracinamida (Z) | 20-30mg/kg. Máximo: 2g/día |
| Etambutol (E) | 25mg/kg los 2 primeros meses; seguir con 15mg/kg. |
| En niños < 5 años: 15mg/kg. Máximo: 2g/día | |
| Estreptomicina (S) | 15-30mg/kg vía intramuscular |
| Capreomicina (Cp) | Máximo: 1g/día o 750mg en > 50 años o peso inferior a 50kg |
| Kanamicina (K) | |
| Amikacina (Ak) | |
| Cicloserina (Cs) | 15mg/kg. Máximo: 1g/día |
| Protionamida (Pt) | 15mg/kg. Máximo: 1g/día |
| Etionamida (Et) | |
| Ácido paminosalicílico (PAS) | 200mg/kg. Máximo: 12g/día |
| Moxifloxacino (Mx) | 400mg/día |
| Ciprofloxacino (Cx) | 750mg/12h |
| Ofloxacino (Ox) | 400mg/12h |
| Levofloxacino (Lx) | 500-1.000mg/día |
| Clofacimina (Cf) | 100-200mg/día |
| Rifabutina (Rb) | 5mg/kg. Máximo: 300mg/día |
| Linezolid (Lz) | 1.200mg/día |
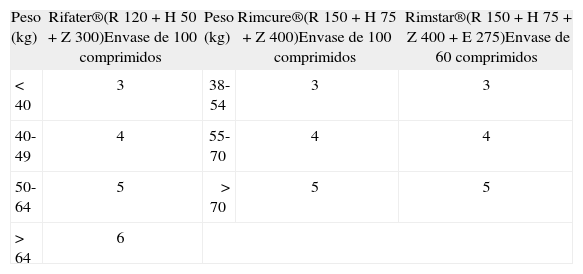
En la actualidad disponemos de preparados comerciales que combinan dosis fijas de los fármacos de primera línea y facilitan el cumplimiento del tratamiento, al reducir el número de pastillas a tomar, además de prevenir el desarrollo de resistencias, al evitar la monoterapia, en caso de abandono. La recomendación es que se generalice el empleo de las combinaciones fijas para tratar la TB (C). En la tabla IV se exponen las combinaciones fijas existentes en el mercado y su dosificación según el peso.
Tratamiento de la tuberculosis con preparados en combinación fija: número de pastillas, según el peso del paciente y el preparado
| Peso (kg) | Rifater®(R 120 + H 50 + Z 300)Envase de 100 comprimidos | Peso (kg) | Rimcure®(R 150 + H 75 + Z 400)Envase de 100 comprimidos | Rimstar®(R 150 + H 75 + Z 400 + E 275)Envase de 60 comprimidos |
| < 40 | 3 | 38-54 | 3 | 3 |
| 40-49 | 4 | 55-70 | 4 | 4 |
| 50-64 | 5 | > 70 | 5 | 5 |
| > 64 | 6 | |||
| Fase de continuación: 4 meses | |||
| Peso (kg) | Rifinah®(R 300 + H 150)Envase de 60 comprimidos | Rimactazid®(R 300 + H 150)Envase de 60 comprimidos | Tisobrif®(R 600 + H 300)Envase de 30 sobres |
| 50-90 | 2 | 2 | 1 |
E: etambutol; H: isoniacida; R: rifampicina; Z: piracinamida.
Como tratamiento alternativo al de 6 meses puede utilizarse el régimen de 9 meses —2 con isoniacida, rifampicina y etambutol, y los 7 restantes con isonicida y rifampicina (2HRE/7HR)—. Esta pauta está especialmente indicada en los pacientes con gota. Otros tratamientos alternativos posibles son los regímenes intermitentes de 6 meses que se administran 2 o 3 veces por semana. Éstos son eficaces, pero producen mayores efectos indeseables y requieren la administración observada (D).
Tratamiento de la tuberculosis en situaciones especialesEl hígado y el riñón, además de sufrir la toxicidad específica del fármaco, pueden potenciarla por deficiencia en su metabolismo o eliminación. En los pacientes con insuficiencia hepática o renal es aconsejable conocer el grado de alteración inicial, que, aunque no se relaciona con el grado de deterioro por el tratamiento, orienta al clínico sobre la reserva funcional del órgano.
Enfermedad hepáticaLa isoniacida, rifampicina y piracinamida se metabolizan en el hígado y son fármacos hepatotóxicos, con el siguiente orden decreciente de frecuencia: la isoniacida es el más frecuente, aunque la piracinamida es el de mayor toxicidad hepatocelular dependiente de la dosis y la rifampicina es responsable de ictericia y colestasis. La asociación de piracinamida y rifampicina aumenta, y aún más con isoniacida, su hepatotoxicidad. De los fármacos de segunda línea, sólo la protionamida y la etionamida pueden llegar a serlo. El abuso crónico de alcohol sin signos clínicos de hepatopatía crónica incrementa la probabilidad de toxicidad hepática, pero no contraindica el tratamiento estándar si el paciente ha renunciado al hábito etílico28,31 (D). Entre las situaciones agudas, en la TB diseminada con alteración hepática debe iniciarse el tratamiento estándar bajo estrecha vigilancia de la función hepática, modificándolo si hay deterioro funcional27 (D). En otras enfermedades agudas, como la hepatitis, se debe comenzar con al menos 3 fármacos que no sean hepatotóxicos y continuar con estreptomicina más etambutol o rifampicina más isoniacida según sea la evolución tras la fase inicial28 (D). El tratamiento del paciente con enfermedad hepática crónica, sobre todo si está muy evolucionada, plantea serios problemas que siempre requieren dedicación especializada: debe evitarse la piracinamida e intentar mantener la isoniacida más rifampicina, o al menos esta última, aunque en manos expertas y situación clínica estable puede iniciarse el tratamiento estándar, con revisión semanal de la función hepática siguiendo los mismos criterios empleados en la hepatitis medicamentosa, e intentar modificarlo, si es necesario, reintroduciendo rifampicina e isoniacida sucesivamente, siempre con la protección de estreptomicina, etambutol, fluoroquinolonas o cicloserina.
Insuficiencia renalEl etambutol, la estreptomicina y todos los fármacos de segunda línea son o pueden llegar a ser nefrotóxicos, ya que se excretan por el riñón en forma activa, excepto la etionamida, que lo hace en forma de metabolitos. Los antituberculosos imprescindibles (isoniacida, rifampicina y piracinamida) que tienen metabolismo hepático y eliminación renal en forma inactiva pueden administrarse sin limitación de dosis en la insuficiencia renal, siendo dializables la isoniacida, rifampicina, etambutol y sobre todo piracinamida27. En nuestro país, sólo los medicamentos de administración oral con isoniacida no combinada con otros fármacos y uno de los combinados llevan incorporada piridoxina, recomendada para prevenir la neuropatía periférica. La pauta más segura, una vez descartada la resistencia a fármacos, es la de 2 meses con isoniacida, rifampicina y piracinamida, y 4 meses con isoniacida y rifampicina (2HRZ/4HR), que no tiene ninguna limitación2831 (D). En la insuficiencia renal pueden administrarse etambutol y estreptomicina, e incluso los fármacos de segunda línea si fuera necesario, reduciendo la cantidad de medicamento a excretar en función del filtrado glomerular. En general, aunque el aclaramiento de creatinina sea inferior a 50ml/min, deben mantenerse las dosis convencionales administradas 3 veces por semana para asegurar la concentración inhibitoria mínima necesaria para su acción bactericida27 (D); en caso de aclaramiento inferior a 30ml/min y de pacientes en hemodiálisis, puede usarse la misma pauta, pero es recomendable realizar el seguimiento de la concentración sérica de los fármacos. Los pacientes en hemodiálisis deben recibir el tratamiento siempre después de la diálisis, ya que, excepto la rifampicina, todos los fármacos de primera línea son dializables en mayor o menor grado.
Coinfección de tuberculosis y virus de la inmunodeficiencia humanaEl tratamiento estándar (2HRZE/4HR) en pauta diaria con combinaciones fijas de fármacos es el más eficaz para el paciente infectado por el VIH (B) y para el que se desconoce si lo está o no (A). Se recomienda determinar la serología del VIH a todo paciente con TB32 (D). La coinfección TB-VIH debe ser manejada siempre por expertos en ambas infecciones30 (D). Los problemas terapéuticos suelen derivar de la mayor prevalencia de resistencia a múltiples fármacos antituberculosos en estos pacientes, que se trata con las mismas directrices que en el no infectado por el VIH, de la gravedad y el momento evolutivo de ambas infecciones, y de la interacción farmacológica entre rifampicina y 2 grupos de fármacos del tratamiento antirretroviral de gran actividad (TARGA): los inhibidores de la proteasa y algún inhibidor de la transcriptasa inversa no análogo de nucleósido; hay normativas32 y excelentes revisiones33,34 al respecto. En esencia, se debe intentar mantener la rifampicina y tratar la TB antes que el sida para evitar el síndrome de reconstrucción inmunológica. Así pues, se aconseja: a) completar los 6 meses de tratamiento antituberculoso en el paciente con recuento de CD4+ por encima de 350 células/μl antes de iniciar el TARGA; b) tratar la TB durante los 2 primeros meses para valores de CD4+ entre 200 y 350 células/μl e iniciar luego el TARGA con 3 de sus fármacos compatibles con rifampicina, si es posible, y c) tratar la TB durante 2-8 semanas en el paciente con recuento de CD4+ menor de 200 células/μ, si tolera la espera, para iniciar luego el TARGA con los mismos requisitos, o bien un tratamiento conjunto desde el inicio con TARGA utilizando sus fármacos compatibles con rifampicina o rifabutina, si el estado del paciente no permite el retraso32,34 (D). Sin rifampicina, el tratamiento antituberculoso es mucho menos efectivo; si es preciso, puede utilizarse rifabutina, que tiene pocas interacciones, o prolongar la fase de mantenimiento con isoniacida y etambutol hasta los 18 meses34 (D).
Embarazo y lactanciaNi el embarazo ni la lactancia modifican el tratamiento estándar de la TB30 (B), y pueden añadirse pequeñas dosis de piridoxina para el lactante27,28 (D). En el embarazo está prohibida la estreptomicina, así como kanamicina, amikacina y capreomicina, por toxicidad fetal; se conoce poco la de otros fármacos de segunda línea, como la cicloserina, protionamida y fluoroquinolonas, que requerirán una valoración puntual de su riesgo y beneficio 27 (D).
Niños y ancianosEl tratamiento de la TB en el niño sólo difiere del adulto en la dosificación de los fármacos con relación al peso (B). En menores de 5 años es difícil obtener información sobre posibles alteraciones de la visión por etambutol. El tratamiento del niño requiere facultativos expertos en ambas áreas27,30 (D). En el anciano, que con frecuencia reúne comorbilidad, tratamientos con numerosos fármacos y algún grado de deterioro de la función renal, debe vigilarse la interacción entre fármacos.
Intolerancia a la vía oral y pérdida de concienciaLa pérdida de conciencia obliga a cambiar las formas farmacéuticas y la vía de administración, ya sea mediante gastrectomía percutánea o por vía parenteral. La intolerancia gástrica puede obligar a fraccionar la dosis en varias tomas, a la administración de antieméticos o anti-H2 e incluso a la utilización de la vía parenteral. En nuestro país sólo están comercializados por vía parenteral la isoniacida, rifampicina, etambutol, estreptomicina, amikacina, kanamicina, capreomicina y fluoroquinolonas.
Efectos adversos de la medicación27,31,35En la mayoría de los pacientes la medicación antituberculosa habitual es bien tolerada y no presenta complicaciones ni efectos adversos significativos. Pueden aparecer, preferentemente al inicio del tratamiento, síntomas leves tales como exantema, urticaria, erupciones cutáneas, que se suelen resolver cambiando la preparación comercial y/o añadiendo tratamiento sintomático (antihistamínicos, raramente corticoides). También pueden aparecer trastornos digestivos leves (náuseas, vómitos) sin afectación hepática, que pueden solucionarse con tratamiento sintomático (antieméticos, anti-H2) o bien modificando el modo de ingestión de los fármacos (en varias tomas, repartiéndolas con las diferentes comidas o tomándolas con éstas).
Pueden producirse asimismo alteraciones hepáticas: elevación de las transaminasas (citólisis) y/o de la fosfatasa alcalina (colestasis), lo cual puede producir o no síntomas. En estos casos ha de retirarse la medicación si las cifras de transaminasas son 5 veces mayores de las normales en pacientes asintomáticos o 3 veces mayores en sintomáticos. Si no es el caso, se puede continuar el tratamiento antituberculoso con vigilancia estricta (clínica y analítica) y medicación sintomática si es preciso. La ictericia es el síntoma más grave y condiciona riesgo de muerte si no se retiran los tóxicos.
Otra complicación es la aparición de fiebre una vez que ha desaparecido tras el tratamiento (hay que tener en cuenta que la fiebre derivada de la propia enfermedad puede tardar varias semanas en desaparecer). Si se sospecha fiebre secundaria a fármacos, se ha de determinar qué medicación es la que lo produce con el fin de retirarla; en ocasiones se pueden añadir corticoides.
En el caso de que haya una complicación importante (fundamentalmente hepatitis o fiebre), ha de determinarse qué medicamento causa el efecto secundario. Para ello se interrumpirá el tratamiento hasta la desaparición de la fiebre o normalización de las pruebas hepáticas (paciente asintomático y con valores de transaminasas por debajo de 2 veces los normales). A continuación se reintroducirán los fármacos de uno en uno cada 3 días (la rifampicina se administrará en dosis progresiva: 150, 300, 450, 600), reservando el que se supone es la causa del problema (la isoniacida es el que suele causar citólisis y la rifampicina, colestasis), o bien se reiniciará el tratamiento completo, excepto el fármaco que se cree que puede ser la causa del problema. Una vez descubierto el medicamento causante del efecto secundario, ha de modificarse la pauta de tratamiento (sin rifampicina o isoniacida no se podrá hacer pauta de 6 o 9 meses; sin piracinamida no se podrá utilizar la pauta de 6 meses). En los casos en que es preciso retirar el tratamiento estándar, conviene que el responsable del paciente tenga experiencia en el manejo de la enfermedad.
Es importante advertir a los pacientes de las posibles alteraciones auditivas (estreptomicina) y oculares (etambutol), así como de las interacciones de la rifampicina con los anticonceptivos hormonales orales.
Los principales efectos adversos de la medicación antituberculosa se recogen en la tabla V.
Efectos adversos de la medicación antituberculosa de primera línea
| Fármacos | Efectos adversos |
| Hidracidas | ExantemaElevación de las transaminasas HepatitisNeuropatía periféricaInteracciones con antiepilépticos (fenitoína) o disulfiram (antabus)Artralgias |
| Rifampicina | ExantemaHepatitisTrombocitopeniaFiebreCuadros seudogripalesHemólisisColoración anaranjada de fluidos corporales (orina, heces, lágrimas) |
| Piracinamida | Malestar gastrointestinalElevación de ácido úricoExantemaHepatitisArtralgiaGota (raro) |
| Etambutol | Neuritis ópticaDisminución de la agudeza visualExantema |
| Estreptomicina | Toxicidad vestibular y auditiva Nefrotoxicidad |
Deben revisarse siempre las posibles interacciones entre los fármacos antituberculosos y el resto de los medicamentos administrados al paciente, ya que son frecuentes y en ocasiones importantes. Cuando un fármaco inhibe o potencia la eliminación de otro, hace que aumente o disminuya su concentración sérica, de modo que puede resultar tóxico o ineficaz a la dosis establecida. Las interacciones de fármacos utilizados conjuntamente, si son opuestas como en la rifampicina e isoniacida, pueden compensarse, pero en general predomina el efecto de uno de ellos, en este caso la rifampicina.
Excepto la rifabutina, muy poco utilizada, ningún fármaco antituberculoso ve modificada con relevancia clínica su eficacia por su interacción con otro. La rifabutina, entre otros efectos, aumenta su concentración sérica por indinavir y ritonavir, lo que obliga a reducir la dosis diaria de indinavir a la mitad y la de ritonavir a 150mg en días alternos27.
Por el contrario, los fármacos antituberculosos interaccionan con numerosos grupos terapéuticos por su acción inductora de diversas isoenzimas del sistema 3A del citocromo P450.
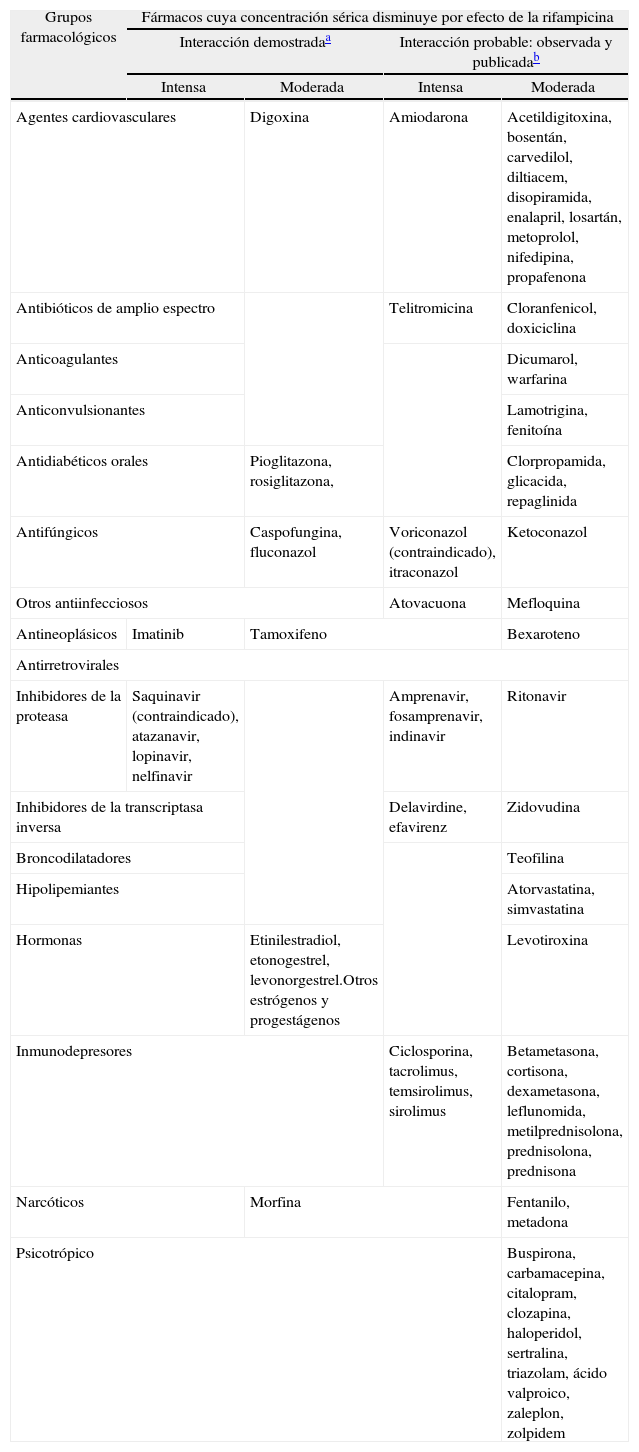
La rifampicina, como potente inductora de numerosas isoenzimas 3A e inhibidora de alguna de ellas, interacciona con muchos fármacos de uso frecuente36,37 (tabla VI). Son necesarios el seguimiento clínico del paciente tratado con estos fármacos, la modificación de su dosis y en ocasiones la determinación de concentraciones sanguíneas del fármaco implicado, que pueden condicionar la sustitución de la rifampicina por otro antituberculoso. Deben recordarse el efecto rebote y la persistencia de los valores séricos alterados hasta 2 semanas después de concluir el tratamiento con rifampicina u otra rifamicina. De todas las interacciones descritas para la rifampicina, sólo 2 (saquinavir y voriconazol) contraindican formalmente su utilización conjunta. La rifabutina es la rifamicina con menor efecto inductor del citocromo P450.
Grupos farmacológicos y fármacos que disminuyen significativamente su concentración sérica por interacción de la rifampicina, según grado de evidencia y gravedad36,37
| Grupos farmacológicos | Fármacos cuya concentración sérica disminuye por efecto de la rifampicina | |||
| Interacción demostradaa | Interacción probable: observada y publicadab | |||
| Intensa | Moderada | Intensa | Moderada | |
| Agentes cardiovasculares | Digoxina | Amiodarona | Acetildigitoxina, bosentán, carvedilol, diltiacem, disopiramida, enalapril, losartán, metoprolol, nifedipina, propafenona | |
| Antibióticos de amplio espectro | Telitromicina | Cloranfenicol, doxiciclina | ||
| Anticoagulantes | Dicumarol, warfarina | |||
| Anticonvulsionantes | Lamotrigina, fenitoína | |||
| Antidiabéticos orales | Pioglitazona, rosiglitazona, | Clorpropamida, glicacida, repaglinida | ||
| Antifúngicos | Caspofungina, fluconazol | Voriconazol (contraindicado), itraconazol | Ketoconazol | |
| Otros antiinfecciosos | Atovacuona | Mefloquina | ||
| Antineoplásicos | Imatinib | Tamoxifeno | Bexaroteno | |
| Antirretrovirales | ||||
| Inhibidores de la proteasa | Saquinavir (contraindicado), atazanavir, lopinavir, nelfinavir | Amprenavir, fosamprenavir, indinavir | Ritonavir | |
| Inhibidores de la transcriptasa inversa | Delavirdine, efavirenz | Zidovudina | ||
| Broncodilatadores | Teofilina | |||
| Hipolipemiantes | Atorvastatina, simvastatina | |||
| Hormonas | Etinilestradiol, etonogestrel, levonorgestrel.Otros estrógenos y progestágenos | Levotiroxina | ||
| Inmunodepresores | Ciclosporina, tacrolimus, temsirolimus, sirolimus | Betametasona, cortisona, dexametasona, leflunomida, metilprednisolona, prednisolona, prednisona | ||
| Narcóticos | Morfina | Fentanilo, metadona | ||
| Psicotrópico | Buspirona, carbamacepina, citalopram, clozapina, haloperidol, sertralina, triazolam, ácido valproico, zaleplon, zolpidem | |||
Dado que el contagio de la TB se produce preferentemente por vía aérea, la sospecha clínica, el aislamiento, diagnóstico e inicio del tratamiento, todo ello de forma precoz, son medidas fundamentales para evitar la transmisión. Hay estudios sobre los efectos del tratamiento en la población bacilar y su acción bactericida y esterilizante; si bien no se refieren ni se han diseñado para investigar la transmisión de la TB38, con estos datos se asume que la contagiosidad de los pacientes con TB pulmonar disminuye de forma importante al inicio del tratamiento, aunque se desconoce el tiempo en que un paciente tratado deja de ser contagioso, establecido de forma empírica en 2 o 3 semanas.
El problema de la transmisión es especialmente importante en las instituciones cerradas, tanto en los hospitales tradicionales o unidades de hospitalización como en otros lugares: consultas, urgencias, residencias, cárceles, hospitalización a domicilio39.
En el medio hospitalario, cuando al servicio de urgencias llega un paciente en el que existe sospecha diagnóstica de TB, debe ser aislado y permanecer el menor tiempo posible en dicha unidad. Se han de evitar ingresos hospitalarios innecesarios y, en caso de ingreso, la estancia debe ser la menor posible. El personal sanitario que entra en contacto con un paciente con TBha de usar mascarilla de partículas, y éste, si por algún motivo debe salir de su habitación (p. ej., para realizarse una radiografía), ha de utilizar mascarilla quirúrgica39; en ambos casos ha de darse una explicación al paciente acerca de los motivos30. Tras el ingreso hospitalario en habitación individual, se suspenderá el aislamiento cuando se obtengan baciloscopias negativas y se alcance un diagnóstico alternativo o no se prosiga el estudio y se descarte el diagnóstico de TB. Si ésta se confirma, se continuará el aislamiento. Dado que no hay evidencia de cuándo un paciente deja de ser contagioso, parece prudente huir de plazos fijos para levantar el aislamiento hospitalario, tal como hace alguna normativa30; en otras39,40 se señala una serie de condicionamientos. Nuestra recomendación es evitar que los pacientes con TB en tratamiento compartan habitación con otros pacientes ingresados durante su estancia en el hospital (sería la situación ideal), o al menos esperar a suspender el aislamiento hasta que hayan transcurrido 3 semanas de tratamiento, haya respuesta y adherencia al mismo, y las baciloscopias hayan resultado negativas. Las recomendaciones se exponen en la tabla VII.
Medidas de aislamiento hospitalario (nivel de evidencia: D)
Evitar ingresosEstancia mínima necesariaMascarilla de partículas para el personal sanitarioMascarilla quirúrgica para el pacienteNo compartir habitación en espera de confirmar/excluir tuberculosisSi existe tuberculosis: aislamiento aéreo del pacienteSituación ideal: no compartir habitaciónPodría suspenderse el aislamiento
|
El lugar más adecuado para tratar a los pacientes y evitar la transmisión de la enfermedad es su domicilio, donde deben permanecer hasta que cumplan 2 o 3 semanas de tratamiento, evitando visitas y contactos con nuevas personas.
Control del tratamientoEl objetivo del seguimiento del tratamiento es controlar el cumplimiento de éste, evaluar su eficacia y detectar lo antes posible los efectos adversos. Estos controles deben incluir:
Clínica. Se realizará una anamnesis de la mejoría clínica y de los potenciales efectos adversos. Se comprobará el correcto cumplimiento del tratamiento y se motivará para que se mantenga en todo momento. Se debe realizar una prueba de reconocimiento de los fármacos, así como un examen sorpresa de orina para comprobar la coloración anaranjada característica de la rifampicina. La reacción de Eidus-Hamilton permite detectar la presencia de los metabolitos de isoniacida en orina. Se advertirá a las mujeres fértiles de la interacción de la rifampicina con los anticonceptivos orales. Es importante controlar los cambios de peso a fin de ajustar las dosis si fuera necesario.
El control clínico debe realizarse a las 2-3 semanas para detectar errores y toxicidad precozmente, y luego cada mes hasta finalizar el tratamiento.
- –
Analítica. Debe incluir hemograma, recuento y fórmula de leucocitos, tiempo de tromboplastina parcial, perfil hepático, renal y ácido úrico. Debe realizarse siempre en el primer mes de tratamiento. En los controles posteriores deberán repetirse el hemograma y el perfil hepático en los meses 2, 4 y 6.
- –
Bacteriología. Deben efectuarse baciloscopia y cultivo de esputo a los 2, 4 y 6 meses, siempre que sea posible la obtención de muestra.
- –
Radiografía de tórax. Se realizará a los 2 meses y al finalizar el tratamiento, y siempre que se considere necesario. En la TB extrapulmonar hay que individualizar las técnicas de imagen según la localización.
El hecho de que la TB precise todavía de un tratamiento que dura tantos meses favorece que determinados individuos lo abandonen. Este fenómeno, que ya se observó cuando se introdujeron los modernos fármacos antituberculosos, propició que a partir de 1950 se sentaran las bases de los tratamientos directamente observados (TDO).
“Cumplimiento del tratamiento” significa que el paciente sigue las prescripciones médicas, mientras que “adherencia” comporta la cooperación activa del paciente, aunque en España ambos términos se equiparan. El objetivo de un programa de control en nuestro medio debería ser alcanzar una adherencia al tratamiento superior al 90%. Para ello es menester, en primer lugar, que el clínico motive al paciente explicándole la importancia de seguir el tratamiento y las recomendaciones habituales41. Se han identificado diversas estrategias para conseguir buenas adherencias que, según el grado de complejidad, son: tratamiento autoadministrado con control mensual, sin o con incentivos; tratamiento supervisado semanal; TDO bimensual; TDO diario o intermitente ambulatorio; TDO diario en unidad cerrada, y TDO obligatorio42.
Los Centers for Disease Control de EE.UU. recomiendan el TDO en los grupos con adherencia inferior al 90%43. En nuestro país, los factores asociados al abandono del tratamiento más frecuentes son: enolismo, indigencia, encarcelamiento y toxicomanía. En estos grupos se recomienda el TDO. Si, además, se potencian la coordinación entre clínicos y el seguimiento de los pacientes por enfermeras de salud pública, se consiguen cumplimientos superiores al 95%44. Por lo que a los presos se refiere, si obtienen la libertad durante el tratamiento, la probabilidad de que lo abandonen es alta. Como quiera que en la mayoría de los casos son además toxicómanos, una buena coordinación entre los programas de metadona de instituciones penitenciarias y los municipales puede lograr que estos pacientes completen el tratamiento45.
Pautas no estándar y retratamientosUna pauta no estándar (PNE) es la que contiene una combinación de fármacos distinta de la que se recomienda para los tratamientos iniciales (2 HRZ más etambutol o estreptomicina/4HR). Cuando la PNE se instaura tras un fracaso terapéutico o tras una recidiva con bacilos resistentes a algún fármaco de primera línea, se ha convenido en llamarlo “retratamiento”, pero a efectos prácticos son equiparables.
Las PNE tienen siempre una duración superior a los 6 meses de las pautas estándar, entre 9 y 24 meses. Se basan en prolongar más de 2 meses la toma de piracinamida, etambutol o estreptomicina en la fase inicial, y casi siempre incluyen otros fármacos de segunda línea, que son menos efectivos, producen más efectos secundarios, son más caros y obligan a un cumplimiento muy estricto para no crear resistencias.
Motivos para iniciar una pauta no estándarSon diversas las situaciones que, tras el diagnóstico de la TB o en el curso de un tratamiento estándar, obligan a iniciar o a cambiar el tratamiento inicial por una PNE:
1. Resistencias. La resistencia de M. tuberculosis a cualquier fármaco antituberculoso se da de forma natural por mutación espontánea, siempre que haya una colonia con más de 105 gérmenes. Para vencer esta resistencia natural, el tratamiento de la TB precisa la combinación de un mínimo de 3 fármacos. Se conocen los genes implicados en la aparición de la mayoría de las resistencias a los fármacos de primera línea, lo cual ha permitido disponer de pruebas rápidas de laboratorio que en poco tiempo aseguran la sensibilidad o resistencia a los fármacos clave: rifampicina y isoniacida.
Las resistencias pueden ser primarias (pacientes que nunca han recibido tratamiento antituberculoso, generalmente debido a un contagio con microorganismos resistentes), o secundarias o adquiridas (pacientes que han hecho un tratamiento previo incorrecto, con monoterapias o biterapias abiertas o encubiertas). Los pacientes también pueden ser: a) monorresistentes, si lo son a un solo fármaco, generalmente isoniacida; b) multirresistentes, si la resistencia afecta por lo menos a rifampicina e isoniacida, o c) extremadamente resistentes, si, aparte de la resistencia a rifampicina e isoniacida, también lo son a quinolonas y a alguno de los fármacos que deben administrarse por vía parenteral. Los pacientes multirresistentes y sobre todo los extremadamente resistentes son de muy difícil manejo y tienen un pronóstico incierto, sobre todo si presentan algún proceso inmunodepresor como el sida46,47.
Debido a la actual globalización del mundo, el riesgo de resistencias puede crecer en todos los países, incluso en los que, como España, tienen tasas de resistencias todavía bajas. Por lo tanto, la sospecha de resistencias debe tenerse ante cualquier nuevo enfermo, sobre todo en aquéllos con lesiones extensas y una densidad bacilar alta30 (B). De todas maneras, el grado de sospecha será mayor en los siguientes casos48,49 (B):
- –
Fracasos terapéuticos, cuando los pacientes no mejoran ni clínica ni radiológicamente y mantienen los cultivos positivos con el mismo número de colonias tras 4 meses de tratamiento, o cuando reaparecen los cultivos positivos tras unos meses de negativización. Es una situación de resistencia a todos los fármacos de la pauta, por lo que debe instaurarse un retratamiento con 3 o 4 fármacos no usados previamente. Los fracasos son raros en España, ya que sólo se producen cuando el paciente sigue de forma inadecuada un tratamiento sin las combinaciones de los fármacos en un sólo medicamento, que son las que se utilizan habitualmente en nuestro país.
- –
Inmigrantes, procedentes de países en vías de desarrollo y con altas tasas de resistencias.
- –
Recaídas en pacientes con historia de haber tomado previamente fármacos antituberculosos por enfermedad o infección. Cuando el tratamiento previo fue correcto, no suele haber resistencias y puede repetirse el mismo tratamiento estándar. Si fue irregular, debe instaurarse un retratamiento con fármacos nuevos hasta obtener el antibiograma.
- –
Contactos íntimos de un paciente con TB resistente.
- –
Infectados por el VIH.
- –
La confirmación de resistencias debe hacerse mediante pruebas del laboratorio de micobacteriología:
- –
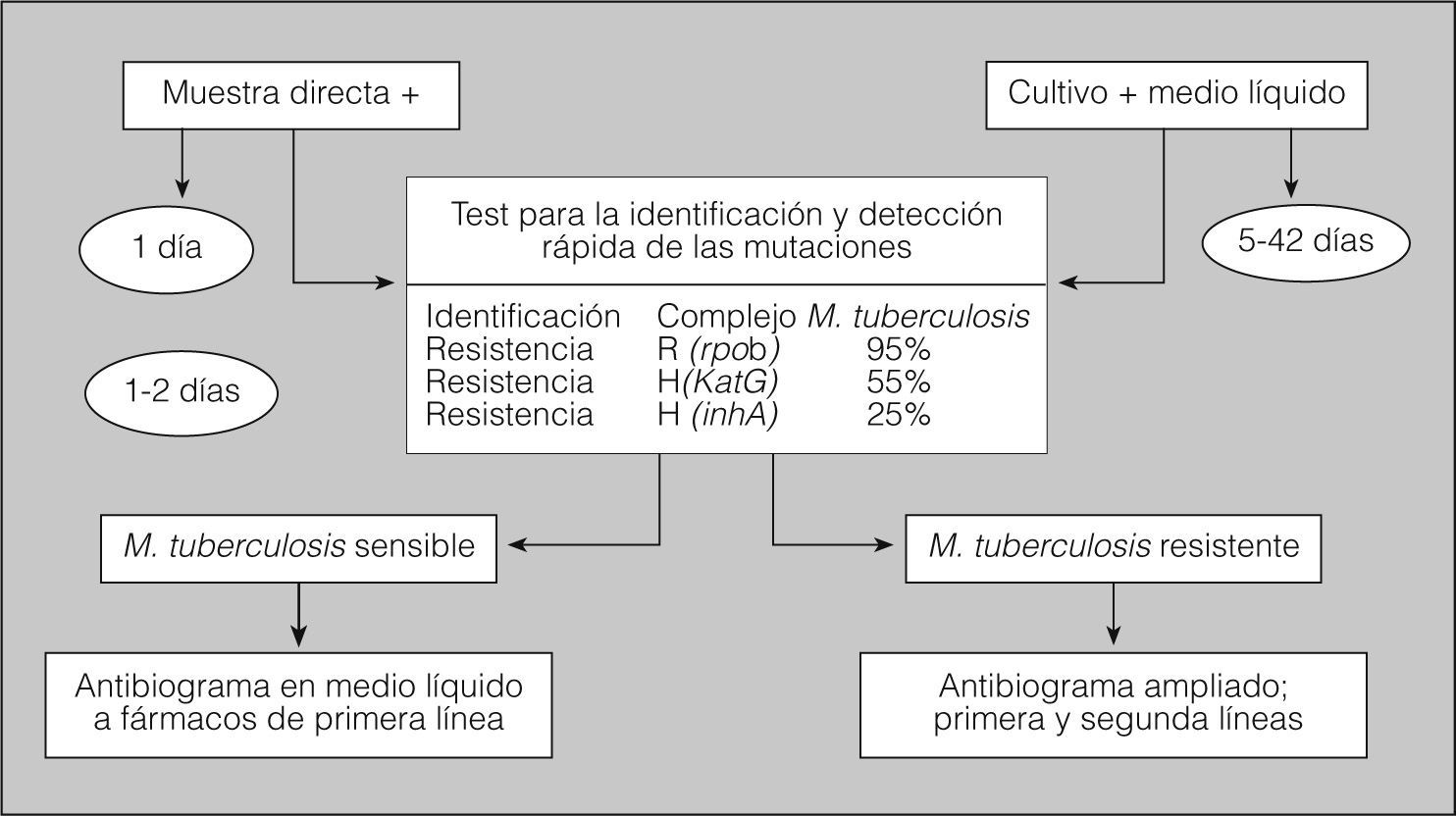
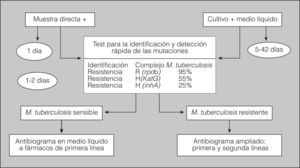
Prueba rápida automatizada, con secuenciación sobre cultivo positivo e incluso sobre baciloscopia positiva. Permite detectar las mutaciones de los genes de la rifampicina (95%) y de la isoniacida (55%). Su resultado se tiene a las pocas horas. Hay que pedirlo siempre que esté disponible (fig. 2).
- –
Antibiograma de los 5 fármacos de primera línea sobre cultivo positivo en medio líquido. Se puede disponer de él a los pocos días del cultivo positivo. Hay que pedirlo siempre; cuando no es posible, hay que solicitarlo por lo menos a los grupos de más alto grado de sospecha, sobre todo en los casos con baciloscopia positiva.
- –
Antibiograma ampliado a fármacos de segunda línea. Los resultados pueden tardar de 3 a 5 semanas desde la obtención del cultivo positivo. Sólo hay que pedirlo cuando hay multirresistencia y se sospecha resistencia extrema (fig. 2).
- 2.
Intolerancia. Cuando al iniciar el tratamiento estándar aparece intolerancia digestiva con vómitos, o enfermedad digestiva grave, que no permiten un tratamiento seguro, debe instaurarse temporalmente una PNE con los fármacos que pueden administrarse por vía parenteral (tabla III). Progresivamente se reinstaurará la pauta habitual oral, que casi siempre es tolerada al cabo de varias semanas.
- 3.
Toxicidad. Los fármacos antituberculosos tienen numerosos efectos tóxicos, algunos potencialmente muy graves, que obligan a cambiar de forma temporal o definitiva la pauta terapéutica por una PNE.
- 4.
A veces, antes de instaurar el tratamiento inicial hay una fuerte sospecha de que alguno de los fármacos dará problemas serios y se inicia una PNE.
- 5.
Interacciones. El fármaco que puede causar más problemas es la rifampicina, que, por ser un potente inductor del citocromo P450, aumenta la metabolización y reduce la vida media de muchos medicamentos que se toman para tratar otras enfermedades concomitantes. En muchos de estos casos deben utilizarse PNE.
- 2.
En ocasiones, en un mismo paciente pueden concurrir resistencias, toxicidad e interacciones, lo que dificulta enormemente encontrar pautas terapéuticas adecuadas para la curación de la enfermedad.
NormasPara elegir la mejor pauta de retratamiento hay que seguir una serie de normas de actuación que se basan en la experiencia de grupos de especialistas26,30 (B):
- 1.
Las resistencias son irreversibles, por lo que nunca se puede reintroducir un fármaco del que se sabe que hay resistencia ni se debe añadir un único medicamento nuevo a una pauta ineficaz.
- 2.
Siempre debe utilizarse en la fase inicial un mínimo de 3 fármacos si se conoce el antibiograma, o de 4, si se desconoce todavía la sensibilidad. No se ha demostrado que más de 4 fármacos aporten mejores resultados. Esta fase inicial debe prolongarse hasta que se obtenga la negativización bacteriológica, o cuando se observe una franca mejoría clínica y radiológica si no es posible conseguir muestras para el seguimiento bacteriológico. En la fase de continuación, deben mantenerse 2 fármacos útiles hasta un mínimo de tiempo total de tratamiento de 12 meses cuando son pautas sin isoniacida, de 18 meses en las pautas sin rifampicina y de 18 a 24 meses cuando no pueden utilizarse ni rifampicina ni isoniacida.
- 3.
Si se tolera, podría mantenerse la isoniacida a dosis más altas como fármaco adicional a las pautas de retratamiento. El motivo es que algunas resistencias a la isoniacida son de bajo nivel y ésta podría mantener cierta actividad aumentando la dosis a 450mg/día.
- 4.
En la confección de los retratamientos, tras conocer el resultado del antibiograma ampliado, se deberá elegir el esquema terapéutico según el siguiente orden:
- –
Combinación atípica con los fármacos de primera línea.
- –
Protionamida o quinolonas: moxifloxacino, levofloxacino, ofloxacino o ciprofloxacino.
- –
Aminoglucósidos o capreomicina.
- –
Cicloserina o ácido p-aminosalicílico.
- –
Otros fármacos con los que hay escasa experiencia (tabla VIII).
Tabla VIII.¿De qué fármacos antituberculosos disponemos?
Grupos de fármacos Fármacos N.° utilizableen una PNE* 1. Primera línea H, R, Z, E 4 2. Inyectables S, Cm, K, Ak 1 3. Quinolonas Mx, Lx, Ox, Cx 1 4. Otros antituberculosos Pt, Cs, PAS 3 5. Dudosos Claritromicina, Cf, amoxicilina-ácido clavulánico, linezolid, tiacetazona, dosis altas de H 6 Cm: capreomicina; PNR: pauta no estándar. Resto de abreviaturas en tabla III.
- –
Los fármacos de segunda línea son más tóxicos, caros y menos eficaces, y tienen más facilidad para crear nuevas resistencias, de modo que el cumplimiento debe ser muy estricto, por lo que se aconseja realizar TDO o supervisión quincenal o mensual y que los controles de toxicidad sean frecuentes50.
Aunque los bacilos con resistencias son menos virulentos, deben extremarse las medidas de aislamiento, que se mantendrán hasta la negativización del esputo.
La utilización de pautas con fármacos de segunda línea debe reservarse a expertos.
En ocasiones, debe emplearse como tratamiento coadyuvante la cirugía a fin de reducir la zona afectada y, por lo tanto, la densidad bacilar. Esto permitirá mejorar la eficacia de las pautas con fármacos de segunda línea que no consegan curar a los pacientes51.
Tratamiento de la infección tuberculosaEl tratamiento de la infección ha de realizarse una vez que se haya descartado enfermedad tuberculosa (clínica, radiografía, nunca pendiente de cultivos si se han recogido). Asimismo, el estudio de infección ha de hacerse con vistas a la posibilidad de iniciar tratamiento en los casos en que mejor se ha demostrado su efectividad14. Las personas infectadas que más se beneficiarán del tratamiento de la infección son: a) las que presentan infección reciente (así se consideran los contactos infectados y quienes han presentado una conversión tuberculínica en los 2 últimos años); b) los pacientes con infección por el VIH, y c) las personas con lesiones residuales en la radiografía de tórax que no han recibido tratamiento previo. Merece mención aparte el caso de un contacto con una PT positiva documentada previamente, pues el riesgo de desarrollar enfermedad es desconocido en esta circunstancia; la decisión ha de individualizarse (valoración del tratamiento previo, susceptibilidad del paciente, tipo de contacto: duración e intensidad de la exposición41,52). Asimismo, en el estudio de contactos y en la decisión del tratamiento deberán valorarse datos de transmisión reciente: proporción alta de infectados en los contactos, evidencia de transmisión secundaria, enfermedad en contactos de baja prioridad, infección en casos menores de 5 años, casos de conversión tuberculínica en el estudio de contactos52.
Otra indicación de tratamiento de la infección tuberculosa se refiere a los pacientes infectados que vayan a iniciar tratamiento con fármacos contra el factor de necrosis tumoral alfa53, los candidatos a trasplante y los que reciben tratamientos prolongados con corticoides a dosis altas.
En el caso de que en un estudio de contactos haya personas con PT negativa, se repetirá ésta a las 8-12 semanas y se indicará tratamiento si hay conversión tuberculínica. La quimioprofilaxis primaria (tratamiento de personas no infectadas en contacto con pacientes bacilíferos) se indicará en contactos menores de 5 años y en personas con infección por el VIH, por ser las más susceptibles a desarrollar TB grave y rápida, por lo que en estos casos se inicia el tratamiento y se repite la PT al cabo de 8-12 semanas41,52. Podría incluirse en estos casos de quimioprofilaxis primaria a otras personas jóvenes (niños hasta la adolescencia41 o adultos jóvenes) y contactos con inmunodepresión.
En cuanto a los fármacos que han de recibir, el tratamiento más estudiado y eficaz es con isoniacida14. Se ha demostrado su efectividad cuando se utiliza durante 6 meses o más y, aunque la eficacia parece aumentar al prolongar el tratamiento más de 6 meses (9 o 12), esto no está claramente demostrado en la práctica clínica54. Tampoco está definida la mejor duración del tratamiento con isoniacida en la coinfección con el VIH55, si bien la recomendación habitual es prolongarlo de 6 a 9 meses. Otro régimen es el de rifampicina e isoniacida durante 3 meses, con una eficacia similar a la isoniacida en monoterapia y mejor cumplimiento56,57. Otra alternativa a la isoniacida, especialmente cuando hay resistencia a ésta, es la utilización de rifampicina durante 4 meses14. La combinación de rifampicina y piracinamida durante 2 meses se desaconseja por sus efectos secundarios58.
En contactos de pacientes con TB multirresistente no hay ninguna pauta recomendada y de efectividad demostrada; se cree preferible la vigilancia clínica59.
Con estos datos, nuestras recomendaciones se muestran en la tabla IX. En relación con los controles que ha de seguir una persona que inicia tratamiento de la infección tuberculosa, se debe vigilar clínicamente hasta su finalización, observando la aparición de efectos secundarios de la medicación. Los controles analíticos no son absolutamente necesarios, aunque nuestra recomendación es realizarlos antes del inicio del tratamiento y al mes, y valorar su repetición al finalizarlo. La indicación es más firme en los pacientes con riesgo de presentar efectos secundarios (hepatopatías, etilismo, infección por el VIH). En cualquier caso, los controles analíticos han de efectuarse siempre que se presenten síntomas indicativos de efectos secundarios del tratamiento.
Tratamiento de la infección tuberculosa
Indicaciones (A)
|
VIH: virus de la inmunodeficiencia humana.
- Home
- All contents
- Publish your article
- About the journal
- Metrics