El número de trasplantes pulmonares que se realizan en España continúa en ascenso, con 235 pacientes trasplantados en 2010. Los programas de donantes en asistolia han contribuido a esta progresión. Nuestra Unidad de Trasplante Pulmonar comenzó su actividad en octubre de 2008, y en estos 3 años se han trasplantado con éxito el 97% de los pacientes intervenidos. Para obtener un mayor número de donantes hemos desarrollado un programa de donación pulmonar en asistolia a partir del programa existente en nuestro hospital. Fue necesario la elaboración de una metodología de preservación multiorgánica (pulmonar, hepática y renal) que hemos denominado «preservación en bitermia». Presentamos la experiencia de su aplicación clínica durante el primer año. Hemos trasplantado 3 pacientes utilizando este tipo de donantes en asistolia. Ninguno de los pacientes desarrolló disfunción primaria del injerto, todos fueron dados de alta, realizan vida activa y sin datos de síndrome de bronquiolitis obliterante.
The number of lung transplantations that are performed in Spain continues to grow, with 235 transplant recipients 2010. Non-heart-beating donations have contributed to this upward progression. Our Lung Transplant Unit began its activity in October 2008 and during these last three years 97% of the transplant interventions performed have been successful. In order to increase the number of donations, we have developed a non-heart-beating donor program as part of the existing organs program in our hospital. In doing so, the development of a multi-organic preservation method (lung, liver and kidney), which we call «Bithermia Preservation», was necessary. This paper presents this methodology as well as the first year of clinical application experience. During this time, 3 patients have been transplanted using such non-heart-beating donations. None of them developed primary graft dysfunction; all the patients have been discharged and lead active lives without any evidence of bronchiolitis obliterans syndrome.
Los donantes en muerte encefálica constituyen la mayor parte de los donantes que se utilizan para trasplante de órganos sólidos. En la última década, ante la necesidad de aumentar el número de donantes multiorgánicos para cubrir las necesidades de trasplante se han desarrollado alternativas al donante convencional como son los donantes en paro cardiaco (llamados en asistolia), tanto intrahospitalarios (controlados) como extrahospitalarios (no controlados).
En cuanto al trasplante pulmonar, la donación en asistolia ha sido uno de los campos en los que más se ha investigado en la última década, sustentado por la hipótesis de que el tejido pulmonar pueda ser viable tras la muerte del organismo y que estos pulmones puedan ser válidos para trasplante, incluso si se extraen tras un periodo considerable de tiempo tras la muerte1. Además se ha demostrado la viabilidad del pulmón tras la muerte del organismo, mediante la observación de que células epiteliales pulmonares pueden ser cultivadas a partir de muestras obtenidas en cadáveres2.
Con el propósito de demostrar esta hipótesis, se han desarrollado innumerables estudios experimentales. Uno de los aspectos analizados ha sido el conocimiento de cómo afecta el tiempo obligado de isquemia caliente desde que se produce el paro cardiaco hasta las maniobras de preservación de los órganos, demostrándose, por ejemplo, que tras 2h de isquemia caliente y sin necesidad de circulación pulmonar es posible obtener un adecuado intercambio gaseoso, o que este periodo seguro de isquemia caliente podía aumentarse hasta 4h si se heparinizaba al donante3, y que el enfriamiento tópico es el mejor método de preservación de los pulmones no ventilados, alcanzando periodos de preservación de hasta 12 a 24h4-7.
A partir de estos avances se realizan los primeros trasplantes pulmonares clínicos procedentes de donantes en asistolia intrahospitalarios8,9. En España, a lo largo de los últimos 15años se desarrollan programas de donantes en asistolia extrahospitalarios, obteniéndose con éxito injertos renales, hepático y de tejidos. Para ello se utiliza un método de preservación del donante, hasta la obtención de los consentimientos para la extracción de los órganos, basado en una oxigenación extracorpórea (CEC) que puede ser en normotermia o en hipotermia profunda, según se vaya a utilizar el hígado o no. En Madrid, a partir del 2002 y gracias a la colaboración con uno de estos programas de asistolia que utiliza CEC en hipotermia profunda, se comenzó a utilizar con éxito injertos pulmonares preservados con frío tópico pleural10.
La Unidad de Trasplante Pulmonar del Hospital 12 de Octubre comenzó su actividad en octubre de 2008. Hasta octubre de 2011 hemos realizado 37 trasplantes pulmonares, con una mortalidad hospitalaria del 2,7% (un paciente), una supervivencia al año del 94% y una supervivencia a los 3 años del 87%. En la actualidad, según el Registro Nacional de Trasplante Pulmonar, lideramos los resultados en cuanto a supervivencia respecto al resto de grupos españoles de trasplante pulmonar, que obtienen globalmente una supervivencia al año del 71% y una supervivencia a los 3 años del 59%.
Fruto de la necesidad de obtener un mayor número de donantes y animados por la existencia en nuestro hospital de un programa de donantes en asistolia extrahospitalarios dirigido a la obtención de órganos abdominales (hígado y riñones) y de tejidos, nos planteamos la posibilidad de valorar los injertos pulmonares procedentes de estos donantes. Para ello desarrollamos un proyecto con los siguientes objetivos:
- •
Realizar las maniobras de preservación pulmonar en los donantes en asistolia hasta obtener el consentimiento familiar y judicial de la extracción.
- •
Analizar la función pulmonar para validar los injertos pulmonares.
- •
Realizar la extracción e implante de los injertos considerados como válidos.
La finalidad principal es el aumento de los posibles donantes pulmonares que puedan ser utilizados para trasplante, y como objetivo secundario, aumentar nuestro conocimiento en la donación pulmonar en asistolia.
Observación clínicaEl proyecto comenzó definiendo los criterios de inclusión y de exclusión específicos del donante pulmonar en asistolia.
Criterios de inclusión- •
Edad ≤55 años.
- •
Tiempo de paro cardiaco conocido.
- •
Inicio de reanimación antes de 15min desde el paro cardiaco.
- •
Radiografía de tórax normal.
- •
Tiempo máximo desde el paro hasta el frío tópico pleural de 180min.
- •
Tiempo máximo de preservación pulmonar, 240min.
- •
Los mismos que el donante en muerte encefálica en cuanto a antecedentes y serologías11.
- •
Gran traumatismo craneoencefálico con pérdida de masa encefálica.
Uno de los aspectos diferenciales de nuestro programa es que la preservación de los órganos abdominales se realiza mediante CEC en normotermia, a diferencia de otros programas, que lo realizan en hipotermia profunda. Esto nos obligó a diseñar un sistema de recirculación de la solución de preservación pleural para mantener el frío tópico y evitar el calentamiento de los pulmones. Esta metodología de preservación multiorgánica del donante en asistolia la hemos denominado «preservación en bitermia», al coincidir la normotermia abdominal con hipotermia torácica.
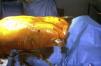
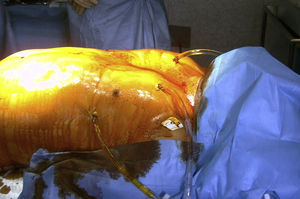
El proceso se inicia cuando la coordinación de trasplante del hospital nos avisa del traslado de un posible donante en asistolia. En ese momento un equipo se desplaza al hospital para realizar las maniobras de preservación pulmonar. Una vez que el donante pasa a quirófano, mientras se realiza la canulación de los vasos femorales para la CEC y estando el donante con la cardiocompresión, se realiza una broncoscopia y se toma muestra de un broncoaspirado para cultivo. Tras la canulación femoral se obtienen unos 300ml de sangre venosa del donante, que se guardan en una bolsa heparinizada a temperatura ambiente. Una vez en CEC se retira el cardiocompresor y se desconecta la ventilación mecánica pulmonar. A continuación se realizan las maniobras de preservación pulmonar. Se colocan dos drenajes pleurales apicales, uno en cada lado, para introducir la solución de preservación fría (Perfadex®), y se colocan otros dos basales para dejar salir la solución. Estos cuatro tubos se conectan a un circuito cerrado que permite la entrada y salida de la solución a las cavidades pleurales (fig. 1). Esta solución se recircula gracias a una bomba de rodillo y se enfría a 4°C mediante un sistema de enfriamiento de líquidos tipo cardioplejía y de un intercambiador de calor. La temperatura se controla mediante un termómetro en la salida pleural del circuito de preservación.
Una vez obtenidos los consentimientos, se practica una esternotomía y se realiza la evaluación de la función pulmonar utilizando una bolsa de sangre venosa del propio donante. Hemos comprobado, mediante un estudio experimental, la validez de esta metodología de evaluación funcional pulmonar12, identificando además la necesidad de continuar utilizando sangre para la correcta determinación de la oxigenación pulmonar evitando utilizar la solución de Perfadex® como único fluido pulmonar12. Posteriormente se completa la extracción pulmonar de forma habitual13.
Finalmente establecimos unos criterios para considerar válido el injerto pulmonar, y son:
- •
Radiografía del tórax normal.
- •
Cumplimentación de los tiempos establecidos.
- •
Broncoscopia sin datos de broncoaspiración, edema pulmonar, secreciones hemáticas o purulentas importantes, ni lesiones de la vía aérea.
- •
Evaluación macroscópica pulmonar normal.
- •
Serologías de virus negativas.
- •
Gases obtenidos en aurícula izquierda y venas pulmonares >400mmHg.
Posteriormente se continúa con la extracción del mismo modo en que se realiza en los donantes convencionales, y el implante se realiza conforme a la técnica habitual.
Establecimos un periodo preclínico de desarrollo del proyecto, para valorar tanto su viabilidad como su influencia en los programas de trasplante renal y hepático. Durante la fase preclínica del programa se valoraron 17 donantes, en los que la radiografía del tórax fue normal en 8 (47%) y la broncoscopia fue normal en 9 (52%). Realizamos las maniobras de preservación pulmonar en 12 donantes. En el 85% de los donantes (6/7) no se objetivó edema de tejidos blandos durante su apertura, y en el 57% de los donantes (4/7) en los que se realizó la evaluación funcional pulmonar los gases obtenidos fueron válidos.
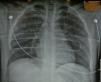
Con estos resultados decidimos iniciar la fase clínica y realizamos el primer trasplante pulmonar con un donante en asistolia extrahospitalario mediante «preservación en bitermia» en junio de 2010 a una paciente de 49 años con déficit de alfa-1 antitripsina. Realizamos un trasplante bipulmonar con éxito, con una magnífica función pulmonar tras más de 12h de isquemia total. Desde entonces, entre junio de 2010 y julio de 2011 hemos valorado 15 donantes en asistolia. La radiografía del tórax fue normal en 6 donantes (40%) (fig. 2), presentaban infiltrados pulmonares 7 donantes, en uno la radiografía era de mala calidad y en otro no se pudo realizar. La broncoscopia fue normal en 8 donantes (53%), 3 presentaban abundantes secreciones hemáticas en la vía aérea y en 2 había datos de broncoaspiración.
Se realizaron maniobras de preservación pulmonar en 6 donantes. Un donante se desestimó por comenzar con secreciones hemáticas durante el tiempo de preservación, y en otro no había receptor adecuado. La valoración funcional pulmonar se realizó en 4 donantes, y los gases obtenidos fueron adecuados en el 75% de los casos (3/4). Se consideraron válidos para su implante 3 donantes pulmonares de 38, 41 y 54 años de edad, con los que realizamos 3 trasplantes pulmonares, uno bipulmonar y 2 unipulmonares. Ofertamos 2 injertos pulmonares a la Organización Nacional de Trasplantes (ONT) para otros grupos de trasplante pulmonar. Las características de los pacientes trasplantados, el tipo de trasplante realizado y su evolución postoperatoria se muestran en la tabla 1. Ningún trasplante sufrió disfunción primaria del injerto (DPI), y los tres mostraron una excelente función pulmonar que permitió la extubación precoz en 2 de ellos. No tuvimos mortalidad hospitalaria. La evolución a largo plazo se muestra en la tabla 2. Los 3 pacientes están vivos, ninguno presenta síndrome de bronquiolitis obliterante y mantienen una vida activa.
Características de los pacientes trasplantados, tipo de trasplante y evolución postoperatoria
| Paciente | Sexo | Edad | Indicación | Tipo de trasplante | Tiempo de isquemia | pO2/FiO2 llegada REA | Extubación | Exitus hospital |
| 1 | F | 49 | Enfisema def α1AT | Bilateral | 12h 40min | 243 | 120h | No |
| 2 | M | 62 | Enfisema | Unilateral derecho | 11h 15min | 391 | 3h | No |
| 3 | M | 64 | Enfisema | Unilateral izquierdo | 11h 44min | 402 | 4h | No |
Def α1AT: déficit de alfa 1 antitripsina; REA: unidad de reanimación
Los primeros trasplantes de órganos sólidos se realizaron con donantes en asistolia. En la actualidad, con el aumento en la indicación de trasplantes existe un nuevo interés en este tipo de donantes. Mientras a nivel internacional la donación en asistolia se limita fundamentalmente a los donantes controlados, en España mayoritariamente son donantes no controlados. En esto influyó el desarrollo de la legislación española con respecto a la donación de órganos14, la colaboración de las unidades de emergencias extrahospitalarias y el impulso de la ONT en el desarrollo de estos programas15.
En España, el trasplante pulmonar utilizando donantes en asistolia extrahospitalarios es una realidad consolidada desde el año 2002, y Madrid es la ciudad pionera a escala mundial en esta actividad10. Hasta ahora el tipo de preservación de órganos de estos donantes multiorgánicos consistía en instaurar una oxigenación extracorpórea en hipotermia profunda (4°C) para obtener injertos renales (los resultados del trasplante hepático con hipotermia no fueron buenos) y frío tópico pleural para obtener injertos pulmonares, o bien una oxigenación extracorpórea en normotermia para obtener injertos hepáticos y renales. Con el desarrollo de la metodología de «preservación multiorgánica en bitermia» hemos logrado utilizar con éxito injertos renales, hepáticos y pulmonares del mismo donante en asistolia.
En cuanto a los donantes en asistolia extrahospitalarios que hemos valorado, observamos que la información de la radiografía del tórax es importante, identificando patología pulmonar en la mitad de los casos. Probablemente los procesos que acompañan al paro cardiaco, como son las arritmias y el fracaso cardiaco, pueden condicionar la aparición de edema pulmonar cardiogénico. De igual forma, la broncoscopia aporta mucha información en cuanto a la presencia de broncoaspiración y secreciones hemáticas que invalidan el injerto como apto para el trasplante.
La incidencia de edema en los tejidos blandos del donante en asistolia de nuestro programa es muy baja. En ello influye el estricto manejo de la circulación extracorpórea que realiza la perfusionista, presente durante todo el tiempo de preservación, evitando el aporte excesivo de volumen e incluso realizando un proceso de ultrafiltración en caso necesario.
En nuestra experiencia, con la «preservación en bitermia» obtenemos una hipotermia pleural suficiente para una correcta preservación pulmonar. En los donantes con una radiografía del tórax sin alteraciones pulmonares, con una broncoscopia normal y que no desarrollan problemas durante este tiempo de preservación, se obtienen excelentes parámetros de oxigenación en el 75% de los casos (pO2/FiO2 >400mmHg).
En cuanto a la evolución postoperatoria inicial, destacamos que ninguno de los 3 trasplantes pulmonares desarrolló DPI. Las ventajas de los donantes pulmonares en asistolia respecto a los donantes convencionales es que no experimentan los efectos pulmonares de la muerte encefálica (edema pulmonar neurogénico), a lo que se suma el escaso tiempo de ventilación mecánica. Las referencias de otros autores a una mayor incidencia de DPI en los trasplantes pulmonares con donantes en asistolia16 no es compartida por nuestro grupo. Es llamativo que en nuestro programa, a pesar de haber aumentado el tiempo de isquemia caliente (desde el paro cardiaco hasta el enfriamiento pulmonar) hasta 3h respecto a las 2h de otros grupos, no objetivemos mayor disfunción del injerto. En este sentido creemos que lo fundamental es la adecuada selección de estos donantes, cumpliendo todos los criterios de inclusión y exclusión.
Los resultados de los trasplantes pulmonares que hemos realizado confirman la validez del procedimiento de «preservación en bitermia» y establecen la posibilidad de realizar una extracción multiorgánica (riñones, hígado y pulmones) aumentando la rentabilidad de los donantes en asistolia.
En el futuro, cabe la posibilidad de que valoremos los donantes en asistolia exanguinados o con lesiones sangrantes, en los que se desestiman los órganos abdominales, realizando solo las maniobras de preservación pulmonar.
Quisiéramos agradecer el esfuerzo de todo el equipo de profesionales del Hospital 12 de Octubre que participan y hacen posible el programa de donación en asistolia (coordinadores, cirujanos, anestesistas, perfusionistas, enfermeras y auxiliares).