La comorbilidad cardiovascular del síndrome de apneas-hipopneas durante el sueño (SAHS) condiciona su pronóstico. La ecocardiografía detecta alteraciones estructurales, pero realizarla a todos los pacientes ocasionaría un gran consumo de recursos. El objetivo de este trabajo ha sido estudiar el papel de la fracción N-terminal del péptido natriurético cerebral (NT-proBNP) para detectar cardiopatía silente.
Pacientes y métodosSe seleccionó a 114 pacientes consecutivos con SAHS, a quienes se les determinó la concentración de NT-proBNP y se les realizó una ecocardiografía antes de que recibieran tratamiento. Se estudiaron las funciones sistólica y diastólica de ambos ventrículos, así como las alteraciones morfológicas. Se analizaron las correlaciones existentes entre el NT-proBNP y las alteraciones halladas. Se realizó una curva de eficacia diagnóstica entre el NT-proBNP y la presencia de alteración cardíaca.
ResultadosFinalmente se estudió a 98 pacientes. El NT-proBNP se correlacionó de forma significativa (p<0,0001) con el grosor del tabique interventricular (r=0,63), con el de la pared posterior (r=0,45) y con el diámetro telediastólico del ventrículo izquierdo (r=0,51). La curva de eficacia diagnóstica calculó un área bajo la curva significativa (0,870; intervalo de confianza del 95%, 0,801–0,939; p<0,0001). Se consideró más útil para la práctica clínica el valor de especificidad. Así, unos valores de NT-proBNP inferiores a 100 y 200pg/ml descartan que haya alteraciones morfológicas cardíacas con una fiabilidad del 90 y el 100%, respectivamente.
ConclusionesEl NT-proBNP tiene correlaciones relevantes con la presencia de alteraciones ecocardiográficas y podría ser una herramienta útil para identificar a los pacientes que deberían ser remitidos para estudio cardiológico.
When sleep apnea-hypopnea syndrome (SAHS) and cardiovascular disease occur concurrently, prognosis is affected. Echocardiography can detect structural cardiac abnormalities but using this technique in all patients would place a heavy burden on resources. The objective of this study was to investigate whether the N-terminal fraction of brain natriuretic peptide (NT-proBNP) can be used as a marker for silent heart disease.
Patients and methodsNT-proBNP concentration was measured in the 114 consecutive patients with SAHS who underwent echocardiography before starting treatment. Left and right ventricular systolic and diastolic function, as well as structural abnormalities, were studied. Correlations between NT-proBNP concentration and the abnormalities detected were investigated. A receiver operating characteristics (ROC) curve was plotted for NT-proBNP concentration and cardiac abnormalities.
ResultsData for 98 patients were finally analyzed. NT-proBNP concentration was significantly correlated with ventricular septal thickness (r=0.63), posterior wall thickness (r=0.45), and left ventricular end-diastolic diameter (r=0.51) (P<.0001 for all correlations). The area under the ROC curve was significant (0.870; 95% confidence interval, 0.801–0.939; P<.0001). Assuming that specificity would be more useful for clinical practice, we calculated that NT-proBNP concentrations below 100 and 200pg/mL could rule out structural abnormalities with a reliability of 90% and 100%, respectively.
ConclusionsNT-proBNP concentration was strongly correlated with echocardiographic abnormalities and so could be a useful tool for identifying patients who should be referred to the cardiologist.
El síndrome de apneas-hipopneas durante el sueño (SAHS) tiene una prevalencia elevada, que aumenta con la edad, y afecta al 4–6% de los varones y al 2–4% de las mujeres de edad media1,2. Esta enfermedad, definida como un cuadro de somnolencia excesiva, trastornos cognitivos-conductuales, respiratorios, cardíacos, metabólicos o inflamatorios secundarios a episodios repetidos de obstrucción de la vía aérea superior durante el sueño, produce alteraciones cardíacas con consecuencias importantes en la morbilidad y con implicaciones pronósticas muy relevantes3–5.
La ecocardiografía Doppler es una técnica cardiológica no invasiva, inocua, de bajo coste, reproducible y disponible en la inmensa mayoría de hospitales, por lo que parece la técnica de elección para detectar alteraciones estructurales en estos pacientes. Sin embargo, muchos hospitales desarrollan con el tiempo largas listas de espera para realizar ecocardiografías y, dada la alta prevalencia del SAHS, hoy por hoy no parece que los servicios de cardiología puedan asumir la realización de esta exploración a todos los pacientes con SAHS.
Por otra parte, el propéptido natriurético cerebral N-terminal (NT-proBNP) ha mostrado ser un biomarcador útil de disfunción miocárdica sistólica y diastólica. Se eleva cuando hay sobrecarga miocárdica y se emplea en cardiología como método de cribado de cardiopatía, de diagnóstico y de pronóstico, y como guía terapéutica de insuficiencia cardíaca6.
La hipótesis planteada en este estudio es que el NT-proBNP podría ayudar a identificar a los pacientes con SAHS que en el momento del diagnóstico tendrían alteraciones cardíacas subsidiarias de evaluación cardiológica, ante la posibilidad de iniciar tratamiento precoz de dichas alteraciones y/o del SAHS. Así pues, el objetivo de este trabajo ha sido analizar los valores plasmáticos de NT-proBNP en una serie de pacientes con SAHS en el momento del diagnóstico, e identificar la capacidad discriminante de este péptido en la detección de las alteraciones cardíacas identificadas por ecocardiografía.
Pacientes y métodosPacientesSe seleccionó a 114 pacientes consecutivos remitidos a una consulta monográfica de trastornos respiratorios durante el sueño a quienes se diagnosticó de SAHS. Se les informó de las características del estudio y aceptaron participar en él. El estudio fue aprobado por el Comité Ético de Investigaciones Clínicas del centro hospitalario.
Estudio de sueñoEl diagnóstico de SAHS se realizó mediante poligrafía respiratoria (PR) con el polígrafo EMBLETTA® (Flaga, Reykjavik, Islandia), convenientemente validado frente a la polisomnografía convencional7. Se registró el flujo nasal con un transductor de presión; la saturación de oxígeno y la frecuencia cardíaca mediante pulsioxímetro digital; el ronquido y el número de apneas según la posición del paciente mediante un sensor de posición corporal, y los movimientos toracoabdominales mediante una banda toracoabdominal elástica con sensor piezoeléctrico. Todos los estudios fueron revisados manualmente por el mismo neumólogo. Cuando la PR se consideró negativa para el diagnóstico de SAHS pero la clínica era muy indicativa del diagnóstico, se remitió al paciente a una unidad de sueño de referencia para la realización de polisomnografía convencional8.
Se definió la apnea obstructiva como la ausencia o reducción superior al 90% de la señal respiratoria durante más de 10s, en presencia de esfuerzo respiratorio detectado por las bandas toracoabdominales, y apnea central como la ausencia o reducción mayor del 90% de la señal respiratoria durante más de 10s, en ausencia de esfuerzo respiratorio detectado por las bandas toracoabdominales. Se consideró apnea mixta cuando el evento respiratorio habitualmente comenzaba con un componente central y terminaba en un componente obstructivo. Se definió la hipopnea como la reducción discernible (>30% y<90%) de la amplitud de la señal respiratoria durante más de 10s, detectada por termistores, cánula nasal o neumotacógrafo, que se acompañó de una desaturación (>3%) y/o un microdespertar en el electroencefalograma del registro de polisomnografía. En el caso de la PR, el índice de apneas-hipopneas (IAH) se definió como el número de eventos respiratorios (apneas o hipopneas) acaecidos por hora de registro en cama8. Los estudios se consideraron válidos cuando el paciente reconocía haber dormido casi con normalidad durante al menos 4h, y no válidos cuando el registro era inferior a 4h o había desconexión de los sensores. Se estableció el diagnóstico de SAHS cuando el IAH era mayor o igual que 10, con o sin hipersomnia diurna patológica (Epworth >10 puntos). La indicación de tratamiento con presión positiva continua de la vía aérea (CPAP) se estableció cuando el IAH era mayor o igual que 30, o bien cuando era igual o superior a 10 y había otros condicionantes, como somnolencia patológica, factores de riesgo cardiovascular o enfermedad vascular conocida8.
Estudio ecocardiográficoSe realizó a todos los pacientes una ecocardiografía Doppler. El equipo utilizado fue HP Sonos 5500® con sonda de 2,5MHz (Philips, Eindhoven, Holanda). Efectuó todas las exploraciones el mismo ecocardiografista, que desconocía los valores de NT-proBNP del paciente y la gravedad del SAHS.
Las medidas morfológicas se realizaron en modo M referenciado por un plano paraesternal longitudinal. El cálculo de la fracción de eyección se obtuvo a partir de esas medidas por el método de Teicholz. Los parámetros de la función diastólica se obtuvieron mediante Doppler pulsado entre los bordes de las válvulas mitrales en un eje apical de 4 cavidades. El flujo aórtico se obtuvo en el plano valvular aórtico.
Se registraron las siguientes variables:
- 1.
Parámetros morfológicos: diámetro telediastólico (DTD) del ventrículo derecho; grosor del tabique interventricular (TIV) y de la pared posterior del ventrículo izquierdo, medidas que conforman la hipertrofia ventricular izquierda (HVI). Tamaño de la aurícula izquierda, DTD y diámetro telesistólico del ventrículo izquierdo, que aportan información sobre el tamaño cardíaco. Se consideró alteración morfológica cardíaca un valor de TIV superior a 12mm, un grosor de la pared posterior del ventrículo izquierdo mayor de 12mm y un DTD del ventrículo izquierdo superior a 56mm.
- 2.
Parámetros de función sistólica: fracción de eyección del ventrículo izquierdo y función ventricular derecha visualmente estimada. Se consideró depresión de la función sistólica del ventrículo izquierdo cuando la fracción de eyección era menor del 50%, y depresión de la función sistólica de ventrículo derecho cuando se observó una contractilidad por debajo de la normalidad.
- 3.
Parámetros de función diastólica: velocidad de las ondas diastólicas de llenado mitral rápido (onda E) y lento (onda A), y tiempo de relajación isovolumétrica, que configuran los patrones de llenado ventricular normal o patológico.
Cada valor registrado fue la media de 3 determinaciones. A partir de esos 3 valores se calculó la variabilidad intraobservador, que en las variables morfológicas y de función sistólica fue del 1,8%, y en las variables de función diastólica, del 0,9%. El índice de concordancia (kappa) fue mayor de 0,8 en todos los casos.
Diseño y criterios de inclusión/exclusiónLa inclusión de los pacientes fue consecutiva antes de que iniciaran el tratamiento con CPAP. Se realizó a todos una determinación plasmática de NT-proBNP y se les efectuó el estudio ecocardiográfico.
Fueron criterios de exclusión la falta de consentimiento del paciente, el tratamiento previo con CPAP, la presencia de fibrilación auricular, bradiarritmias (<60lat/min) o taquiarritmias (>100lat/min), así como la existencia de enfermedad cardíaca previa conocida o valvular detectada durante la exploración, de enfermedad pulmonar obstructiva crónica de gravedad superior al estadio I de la Global Initiative for Chronic Obstructive Lung Disease (GOLD)8, o de cor pulmonale crónico de cualquier etiología.
Se consideró hipertenso a todo paciente que recibía tratamiento farmacológico o tenía cifras de presión arterial superiores a 140/90mmHg en 3 mediciones matutinas realizadas por el mismo personal de enfermería experto9. Se realizó cribado de enfermedad pulmonar obstructiva crónica a todos los fumadores mediante espirometría con prueba broncodilatadora, siguiendo las recomendaciones y la clasificación de gravedad de la guía GOLD10.
Técnica de determinación del propéptido natriurético cerebral N-terminalPersonal cualificado extrajo las muestras de sangre venosa después del descanso nocturno de los pacientes, tras al menos 30min de reposo y antes de la ingesta oral de alimentos o medicación. Los valores de NT-proBNP se analizaron mediante quimioluminiscencia con el equipo Elecsys proBNP® (Roche Diagnostics, Mannheim, Alemania).
Análisis estadísticoLas variables numéricas se expresan como medias±desviación estándar, y las categóricas, en porcentajes. Para comprobar la normalidad se aplicó el test de Kolmogorov-Smirnov. Las variables sin distribución normal se expresan como mediana y percentiles 25–75. El coeficiente de correlación de las variables no paramétricas se calculó con el test de la rho de Spearman. Se determinó el coeficiente de correlación de Pearson cuando la distribución fue normal. La representación gráfica ofreció la correlación lineal y cuadrática con el correspondiente coeficiente de determinación. Se utilizó el test de Kruskal-Wallis para comparar los grupos. La significación estadística se estableció en valores de p<0,05. Se utilizó el paquete estadístico SPSS 12.0© (SPSS Inc. Chicago, Illinois, EE.UU.).
ResultadosTras descartar a los pacientes que cumplían los criterios de exclusión (n=5) y a aquéllos en que el tiempo transcurrido entre la extracción de sangre para el análisis del péptido y el estudio ecocardiográfico superó los 15 días (n=11), el número final de pacientes estudiados fue 98.
Perfil clínico y ecocardiografíaEn las tablas 1 y 2 se muestran el perfil clínico y las características ecocardiográficas de la serie estudiada. De los 98 pacientes, 31 (31,6%) presentaron alguna alteración morfológica del ventrículo izquierdo (aumento del TIV, de la pared posterior y/o del DTD). Sólo uno presentó depresión de la función sistólica del ventrículo izquierdo, que se asoció a un incremento del DTD del mismo ventrículo.
Perfil clínico de los pacientes (n=98)
| Edad media (años) | 54±13 |
| Varones | 72% |
| Índice de masa corporal (kg/m2) | 32±5 |
| Hipertensión arterial | 48% |
| EPOC conocida (estadio I GOLD) | 4% |
| Meses desde el inicio de los síntomas* | 48 (24–60) |
| Índice de apneas-hipopneas | 40±18 |
| Índice de desaturaciones >4% | 37±19 |
| Epworth | 12±5 |
| TC90* | 11% (3–23) |
| SaO2 media* | 93% (92–95) |
| SaO2 mínima* | 76% (64–81) |
| Creatinina (mg/dl)* | 1,0 (0,9–1,1) |
| NT-proBNP (pg/ml)* | 50 (20–91) |
| FEV1 (% predicho) | 97±31% |
| Síntoma de consulta | |
| Ronquidos | 43% |
| Apneas referidas | 37% |
| Somnolencia | 19% |
| Otros | 1% |
| Gravedad del SAHS10 | |
| Leve | 7% |
| Moderado | 29% |
| Grave | 64% |
Los valores se expresan como media±desviación estándar o mediana y percentiles 25 y 75.
EPOC: enfermedad pulmonar obstructiva crónica; FEV1: volumen espiratorio forzado en el primer segundo; GOLD: Global Initiative for Chronic Obstructive Lung Disease; NT-proBNP: propéptido natriurético cerebral N-terminal; SAHS: síndrome de apneas-hipopneas durante el sueño; SaO2: saturación arterial de oxígeno, registrada durante la noche; TC90: porcentaje de tiempo nocturno con SaO2<90%.
Características ecocardiográficas de los 98 pacientes
| Diámetro telediastólico del VD (mm) | 23,1±5,3 |
| Tabique interventricular (mm)* | 12 (10–13) |
| Diámetro telediastólico del VI (mm) | 47,6±6,3 |
| Diámetro telesistólico del VI (mm) | 27,6±5,4 |
| Pared posterior del VI (mm)* | 10 (10–12) |
| Aurícula izquierda (mm) | 37,5±6,3 |
| Depresión de la función del VI | 1 paciente |
| Depresión de la función del VD | 0 pacientes |
| Velocidad máxima de la onda E mitral (cm/s) | 69,6±19,7 |
| Velocidad máxima de la onda A mitral (cm/s) | 75,7±18,3 |
| Tiempo de relajación isovolumétrica del VI (ms)* | 100 (90–110) |
| Velocidad máxima de la onda E tricuspídea (cm/s) | 54,8±10,3 |
| Velocidad máxima de la onda A tricuspídea (cm/s) | 57,4±15,7 |
| Tiempo de relajación isovolumétrica del VD (ms) | 69,2±27,7 |
Los valores se expresan como media±desviación estándar o mediana y percentiles 25 y 75.
VD: ventrículo derecho; VI: ventrículo izquierdo.
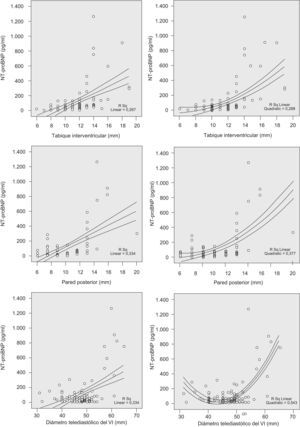
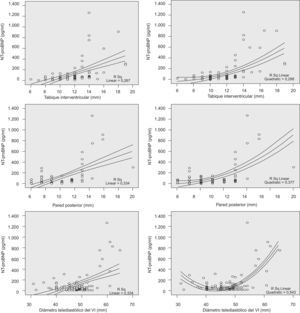
El valor de NT–proBNP se correlacionó de forma significativa (p<0,0001) con el grosor del TIV (r=0,63), de la pared posterior del ventrículo izquierdo (r=0,45) y el DTD del ventrículo izquierdo (r=0,51). En la figura 1 se representan gráficamente las correlaciones y el coeficiente de determinación (R2) lineal y cuadrático.
Representación gráfica de las correlaciones significativas (p<0,0001) de los valores plasmáticos de propéptido natriurético cerebral N-terminal (NT-proBNP) con el grosor del tabique interventricular (arriba), grosor de la pared posterior (medio) y diámetro telediastólico del ventrículo izquierdo (VI; abajo). La correlación cuadrática (gráficas de la derecha) mejora el índice de determinación (R2) con respecto a la correlación lineal (gráficas de la izquierda), sobre todo en el diámetro telediastólico del VI.
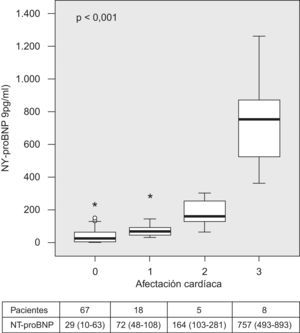
Hubo diferencias significativas (p<0,0001) en los valores de NT-proBNP entre los pacientes sin alteraciones y aquellos que presentaban una o varias (incremento del TIV, aumento de la pared posterior del ventrículo izquierdo o crecimiento del DTD del ventrículo izquierdo), como se observa en la figura 2.
Diagrama de cajas donde se aprecia el rango de valores del propéptido natriurético cerebral N-terminal (NT-proBNP) en los pacientes con síndrome de apneas-hipopneas durante el sueño sin afectación cardíaca (0) y con una (1), dos (2) o tres (3) alteraciones (grosor del tabique interventricular, pared posterior o diámetro telediastólico del ventrículo izquierdo) (p<0,0001). En la tabla de abajo se indican el número de pacientes de cada grupo y la mediana con los percentiles 25 y 75. Los círculos indican los valores entre 1,5 y 3 veces el límite superior del rango intercuartílico (valores atípicos), y los asteriscos, los valores más de 3 veces el límite superior del rango intercuartílico (valores extremos).
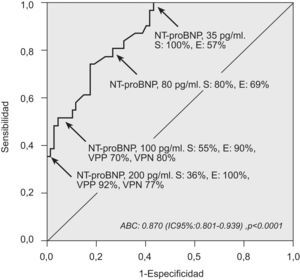
Se contrastaron los valores de NT-proBNP con la presencia de alteraciones cardíacas. La curva de eficacia diagnóstica calculó un área bajo la curva significativa (p<0,0001). En la figura 3 se representan los valores de sensibilidad y especificidad para clasificar a los pacientes con alteración cardíaca. Se consideró más útil en nuestra práctica clínica diaria el valor de especificidad. Para un valor sérico de NT-proBNP de 100pg/ml, la sensibilidad hallada fue del 55%, la especificidad del 90%, el valor predictivo positivo del 70% y el valor predictivo negativo del 80%; para un valor de 200pg/ml, la sensibilidad fue del 36%, la especificidad del 100%, el valor predictivo positivo del 92% y el valor predictivo negativo del 77%. Así, unos valores de NT–proBNP inferiores a 100 y 200pg/ml descarta que haya alteraciones cardíacas con una fiabilidad del 90 y el 100%, respectivamente.
Curva de eficacia diagnóstica para el cálculo de la sensibilidad y especificidad entre los valores del propéptido natriurético cerebral N-terminal (NT-proBNP) y la presencia de alguna alteración cardíaca (grosor del tabique interventricular, pared posterior o diámetro telediastólico del ventrículo izquierdo).
ABC: área bajo la curva; E: especificidad; IC: intervalo de confianza; S: sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
El SAHS es la causa más frecuente de trastornos respiratorios durante el sueño1, afectando al 4–6% de los varones y al 2–4% de las mujeres de edad media2. Además del impacto negativo en la vida social del paciente, el SAHS tiene graves efectos perjudiciales en la salud debido a que es un importante factor de riesgo cardiovascular3,4.
Los efectos cardiovasculares del SAHS parecen ser consecuencia del efecto mecánico de las apneas sobre las presiones intratorácicas, que repercuten en la función cardíaca, y de la hipoxia intermitente, que ocasiona hiperestimulación simpática y disfunción celular endotelial5. El Sleep Heart Health Study4 demostró un riesgo de 2,38 para la insuficiencia cardíaca en pacientes con SAHS, mayor que el encontrado para la hipertensión arterial (HTA), la cardiopatía isquémica o los accidentes cerebrovasculares. Dadas las implicaciones pronósticas de la insuficiencia cardíaca en pacientes con SAHS11, es necesario un diagnóstico precoz. En este sentido, la ecocardiografía Doppler es una técnica sencilla, de bajo coste, inocua y de total disponibilidad. Su aplicación en estos pacientes ha permitido detectar alteraciones estructurales12 y disfunción tanto sistólica como diastólica13,14. Sin embargo, no es posible realizar una ecocardiografía a todos los pacientes con SAHS, por lo que encontrar un marcador biológico ayudaría a seleccionarlos.
El péptido natriurético cerebral (BNP) es una neurohormona cardíaca segregada fundamentalmente por los ventrículos en respuesta a sobrecargas de presión o volumen en forma de proBNP. Éste se transforma en el torrente sanguíneo en la forma activa (BNP) y su fracción NT-terminal inactiva (NT-proBNP) en proporción 1:1. Ambos son excelentes marcadores diagnósticos y pronósticos de insuficiencia cardíaca y de síndrome coronario agudo15. Estudios recientes16 han demostrado que el NT-proBNP es un importante predictor de episodios cardiovasculares en pacientes con HTA e hipertrofia ventricular izquierda, especialmente si no hay otra comorbilidad cardiovascular. Por lo tanto, su determinación como marcador de estrés miocárdico en pacientes con SAHS ayudaría al diagnóstico precoz de cardiopatía subclínica susceptible de empeorar con los episodios apneicos, y podría ser una herramienta útil en el seguimiento de estos pacientes17.
Los pacientes incluidos en nuestro estudio tienen el perfil habitual: varones obesos (índice de masa corporal medio±desviación estándar: 32±5kg/m2), de edad media (54±13 años), con criterios de SAHS grave (IAH⩾30 en el 64% de los casos). Un 31,6% presentó alguna alteración morfológica del ventrículo izquierdo (tabla 2) considerada de relevancia clínica desde el punto de vista cardiológico, aun cuando ninguno tuviera signos ni síntomas de insuficiencia cardíaca. Estos parámetros tuvieron una correlación significativa con los valores plasmáticos de NT-proBNP, correlación que se ajustó mejor a una curva cuadrática que a una relación lineal (fig. 1); es decir, a partir del valor normal de cada medida, el NT-proBNP se elevaba considerablemente. Además, a mayor número de alteraciones cardíacas en un mismo paciente, más alto era el NT-proBNP (fig. 2). Los incrementos repetidos de poscarga que conlleva el SAHS se acompañarían de una hipertrofia compensadora del miocardio que, además, parece ser independiente de la coexistencia de HTA12,18, tal como también ha documentado nuestro grupo19. Por lo tanto, no es de extrañar que el valor del NT-proBNP refleje estas alteraciones subclínicas incrementándose cuanto mayor sea el número de éstas.
Hasta el momento, los trabajos publicados que han estudiado la implicación de los péptidos natriuréticos en el SAHS son escasos, de resultados dispares y enfocados a los cambios agudos durante el sueño. En el SAHS, las concentraciones de BNP se incrementan a medida que se elevan las cifras de presión arterial sistólica y la duración de la apnea, pero se mantienen sin oscilaciones en personas sanas20 y se normalizan con el tratamiento efectivo con CPAP. Svatikova et al21, que compararon los valores de distintos péptidos en grupos de afectados de SAHS con y sin comorbilidad cardiovascular frente a controles sanos, concluyeron que el SAHS eleva los valores del péptido natriurético auricular de forma aguda durante el sueño apneico y mejora con CPAP, mientras que el BNP no se modifica, lo que debería suceder al menos en el grupo de pacientes con SAHS e insuficiencia cardíaca grave. Sus resultados contradicen los múltiples estudios realizados en pacientes con insuficiencia cardíaca22, posiblemente por el escaso número de pacientes. Un trabajo más reciente23, de diseño y método en parte similares al nuestro, evaluó el impacto del SAHS sobre las concentraciones plasmáticas de NT-proBNP y el efecto del tratamiento con CPAP, para lo cual el grupo de SAHS, dividido en hipertensos y no hipertensos, se comparó con un grupo control. No se encontraron diferencias en los valores basales de NT-proBNP, aunque sí un descenso significativo tras tratamiento con CPAP en ambos grupos con SAHS. Los autores remarcan el valor más elevado del péptido en pacientes con HTA, aunque sin diferencias estadísticamente significativas. Posiblemente con un mayor número de individuos sí se hubieran obtenido; por otra parte, las diferencias entre los grupos en cuanto a edad, número de mujeres e índice de masa corporal hacen que sus resultados deban interpretarse con cautela, puesto que son factores que influyen directamente en los valores plasmáticos de NT-proBNP6. En cualquier caso, debería tenerse en cuenta la fisiología de la secreción de estos péptidos a la hora de utilizarlos como marcadores. El péptido natriurético auricular se almacena en forma de gránulos en las aurículas, lo que supone una fuente de liberación rápida, tiene una corta vida media (2–5min) y es rápidamente extraído de la circulación; en cambio, el BNP no se almacena, por lo que su liberación requiere un estímulo más prolongado. El péptido natriurético auricular es una hormona de respuesta rápida, mientras que el BNP y el NT-proBNP reflejan mejor la sobrecarga cardíaca crónica, por lo que se recomiendan como marcadores de disfunción ventricular crónica6.
El reciente trabajo de Hübner et al24 incide en que los valores de NT-proBNP no se correlacionan con la gravedad del SAHS medida por el IAH. Aunque pudiera parecerlo, esta afirmación no contradice ni invalida nuestros resultados. En su modelo de regresión múltiple, realizado sobre 28 pacientes, como factores independientes de las concentraciones plasmáticas de NT-proBNP se identifican la mayor masa del ventrículo izquierdo y la peor fracción de eyección del ventrículo izquierdo, además de otros ya reconocidos (función renal, edad e HTA por su propia repercusión sobre el miocardio). Estos datos concuerdan con los nuestros: a mayor repercusión cardíaca, mayor incremento del NT-proBNP, ya que estas alteraciones que acompañan al SAHS serían las responsables de su aumento.
Encontramos 2 puntos de corte para el NT-proBNP con sensibilidad baja pero especificidad y valor predictivo negativo muy altos, lo que los hace idóneos como método de cribado de la cardiopatía silente. Con un valor de NT-proBNP mayor o igual que 200pg/ml, es alta la probabilidad de que remitimos al cardiólogo a pacientes que tienen al menos una alteración morfológica detectable y de incuestionable valor pronóstico.
En este trabajo no hemos estudiado la correlación de parámetros de disfunción diastólica con el NT-proBNP. Aunque la disfunción diastólica está presente en un porcentaje importante de estos pacientes18, también puede encontrarse en casi un 30% de la población sana de edad y características morfométricas similares18,25; por ello consideramos las alteraciones morfológicas asintomáticas de mayor relevancia clínica e implicación pronóstica a la hora de seleccionar a pacientes para evaluación cardiológica.
Desde nuestro punto de vista, este estudio tiene una gran relevancia clínica en el manejo de los pacientes con SAHS. Detectar la cardiopatía subclínica por métodos fáciles de reproducir y mínimamente invasivos, como la determinación del NT-proBNP plasmático, permitirá seleccionar a pacientes para la evaluación y el seguimiento cardiológicos sin sobrecargar las unidades de ecocardiografía. Es de esperar que este diagnóstico precoz incida favorablemente en la morbimortalidad del SAHS.
En cuanto a las limitaciones del estudio, la primera es haber utilizado mayoritariamente la PR como método diagnóstico de SAHS. Sin embargo, esta práctica está muy extendida y suficientemente avalada en las recomendaciones de consenso8 y guías internacionales26. Debido a las largas listas de espera para polisomnografía, la PR se ha convertido en el método diagnóstico, e incluso de ajuste de CPAP, más utilizado27. La segunda limitación podría derivar del hecho de no haber dividido a los pacientes en 2 grupos, con y sin HTA, como hacen otros autores23, pero nuestros propios datos19, en consonancia con los de publicaciones previas12, hacen innecesaria tal división. Una tercera limitación podría ser el haber utilizado la ecocardiografía transtorácica convencional en lugar de técnicas más precisas como el Doppler tisular28, pero este equipo no está al alcance de todas las unidades de ecocardiografía por el momento. Nuestro trabajo pretende ajustarse a la realidad asistencial de los neumólogos de las consultas de sueño cuyos pacientes con SAHS pudieran ser susceptibles de estudio cardiológico, y en las que la ecocardiografía transtorácica convencional sigue siendo el método diagnóstico más disponible y utilizado. Así pues, creemos que estas limitaciones no restan relevancia a nuestros resultados.
En definitiva, en una importante proporción de pacientes con SAHS hemos encontrado desde su diagnóstico alteraciones estructurales cardíacas asintomáticas que guardan una correlación positiva con los valores plasmáticos de NT-proBNP, por lo que éste serviría como un marcador de cardiopatía silente que permitiría identificar a los pacientes que deben ser evaluados por el cardiólogo.