Evaluar los resultados clínicos y los costes de 2 estrategias de administración de omalizumab.
MétodoSe compararon, de forma retrospectiva, 2 cohortes de pacientes con asma grave no controlada: una, procedente del hospital A, en la que el tratamiento se administró en un centro de salud, y otra, procedente del Hospital B, con administración hospitalaria convencional.
ResultadosSe estudió a 130 pacientes, 86 en A y 44 en B, 30 hombres (24%) y 100 mujeres (76%), edad 50±15 años, FEV1% 67±22%, índice de masa corporal (IMC) 28±6kg/m2, IgE 639±747 UI/mL, seguimiento de 24±11 meses (12-45), Asthma Control Test (ACT) 12±4 y Asthma Control Questionnaire (ACQ) 3±2, sin diferencias significativas basales entre ambas cohortes en ingresos hospitalarios ni visitas a urgencias en el año previo, ni en número de pacientes con esteroides orales. Al comparar la situación basal y tras los 12 meses de tratamiento, se observaron diferencias significativas en ACT (p<0,001), ACQ (p<0,001) y mejoría en el FEV1% (p<0,001), reducción en número de ingresos (p<0,001), días de hospitalización (p<0,001), visitas a urgencias (p<0,001), ciclos y dosis de esteroides p<0,001) respecto al año previo, tanto individualmente como en conjunto. Los costes de hospitalización, visitas a urgencias, visitas no programadas a Primaria y al neumólogo se redujeron significativamente en ambos hospitales, pero los costes de administración y desplazamiento fueron un 35% inferiores con la pauta ambulatoria en A.
ConclusiónLa administración ambulatoria de omalizumab en los centros de salud consigue los mismos resultados clínicos que una pauta de administración hospitalaria, con menores costes.
To compare clinical outcomes and costs between two administration strategies of omalizumab treatment.
MethodWe evaluated two cohorts of patients with uncontrolled severe asthma over a 1-year period. Patients received the treatment in the primary care center in Hospital A and conventional hospital administration in Hospital B.
ResultsWe studied 130 patients, 86 in Hospital A and 44 in Hospital B, 30 men (24%) and 100 women (76%), age 50±15 years, FEV1% 67±22%, body mass index (BMI) 28±6kg/m2, 639±747 UI IgE/mL, followed for 24±11 months (12-45), Asthma Control Test (ACT) score 12±4 and Asthma Control Questionnaire (ACQ) 3±2. There were no significant pretreatment differences between the groups in hospital admissions and emergency room visits in the previous year, nor in proportion of patients receiving oral steroids. Evaluations were performed at baseline and after 12 months of treatment, revealing significant differences in ACT (P<0.001), ACQ (P<0.001), improvement in FEV1% (P<0.001), reduction in total admissions (P<0.001), days of hospitalization (P<0.001), emergency room visits (P<0.001), cycles and doses of oral steroids (P<0.001) compared to the previous year. Hospitalization costs, emergency room visits, unscheduled visits to primary care and to the pulmonologist were significantly reduced in each hospital and on the whole, but administration and travel costs were 35% lower in the ambulatory strategy adopted in Hospital A.
ConclusionThe administration of omalizumab in ambulatory health centers achieved the same clinical results as a hospital administration strategy, but with lower costs.
El asma grave no controlada (AGNC) afecta al menos al 5% de los enfermos asmáticos1,2. La guía GEMA define el AGNC como aquella que no alcanza el control pese a recibir tratamiento con una combinación de GCI/LABA a dosis elevadas en el último año, o bien glucocorticoides por vía oral durante al menos 6 meses del mismo período3. Una historia de asma grave se asocia a un incremento de 6 veces el riesgo de muerte a los 3 años del alta hospitalaria y estos pacientes presentan alto riesgo de hospitalizaciones en relación con su patología, deterioro en la calidad de vida, altos costes relacionados con la enfermedad y mortalidad1-4. Sin embargo, pasan a menudo desapercibidos, tanto para los médicos de Atención Primaria como para los propios especialistas. Al quedar circunscritos a las unidades de asma, que suelen concentrarlos5, los profesionales pueden dejar de familiarizarse con ellos en su práctica habitual.
El tratamiento del asma se ha mantenido prácticamente sin cambios en cuanto a fármacos desde hace años. Desde 2006 se dispone en España del primer anticuerpo monoclonal anti-IgE (omalizumab), indicado precisamente para AGNC. Estos pacientes son los que generan más morbimortalidad y ocasionan la mayor parte del gasto sanitario que, por ejemplo, supone el 70% del total en el programa finlandés de asma6. El omalizumab ha demostrado su eficacia en esta situación clínica. Su dosis y la frecuencia de administración se calculan a partir de la concentración basal de IgE (UI/ml), determinada antes de iniciar el tratamiento y del peso corporal (kg), con dosis que oscilan entre 75-600mg de omalizumab cada 15 o 30 días, ajustadas al nivel de IgE7-9.
Aunque la administración del omalizumab es ambulatoria, en España se administra mayoritariamente en el hospital, con pautas adaptadas al medio en que se dispensa, como hospitales de día, servicios de farmacia o los propios servicios de Neumología. Ello conlleva gastos adicionales derivados de su forma de administración y del personal necesario, además de una obvia repercusión para el paciente, que se ve obligado a acudir al hospital, con el consiguiente coste añadido. Sin embargo, no se conocen si la administración ambulatoria pudiera tener los mismos resultados y tampoco las diferencias de costes según la estrategia de administración.
El objetivo del presente trabajo fue comparar los resultados clínicos y los costes asociados al tratamiento con omalizumab en pacientes con AGNC entre 2 hospitales de tercer nivel, en el primero administrado en régimen ambulatorio en el centro de salud y en el segundo administrado hospitalariamente, en el hospital de día.
MétodoTipo de estudioEstudio observacional, poblacional, retrospectivo, comparativo y de cohortes.
DuraciónDoce meses.
ÁmbitoUnidad de Asma de los servicios de Neumología del Hospital Universitario San Juan de Alicante (hospital A) y Consorcio Hospital General Universitario de Valencia (hospital B).
PoblaciónPacientes con AGNC incluidos en un programa de tratamiento con omalizumab en ambos centros, agrupados en una base de datos y que reunieron los siguientes criterios:
- –
Edad>18 años.
- –
IgE>100 UI/ml.
- –
Prick cutáneo positivo y/o IgE específica positiva a aeroalérgenos.
- –
Criterios de AGNC en tratamiento con dosis elevadas de esteroide inhalado y un beta-2 de larga duración además de otros fármacos, como inhibidores de leucotrienos y/o anticolinérgicos de larga duración y/o teofilinas y/o esteroides por vía oral3.
- –
Administración de omalizumab con un período superior a 12 meses ininterrumpidos.
- –
Comparar los costes económicos de 2 estrategias de administración de omalizumab en AGNC: ambulatoria y hospitalaria.
- –
Comparar los resultados en ambos hospitales en términos de exacerbaciones, ingresos hospitalarios, ahorro de medicación y función pulmonar tras tratamiento durante un mínimo de 12 meses de omalizumab.
- –
Comparar el número y las características de las exacerbaciones, los ingresos hospitalarios, el ahorro de medicación y la función pulmonar antes y después de un mínimo de 12 meses de administración de omalizumab en ambos hospitales.
Pauta A. La medicación fue dispensada en la farmacia hospitalaria en bolsa de refrigeración y recogida por el paciente. Tras instrucciones orales y escritas, se administró en la consulta de enfermería de su centro de Atención Primaria habitual, incluyendo la primera dosis.
Pauta B. La medicación se dispensó en la farmacia hospitalaria y se administró en el hospital de día según prescripción médica establecida.
Variables analizadasEstudio de costesA través de los servicios hospitalarios de contabilidad analítica se adjudicaron las siguientes unidades de coste:
- –
Costes de enfermería hospitalaria.
- –
Costes de enfermería en centro de salud.
- –
Costes medios por desplazamiento del paciente al hospital o al centro de salud.
- –
Coste de hospitalización/día.
- –
Coste por visita a urgencias.
- –
Coste por visita no programada al médico de Atención Primaria.
- –
Coste por visita no programada al especialista.
Cada una de las partidas de coste fue obtenida y calculada directamente, y con carácter específico para cada servicio hospitalario, de acuerdo con las directrices de gestión de la Generalitat Valenciana para el año 2014.
En la tabla 1 se desglosan los costes asignados para cada variable en el hospital A y B.
Costes analíticos por hospital, expresados en euros para cada una de las variables analizadas
| Costes analíticos | Hospital A | Hospital B |
|---|---|---|
| Estancia no quirúrgica | 250 | 208 |
| Urgencia hospitalaria | 189 | 189 |
| Primera consulta de facultativo de Neumología | 65 | 70 |
| Consulta sucesiva de facultativo de Neumología | 40 | 40 |
| Consulta médica de Atención Primaria en centro en horario ordinario, primera consulta | 57 | 57 |
| Consulta médica de Atención Primaria en centro en horario ordinario, consulta sucesiva | 29 | 29 |
| Administración enfermería | 6 | 11 |
| Coste desplazamiento del paciente | 3 | 6 |
- –
Se analizaron: edad, sexo, comorbilidad, tratamientos, atopia, dosis administradas, función pulmonar, IgE, exacerbaciones, visitas a urgencias y hospitalizaciones antes y después de la indicación del tratamiento, medida del grado de control del asma mediante las versiones validadas en castellano del Asthma Control Test (ACT)10 y Asthma Control Questionnaire (ACQ)11.
- –
Uso de medicación antiasmática, tanto de mantenimiento como de rescate, antes y después del tratamiento con omalizumab
Se empleó una base de datos unificada incluyendo a los pacientes de cada hospital, para efectuar el estudio estadístico mediante el programa SPSS.
Se efectuó un análisis descriptivo de las variables numéricas (media ± DE). Tras aplicar el test de Kolgomorov-Smirnov y evaluar la normalidad de las varianzas, se aplicaron pruebas paramétricas (t de Student) o no paramétricas (test de McWhitney) para comparar las variables numéricas entre A y B, empleando muestras no pareadas e igualmente pruebas paramétricas o no paramétricas (muestras pareadas) para comparar las variables clínicas antes y después del tratamiento, tanto para pacientes con pauta A, B y ambas en conjunto.
Para la comparación de variables cualitativas se empleó el test de la chi al cuadrado o la prueba de Fisher. Para todas las comparaciones se exigió un nivel de significación p<0,05.
Aspectos éticosEl estudio fue aprobado por el Comité Ético y de Ensayos Clínicos del Consorcio H. General Universitario de Valencia con el código CHI-OMA-2013-01 y clasificado por el Ministerio de Sanidad, Asuntos Sociales e Igualdad como «Estudio postautorización con otros diseños al de seguimiento prospectivo» (EPA-OD), no estando sujeto, por ser un estudio retrospectivo, a consentimiento informado por parte de los pacientes, aunque los datos clínicos fueron encriptados en la base de datos. En todo momento se aplicaron las normas de Declaración de Helsinki y la actualizada en Edimburgo en el año 2000.
ResultadosSe incluyó inicialmente a 138 pacientes, de los cuales se excluyeron 5 en el hospital A y 3 en el B. Los motivos de exclusión fueron: pérdida de seguimiento en 3 casos, seguimiento inferior a 12 meses en otros 3 casos y abandono voluntario por falta de eficacia subjetiva en 2. No existieron diferencias entre hospitales en el número de pacientes perdidos (5,3% vs. 6,4%, p=ns) ni en sus características clínicas basales. Se estudiaron 130 pacientes, 86 en el hospital A y 44 en el hospital B.
En la tabla 2 se muestran las características generales de la población, así como la comorbilidad, tabaquismo y tratamiento previo al inicio. Cuatro pacientes del hospital A estaban diagnosticados de aspergilosis broncopulmonar alérgica. No se apreciaron diferencias significativas en cuanto a comorbilidad y antecedentes previos de atopia entre ambos hospitales. Todos los pacientes empleaban medicación de rescate con broncodilatadores de corta duración a demanda, con una frecuencia superior a 4 inhalaciones por semana en el 75% de ellos. Un paciente que recibía esteroides por vía oral diariamente, además de anticolinérgicos y antileucotrienos, no recibía, por voluntad propia, esteroides inhalados.
Características generales de los pacientes estudiados, comorbilidad, hábito tabáquico y tratamiento habitual
| Pacientes | 130 |
| Hombres | 30 (24%) |
| Mujeres | 100 (76%) |
| Edad (años, media ± DE) | 50±15 años |
| FEV1% (media ± DE) | 67±22 |
| IMC (media ± DE) | 28±6 kg/m2 |
| Seguimiento (media ± DE) | 24±11 meses |
| IgE (media ± DE) | 639±747 UI/mL |
| ACT (media ± DE) | 12±4 |
| ACQ (media ± DE) | 3±2 |
| Comorbilidad | |
| Obesidad (IMC > 30kg/m2) | 10% |
| S. apnea de sueño | 8,5% |
| Cardiopatía isquémica | 2% |
| Otras patologías | 4% |
| Rinitis alérgica | 47% |
| Dermatitis atópica | 16% |
| Poliposis nasal | 15% |
| Tabaquismo | |
| Fumadores activos | 17% |
| Exfumadores | 39% |
| Tratamiento | |
| Esteroides inhalados | 99% |
| LABA | 99% |
| Antileucotrienos | 76% |
| LAMA | 48% |
| Antihistamínicos | 19% |
| Xantinas | 7% |
| Esteroides diarios orales | 16% |
ACT: puntuación del Asthma Control Test; ACQ: puntuación del Asthma Control Questionnaire; DE: desviación estándar; FEV1%: porcentaje del valor predicho del volumen espiratorio forzado en el primer segundo; IMC: índice de masa corporal; LABA: broncodilatador de larga duración; LAMA: anticolinérgico de larga duración.
Al comparar las características de los pacientes de A frente a B antes de recibir el tratamiento con omalizumab, no se observaron diferencias significativas basales en edad, género, FEV1%, IMC, puntuación en ACT, niveles de IgE, puntuación en ACQ, ni en las dosis de corticoides inhalados, ciclos de esteroides por vía oral o de mantenimiento, número de ingresos hospitalarios ni de visitas a urgencias en el año previo, aunque el número de días acumulados de ingreso fue mayor en A (p<0,05) (tabla 3).
Comparación de las características clínicas pretratamiento con omalizumab entre ambos hospitales
| Pretratamiento | Hospital A | Hospital B | p |
|---|---|---|---|
| n | 86 | 44 | |
| Edad (años, media ± DE) | 48±15 | 53±13 | n.s. |
| IMC (media ± DE) | 28±6 | 28±5 | n.s. |
| FEV1 (media ± DE) | 68±22 | 65±23 | n.s. |
| ACT (media ± DE) | 13±4 | 11±5 | n.s. |
| ACQ (media ± DE) | 3±2 | 3±1 | n.s. |
| Dosis máximas esteroides inhaladosa | 92% | 89% | n.s. |
| Ciclos esteroides sistémicos (media ± DE) | 3±3 | 2±2 | n.s. |
| N.° ingresos en año previo (media ± DE) | 2±1 | 2±1 | n.s. |
| Visitas a Urgencias año previo (media ± DE) | 2±2 | 4±4 | n.s. |
| Dosis total mensual omalizumab (media ± DE) | 540±250 | 476±316 | n.s. |
| Días ingreso año previo (media ± DE) | 5±2 | 2±2 | < 0,05 |
ACT: puntuación del Asthma Control Test; ACQ: puntuación del Asthma Control Questionnaire; DE: desviación estándar; FEV1%: porcentaje del valor predicho del volumen espiratorio forzado en el primer segundo; IMC: índice de masa corporal; n.s.: no significativo.
Al comparar la situación basal y tras 12 meses de tratamiento mantenido con omalizumab, tanto en cada hospital como analizadas en conjunto ambas cohortes, se observaron diferencias significativas en ACT (p<0,001), ACQ (p<0,001) y mejoría en el FEV1% (p<0,001). En ambos hospitales el número total de ingresos se redujo significativamente (p<0,001), así como los días de hospitalización (p<0,001), las visitas a urgencias (p<0,001) y el número de ciclos de esteroides por vía oral (p<0,001) respecto al año previo, sin observarse diferencias al comparar dichas variables entre hospitales tras el tratamiento (tabla 4).
Comparación de las características clínicas, pre y postratamiento con Omalizumab durante un año, para cada hospital y para el conjunto de los pacientes
| Hospital A | Hospital B | Conjunto de pacientes | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Pre | Post | p | Pre | Post | p | Pre | Post | p | |
| ACT | 13±4 | 21±5 | < 0,001 | 11±5 | 21±4 | < 0,001 | 12±4 | 21±4 | < 0,001 |
| ACQ | 3±1 | 2±1 | < 0,001 | 3±1 | 2±1 | < 0,001 | 3±1 | 2±1 | < 0,001 |
| FEV1% | 68±22 | 73±21 | < 0,01 | 64±24 | 71±26 | < 0,05 | 67±22 | 73±22 | < 0,001 |
| Ingresos hospitalarios/paciente | 2±1 | 1±1 | < 0,001 | 2±1 | 1±1 | < 0,01 | 3±1 | 1±1 | < 0,001 |
| Visitas Urgencias/paciente | 3±1 | 1±1 | < 0,001 | 4±5 | 1±1 | < 0,001 | 4±3 | 1±1 | < 0,001 |
| Visitas extra A. Primaria/paciente | 4±2 | 2±1 | < 0,001 | 5±2 | 1±1 | < 0,001 | 3±2 | 1±1 | < 0,001 |
| Visitas Neumólogo/paciente | 3±1 | 1±1 | < 0,001 | 4±1 | 2±1 | < 0,001 | 3±2 | 1±1 | < 0,001 |
| Ciclos esteroides orales/paciente | 3±3 | 1±1 | < 0,001 | 3±2 | 2±1 | < 0,001 | 3±3 | 2±2 | < 0,001 |
ACT: puntuación del Asthma Control Test; ACQ: puntuación del Asthma Control Questionnaire; FEV1%: porcentaje del valor predicho del volumen espiratorio forzado en el primer segundo.
Los valores corresponden a media ± desviación estándar.
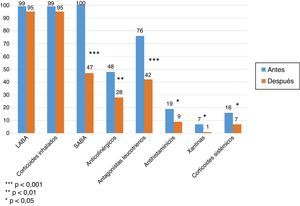
Al analizar la medicación necesaria para controlar el asma, en ambos hospitales disminuyó significativamente. El número de pacientes con esteroides inhalados no descendió, pero globalmente las dosis se redujeron el 40% frente a la inicial. La proporción de pacientes que usaban broncodilatadores de corta duración descendió significativamente (p<0,001), lo mismo que de antileucotrienos (p<0,001), de anticolinérgicos (p<0,01), de antihistamínicos (p<0,05), xantinas (p<0,05) y la proporción de pacientes con esteroides por vía oral de mantenimiento (p<0,05) (fig. 1). Además, disminuyó la dosis media diaria de aquellos que los recibían (22±12mg vs. 10±5mg, p<0,01).
Respecto a la seguridad de la administración del tratamiento, solo se apreció cuadro seudogripal inicial en 10 pacientes y eritema e induración local en 4 pacientes, sin diferencias significativas entre ambas cohortes. En ningún caso obligó a suspender el tratamiento ni se retiró ningún paciente del estudio.
Al evaluar el estudio de costes, estos se redujeron significativamente en ambos hospitales en relación con los gastos derivados de hospitalización, visitas a urgencias, visitas no programadas a Atención Primaria y al neumólogo (tabla 5). La reducción media de costes calculada respecto al año previo a la instauración del tratamiento por este concepto fue de 1.250 euros por paciente y año.
Costes medios por paciente en euros pre y postratamiento con omalizumab durante un año para ambos hospitales
| Pretratamiento | Postratamiento | p | |
|---|---|---|---|
| Coste visitas urgencias | 484±737 € | 87±238 € | < 0,001 |
| Coste de ingreso | 1.022±1.839 € | 402±1.398 € | < 0,001 |
| Coste visitas a neumólogo | 201±59 € | 152±39 € | < 0,001 |
| Coste visitas a Primaria | 172±67 € | 59±30 € | < 0,001 |
Datos expresados como media±desviación estándar.
En la tabla 6 se muestra la comparación de costes entre A y B en función de la pautas de administración de omalizumab. Los costes derivados de la administración, derivados de enfermería y desplazamiento del paciente fueron inferiores en el hospital A, sin mostrar diferencias significativas al comparar el resto de los costes individualizados, a excepción de los costes en visitas a Atención Primaria y al neumólogo antes del tratamiento, que fueron inferiores en el hospital A (tabla 6). La reducción media anual por paciente en concepto de enfermería y desplazamiento entre la administración ambulatoria u hospitalaria de omalizumab fue de 100 euros por paciente y año, lo que supone una disminución del 35% entre ambas pautas.
Costes medios analíticos desglosados por paciente entre ambos hospitales
| Hospital A | Hospital B | p | |
|---|---|---|---|
| Coste Urgencias pretratamiento | 398±438 € | 653±1.09 € 8 | n.s. |
| Coste Urgencias postratamiento | 103±282 € | 56±104 € | n.s. |
| Coste ingreso pretratamiento | 1308±2.168 € | 463±600 € | < 0,05 |
| Coste ingreso postratamiento | 552±1.690 € | 109±289 € | n.s. |
| Costes Atención Primaria pretratamiento | 160±62 € | 198±69 € | < 0,01 |
| Costes Atención Primaria postratamiento | 57±29 € | 64±31 € | n.s. |
| Costes Neumólogo pretratamiento | 191±62 € | 220±49 € | < 0,01 |
| Costes Neumólogo postratamiento | 156±41 € | 145±34 € | n.s. |
| Costes enfermería | 182±50 € | 278±99 € | < 0,001 |
| Costes desplazamiento | 61±17 € | 98±35 € | < 0,001 |
Datos expresados como media ± desviación estándar.
Aunque omalizumab ha mostrado su eficacia en el tratamiento del AGNC12, el estudio de costes derivados del régimen de administración de omalizumab, ambulatorio u hospitalario, en nuestro conocimiento no ha sido abordado, tanto en términos de resultados clínicos, como económicos. Nuestro trabajo demuestra que en 2 poblaciones semejantes de asma grave, la administración ambulatoria en los centros de salud es factible, con unos resultados semejantes en términos de salud, pero con unos costes inferiores a los de administración hospitalaria y con menores costes repercutidos en el paciente, suponiendo una mayor comodidad para el mismo. En nuestro estudio se observaron diferencias en costes imputables al mayor coste de la estancia en el hospital en que se efectuó una pauta ambulatoria, aunque fueron inferiores en los costes derivados de visitas al médico de Atención Primaria y al neumólogo antes de iniciar el tratamiento. El coste de estancia es inherente a las características de un hospital y depende de distintos factores, como los derivados de la estructura, número de camas, mantenimiento, personal, etc.13, al igual que los costes de las primeras o sucesivas visitas dependen de costes estructurales, del personal o de los pacientes atendidos en la agenda. Al estar unidos a la gestión hospitalaria, son difícilmente modificables en corto espacio de tiempo y pueden diferir entre hospitales.
Omalizumab es un tratamiento de prescripción especializada. Su pauta convencional de administración en España es hospitalaria, posiblemente debido a que su dispensación también lo es. Precisa enfermería y administración controlada, aunque la baja frecuencia de efectos adversos graves no lo justifica. Por otra parte, no existe evidencia de que esta pauta sea más adecuada en términos de resultados clínicos o de seguridad, que su administración en otros ambientes sanitarios, como en los centros de salud. En nuestro trabajo, todos los pacientes procedían de una consulta especializada de asma, donde además de prescribir el fármaco y ajustar el tratamiento, seguían su control clínico habitual. Por el momento, el control de pacientes con AGNC con este tratamiento no ha sido evaluado en otros ámbitos sanitarios, como Atención Primaria. Por otra parte, el tratamiento en sí mismo tiene un alto precio y reducir los costes del proceso es importante para el sistema sanitario. Algunos autores han estimado una población en España de 857.514 pacientes asmáticos, que generan unos costes anuales de 1.480 millones de euros14. Al mal control de la enfermedad se le atribuye un 70% del coste: la totalidad de los costes no sanitarios y una parte de los costes directos sanitarios (hospitalización, visitas a urgencias, muertes). En nuestro estudio, el coste medio por paciente antes y después del tratamiento, aun con amplias variaciones individuales, se redujo en 1.200 euros anuales por paciente en costes directos de atención sanitaria, como visitas a urgencias, ingresos hospitalarios y visitas no programadas a Atención Primaria y al especialista. Asumiendo una prevalencia de AGNC del 5% en esta población de asmáticos, 45.000 pacientes en España estarían afectados de AGNC, gran parte de ellos susceptibles de ser tratados con omalizumab o con futuros tratamientos biológicos. A partir de los datos de nuestro estudio, una reducción de costes de un 35%, solo por el modelo de administración de omalizumab, podría estimarse entre 4,5 y 9 millones de euros anuales.
Como otros autores han demostrado, omalizumab redujo significativamente los ingresos hospitalarios por exacerbación, las visitas a urgencias, visitas no programadas al médico de Atención Primaria y al especialista, también las dosis de esteroides inhalados y orales12,15-18 y ello se apreció en ambos hospitales, con independencia de su administración ambulatoria u hospitalaria, lo que, además de reforzar su utilidad clínica en AGNC, permite considerar igualmente la efectividad de la pauta ambulatoria.
Varios estudios han abordado el fármaco desde el punto de vista farmacoeconómico. Oba et al.19 estimaron en 523 $ el coste por día adicional de buen control asmático y en 378 $/día para alcanzar al menos una mejoría de 0,5 puntos en la escala de calidad de vida. Los autores concluyeron que, desde un punto de vista farmacoeconómico, sería preferible utilizar omalizumab en pacientes con AGNC, siendo coste-efectivo si se tratara a pacientes no fumadores que son hospitalizados anualmente 5 o más veces, o bien más de 20 días, a pesar de recibir todos los tratamientos posibles.
Dewilde et al.20, estimaron el coste-efectividad de omalizumab en 56.091 €/QALY, asumiendo que un 1-3% de las exacerbaciones tienen un resultado fatal y que la reducción de la mortalidad sería análoga a la reducción de exacerbaciones. Un estudio de coste-utilidad se mostró sensible para establecer diferencias a favor del tratamiento con omalizumab sobre cronicidad, mortalidad asociada a exacerbación, precio, exacerbaciones y respuesta clínica, mejorando los QALY, aun aumentando los costes médicos directos. Concluyeron que el coste-efectividad es similar a otros tratamientos biológicos crónicos21.
Un reciente estudio mostró que omalizumab mejoró progresivamente el control del asma y la calidad de vida, disminuyendo los costes de medicación y de cuidados hospitalarios. Aunque se observó un incremento de costes de 450 € mensuales, también se apreció un gran incremento coste/utilidad de € 23.880 por año de vida ganado ajustado por calidad, lo que favorece su inversión en términos de salud en los países industrializados22. Un estudio español mostró una relación de coste-efectividad incremental de 462.08 euros por exacerbación evitada y de 26.864,89 euros por QALY ganado23. Una revisión reciente muestra que el tratamiento actual del asma es coste-efectivo en relación con el grado de control de la enfermedad y sus alternativas de manejo, incluyendo esteroides inhalados, broncodilatadores de larga duración y omalizumab24. Hay que tener en consideración que la diferencia de coste-efectividad medida por QALY depende de los métodos empleados para su cálculo, la cronicidad y gravedad del proceso analizado y del sistema sanitario donde se calcule, lo que puede explicar las diferencias económicas existentes entre distintos estudios25.
Nuestro trabajo presenta unas limitaciones potenciales. Se trata de un estudio retrospectivo, realizado en 2 unidades de asma especializada en pacientes con AGNC. Sin embargo, aunque podría tener sesgos de selección de la muestra, se incluyó a todos los pacientes que cumplieron un mínimo de tratamiento durante un año, con escasas pérdidas preinclusión. Consideramos que nuestro estudio es concluyente, al estar realizado en condiciones de práctica clínica habitual. No obstante, los resultados en el grupo de administración ambulatoria podrían no ser extrapolables a otras unidades, en función de las características geográficas de la población atendida, o de la complejidad de los pacientes con mayor riesgo (gravedad, frecuencia, labilidad de las crisis, comorbilidad). La atracción hospitalaria, su lejanía, su complejidad y tipo de organización pueden producir gran variabilidad en los costes.
En conclusión, nuestro trabajo contribuye a profundizar en el estudio de los costes asociados a omalizumab en pacientes con AGNC e indica que puede administrarse de forma ambulatoria, permitiendo reducir parte de los costes asociados al tratamiento. Con idénticos resultados clínicos, y sin poner en riesgo la seguridad, supone una mayor comodidad para el paciente.
FinanciaciónFinanciado en parte con una ayuda a la investigación de Novartis en 2014.
AutoríaECHV y EFB diseñaron y planificaron el estudio, efectuaron el estudio estadístico y redactaron y revisaron el manuscrito.
PL y LN fueron los responsables de la base de datos, evaluaron pacientes y revisaron el manuscrito.
MR, JNSCH, CS y JB evaluaron a pacientes en consulta, contribuyeron a la redacción y revisión del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.