La afectación pulmonar por COVID-19 se asocia frecuentemente con alteraciones en la oxigenación. La presión parcial arterial de oxígeno (PaO2) es la variable más utilizada clínicamente para valorar dicha oxigenación, ya que influye decisivamente en el oxígeno transportado por la hemoglobina (expresado por porcentaje de saturación, SaO2). Sin embargo, dos estudios recientes realizados respectivamente in silico y mediante técnicas ómicas en hematíes de pacientes han sugerido que SARS-CoV-2 podría disminuir la afinidad del oxígeno por la hemoglobina (lo que implicaría que la PaO2 sobrevaloraría la SaO2 real), e incluso reduciría la cantidad de esta molécula transportadora.
ObjetivoEvaluar dicha hipótesis en muestras gasométricas de pacientes con COVID-19.
MétodosSe incluyeron las gasometrías de todos los pacientes con COVID-19 realizadas en nuestro laboratorio, así como las de dos grupos control: pacientes sincrónicos con PCR negativa (GCS) y grupo histórico (GCH). Se compararon por separado las SaO2 y saturaciones venosas (SvO2), medidas por cooximetría (COX) con las calculadas mediante las ecuaciones de Kelman (K), Severinghaus (SV) y Siggaard-Andersen (SA) en cada grupo.
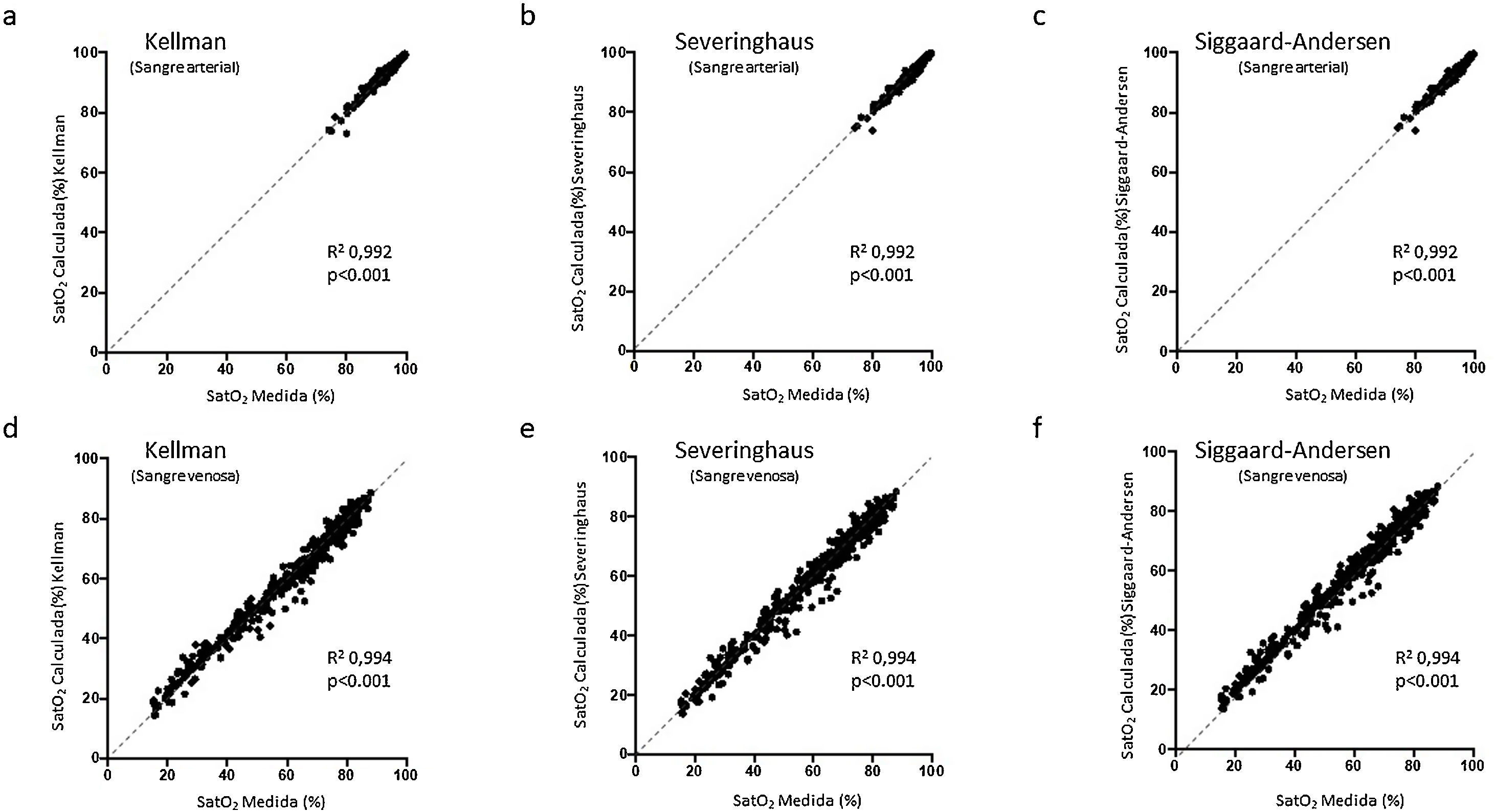
ResultadosLas cifras de SaO2 y SvO2 medidas y calculadas fueron prácticamente superponibles en todos los grupos. Así, los coeficientes de correlación intraclase (CCI) en COVID-19 para SaO2 fueron 0,993 en COX-K y 0,992 en COX-SV y COX-SA; siendo 0,995 para SvO2 tanto en COX-K como en COX-SV y COX-SA. La hemoglobina y la ferritina resultaron algo superiores en el grupo COVID-19 respecto de GCS y GCH (hemoglobina, p < 0,001 en ambos; ferritina, p < 0,05 para GCS y p < 0,001 para GCH).
ConclusionesEn condiciones clínicas, el SARS-CoV-2 no influye de forma apreciable en la afinidad del oxígeno por la hemoglobina, ni tampoco en los niveles de esta última. Por tanto, la PaO2 es un buen marcador de oxigenación sanguínea también en COVID-19.
Pulmonary involvement in COVID-19 is frequently associated with alterations in oxygenation. The arterial partial pressure of oxygen (PaO2) is the most clinically used variable to assess such oxygenation, since it decisively influences the oxygen transported by hemoglobin (expressed by its percentage of saturation, SaO2). However, two recent studies conducted respectively in silico and using omic techniques in red blood cells of COVID-19 patients have suggested that SARS-CoV-2 could decrease the affinity of oxygen for the hemoglobin (which would imply that PaO2 would overestimate SaO2), and also reduce the amount of this carrier molecule.
ObjectiveTo evaluate this hypothesis in blood samples from COVID-19 patients.
MethodsBlood gases of all COVID-19 patients performed in our laboratory in two months were included, as well as those from two control groups: synchronous patients with negative PCR for SARS-CoV-2 (SCG) and a historical group (HCG). Both SaO2 and venous saturations (SvO2) measured by cooximetry (COX) were compared separately with those calculated using the Kelman (K), Severinghaus (SV) and Siggaard-Andersen (SA) equations in each group.
ResultsMeasured and calculated SaO2 and SvO2 were practically equivalent in all groups. Intraclass correlation coefficients (ICC) for SaO2 in COVID-19 were 0.993 for COX-K and 0.992 for both COX-SV and COX-SA; being 0.995 for SvO2 for either COX-K, COX-SV or COX-SA. Hemoglobin and ferritin were slightly higher in COVID-19 compared to SCG and HCG (hemoglobin, p < 0.001 for both; ferritin, p < 0.05 for SCG and p < 0.001 for HCG).
ConclusionUnder clinical conditions SARS-CoV-2 does not have an appreciable influence on the affinity of oxygen for the hemoglobin, nor on the levels of this carrier molecule. Therefore, PaO2 is a good marker of blood oxygenation also in COVID-19.
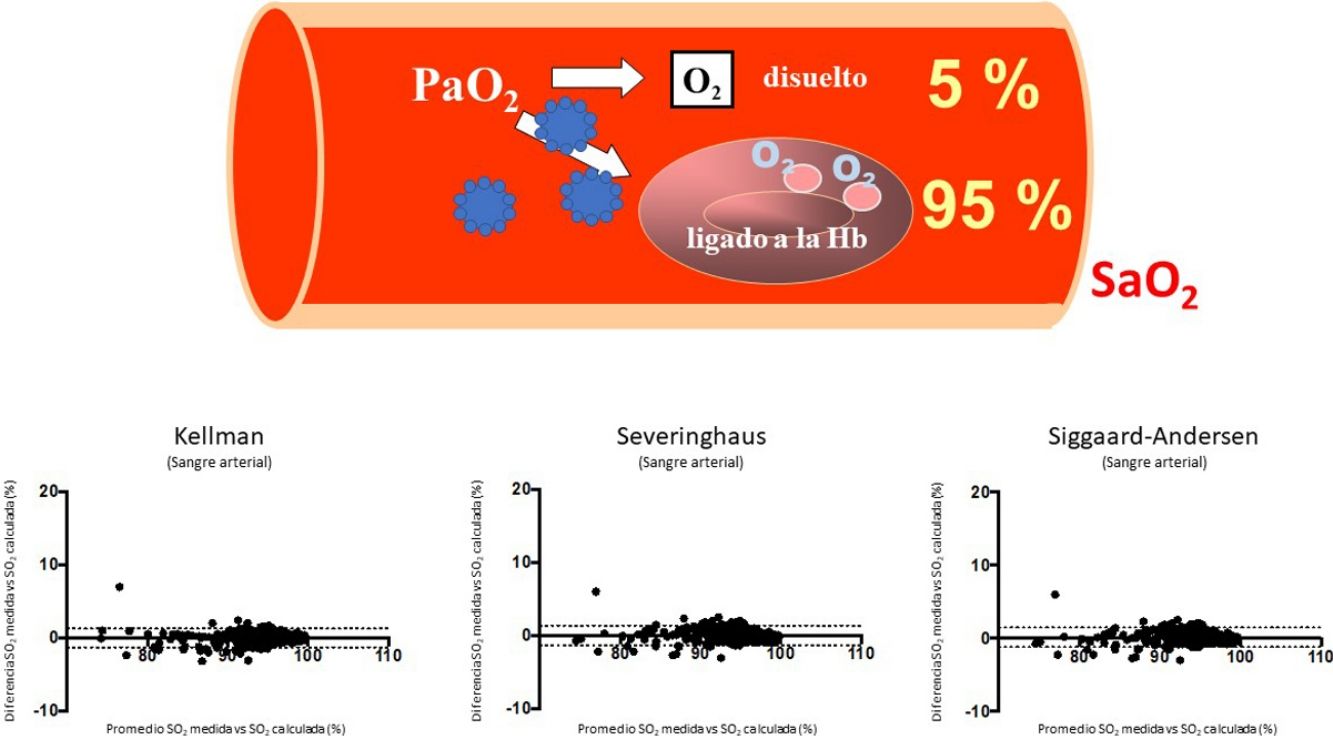
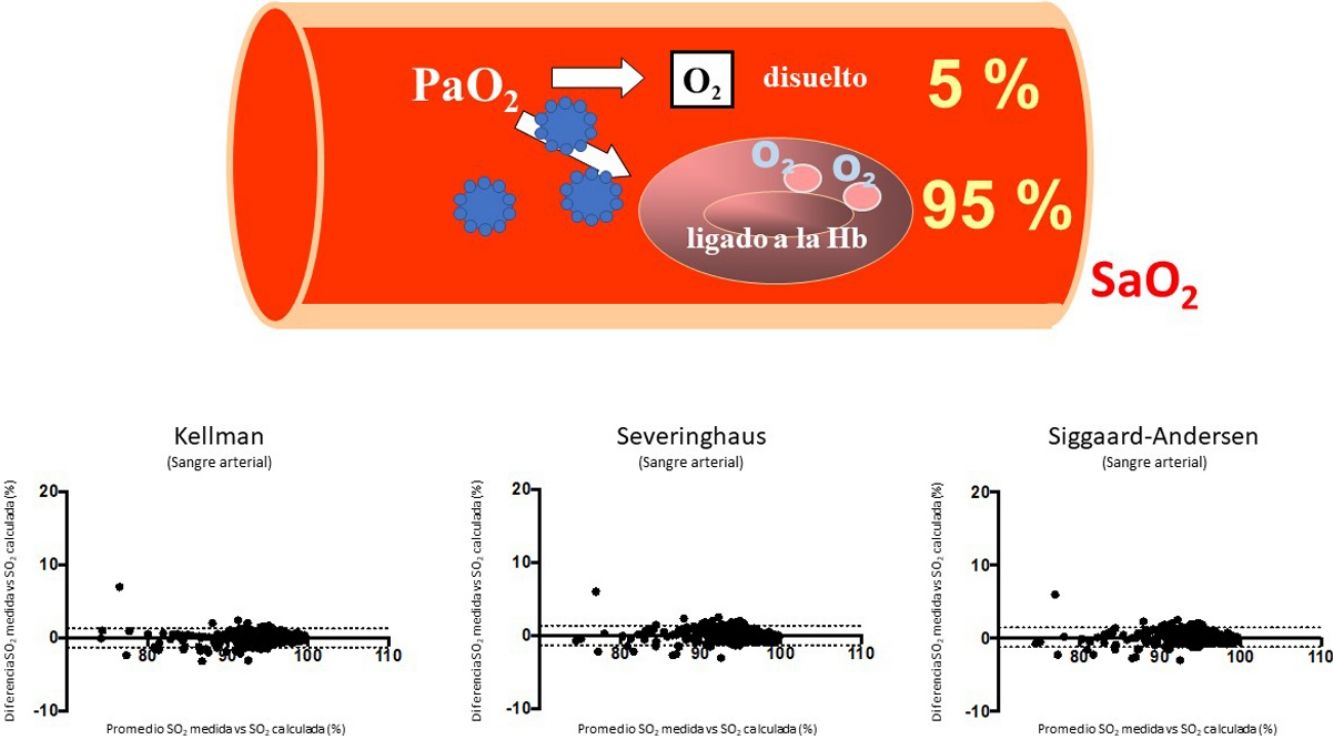
El SARS-CoV-2 es un virus que está provocando una grave pandemia, cuya expresión clínica se ha denominado COVID-191,2. Aunque esta enfermedad puede afectar a diversos órganos, el principal es el pulmón, donde puede producir tanto neumonía con inflamación tisular reactiva como alteraciones vasculares y sanguíneas2,3. Como consecuencia, aparece en muchos casos insuficiencia respiratoria, que puede llegar a ser muy grave y asociarse con el síndrome de la dificultad respiratoria aguda (SDRA). El manejo clínico de estos procesos requiere valorar evolutivamente el intercambio pulmonar de gases, lo que preferentemente se lleva a cabo mediante la gasometría arterial, aunque para disminuir la invasividad se suele monitorizar su evolución mediante la oximetría. La variable más utilizada en la valoración de la gravedad de la hipoxemia y la evolución del paciente es la presión parcial de oxígeno (PaO2), así como su relación con la concentración de gas administrada (fracción inspiratoria de oxígeno [FiO2]), variable conocida como PaFi (PaO2/FiO2)4. La PaO2 es importante para conocer el contenido total de oxígeno que desde la sangre arterial (CaO2) puede llegar a los tejidos, ya que es determinante tanto en la cantidad de gas unido a la hemoglobina como en el disuelto en el plasma5. La primera es mucho más importante (un 95% del CaO2) y se expresa mediante el porcentaje de saturación de dicha molécula (SaO2). Sin embargo, recientemente se ha reportado en un estudio realizado in silico que el SARS-CoV-2 sería capaz de dificultar la unión entre hemoglobina y oxígeno mediante algunas de sus proteínas (por ejemplo, ORF8)6,7 e incluso destruir moléculas de hemoglobina6,7. Un estudio todavía más reciente, realizado sobre hematíes de pacientes con COVID-19 mediante determinaciones proteómica y lipidómica, también sugiere que pueda existir una menor afinidad entre el oxígeno y la hemoglobina en estos pacientes8. Las consecuencias clínicas de estos dos estudios podrían ser importantes, ya que limitarían el valor de la PaO2 y de la PaFi en la evaluación del estado real de oxigenación del paciente con COVID-197. Dado que existen numerosas ecuaciones validadas que permiten calcular la saturación que corresponde a una determinada presión parcial de oxígeno, y teniendo en cuenta los otros factores principales implicados, la diferencia entre dicha variable y la saturación real del paciente permite inferir si la afinidad del gas por la molécula de hemoglobina se ha visto afectada o no por el virus. El objetivo del presente estudio fue analizar la concordancia entre la SaO2 medida y la estimada a partir de la PaO2, con el fin de valorar si la infección tiene realmente efectos sobre la afinidad del oxígeno sobre la hemoglobina.
MétodoEl presente estudio se llevó a cabo analizando todas las muestras de gasometría arterial y venosa procedentes de pacientes con COVID-19 (confirmación por reacción en cadena de la polimerasa o PCR en frotis nasal o faríngeo), obtenidas en el laboratorio central de nuestro centro entre los meses de marzo y abril de 2020. En total fueron 549 muestras de sangre arterial procedentes de 139 pacientes, y adicionalmente 544 muestras venosas extraídas en 215 enfermos. Se descartaron otras gasometrías, al estar realizadas y procesadas en otros dispositivos asistenciales, con criterios de calibración y mantenimiento instrumental levemente diferentes. También se incluyeron las gasometrías de dos grupos control: el primero formado por pacientes sincrónicos al primer grupo, con cuadros febriles, pero radiología no sugestiva de afectación por SARS-CoV-2 y PCR negativa para dicho virus (251 muestras arteriales de 73 enfermos y 1.069 muestras venosas correspondientes a 379 pacientes), y el segundo constituido por sujetos ingresados en los dos meses anteriores a la detección de los primeros casos de infección por SARS-CoV-2 y por cuadros pulmonares no parenquimatosos (2.614 muestras arteriales procedentes de 1.089 enfermos y 3.098 muestras venosas de 1.461 pacientes). La inclusión de muestras arteriales y venosas se debió al interés en analizar la afinidad del oxígeno por la hemoglobina en un amplio rango de presiones arteriales de dicho gas. De acuerdo con el Comité de Ética de la Investigación Clínica (CEIC) de la institución, los pacientes dieron inicialmente su consentimiento verbal para la inclusión de sus datos clínicos y analíticos, con aprobación posterior en el marco de un estudio sobre pacientes graves con COVID-19 (ref. 2020/9458).
TécnicasGasometría arterial y venosa: La primera se realizó mediante punción de la arteria radial y siguiendo las indicaciones de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) para la obtención y preservación de la muestra9, mientras que la segunda se obtuvo por venopunción, generalmente de la cubital, aunque también de la cefálica o la basílica.Las gasometrías mencionadas fueron analizadas en aparatos de medición de gases Rapidpoint 405 (Siemens, Múnich, Alemania), dotados de cooximetría para la medida de la saturación de oxígeno, fuera en sangre arterial (SaO2) o venosa sistémica (SvO2). Además, se obtuvieron los restantes parámetros estándar de gasometría. Los controles de calidad fueron los recomendados por los proveedores, con 3 runs diarios del líquido de ajustes. Los valores medidos de las variables antes mencionadas se compararon en cada uno de los grupos con los obtenidos por su cálculo mediante las ecuaciones de Kelman, Severinghaus y Siggaard-Andersen10–12, que los estiman fundamentalmente a partir de la PaO2 medida, teniendo en cuenta también las desviaciones de la curva de saturación. Además, se disponía del valor de hemoglobina en sangre en el momento de la punción, ya que es proporcionado por el mismo medidor de gases (valores normales en nuestro laboratorio, 12,0 a 17,0 g/dL). Dentro de la analítica general de los pacientes con COVID-19 también se valoró la ferritina en sangre (valores normales en nuestro laboratorio, 30 a 400 ng/mL), mediante inmunoensayo electroquimioluminiscente (ECLIA) en «sandwich» (analizador Cobas 8000 e801, Roche, Basel, Suiza).
Análisis estadísticoTras comprobar la normalidad en sus distribuciones, se procedió a mostrar los valores de las variables como media y desviación estándar de esta. Los valores medidos y calculados de la SaO2 y la SvO2 para un mismo grupo fueron comparados con análisis de la varianza de tipo aleatorio de dos vías (two-way random ANOVA), con obtención del CCI como expresión de la consistencia, empleándose la misma aproximación para las comparaciones entre los tres grupos. La relación entre variables se analizó con el coeficiente de Pearson y regresión lineal. También se efectuó un análisis de concordancia mediante la representación de Bland-Altman, basado en la media de las diferencias13. Dado que a PaO2 superiores a 100 mmHg podría producirse un efecto meseta sobre la SaO2, se efectuó un análisis post hoc adicional censurando dichos valores. En todas las pruebas se ha considerado como significativo un valor de p < 0,05.
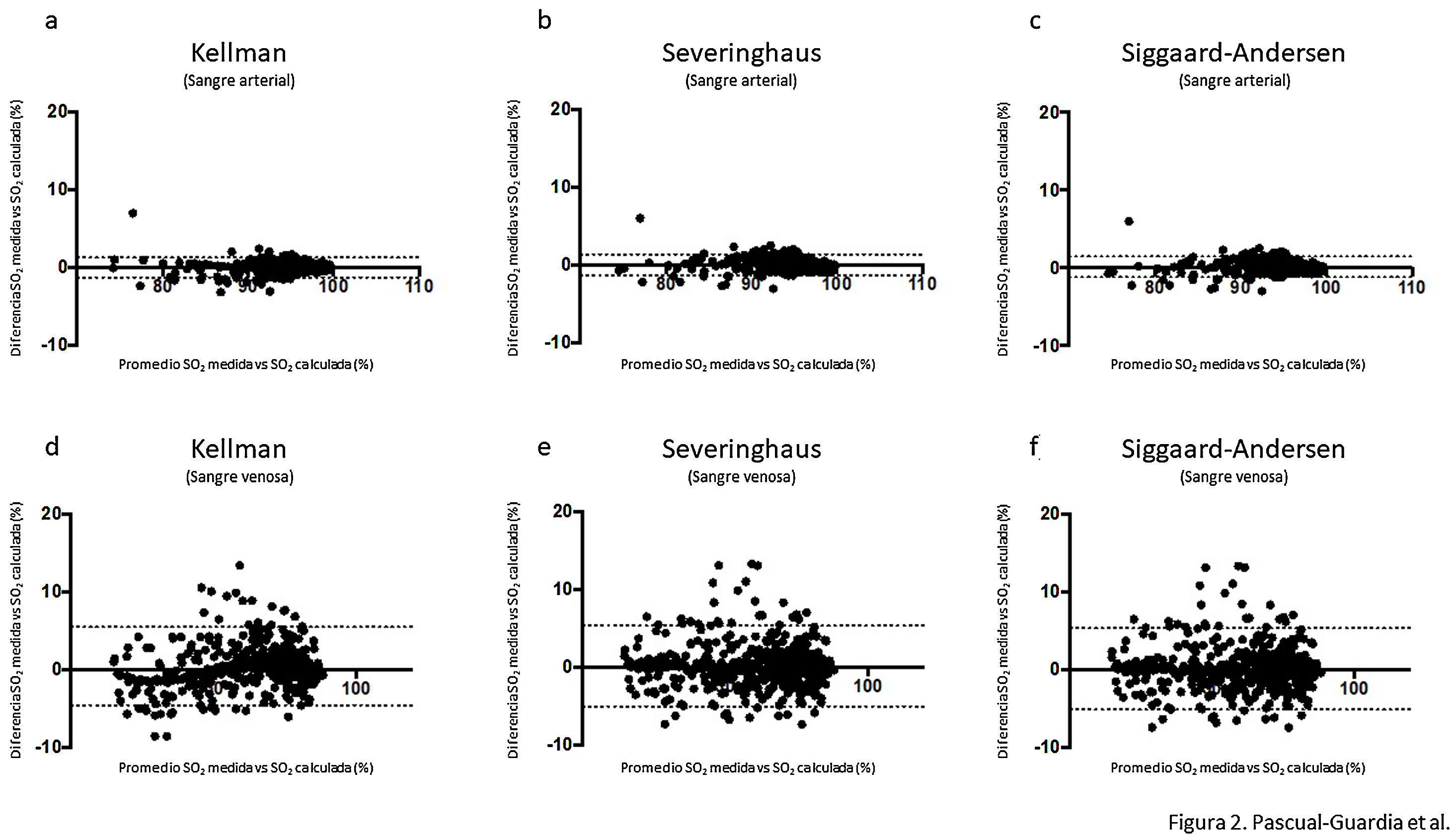
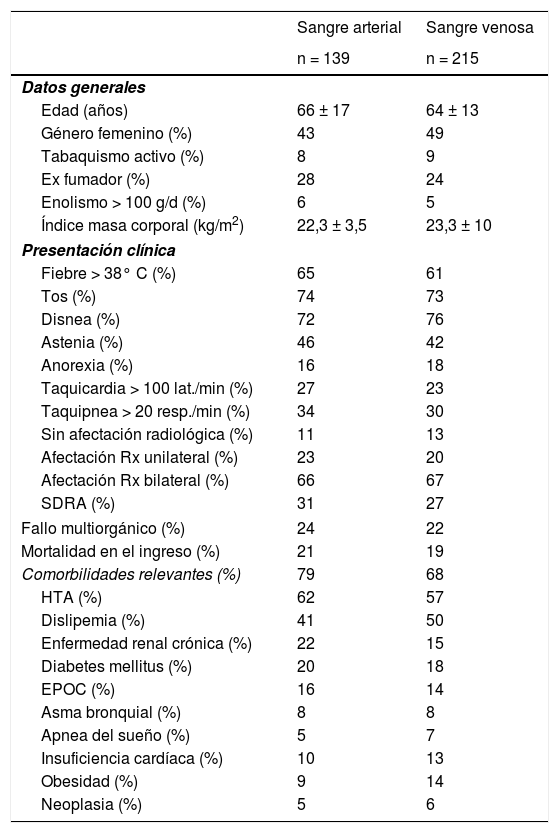
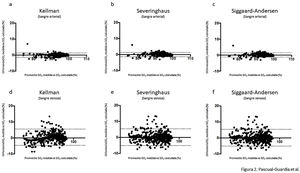
ResultadosEn la tabla 1 aparecen las características generales y clínicas más relevantes de los pacientes, mientras que en la tabla 2 se muestran los valores medios de sus gasometrías arteriales y venosas para cada uno de los tres grupos. En el grupo con COVID-19, la SaO2 medida por cooximetría fue prácticamente superponible a la calculada por las diferentes ecuaciones (tabla 3). Los resultados fueron similares en sangre venosa. Por otra parte, las correlaciones entre SaO2 medida y calculada y entre SvO2 medida y calculada mostraron asimismo valores muy elevados, con la línea de regresión muy cercana a la de identidad (figura 1 del manuscrito y figura A(a) del suplemento on line); resultados corroborados además por el análisis de consistencia, en que los valores de los CCI fueron siempre superiores a 0,98 (tabla 3). Situación que también es evidente en la gráfica de Bland-Altman (fig. 2). Por otra parte, los pacientes mostraban unos valores medios de presión parcial de dióxido de carbono (PCO2) y de pH dentro de la normalidad, tanto en sangre arterial como venosa. No se observaron relaciones de interés entre variables clínicas y las diferencias entre saturaciones medidas y calculadas.
Datos generales y clínicos más relevantes de los pacientes con COVID-19 incluidos en el estudio
| Sangre arterial | Sangre venosa | |
|---|---|---|
| n = 139 | n = 215 | |
| Datos generales | ||
| Edad (años) | 66 ± 17 | 64 ± 13 |
| Género femenino (%) | 43 | 49 |
| Tabaquismo activo (%) | 8 | 9 |
| Ex fumador (%) | 28 | 24 |
| Enolismo > 100 g/d (%) | 6 | 5 |
| Índice masa corporal (kg/m2) | 22,3 ± 3,5 | 23,3 ± 10 |
| Presentación clínica | ||
| Fiebre > 38° C (%) | 65 | 61 |
| Tos (%) | 74 | 73 |
| Disnea (%) | 72 | 76 |
| Astenia (%) | 46 | 42 |
| Anorexia (%) | 16 | 18 |
| Taquicardia > 100 lat./min (%) | 27 | 23 |
| Taquipnea > 20 resp./min (%) | 34 | 30 |
| Sin afectación radiológica (%) | 11 | 13 |
| Afectación Rx unilateral (%) | 23 | 20 |
| Afectación Rx bilateral (%) | 66 | 67 |
| SDRA (%) | 31 | 27 |
| Fallo multiorgánico (%) | 24 | 22 |
| Mortalidad en el ingreso (%) | 21 | 19 |
| Comorbilidades relevantes (%) | 79 | 68 |
| HTA (%) | 62 | 57 |
| Dislipemia (%) | 41 | 50 |
| Enfermedad renal crónica (%) | 22 | 15 |
| Diabetes mellitus (%) | 20 | 18 |
| EPOC (%) | 16 | 14 |
| Asma bronquial (%) | 8 | 8 |
| Apnea del sueño (%) | 5 | 7 |
| Insuficiencia cardíaca (%) | 10 | 13 |
| Obesidad (%) | 9 | 14 |
| Neoplasia (%) | 5 | 6 |
lat./min: latidos/minuto; resp./min: respiraciones/minuto; Rx: radiología simple; SDRA: síndrome del distrés respiratorio agudo; HTA: hipertensión arterial; EPOC: enfermedad pulmonar obstructiva crónica.
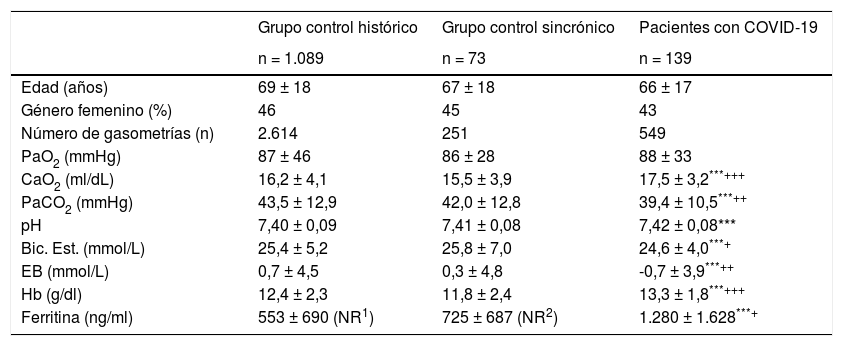
Datos relativos a las gasometrías arterial y venosa en los diferentes grupos de pacientes a) Sangre arterial
| Grupo control histórico | Grupo control sincrónico | Pacientes con COVID-19 | |
|---|---|---|---|
| n = 1.089 | n = 73 | n = 139 | |
| Edad (años) | 69 ± 18 | 67 ± 18 | 66 ± 17 |
| Género femenino (%) | 46 | 45 | 43 |
| Número de gasometrías (n) | 2.614 | 251 | 549 |
| PaO2 (mmHg) | 87 ± 46 | 86 ± 28 | 88 ± 33 |
| CaO2 (ml/dL) | 16,2 ± 4,1 | 15,5 ± 3,9 | 17,5 ± 3,2***+++ |
| PaCO2 (mmHg) | 43,5 ± 12,9 | 42,0 ± 12,8 | 39,4 ± 10,5***++ |
| pH | 7,40 ± 0,09 | 7,41 ± 0,08 | 7,42 ± 0,08*** |
| Bic. Est. (mmol/L) | 25,4 ± 5,2 | 25,8 ± 7,0 | 24,6 ± 4,0***+ |
| EB (mmol/L) | 0,7 ± 4,5 | 0,3 ± 4,8 | -0,7 ± 3,9***++ |
| Hb (g/dl) | 12,4 ± 2,3 | 11,8 ± 2,4 | 13,3 ± 1,8***+++ |
| Ferritina (ng/ml) | 553 ± 690 (NR1) | 725 ± 687 (NR2) | 1.280 ± 1.628***+ |
| b) Sangre venosa | |||
|---|---|---|---|
| Grupo control histórico | Grupo control sincrónico | Pacientes con COVID-19 | |
| n = 1.461 | n = 379 | n = 215 | |
| Edad (años) | 65 ± 23 | 64 ± 22 | 67 ± 18 |
| Género (femenino, %) | 46 | 46 | 49 |
| Número de gasometrías (n) | 3.098 | 1.069 | 544 |
| PvO2 (mmHg) | 34 ± 9 | 34 ± 9 | 34 ± 9 |
| PvCO2 (mmHg) | 45,7 ± 10,0 | 45,8 ± 10,7 | 44,8 ± 9,2*+ |
| CvO2 (ml/dl) | 10,3 ± 5,4 | 9,8 ± 5,1 | 11,2 ± 5,2*++ |
| pH | 7,37 ± 0,07 | 7,36 ± 0,08 | 7,38 ± 0,06***+++ |
| Bic. Est. (mmol/L) | 24,0 ± 4,3 | 23,8 ± 5,2 | 24,4 ± 4,0*++ |
| EB (mmol/L) | 0,3 ± 4,0 | -0,2 ± 4.2 | 1,0 ± 4,1***+++ |
COVID-19: enfermedad producida por el coronavirus 2019; PaO2: presión parcial de oxígeno en sangre arterial; PvO2: presión parcial de oxígeno en sangre venosa; PaCO2: presión parcial de dióxido de carbono en sangre arterial; PvCO2: presión parcial de dióxido de carbono en sangre venosa; CaO2: contenidos de oxígeno en sangre arterial; CvO2: contenidos de oxígeno en sangre venosa; pH: cologaritmo de la concentración de iones hidrógeno; Bic. Est.: bicarbonato estándar; EB: exceso de base.
Niveles de significancia entre control histórico y pacientes COVID-19:
* p ≤ 0,05; ** p ≤ 0,01; *** p ≤ 0,001.
Niveles de significancia entre control sincrónico y pacientes COVID-19: + p ≤ 0,05; ++ p ≤ 0,01; +++ p ≤ 0,001.
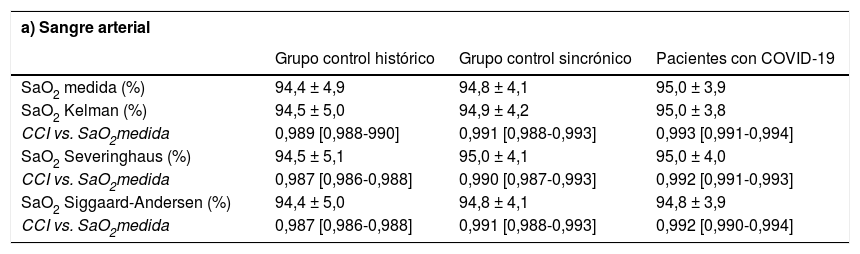
Comparación entre la saturación de la hemoglobina medida por oximetría y calculada con las diferentes ecuaciones de predicción
| a) Sangre arterial | |||
|---|---|---|---|
| Grupo control histórico | Grupo control sincrónico | Pacientes con COVID-19 | |
| SaO2 medida (%) | 94,4 ± 4,9 | 94,8 ± 4,1 | 95,0 ± 3,9 |
| SaO2 Kelman (%) | 94,5 ± 5,0 | 94,9 ± 4,2 | 95,0 ± 3,8 |
| CCI vs. SaO2medida | 0,989 [0,988-990] | 0,991 [0,988-0,993] | 0,993 [0,991-0,994] |
| SaO2 Severinghaus (%) | 94,5 ± 5,1 | 95,0 ± 4,1 | 95,0 ± 4,0 |
| CCI vs. SaO2medida | 0,987 [0,986-0,988] | 0,990 [0,987-0,993] | 0,992 [0,991-0,993] |
| SaO2 Siggaard-Andersen (%) | 94,4 ± 5,0 | 94,8 ± 4,1 | 94,8 ± 3,9 |
| CCI vs. SaO2medida | 0,987 [0,986-0,988] | 0,991 [0,988-0,993] | 0,992 [0,990-0,994] |
| b) Sangre venosa | |||
|---|---|---|---|
| Grupo control histórico | Grupo control sincrónico | Pacientes con COVID-19 | |
| SvO2 medida (%) | 60,3 ± 17,9 | 60,1 ± 18,0 | 61,6 ± 18,8 |
| SvO2 Kelman (%) | 60,0 ± 17,4 | 59,5 ± 17,3 | 61,1 ± 18,2 |
| CCI vs. SvO2medida | 0,991 [0,990-0,991] | 0,990 [0,988-0,991] | 0,995 [0,994-0,996] |
| SvO2 Severinghaus (%) | 60,1 ± 18,2 | 59,6 ± 18,1 | 61,4 ± 19,0 |
| CCI vs. SvO2medida SvO2 | 0,990 [0,989-0,990] | 0,989 [0,987-0,990] | 0,995 [0,994-0,996] |
| Siggaard-Andersen (%) | 60,2 ± 18,2 | 59,6 ± 18,1 | 61,4 ± 19,0 |
| CCI vs. SvO2medida | 0,990 [0,989-0,990] | 0,989 [0,987-0,990] | 0,995 [0,994-0,996] |
SaO2: saturación de oxígeno en sangre arterial; SvO2: saturación de oxígeno en sangre venosa; CCI: coeficiente de correlación intraclase.
Gráficas de Bland-Altman para las diferencias entre saturación medida y calculada por las tres ecuaciones utilizadas en el estudio, tanto para sangre arterial (a), (b) y (c), como para sangre venosa sistémica (d), (e) y (f). La línea continua representa la media entre los valores medidos y calculados. Las líneas discontinuas representan la media±1,96 x desviación estándar (intervalo de confianza del 95%).
Los resultados no fueron sustancialmente diferentes en ninguno de los dos grupos control. El de pacientes sincrónicos con PCR negativa para SARS-CoV-2 tampoco mostró diferencias entre la saturación medida y la calculada con las diferentes ecuaciones, tanto en sangre arterial como venosa. Lo mismo sucedió con el grupo de pacientes sin patología infecciosa, cuyos análisis gasométricos fueron efectuados en los meses anteriores a la pandemia. También en estos dos casos las correlaciones y CCI fueron altamente significativos. El valor de hemoglobina y la ferritina fueron algo superiores en el grupo con COVID-19, comparado con ambos grupos control.
En el análisis post hoc, con exclusión de las gasometrías con valores de PaO2 superiores a 100 mm Hg, tampoco se objetivaron diferencias entre la SaO2 medida y los valores calculados para esta variable con cualquiera de las tres ecuaciones y para ninguno de los tres grupos del estudio (tablas A y B, y figura A del suplemento on line).
DiscusiónEl resultado principal del presente estudio es la demostración de que la infección activa por SARS-CoV-2 no modifica de forma sustancial la relación entre PaO2 y SaO2. Esto es especialmente relevante para el manejo clínico de los pacientes con afectación pulmonar debida a COVID-19. Además, tampoco se observó afectación de la afinidad del oxígeno por la hemoglobina en sangre venosa, ni una reducción de dicha molécula secundaria a la infección.Un estudio reciente, realizado in silico, sugería que diversas proteínas de superficie del virus (como ORF8 y quizás alguna otra glicoproteína) serían capaces de dificultar la unión entre el hierro de la molécula de hemoglobina y el oxígeno6,14, dificultando así el transporte del gas a los tejidos, aunque se mantuviera una PaO2 adecuada. Esto tendría además como consecuencia que esta última variable solo tendría un valor relativo en el manejo de los pacientes, al no reflejar su estado real de oxigenación7,14. Más recientemente aún, y utilizando técnicas ómicas, otro grupo ha descrito alteraciones proteicas y lipídicas que afectan a la membrana de los hematíes, y que también podrían condicionar una menor afinidad del oxígeno por la hemoglobina para una determinada presión parcial del gas8. En circunstancias normales, se sabe que dicha presión permite predecir con aceptable aproximación la saturación de la hemoglobina, ya que ambas variables mantienen una relación conocida, en forma de «S» itálica. A valores altos o muy bajos de presión, los cambios de saturación son relativamente pequeños; sin embargo, cuando la primera desciende por debajo de 60 mm Hg se producen descensos dramáticos de la segunda5,15. Ciertamente hay factores que pueden modificar la relación entre ambas variables, desplazando la curva hacia la izquierda o la derecha. Los más importantes son la temperatura, la PaCO2, el pH y la concentración del 2-3-difosfoglicerato5, así como la presencia de hemoglobinas anómalas, que sería el caso sugerido para la infección por SARS-CoV-2. En circunstancias clínicas, estos desplazamientos no son tenidos habitualmente en cuenta, pero sí que se utilizan para el cálculo de la saturación cuando esta no se ha podido determinar directamente. Esto ya no es frecuente, debido a que la mayoría de los medidores de gases actuales incorporan la cooximetría. Sin embargo, esta técnica no se hallaba disponible hasta hace relativamente pocos años, por lo que se desarrollaron diversas ecuaciones de predicción de la saturación (siendo las de Kelman, Severinghaus y Siggaard-Andersen, las que ofrecen mejores concordancias con la saturación medida)10–12,16. Para el presente estudio, estas mismas ecuaciones han permitido predecir la saturación que correspondería a una determinada presión de oxígeno y a los otros factores mencionados, tanto en sangre arterial como venosa y en una muestra amplia tanto de pacientes como de extracciones sanguíneas. Nuestros resultados indican que utilizando cualquiera de las principales ecuaciones no existen diferencias relevantes clínicamente entre la saturación medida por cooximetría y las calculadas, desmintiendo contundentemente y en situación clínica real, la hipótesis de una alteración relevante de la afinidad del oxígeno por la hemoglobina, como consecuencia de la infección por SARS-CoV-2. Muy recientemente, un grupo británico también ha sugerido que dicha hipótesis pudiera ser falsa en un pequeño estudio piloto con 14 muestras de gasometría arterial procedentes de pacientes con COVID-1917. En este sentido, sus resultados utilizando una metodología diferente y basada en el cálculo de la P50, son coincidentes con los nuestros. Sin embargo, la situación real respecto de la afinidad del oxígeno por la hemoglobina en estos enfermos sigue siendo debatida18,19. Los presentes resultados mueven también a una reflexión adicional, consistente en recordar el enorme espacio que existe entre las aproximaciones in sílico o in vitro y las circunstancias observables en la clínica humana.
El trabajo in sílico antes mencionado también sugería que otras proteínas virales, como orf1ab, ORF3a y ORF10, desnaturalizarían la estructura de la molécula de hemoglobina liberando el hierro, con lo que los grupos hemo preexistentes pasarían a ser simples porfirinas, sin capacidad de transportar oxígeno6. Esto tendría impacto en el CaO2, ya que este depende predominantemente del gas unido a la hemoglobina, con disminución subsiguiente del aporte a los tejidos5. El presente estudio tampoco sustenta dicha hipótesis, ya que ha permitido comprobar que los valores sanguíneos de hemoglobina en los enfermos con COVID-19 eran incluso algo superiores a los de los grupos control. Sin embargo, algunos trabajos han reportado descensos de la hemoglobina en este tipo de enfermos20–22. En general, dichos estudios no han incluido grupos control con enfermedad grave, en los que las extracciones de sangre y los descensos de hemoglobina son muy frecuentes. Por otra parte, y como en el presente trabajo, otros autores han reportado incrementos en la ferritina sérica en pacientes con COVID-1923, lo que se ha relacionado con un eventual papel de esta molécula para tamponar el hierro liberado por la hemoglobina22. El hierro es esencial para la replicación viral, y quizás por ello numerosos virus son capaces de interferir en la homeostasis de este metal24. Sin embargo, todavía no se conoce si este podría ser también el caso del SARS-CoV-2. Por otra parte, los macrófagos juegan un papel importante en la regulación de la homeostasis del hierro, ya que previenen la liberación de moléculas de hemoglobina por parte de los hematíes25. Sin embargo, un exceso de grupos hemo también puede ayudar a activar el sistema de inmunidad innata, desencadenando la orientación proinflamatoria de los macrófagos26,27, lo que parece ser un desencadenante clave de la tormenta inflamatoria propia de la COVID-1928.
Limitaciones del estudioCiertamente el grupo control de pacientes con PCR negativa para SARS-CoV-2 puede contener algún sujeto con COVID-19, ya que la sensibilidad de esta prueba no es del 100%, y además algunos enfermos podrían estar en una fase con escasa población viral. Esta fue la razón de añadir un segundo grupo control, formado por pacientes cuya estancia hospitalaria fue previa a la observación de casos COVID-19 en nuestro medio.
Por otra parte, es posible que alguna muestra solicitada y consignada como arterial se correspondiera finalmente con una muestra venosa. Aunque dicha posibilidad se minimizó en la medida de lo posible puede haber ocurrido de forma ocasional. No obstante, también en estos casos la similitud entre saturación medida y calculada sería útil para el objetivo del estudio, distorsionando además mínimamente los valores globales de las muestras clasificadas como arteriales o venosas. Por otra parte, debemos reconocer un cierto grado menor de incertidumbre respecto al desplazamiento real de la curva de saturación de la hemoglobina, al no disponer de algunos factores menores que pueden influirla. Sin embargo, los más relevantes sí se han utilizado en las ecuaciones.
Llama la atención que los pacientes con COVID-19 del presente estudio mostraban una hemoglobina algo superior a la de los otros dos grupos, en contra de lo reportado en parte de la literatura (fundamentalmente en pacientes graves o con comorbilidades)1,21–23, y sugerido por uno de los dos artículos que analizan los mecanismos para la desnaturalización de la molécula6, sino al contrario. Esto además motivó que en el primer grupo se evidenciara un contenido de oxígeno en sangre algo superior. Pensamos que el mantenimiento de la cifra de hemoglobina en los pacientes con COVID-19 fue debido a que durante la pandemia se fue muy estricto en minimizar las extracciones de sangre, reduciéndose incluso las puramente asistenciales y tomándose una única muestra para estudios, que se almacenó en el Biobanco. Por otra parte, nuestra serie incluye pacientes con niveles moderados de gravedad.Finalmente, hubiera sido deseable disponer de la determinación de la P50 (PaO2 a la que corresponde una SaO2 del 50%), como complemento de las ya mencionadas ecuaciones de predicción de la SaO2. Sin embargo, las especiales y dramáticas circunstancias de la pandemia por COVID-19 no permitieron dicha aproximación. No obstante, las ecuaciones utilizadas permiten una aproximación suficientemente exacta a la relación entre PaO2 y SaO2165.
En conclusión, el presente estudio demuestra de forma fehaciente, y en situación clínica real, que el virus SARS-CoV-2 no parece afectar de forma relevante la afinidad entre el oxígeno y la molécula de hemoglobina, ni tampoco desnaturalizar el grupo hemo. Por tanto, el uso de la PaO2 para valorar el estado de oxigenación sigue siendo válido también en pacientes con COVID-19.
FinanciaciónFinanciado por una beca no restringida de Boehringer-Ingelheim y por Fundación Catalana de Neumología (FUCAP).
A todo el personal de enfermería y a los médicos que atendieron a los pacientes con COVID-19 en los momentos más duros de la pandemia, colaborando además en la realización de este y otros múltiples estudios.