Recientemente se ha comunicado un exceso de riesgo de bacteriemia en pacientes con hipertensión arterial pulmonar (HAP) que reciben tratamiento con treprostinil intravenoso. Pretendemos evaluar esta asociación en una unidad de referencia española.
Pacientes y métodoEstudio de cohortes retrospectivo con inclusión de 55 pacientes con HAP seguidos en nuestro centro y que recibieron tratamiento mediante perfusión intravenosa continua con un prostanoide (epoprostenol o treprostinil) durante ≥1mes entre enero de 1991 y diciembre de 2011. Analizamos mediante el test de log-rank los factores asociados a la incidencia de bacteriemia.
ResultadosTras un seguimiento total de 64.453 días se documentaron 12 episodios de bacteriemia: Staphylococcus aureus (5 episodios), bacilos gramnegativos (BGN) no fermentadores (4 episodios), otros cocos grampositivos (2 episodios) y Enterobacter cloacae (un episodio). La incidencia de bacteriemia fue de 0,118 episodios por 1.000 días de tratamiento con epoprostenol, frente a 0,938 episodios por 1.000 días de tratamiento con treprostinil (p=0,0037). Todos los casos de bacteriemia por BGN tuvieron lugar en pacientes que recibían treprostinil. En el análisis univariante el tratamiento con treprostinil se asoció a la incidencia de bacteriemia (hazard ratio: 4,09; intervalo de confianza del 95%: 1,24-14,53), si bien el limitado número de eventos impidió la realización de un modelo multivariante.
ConclusionesEl tratamiento con treprostinil intravenoso conlleva un mayor riesgo de bacteriemia, especialmente por BGN no fermentadores. Esta asociación debe ser tenida en cuenta en la elección del tratamiento antibiótico empírico en pacientes con HAP y sepsis.
An excessive risk for bacteremia has recently been reported in patients with pulmonary arterial hypertension (PAH) treated with intravenous treprostinil. We aimed to assess this association in a cohort of patients from a Spanish referral center.
Patients and methodsWe performed a retrospective cohort study that included 55 patients diagnosed with PAH who received a continuous intravenous infusion of a prostanoid (epoprostenol or treprostinil) for ≥1month at our center between January 1991 and December 2011. The risk factors associated with the incidence of bacteremia were analyzed with the log-rank test.
ResultsAfter a total follow-up of 64,453 treatment days, we found 12 episodes of bacteremia: Staphylococcus aureus (5 episodes), non-fermenting gram-negative bacilli (4 episodes), other gram-positive cocci (2 episodes), and Enterobacter cloacae (one episode). The incidence of bacteremia was 0.118 episodes per 1,000 treatment days in patients receiving epoprostenol versus 0.938 episodes per 1,000 treatment-days in patients receiving treprostinil (P=.0037). All episodes of bacteremia due to Gram-negative bacilli were diagnosed in patients on treprostinil. In the univariate analysis the treatment with intravenous treprostinil was associated with the incidence of bacteremia (hazard ratio: 4.09; 95% confidence interval: 1.24-14.53), although the low number of events prevented us from performing a multivariate analysis.
ConclusionsTherapy with intravenous treprostinil is associated with a higher risk for bacteremia, especially due to non-fermenting Gram-negative bacilli. This association should be taken in consideration when choosing empirical antibiotic therapy for patients with PAH and sepsis.
Gracias a sus efectos vasodilatadores, antiagregantes e inhibidores del remodelado de la pared vascular, los análogos sintéticos de la prostaciclina (PGI2) figuran actualmente entre las opciones terapéuticas de primera línea en los pacientes con hipertensión arterial pulmonar (HAP)1. Tanto el epoprostenol (Flolan®) como el treprostinil (Remodulin®), los 2 prostanoides con más amplia experiencia de uso, presentan una reducida vida media (3-5min y 2-4h, respectivamente) que condiciona su posología2. El epoprostenol es un fármaco inestable a temperatura ambiente, por lo que debe ser reconstituido con un diluyente de pH alcalino (10,2-10,8) antes de su administración intravenosa (i.v.) en bomba de perfusión continua a través, habitualmente, de un catéter venoso central (CVC)3. La mayor estabilidad del treprostinil, por su parte, permite que sea administrado mediante perfusión subcutánea (s.c.) continua. Este fármaco se presenta en forma de sal sódica y debe ser diluido antes de su perfusión en agua estéril o suero salino, manteniendo un pH neutro (6,0-7,2)4. En vista de los efectos adversos a nivel local (dolor e inflamación) relacionados con la perfusión s.c. del treprostinil, a partir de 2004 se aprobó su administración i.v. tras comprobar la bioequivalencia entre ambas formulaciones5. En 2007 los Centers for Disease Control (CDC) estadounidenses observaron un aumento inesperado en la notificación de casos de bacteriemia en pacientes que recibían treprostinil i.v., con particular implicación de bacilos gramnegativos (BGN)6. Esta alarma motivó la realización de un estudio retrospectivo en 2 centros de referencia que confirmó que la incidencia de bacteriemia por BGN entre los pacientes con HAP en tratamiento con treprostinil i.v. era significativamente mayor respecto a la de los tratados con epoprostenol (0,81 vs. 0,04 episodios por 1.000 días de tratamiento, respectivamente)7. Entre otras hipótesis, se ha sugerido que este hallazgo pudiera estar parcialmente justificado por diferencias entre los hospitales participantes en las técnicas de mantenimiento del catéter o en la epidemiología local de infección nosocomial6. Por este motivo nos propusimos analizar la incidencia de bacteriemia y de tunelitis en pacientes sometidos a tratamiento i.v. con análogos de la PGI2 en nuestro centro.
Pacientes y métodosRealizamos un estudio de cohortes retrospectivo con inclusión de todos los pacientes en seguimiento por la Unidad Multidisciplinar de HAP del Hospital Universitario 12 de Octubre de Madrid entre enero de 1991 y diciembre de 2011, y que recibieron tratamiento mediante perfusión i.v. continua con un análogo de la PGI2 (epoprostenol o treprostinil) durante al menos un mes. La Unidad Multidisciplinar de HAP de nuestro centro fue la primera de este tipo creada en España y actúa como centro de referencia nacional. Todos los pacientes y sus cuidadores fueron instruidos en el cuidado estéril del catéter y del sistema de perfusión, además de proporcionarles información por escrito al respecto. A través de un formulario estandarizado recogimos las siguientes variables: datos demográficos; comorbilidades; etiología de la HAP; clase funcional; inmunodepresión (infección por el virus de la inmunodeficiencia humana, neoplasia activa, o tratamiento esteroideo sistémico, inmunosupresor o quimioterápico en el mes previo); duración del tratamiento con el prostanoide i.v.; tipo de catéter empleado para su perfusión (CVC semi-implantable tipo Hickman, CVC totalmente implantable [Port-A-Cath], catéter central de inserción periférica [PICC], o vía periférica); número de catéteres insertados; administración concomitante de otros tratamientos para la HAP; desarrollo de bacteriemia o tunelitis durante el seguimiento, y evolución. Definimos «bacteriemia» como la positividad de al menos un hemocultivo (HC) obtenido mediante venopunción periférica o a través del catéter empleado para la perfusión. Para los microorganismos habitualmente saprofitos de la piel (estafilocococos coagulasa-negativa [ECN], difteroides, Bacillus spp.) se exigió la positividad de 2 o más HC acompañada de síntomas o signos de infección. Se consideró «bacteriemia relacionada con catéter» (BRC) aquella en la que el microorganismo aislado en el HC coincidiese con el del cultivo semicuantitativo de la punta del catéter, de la piel peri-inserción, de la conexión o del líquido de perfusión, o bien en presencia de un cuadro de sepsis en un paciente con HC positivo sin foco alternativo de infección. Consideramos como individuales los episodios repetidos de bacteriemia documentados en el mismo paciente con un intervalo superior a 2 semanas. Los episodios polimicrobianos con aislamiento de microorganismos grampositivos y gramnegativos fueron incluidos en el grupo de bacteriemia por BGN. La «tunelitis» fue definida a partir de la presencia de signos inflamatorios locales en el trayecto subcutáneo del catéter, con o sin exudado purulento en el punto de inserción, en ausencia de bacteriemia simultánea.
Las variables cualitativas aparecen descritas con sus frecuencias absolutas y relativas; las variables cuantitativas se ofrecen por su media o mediana±desviación estándar (DE) o rango intercuartílico (Q1-Q3). La densidad de incidencia de bacteriemia y de tunelitis fue calculada por 1.000 días de tratamiento i.v. con cada prostanoide. La comparación entre grupos fue realizada mediante los tests de la χ2, exacto de Fisher, t de Student y U de Mann-Whitney, según procediera, con un nivel de significación fijado en un valor de p<0,05. Debido a que algunos pacientes fueron tratados de forma secuencial con ambos fármacos, a la hora de comparar sus características basales establecimos dos grupos: grupo de epoprostenol (en los que constituyó el único análogo administrado por vía i.v.) y grupo de treprostinil (pacientes que recibieron este fármaco, ya fuera como único análogo por vía i.v., o bien precedido o seguido del tratamiento con epoprostenol). Dividimos el tiempo del estudio en 2 periodos (1991-2005 y 2006-2011). Estimamos la probabilidad acumulada de bacteriemia desde el inicio del tratamiento por el método de Kaplan-Meier y realizamos un análisis univariante mediante el test de log-rank. En los pacientes que recibieron ambos prostanoides de forma secuencial analizamos cada curso de tratamiento de forma individual. Debido al reducido número de eventos no fue posible realizar un análisis multivariante. Empleamos las aplicaciones SPSS versión 13.0 (SPSS Inc., Chicago, IL) y EPIDAT versión 3.1 (Xunta de Galicia/OPS/OMS). Dado que se trataba de un estudio de naturaleza puramente observacional y con recogida de datos retrospectiva a lo largo de un prolongado periodo de tiempo, no se consideró necesaria la evaluación del Comité de Ética e Investigación Clínica de nuestro centro ni se hizo entrega de un consentimiento informado específico a los pacientes.
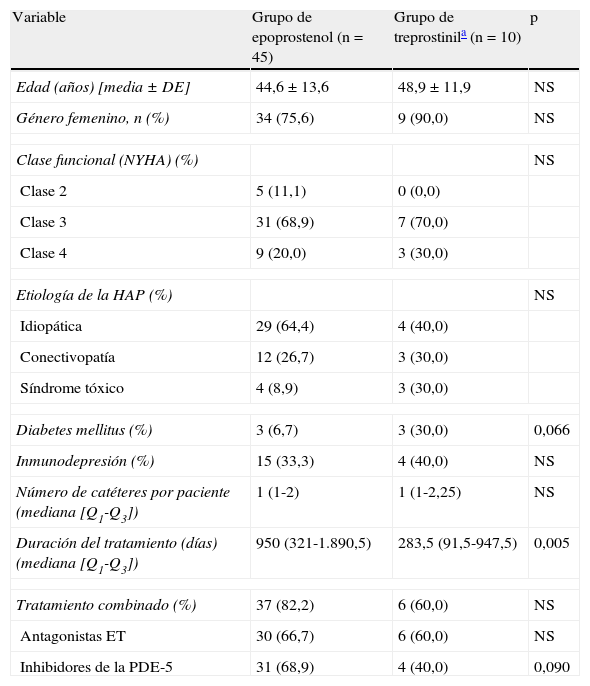
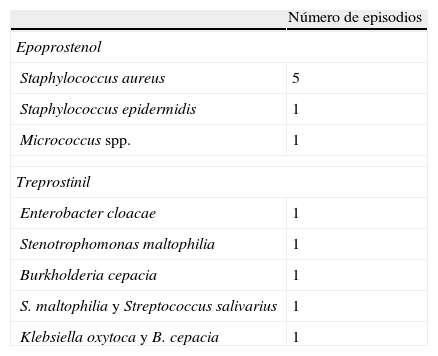
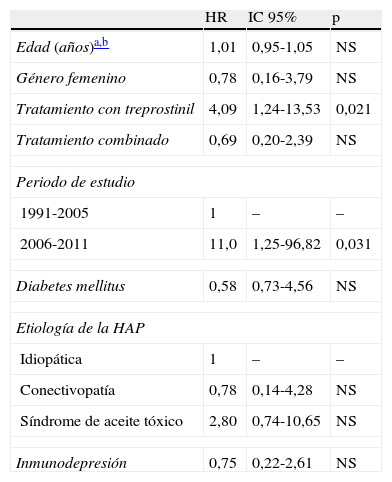
ResultadosFueron incluidos en el estudio 55 pacientes, 45 en el grupo de epoprostenol y 10 en el de treprostinil (2 de los cuales, a su vez, también recibieron epoprostenol), con un seguimiento total de 64.453 días de tratamiento i.v. (59.124 y 5.329 en cada grupo, respectivamente). Al comparar sus características basales (tabla 1) observamos una mayor prevalencia de diabetes mellitus (DM) en el grupo de treprostinil (p=0,066), en tanto que el tratamiento combinado con inhibidores de la fosfodiesterasa 5 fue más frecuente en el grupo de epoprostenol (p=0,090). La duración del tratamiento i.v. con el prostanoide fue mayor en el grupo de epoprostenol (p=0,005). Durante el periodo de seguimiento tuvieron lugar 11 episodios de tunelitis, sin diferencias en su incidencia en función del prostanoide i.v. administrado (0,169 versus 0,187 episodios por cada 1.000 días de tratamiento en los grupos de epoprostenol y de treprostinil, respectivamente; p=1,226). La presencia de DM fue la única variable que demostró estar asociada con el desarrollo de esta complicación en el análisis univariante (odds ratio: 6,29; intervalo de confianza del 95% [IC95%]: 1,05-37,54; p=0,027). Fueron documentados un total de 12 episodios de bacteriemia (incidencia global de 0,18 episodios por 1.000 días de tratamiento): 7 de ellos en pacientes que estaban recibiendo epoprostenol y 5 en pacientes que estaban recibiendo treprostinil. Todos los episodios fueron considerados como BRC (asociados a CVC semiimplantable tipo Hickman en 6 casos, PICC en 5 casos, y vía periférica en un caso). La incidencia de bacteriemia fue de 0,118 episodios por 1.000 días de tratamiento con epoprostenol, frente a 0,938 episodios por cada 1.000 días de tratamiento con treprostinil (p=0,0037). Los microorganismos identificados fueron: Staphylococcus aureus (5 episodios), S. epidermidis, Micrococcus spp., Burkholderia cepacia, Stenotrophomonas maltophilia y Enterobacter cloacae (un episodio cada uno). Los 2 episodios restantes fueron de naturaleza polimicrobiana, con implicación de BGN (Klebsiella oxytoca y B. cepacia, y S. maltophilia y Streptococcus salivarius, respectivamente). Todos los episodios de bacteriemia por BGN fueron diagnosticados en pacientes que estaban recibiendo treprostinil i.v. (tabla 2). Los 2 casos de BRC por B. cepacia se agruparon en el plazo de 2 meses (julio y agosto de 2010), por lo que se planteó una posible relación clonal entre ambos aislamientos, que fue posteriormente descartada mediante una electroforesis en gel de campo pulsado (PFGE). Quince pacientes (27,3%) fallecieron durante el periodo de estudio, sin que ninguna de las muertes estuviera relacionada con bacteriemia. Finalmente, la administración de treprostinil (hazard ratio [HR]: 4,09; IC95%: 1,24-14,53; p=0,021) y el hecho de que el paciente fuera tratado durante el segundo periodo de estudio (HR: 11,0; IC95%: 1,25-96,82; p=0,031) fueron los únicos factores asociados a la incidencia de bacteriemia en el análisis univariante (tabla 3).
Características basales de los 2 grupos de pacientes en función del prostanoide intravenoso
| Variable | Grupo de epoprostenol (n=45) | Grupo de treprostinila (n=10) | p |
| Edad (años) [media±DE] | 44,6±13,6 | 48,9±11,9 | NS |
| Género femenino, n (%) | 34 (75,6) | 9 (90,0) | NS |
| Clase funcional (NYHA) (%) | NS | ||
| Clase 2 | 5 (11,1) | 0 (0,0) | |
| Clase 3 | 31 (68,9) | 7 (70,0) | |
| Clase 4 | 9 (20,0) | 3 (30,0) | |
| Etiología de la HAP (%) | NS | ||
| Idiopática | 29 (64,4) | 4 (40,0) | |
| Conectivopatía | 12 (26,7) | 3 (30,0) | |
| Síndrome tóxico | 4 (8,9) | 3 (30,0) | |
| Diabetes mellitus (%) | 3 (6,7) | 3 (30,0) | 0,066 |
| Inmunodepresión (%) | 15 (33,3) | 4 (40,0) | NS |
| Número de catéteres por paciente (mediana [Q1-Q3]) | 1 (1-2) | 1 (1-2,25) | NS |
| Duración del tratamiento (días) (mediana [Q1-Q3]) | 950 (321-1.890,5) | 283,5 (91,5-947,5) | 0,005 |
| Tratamiento combinado (%) | 37 (82,2) | 6 (60,0) | NS |
| Antagonistas ET | 30 (66,7) | 6 (60,0) | NS |
| Inhibidores de la PDE-5 | 31 (68,9) | 4 (40,0) | 0,090 |
DE: desviación estándar; ET: receptor de la endotelina; HAP: hipertensión arterial pulmonar; NS: no significativo; NYHA: New York Heart Association; PDE-5: fosfodiesterasa 5; Q1-Q3: rango intercuartílico.
Distribución de los microorganismos aislados en los 12 episodios de bacteriemia
| Número de episodios | |
| Epoprostenol | |
| Staphylococcus aureus | 5 |
| Staphylococcus epidermidis | 1 |
| Micrococcus spp. | 1 |
| Treprostinil | |
| Enterobacter cloacae | 1 |
| Stenotrophomonas maltophilia | 1 |
| Burkholderia cepacia | 1 |
| S. maltophilia y Streptococcus salivarius | 1 |
| Klebsiella oxytoca y B. cepacia | 1 |
Análisis univariante (mediante test de log-rank) de los factores asociados a una mayor probabilidad acumulada de bacteriemia (método de Kaplan-Meier) en el curso del tratamiento con prostanoides intravenosos
| HR | IC95% | p | |
| Edad (años)a,b | 1,01 | 0,95-1,05 | NS |
| Género femenino | 0,78 | 0,16-3,79 | NS |
| Tratamiento con treprostinil | 4,09 | 1,24-13,53 | 0,021 |
| Tratamiento combinado | 0,69 | 0,20-2,39 | NS |
| Periodo de estudio | |||
| 1991-2005 | 1 | – | – |
| 2006-2011 | 11,0 | 1,25-96,82 | 0,031 |
| Diabetes mellitus | 0,58 | 0,73-4,56 | NS |
| Etiología de la HAP | |||
| Idiopática | 1 | – | – |
| Conectivopatía | 0,78 | 0,14-4,28 | NS |
| Síndrome de aceite tóxico | 2,80 | 0,74-10,65 | NS |
| Inmunodepresión | 0,75 | 0,22-2,61 | NS |
HAP: hipertensión arterial pulmonar; HR: hazard ratio; IC 95%: intervalo de confianza del 95%; NS: no significativo.
En nuestra experiencia la administración de treprostinil i.v. en pacientes con HAP supuso un factor de riesgo para el desarrollo de BRC, fundamentalmente a expensas de BGN no fermentadores tales como S. maltophilia o B. cepacia. La incidencia de episodios de bacteriemia en este grupo fue similar a la comunicada por los CDC en su informe original (1,11 por 1.000 días de tratamiento)6 y por Kallen et al. en un estudio realizado en 2 hospitales de EE.UU. (1,13 por 1.000 días de tratamiento)7. La reproducción de estos resultados en series procedentes de diversos centros y países hace improbable la influencia de variaciones locales o individuales en la manipulación aséptica del catéter o de los sistemas de perfusión, una de las explicaciones inicialmente sugeridas6. Por otra parte, no demostramos diferencias en la incidencia de tunelitis entre ambos grupos, una complicación que podría estar más directamente relacionada con la cumplimentación por parte del paciente de las medidas de cuidado del CVC. Así, se han de invocar otros factores a la hora de justificar el exceso de riesgo de bacteriemia asociado al treprostinil i.v.
Entre ellos figuran las diferencias en los procesos de reconstitución y conservación de ambos fármacos en el curso de su administración domiciliaria. Los viales de epoprostenol son de un único uso y, una vez reconstituidos, deben almacenarse a baja temperatura (entre 2 y 8°C) durante un máximo de 24h3. Por el contrario, la mayor estabilidad química del treprostinil permite su conservación durante 48h a temperatura ambiente tras ser diluido en agua estéril, así como la utilización de un mismo vial en repetidas perfusiones (siempre que no permanezca abierto durante más de 30 días)4. El propio paciente lleva a cabo la carga del casete de perfusión tras extraer el fármaco del vial, ya sea con una aguja desechable o mediante un adaptador que puede ser empleado para múltiples administraciones. También se ha analizado el impacto del pH del diluyente empleado en cada fármaco8,9. Rich et al. estudiaron prospectivamente la frecuencia de bacteriemia en un grupo de pacientes que recibieron treprostinil i.v. reconstituido con el diluyente básico del epoprostenol en lugar de su diluyente nativo (de pH neutro)8. No observaron diferencias en la incidencia global de bacteriemia entre este grupo y el de los tratados con epoprostenol (0,32 vs. 0,40 episodios por 1.000 días de tratamiento, respectivamente), ni tampoco en la incidencia de bacteriemia por BGN. Por otra parte, el riesgo de bacteriemia en el grupo de intervención fue significativamente menor en comparación con el de una cohorte histórica de pacientes tratados con treprostinil i.v. en su diluyente original (0,90 episodios por 1.000 días de tratamiento)8. Existe además evidencia in vitro de que la actividad microbicida frente a Escherichia coli y Pseudomonas aeruginosa del treprostinil reconstituido con el diluyente del epoprostenol es superior a la observada con el treprostinil reconstituido en suero salino9.
Pseudomonas spp. fue el BGN más frecuente en los casos de bacteriemia en pacientes tratados con treprostinil i.v. en las series de Kallen et al. (13% de los aislamientos)7 y de los CDC (19%)6. Por el contrario, los BGN predominantes en nuestra cohorte fueron S. maltophilia y B. cepacia, identificados cada uno de ellos en 2 de los 5 episodios de bacteriemia en el grupo de treprostinil. Es interesante señalar que, al emplear el treprostinil i.v. con el diluyente básico del epoprostenol en el estudio de Rich et al.8, los cocos grampositivos fueron los microorganismos predominantes (con aislamiento de S. aureus en 3 de 4 episodios), tal y como ocurre en la etiología de la BRC en la población general. La mayor parte de las BRC producidas por el complejo B. cepacia tienen lugar en el contexto de brotes nosocomiales por contaminación de fluidos de administración i.v. o de soluciones antisépticas10. En nuestro caso pudimos descartar el origen común de ambos episodios mediante un análisis de clonalidad por PFGE. S. maltophilia ha sido reconocido como una causa emergente de BRC, particularmente en pacientes oncológicos portadores de un CVC permanente11. La relevancia de estos BGN no fermentadores es notable debido a que su perfil de resistencia obliga al empleo de antibióticos habitualmente no incluidos en las pautas de tratamiento empírico de la BRC. Cotrimoxazol o tigeciclina son activos frente a la mayor parte de las cepas de B. cepacia, en tanto que S. maltophilia acumula numerosos mecanismos de resistencia, entre los que destaca la presencia de 2 β-lactamasas cromosómicas inducibles de las clases A y B (metalo-enzima) que le confieren resistencia de alto nivel a los β-lactámicos11. El cotrimoxazol, en monoterapia o asociado a otro fármaco, es considerado como el tratamiento de primera elección11, y existe experiencia clínica favorable con otros agentes como minociclina, tigeciclina, ticarcilina/ácido clavulánico o quinolonas11,12.
Respecto al grupo de epoprostenol, la incidencia de bacteriemia en nuestro estudio (0,118 episodios por 1.000 días de tratamiento) fue inferior a la descrita por Kallen et al. (0,42 por 1.000 días)7 y Rich et al. (0,40 por 1.000 días)8. Al igual que en esta última, en nuestra serie el microorganismo más comúnmente aislado fue S. aureus (identificado en 5 de los 7 episodios asociados al epoprostenol), en contraste con el predominio de los ECN comunicado por los CDC6. No encontramos ninguna muerte directamente atribuible a la bacteriemia en ninguno de los 2 grupos, frente a la mortalidad del 1,4% del estudio original en EE.UU. (con 2 muertes en el grupo de pacientes que recibían treprostinil i.v.)6.
Nuestro estudio se ve limitado por su tamaño muestral relativamente reducido, si bien ha sido realizado en uno de los centros con experiencia más prolongada en el tratamiento de la HAP a nivel nacional. En particular, el escaso número de eventos (12 episodios de bacteriemia) impidió la identificación, mediante un análisis multivariante, de los factores relacionados de forma independiente con el desarrollo de esta complicación. El periodo de seguimiento de ambos grupos no fue comparable debido a la introducción más reciente de la formulación i.v. del treprostinil en la práctica habitual. En ese sentido, el análisis univariante reveló que los pacientes tratados durante el segundo periodo de estudio (2006-2011) estuvieron expuestos a una mayor incidencia de bacteriemia. Marcos et al. han comunicado recientemente un incremento en la incidencia de BRC por BGN en su institución a lo largo de las últimas décadas (que aumentó de 0,005 a 0,13 episodios por 1.000 días-paciente entre 1991 y 2008)13. Por desgracia, la ausencia de un análisis multivariante impide confirmar si este hallazgo en nuestro estudio obedece realmente a cambios históricos en la epidemiología de la infección asociada al cuidado sanitario, o si es efecto de factores de confusión no considerados. No obstante sus limitaciones, en nuestro conocimiento el presente trabajo es el primero en analizar de forma específica la incidencia y los factores de riesgo de bacteriemia en pacientes con HAP en España y se suma a la limitada literatura existente al respecto, circunscrita hasta el momento a centros estadounidenses6,7.
En conclusión, los pacientes con HAP sometidos a tratamiento con treprostinil i.v. están expuestos a una mayor incidencia de BRC, especialmente por BGN no fermentadores. Esta asociación debe ser tenida en cuenta a la hora de seleccionar su tratamiento empírico, en vista de la elevada mortalidad que conlleva el retraso en el inicio de la antibioterapia eficaz en los episodios de sepsis en pacientes con reserva hemodinámica limitada. Por otra parte, parece razonable ponderar detenidamente la relación beneficio-riesgo del tratamiento con treprostinil por vía i.v., y o bien emplear el fármaco con el diluyente básico del epoprostenol, o bien evitar esta forma de administración en pacientes de edad avanzada, con peor clase funcional o inmunodeprimidos, en los que cabría esperar un peor pronóstico en el curso de una eventual bacteriemia.
FinanciaciónFLM disfruta de una beca de investigación de la Fundación Mutua Madrileña. MFR disfruta de un Contrato de Formación en Investigación Río Hortega (CM11/00187) del Instituto de Salud Carlos III.
Conflicto de interesesLos autores no declaran no tener ningún conflicto de intereses.
Los autores desean reconocer la labor desarrollada por el personal de enfermería de la Unidad Multidisciplinar de Hipertensión Pulmonar (Fernando Romero y Asunción Parra) en la educación sanitaria y el entrenamiento de los pacientes.
Este estudio fue parcialmente presentado en el 51th Annual Interscience Congress on Antimicrobial Agents and Chemotherapy (ICAAC), en Chicago, Illinois (17 al 20 de septiembre de 2011) [póster K-842].