Estudios recientes han constatado variabilidad del fenotipo inflamatorio del asma en el recuento de las células inflamatorias del esputo inducido (EI). El objetivo del presente estudio fue determinar la frecuencia y los factores que condicionan la variabilidad del fenotipo inflamatorio del EI.
MétodosEstudio observacional retrospectivo que incluyó 61 pacientes asmáticos a los que se les practicó un mínimo de dos EI en un período de 5 años. Los pacientes fueron clasificados según su fenotipo inflamatorio y posteriormente agrupados según la variabilidad del fenotipo (eosinofílicos persistentes, no eosinofílicos persistentes y eosinofílicos intermitentes). De todos los casos incluidos se recogieron datos demográficos y clínico-funcionales, así mismo se valoró los factores que pudiesen influir en la variabilidad del EI.
ResultadosDe los 61 pacientes, 31 (50,8%) presentaron un cambio del fenotipo inflamatorio inicial. De estos, 16 (51,6%) eran eosinofílicos, 5 (16,1%) neutrofílicos; 1 (3,2%) mixto y 9 (29,1%) paucigranulocíticos. Según la variabilidad, 18 pacientes (29,5%) se clasificaron como eosinofílicos persistentes, 17 (27,9%) no eosinofílicos persistentes y 26 (42,6%) eosinofílicos intermitentes. El tabaquismo y una exacerbación asmática reciente se asociaron significativamente con mayor riesgo de variabilidad del fenotipo inflamatorio del EI (OR=6,44; p=0,013; IC95%=1,49-27,80 y OR=5,84; p=0,022; IC95%=1,29-26,37, respectivamente).
ConclusiónLa mitad de los pacientes asmáticos modifican el fenotipo inflamatorio del EI, predominando los de fenotipo eosinofílico. Esta variabilidad se asocia al tabaquismo y a una exacerbación asmática reciente. Los datos sugieren que estos factores podrían influir en la determinación del fenotipo inflamatorio del EI en la práctica clínica habitual.
Recent studies have found variability in asthma inflammatory phenotypes determined by the inflammatory cells in induced sputum (IS). The aim of this study was to determine the frequency and factors affecting inflammatory phenotype variability in IS.
MethodsRetrospective observational study that included 61 asthmatic patients who underwent at least two IS tests over a period of 5 years. They were classified according to their baseline inflammatory phenotype and subsequently grouped according to phenotype variability (persistent eosinophilic, persistent non-eosinophilic and intermittent eosinophilic). Demographic, clinical and functional data and factors potentially influencing IS variability were collected in all cases.
ResultsOf the 61 patients, 31 (50.8%) had a change with respect to baseline inflammatory phenotype. Of these, 16 (51.6%) were eosinophilic, 5 (16.1%) neutrophilic, 1 (3.2%) mixed and 9 (29.1%) paucigranulocytic. According to phenotype variability, 18 patients (29.5%) were classified as persistent eosinophilic, 17 (27.9%) non-persistent eosinophilic, and 26 (42.6%) intermittent eosinophilic. Smoking and recent asthma exacerbation were significantly associated with increased risk of variability of the IS inflammatory phenotype (OR=6.44; p=.013; 95% CI=1.49-27.80 and OR=5.84; p=.022; 95% CI=1.29-26.37, respectively).
ConclusionHalf of asthma patients, predominantly those with eosinophilic phenotype, present a change in IS inflammatory phenotype. This variability is associated with smoking and recent asthma exacerbation. Data suggest these factors can modify the classification of IS inflammatory phenotype in clinical practice.
El estudio de la inflamación bronquial en el asma se ha convertido en una herramienta de gran utilidad para la caracterización y seguimiento de los pacientes. El desarrollo de técnicas no invasivas, como el recuento de células inflamatorias en el esputo inducido (EI), se ha revelado como una técnica de utilidad al permitir caracterizar el fenotipo inflamatorio del asma grave e individualizar el tratamiento de cada paciente1,2. En este contexto, la identificación del fenotipo inflamatorio proporcionada por el EI es superior a la obtenida con la determinación de la fracción exhalada del óxido nítrico (FENO)3. Diversas guías de práctica clínica recomiendan su utilización en la valoración clínica de los pacientes con asma grave no controlada1,4.
En el asma se han descrito cuatro fenotipos inflamatorios según la celularidad del EI: eosinofílico, neutrofílico, mixto y paucigranulocítico5. La identificación de estos fenotipos, no es solo una mera cuestión académica, sino que implica aspectos terapéuticos diferenciales. Los pacientes con fenotipos no eosinofílicos, a diferencia de los eosinofílicos, responden menos al tratamiento con glucocorticoides inhalados (GCI)6,7. Se ha sugerido asimismo que los pacientes con fenotipo neutrofílico podrían responder favorablemente a tratamientos prolongados con macrólidos8, y posiblemente a tiotropio9.
No obstante, se ha cuestionado la fiabilidad proporcionada por el recuento de celularidad en el EI, dado que en algunos estudios recientes se han observado cambios en la proporción de las células inflamatorias del EI de un mismo paciente, obtenidos en momentos diferentes. Se ha observado que dicha variabilidad puede aparecer a lo largo del día10, por efecto del tratamiento con GCI11,12, o a lo largo del curso evolutivo de la enfermedad, tanto en adultos13 como en niños14. Sin embargo, en otros estudios no se observó dicha variabilidad6,15. En todo caso, en la actualidad se recomienda efectuar más de una determinación en cada paciente para establecer el correcto fenotipo inflamatorio14,16,17.
Independientemente de la controversia sobre la existencia y frecuencia de dicha variabilidad, se dispone de escasa información sobre los factores relacionados con la misma. Conocer las causas de la variabilidad del recuento de las células inflamatorias en el EI es un hecho de gran trascendencia en la práctica clínica. Por un lado, para conocer las eventuales limitaciones de la técnica del EI en la identificación de los patrones inflamatorios del asma; y por otro, para prevenirlas o evitarlas, en caso de que ello fuera posible. En dicho contexto, los objetivos principales del presente estudio fueron determinar la frecuencia de la variabilidad del fenotipo inflamatorio del asma obtenido en el EI e identificar factores que pudiesen ocasionar dichos cambios.
MétodosDiseñoEstudio observacional retrospectivo, en el que se analizaron los EI de 61 pacientes con asma, bajo tratamiento de mantenimiento, entre 18 y 85 años. Se estableció el diagnóstico de asma, cuando existían síntomas compatibles y limitación variable del flujo aéreo confirmada (prueba broncodilatadora positiva, variabilidad del flujo espiratorio máximo diurno >20% durante 2 semanas, o prueba de provocación bronquial con metacolina positiva), según los criterios de la Guía Española para el Manejo del Asma4. Los datos de este estudio se obtuvieron a partir de la historia clínica de pacientes que acudieron a consultas monográficas de asma del hospital y a los que se les había realizado una determinación de EI por motivos clínicos (disociación clínica-FENO, mal control del asma, y/o sospecha de reflujo gastroesofágico asociado) o bien por formar parte de otro estudio (para conocer el fenotipo inflamatorio). A todos ellos se les habían realizado al menos dos EI en el período comprendido entre los años 2008 y 2013. El diseño del estudio cumplió con los principios de la Declaración de Helsinki (1964) y formó parte de un subanálisis de otro estudio aprobado por el Comité de ética del Hospital (ClinicalTrials.gov: NCT02028637).
ProcedimientosSe recogieron datos demográficos y clínicos, tales como sexo, edad y antecedente de tabaquismo, definido como consumo de tabaco activo o ex fumadores de menos de un año de evolución. La clasificación de gravedad del asma, al igual que la estratificación de las dosis de GCI, se establecieron de acuerdo con las directrices de la Guía Española para el Manejo del Asma (GEMA)4 y la Global INitiative for Asthma (GINA)18. Se utilizó el Asthma Control Test (ACT), cuestionario de autoevaluación validado al español diseñado para valorar el control del asma19. Se definió como exacerbación asmática a cualquier episodio (infeccioso o no) que produjera un cambio en el estado clínico previo del paciente, independientemente de la gravedad del evento, según los criterios de la ATS/ERS20. El cambio en las dosis de glucocorticoides se definió como cualquier modificación en el tratamiento del paciente que implicara el inicio, aumento, suspensión o descenso de la terapia glucocorticoidea inhalada o sistémica. Los datos clínicos y complementarios incluidos se limitaron a aquellos determinados en los tres meses previos a la recogida de la muestra del EI. Así los procedimientos se realizaron de la siguiente forma: el prick test cutáneo a aeroalérgenos comunes, según el procedimiento estándar21. Las mediciones espirométricas se realizaron con un equipo Datospir-600 (Sibelmed SA, Barcelona, España) siguiendo las recomendaciones de la normativa SEPAR 201322,23. La medición de la FENO se realizó con un equipo electroquímico (NO Vario Analyzer. FILT Lungen and Thorax diagnostic GmbH, Berlín, Alemania) a un flujo de 50mL/s, siguiendo las recomendaciones de la ATS/ERS 200524, se consideró una elevación significativa de la FENO cuando los valores resultaron igual o superiores a 50 ppb25. La determinación de la IgE sérica total se realizó mediante ImmunoCAP (Phadia 250). La inducción y el procesado de la muestra de esputo se realizaron según el procedimiento estandarizado descrito por Pizzichini et al.: todos los pacientes fueron premedicados con 200μg de salbutamol inhalado. Tras 10 minutos de broncodilatación, el EI se obtuvo tras la inhalación de un aerosol de solución hipertónica durante 7 minutos por cada concentración (3, 4 y 5%). Las partículas se generaron mediante un nebulizador ultrasónico (Omron NE U07) con un diámetro medio de 7μ y un débito de 3ml/s. Después de cada período de inhalación y por seguridad, se midió el FEV1. Antes de 2 horas, el esputo se procesó seleccionando los tapones de moco tratados con ditiotreitol (Sputolysin, Calbiochem Corp., San Diego, CA, EE. UU.) y solución salina fosfatada. La suspensión celular se filtró y, mediante un hemocitómetro y la tinción de azul de tripano, se calculó el número total de células por gramo de esputo, la viabilidad y el total de células escamosas procedentes de contaminación de las vías respiratorias superiores. Tras citocentrifugar, se obtuvo el preparado celular y el sobrenadante. Esta preparación se utilizó para el recuento diferencial de células, realizando la tinción May-Grünwald-Giemsa26.
Fenotipos inflamatorios del asmaLos fenotipos inflamatorios del EI se clasificaron en 4 grupos, según lo estipulado por estudios previos como los de Simpson et al.5, Fleming et al.14 y Haldar et al.16 en: eosinofílico (eosinófilos >2,5%); neutrofílico (neutrófilos >64%); mixto (eosinófilos >2,5% y neutrófilos >64%); y paucigranulocítico (eosinófilos <2,5% y neutrófilos <64%).
Para definir el tipo de variabilidad del fenotipo inflamatorio del EI entre las dos muestras, se utilizó la clasificación previamente empleada por estudios similares dada la diferencia poblacional entre los cuatro fenotipos iniciales14,27. Así, los pacientes fueron clasificados en tres grupos: eosinofílicos persistentes (eosinófilos >2,5% en ambos EI), no eosinofílicos persistentes (eosinófilos <2,5% en ambos EI), y eosinofílicos intermitentes (eosinófilos >2,5% en alguno de los dos EI). Se compararon las características de los tres grupos para identificar variables asociadas con la presencia o no de variabilidad fenotípica.
Análisis estadísticoLos resultados se expresaron como medias y desviación estándar para las variables continuas con distribución normal. Para las variables continuas que no cumplían con la distribución normal los valores fueron expresados en mediana y rango, y para las variables categóricas se empleó la frecuencia y sus porcentajes. Para comparar los datos demográficos y clínicos entre los tres grupos, se empleó el análisis de la varianza (ANOVA). Se realizó un análisis multivariante mediante regresión logística, para determinar las variables asociadas de forma independiente con la variabilidad del fenotipo inflamatorio en el segundo esputo. En el mismo se incluyeron las variables con diferencias estadísticamente significativas entre los tres grupos de pacientes. Los resultados se consideraron significativos cuando se obtuvo p<0,05. No se realizó ninguna imputación en los datos perdidos dentro de las variables estudiadas. Todos los análisis se llevaron a cabo empleando SPSS (V.18) y GraphPad Prism. V5.
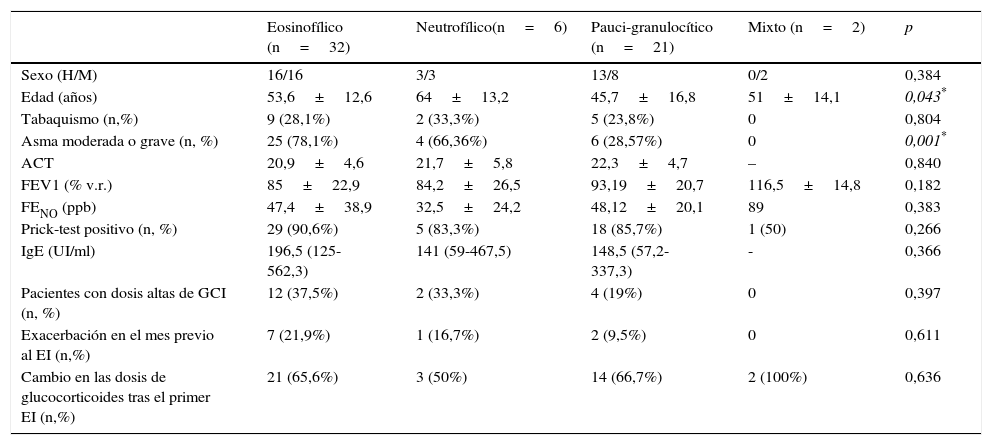
ResultadosDe los 61 pacientes incluidos, 32 (52,5%) eran hombres, con una media de edad de 51,8 años. Los datos demográficos y clínicos de la población incluida según los fenotipos inflamatorios iniciales se recogen en la tabla 1.
Características demográficas y clínicas según el fenotipo inflamatorio inicial
| Eosinofílico (n=32) | Neutrofílico(n=6) | Pauci-granulocítico (n=21) | Mixto (n=2) | p | |
|---|---|---|---|---|---|
| Sexo (H/M) | 16/16 | 3/3 | 13/8 | 0/2 | 0,384 |
| Edad (años) | 53,6±12,6 | 64±13,2 | 45,7±16,8 | 51±14,1 | 0,043* |
| Tabaquismo (n,%) | 9 (28,1%) | 2 (33,3%) | 5 (23,8%) | 0 | 0,804 |
| Asma moderada o grave (n, %) | 25 (78,1%) | 4 (66,36%) | 6 (28,57%) | 0 | 0,001* |
| ACT | 20,9±4,6 | 21,7±5,8 | 22,3±4,7 | – | 0,840 |
| FEV1 (% v.r.) | 85±22,9 | 84,2±26,5 | 93,19±20,7 | 116,5±14,8 | 0,182 |
| FENO (ppb) | 47,4±38,9 | 32,5±24,2 | 48,12±20,1 | 89 | 0,383 |
| Prick-test positivo (n, %) | 29 (90,6%) | 5 (83,3%) | 18 (85,7%) | 1 (50) | 0,266 |
| IgE (UI/ml) | 196,5 (125-562,3) | 141 (59-467,5) | 148,5 (57,2-337,3) | - | 0,366 |
| Pacientes con dosis altas de GCI (n, %) | 12 (37,5%) | 2 (33,3%) | 4 (19%) | 0 | 0,397 |
| Exacerbación en el mes previo al EI (n,%) | 7 (21,9%) | 1 (16,7%) | 2 (9,5%) | 0 | 0,611 |
| Cambio en las dosis de glucocorticoides tras el primer EI (n,%) | 21 (65,6%) | 3 (50%) | 14 (66,7%) | 2 (100%) | 0,636 |
Valores expresados como media±desviación estándar, mediana (rango) o en porcentaje, como se indica.
ACT: asthma control test; EI: esputo inducido; FENO: fracción espirada de óxido nítrico; FEV1: volumen espiratorio forzado en el primer segundo; GCI: glucocorticoide inhalado; IgE: inmunoglobulina E; v.r.: valor de referencia.
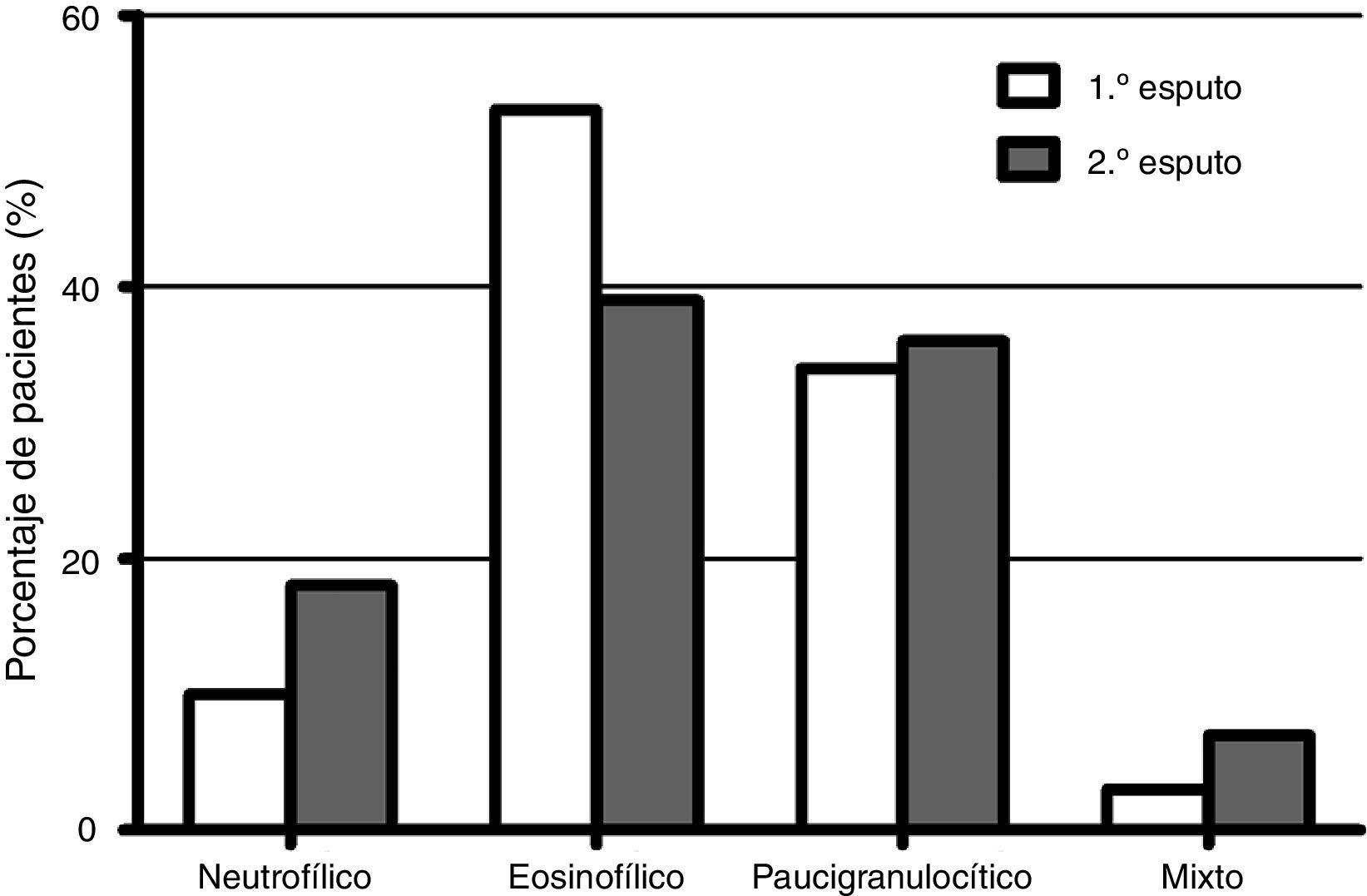
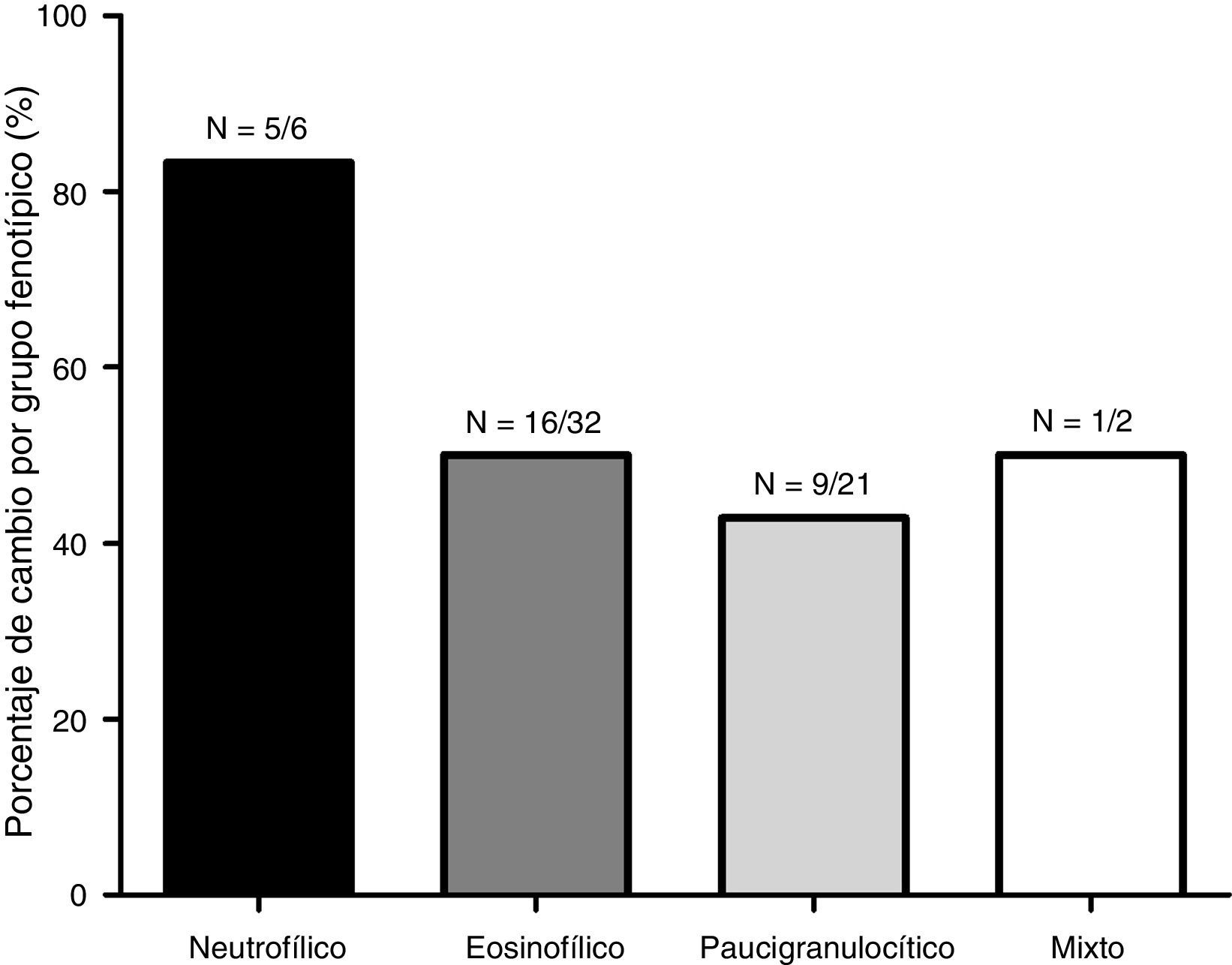
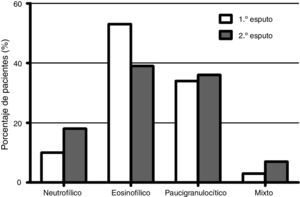
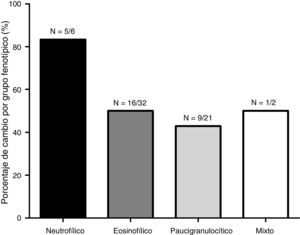
En la figura 1 se representa la distribución de los fenotipos inflamatorios observados en el primer y segundo esputo inducido, observando un predominio del fenotipo eosinofílico en ambos recuentos celulares (52,5 y 39,3% respectivamente). Treinta y un pacientes presentaron un cambio fenotípico en el segundo EI. En la figura 2 se observa el porcentaje de pacientes que cambian de fenotipo inflamatorio dentro de cada grupo fenotípico inicial.
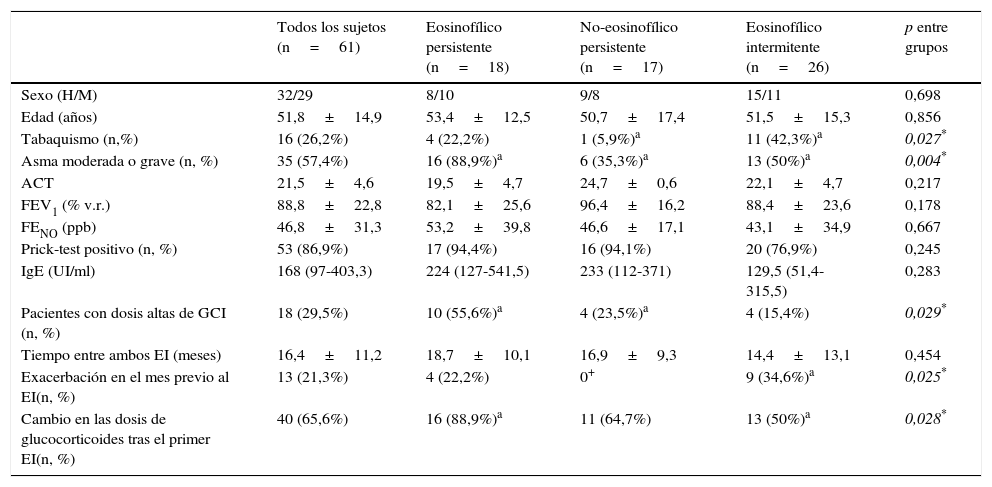
El análisis de la variabilidad del fenotipo inflamatorio entre ambos EI mostró que 18 pacientes (29,5%) eran eosinofílicos persistentes, 17 (27,9%) no eosinofílicos persistentes y 26 (42,6%) eosinofílicos intermitentes. Las características demográficas y clínicas de los enfermos de estos tres grupos se resumen en la tabla 2. Se observó: una significativa mayor tasa de tabaquismo y exacerbaciones en el mes previo en el grupo eosinofílico intermitente; y una significativa mayor proporción de pacientes con asma moderada-grave, que recibían dosis elevadas de GCI y a los que se les cambió las dosis de glucocorticoides tras el primer esputo, en el eosinofílico persistente.
Características demográficas y clínicas según la variabilidad del fenotipo inflamatorio final
| Todos los sujetos (n=61) | Eosinofílico persistente (n=18) | No-eosinofílico persistente (n=17) | Eosinofílico intermitente (n=26) | p entre grupos | |
|---|---|---|---|---|---|
| Sexo (H/M) | 32/29 | 8/10 | 9/8 | 15/11 | 0,698 |
| Edad (años) | 51,8±14,9 | 53,4±12,5 | 50,7±17,4 | 51,5±15,3 | 0,856 |
| Tabaquismo (n,%) | 16 (26,2%) | 4 (22,2%) | 1 (5,9%)a | 11 (42,3%)a | 0,027* |
| Asma moderada o grave (n, %) | 35 (57,4%) | 16 (88,9%)a | 6 (35,3%)a | 13 (50%)a | 0,004* |
| ACT | 21,5±4,6 | 19,5±4,7 | 24,7±0,6 | 22,1±4,7 | 0,217 |
| FEV1 (% v.r.) | 88,8±22,8 | 82,1±25,6 | 96,4±16,2 | 88,4±23,6 | 0,178 |
| FENO (ppb) | 46,8±31,3 | 53,2±39,8 | 46,6±17,1 | 43,1±34,9 | 0,667 |
| Prick-test positivo (n, %) | 53 (86,9%) | 17 (94,4%) | 16 (94,1%) | 20 (76,9%) | 0,245 |
| IgE (UI/ml) | 168 (97-403,3) | 224 (127-541,5) | 233 (112-371) | 129,5 (51,4-315,5) | 0,283 |
| Pacientes con dosis altas de GCI (n, %) | 18 (29,5%) | 10 (55,6%)a | 4 (23,5%)a | 4 (15,4%) | 0,029* |
| Tiempo entre ambos EI (meses) | 16,4±11,2 | 18,7±10,1 | 16,9±9,3 | 14,4±13,1 | 0,454 |
| Exacerbación en el mes previo al EI(n, %) | 13 (21,3%) | 4 (22,2%) | 0+ | 9 (34,6%)a | 0,025* |
| Cambio en las dosis de glucocorticoides tras el primer EI(n, %) | 40 (65,6%) | 16 (88,9%)a | 11 (64,7%) | 13 (50%)a | 0,028* |
Valores expresados como media±desviación estándar, mediana (rango) o en porcentaje, como se indica.
ACT: asthma control test; EI: esputo inducido; FENO: fracción espirada de óxido nítrico; FEV1: volumen espiratorio forzado en el primer segundo; GCI: glucocorticoide inhalado; IgE: inmunoglobulina E; v.r.: Valor de referencia.
El análisis de regresión logística utilizado para identificar las causas que se asociaron de forma independiente a la variabilidad en el EI, se refleja en la tabla 3, y mostró que presentar una exacerbación asmática en el mes previo al segundo EI (OR=5,84; p=0,022; IC95%=1,29-26,37) y el tabaquismo (OR=6,44; p=0,013; IC95%=1,49-27,80), se asociaron de forma significativa a un mayor riesgo de cambio fenotípico, mientras que los cambios en la dosis de glucocorticoides entre ambas determinaciones fueron un factor protector frente a la variabilidad (OR=0,27; p=0,037; IC95%=0,076-0,923). El asma moderada/grave (OR=0,09; p=0,787; IC95%=0,170-3,824) y las dosis altas de GCI recibidos (OR=0,50; p=0,118; IC95%=0,211-1,191) no se asociaron a la variabilidad del fenotipo inflamatorio inicial.
Análisis multivariante de las características demográficas y clínicas relacionadas con la variabilidad del fenotipo inflamatorio del EI
| OR | IC (95%) | P | |
|---|---|---|---|
| Tabaquismo | 6,44 | 1,49-27,80 | 0,013* |
| Asma moderada o grave | 0,09 | 0,17-3,82 | 0,787 |
| Pacientes con altas dosis de GCI | 0,50 | 0,21-1,19 | 0,118 |
| Exacerbación en el mes previo al EI | 5,84 | 1,29-26,37 | 0,022* |
| Cambio en las dosis de glucocorticoides tras el primer EI | 0,27 | 0,08-0,92 | 0,037* |
EI: esputo inducido; GCI: glucocorticoide inhalado.
La principal aportación del presente estudio es la constatación de que el tabaquismo y una exacerbación asmática reciente constituyen factores de riesgo independientes para modificar el fenotipo inflamatorio del EI en los pacientes con asma. Asimismo, se confirma en nuestra serie que hasta la mitad de los casos experimentan una variación del fenotipo inflamatorio, siendo el fenotipo eosinofílico el que presenta esta variabilidad con mayor frecuencia.
La evidencia actual sobre la estabilidad del fenotipo inflamatorio de los pacientes asmáticos proporciona resultados contradictorios y se basa en escasos estudios. Dos estudios realizados en adultos asmáticos describieron una estabilidad en el recuento celular del EI entre dos determinaciones en un plazo de hasta 5 años6,15. Sin embargo, otros estudios realizados en adultos13,28, a los que se les efectuaron determinaciones reiteradas del recuento celular del EI durante un año (mensualmente en pacientes con asma grave y cada 3 meses en asma moderada) y durante las exacerbaciones28, constataron variabilidad en el número de eosinófilos y neutrófilos del EI, siendo mayor en el asma moderada y grave; y solo un tercio de la muestra no presentó variabilidad13. De la misma manera, un estudio reciente comparó los fenotipos de pacientes categorizados por variables fisiológicas o biomarcadores como el EI a los largo de un año, evidenciando una mayor variabilidad en aquellos caracterizados por el EI, sobre todo en formas más graves de la enfermedad29; en cambio, otro estudio realizado en niños, con diferentes grados de control del asma, evidenció que la variación del fenotipo inflamatorio aparecía independientemente del nivel de gravedad del asma14. Todo esto apunta a que realizar determinaciones repetidas del EI puede ayudar a caracterizar mejor el asma en cada individuo a lo largo de la evolución de su enfermedad29, pero dada la complejidad de la enfermedad es posible que en un futuro sea necesario definir también a los pacientes por un «endotipo» además de los ya conocidos fenotipos clínicos e inflamatorios empleados en la actualidad30.
En nuestro estudio se observó que la mitad de los pacientes incluidos presentaron una variación en el fenotipo inflamatorio inicial, de los que algo más de la mitad eran eosinofílicos. Esta variabilidad no mostró relación con el sexo, la edad, el antecedente de atopia, el nivel de control del asma, los niveles de IgE sérica, la FENO o los valores de función pulmonar. Estos resultados son diferentes a los del estudio de Schleich et al31, que incluyó 508 pacientes asmáticos y evidenció que un recuento elevado de eosinófilos en sangre, altos niveles de FENO e IgE, y peores valores espirométricos constituían factores predictores de eosinofilia en el EI.
Diversos factores como el tabaquismo, la obesidad, los cambios hormonales, las infecciones respiratorias, entre otros, tienen relación con el recuento de células inflamatorias en el EI de los pacientes asmáticos2. En el presente trabajo se observó una proporción significativamente mayor de tabaquismo en el grupo de pacientes con eosinofilia intermitente, probablemente debido a que la mayoría de estos presentaban un fenotipo eosinofílico inicial, y a que el fumar fue identificado como un factor de riesgo para el cambio del fenotipo inflamatorio al realizar el análisis estadístico mediante una regresión logística. Es interesante destacar que además el tabaquismo se asocia a formas de asma más graves, con una mayor proporción de inflamación neutrofílica y estrés oxidativo32,33.
Estudios previos han demostrado que en adultos asmáticos las infecciones virales pueden desencadenar asma o exacerbar la enfermedad34,35. La inflamación neutrofílica a nivel bronquial producida por estas infecciones se ve reflejada en la celularidad del EI, lo cual puede ser un factor de confusión en la interpretación del EI. En el estudio realizado por Wark et al34, se realizó una determinación de EI a pacientes con exacerbación asmática infecciosa (viral) y no infecciosa; en el primer grupo se observó un predominio neutrofílico, mientras que en el segundo fue eosinofílico. En nuestro estudio, los pacientes que presentaron una exacerbación asmática durante el mes previo a la segunda visita del EI, tuvieron una mayor variabilidad en el recuento de eosinófilos y neutrófilos, constituyendo un factor de riesgo para presentar variabilidad del fenotipo inflamatorio. Este resultado otorga argumentos sólidos para desaconsejar realizar el recuento de células inflamatorias en el EI en pacientes con exacerbación reciente.
Se ha observado una correlación positiva entre la reducción del número de eosinófilos en el EI y la mejoría del FEV1, tras 48 horas del inicio del tratamiento con GCI36. Por ello, se ha sugerido que la monitorización del número de eosinófilos en el EI podría ser útil para identificar la dosis mínima de GCI necesaria para conseguir el control de la inflamación bronquial37. En nuestro estudio, los pacientes a los que se les realizó algún cambio de la dosis de glucocorticoides recibidos, presentaron menor variabilidad del fenotipo inflamatorio inicial. Este hallazgo contradictorio puede deberse en parte a la presencia de un número considerable de pacientes con asma no eosinofílica persistente (27,9%) que tienen una respuesta inferior al tratamiento convencional para el asma, en comparación con los pacientes con fenotipos eosinofílicos38.
Es un hecho bien establecido que el tratamiento con glucocorticoides ocasiona un descenso del recuento de eosinófilos en el EI39,40. En el presente estudio, el grupo de pacientes con eosinofilia persistente presentó mayor gravedad del asma y como es lógico, dosis mayores de GCI. Sin embargo, estos dos factores no se asociaron a un mayor riesgo de variabilidad del fenotipo inflamatorio. Este hallazgo pone de manifiesto la existencia de un grupo de pacientes con fenotipo inflamatorio eosinofílico en el EI que no responde al tratamiento con GCI y que cursa con una presentación más grave del asma.
Nuestro estudio presenta limitaciones por ser de carácter retrospectivo como: el sesgo de selección de pacientes (dependiendo esta de la presencia de una segunda determinación de EI), el tiempo transcurrido entre ambas muestras recogidas (no fue el mismo para todos los pacientes), la ausencia de algunos datos clínicos como la adhesión terapéutica, las pautas de glucocorticoides sistémicos recibidas, el tiempo de duración del tabaquismo y la dosis acumulada de paquetes/año en cada individuo, así como la información de variables secundarias como el ACT, FENO y niveles de IgE en algunos casos. Sin embargo, estas limitaciones no influyeron en los resultados principales del estudio, el cual ha proporcionado potencia suficiente para identificar a dos factores asociados a la variabilidad del recuento celular del EI. Por otro lado, y a su favor, el tamaño muestral ha sido mayor en comparación con otros estudios similares, y el amplio análisis realizado incluyó múltiples variables clínicas del asma que permitió una completa caracterización clínica de los pacientes. Asimismo, la inducción del EI, su procesado y posterior análisis se llevaron a cabo bajo un protocolo sistematizado, siempre por el mismo personal técnico con amplia experiencia y siguiendo un riguroso control de calidad. Todo ello contribuyó a aminorar la potencial variabilidad interobservador en los recuentos celulares, en la recogida y procesado de las muestras.
ConclusionesEn resumen, los resultados del presente trabajo confirman que existe una elevada proporción de pacientes con asma en los que su fenotipo inflamatorio, establecido mediante el recuento de células inflamatorias en el EI, varía en determinaciones seriadas. La constatación de que el tabaquismo y las exacerbaciones asmáticas recientes contribuyen a dicha variabilidad, aporta nueva y relevante información relacionada con este fenómeno. Los datos sugieren que la circunstancia de haber padecido una exacerbación reciente de la enfermedad debería figurar entre los motivos de exclusión para la realización de la técnica del EI. A nuestro juicio, estos resultados no cuestionan la utilidad del EI en la evaluación del paciente asmático, sino que delimitan su indicación en el ámbito clínico y permiten excluir a algunos pacientes en los que se debería posponer la técnica.
Conflicto de interesesLos autores no presentan conflicto de intereses en relación con lo expuesto en este artículo.