Evaluación clínica frente a evaluación funcional en la EPOC
La enfermedad pulmonar obstructiva crónica (EPOC) es una de las causas de mortalidad más importantes en Occidente y se prevé que ocupe el tercer lugar a escala mundial hacia el año 20201. Sin embargo, sigue siendo una enfermedad infradiagnosticada y ello probablemente se deba al escaso uso de la espirometría como método de exploración complementaria entre los médicos generalistas y al hecho de que los pacientes consultan en etapas relativamente avanzadas de la enfermedad2. El retraso en su diagnóstico hace que los pacientes que la presentan tengan un riesgo aumentado de morbilidad y mortalidad. La EPOC es fácilmente diagnosticable incluso en fases preclínicas realizando espirometría a personas fumadoras. Su presencia debe considerarse en todo paciente que presenta síntomas respiratorios crónicos (tos, expectoración, disnea), especialmente si ha sido o es fumador. En este contexto, la sospecha diagnóstica de EPOC se confirma con la demostración de la existencia de obstrucción al flujo aéreo mediante espirometría. Una relación volumen espiratorio forzado en el primer segundo (FEV1)/capacidad vital forzada inferior a 0,7 indica la presencia de limitación al flujo aéreo y la descripción del FEV1 en términos de su valor previsto (FEV1% pred.) establece la gravedad de la enfermedad de acuerdo con diferentes cortes. El factor de confusión surge cuando el paciente presenta unas características clínicas en términos de síntomas, capacidad de ejercicio y calidad de vida que no "concuerdan" con el grado de obstrucción evaluado por la espirometría. A pesar de estas limitaciones, las actuales guías de diagnóstico y tratamiento siguen clasificando la gravedad de la enfermedad en función únicamente del FEV1 (tabla I) y plantean un tratamiento homogéneo según la gravedad funcional aunque el pronóstico y la percepción de la enfermedad sean diferentes en los pacientes3,4. Estas discrepancias entre el deterioro funcional y la realidad del estado clínico han inducido tradicionalmente al médico a dejarse llevar por su propio criterio más que por el seguimiento de guías de consenso (basadas en el grado de deterioro funcional) al manejar el día a día de los pacientes con EPOC.
Valor y limitaciones del FEV1
La razón principal para que el FEV1 siga siendo la variable más importante a evaluar en todo paciente con EPOC es que su deterioro en el tiempo muestra una relación directa con la mortalidad5. Recientemente se han revaluado los datos de supervivencia del estudio epidemiológico americano sobre salud y nutrición que incluye a una cohorte de 5.542 personas seleccionadas de la población general6. Tras 22 años de seguimiento, se volvió a demostrar que los sujetos que padecían EPOC presentan una supervivencia inversamente relacionada con el valor del FEV1 que tenían al entrar en el estudio.
Un hallazgo interesante del estudio americano arriba mencionado fue encontrar personas con un FEV1 por debajo de la normalidad, sin EPOC, que mostraron una supervivencia acortada; esto concuerda con el hecho conocido de que un grado similar de obstrucción al flujo aéreo en el asma y en la EPOC es más letal en estos últimos que en los primeros. Esto demuestra una cierta debilidad del FEV1 como marcador de mortalidad entre diferentes poblaciones. Siendo la medición del FEV1 imprescindible para el diagnóstico de la EPOC, paradójicamente este parámetro se relaciona de forma débil con otras consecuencias esenciales de la enfermedad como es la disnea y la percepción del estado de salud7,8. Cuando se ha querido utilizar el FEV1 como variable "respuesta" al efecto terapéutico de una determinada intervención médica, este parámetro se ha demostrado insensible al efecto del tratamiento, mientras que paralelamente se mejoraban otras variables o outcomes como la disnea, la calidad de vida o la utilización de recursos sanitarios9,10. Se hace por tanto necesario disponer de variables alternativas al FEV1, ya sean clínicas, biológicas o funcionales, para monitorizar la evolución de la enfermedad y medir la respuesta al tratamiento11-13.
Otras variables determinantes de la historia natural de la EPOC
Capacidad de difusión del monóxido de carbono (DLCO)
La reducción de la DLCO en un paciente con EPOC se considera un hallazgo que se relaciona con el grado de enfisema, por otra parte presente en todos los pacientes. Aunque la DLCO ha mostrado cierta relación inversa con la mortalidad en pacientes con EPOC grave que reciben oxigenoterapia14, esta relación se difumina cuando se incluyen en el modelo predictivo la edad y el FEV115. Desde la década de los años ochenta no se han obtenido datos adicionales sobre el valor de la DLCO como predictor de mortalidad.
Gases arteriales
La hipoxemia y la hipercapnia se consideran factores de riesgo de mortalidad y su tratamiento implica una mejoría en este exceso de mortalidad. La información que sustenta esta afirmación procede de estudios antiguos, realizados en una época con pocos recursos terapéuticos, y por tanto su valor clínico como instrumento predictor del pronóstico de la EPOC en el momento actual es desconocido16,17.
Volúmenes pulmonares
A medida que la destrucción del parénquima pulmonar progresa, la capacidad de retracción elástica del pulmón se reduce; con ello, el aire contenido en los espacios aéreos distales aumenta al final de la espiración (aumento de la capacidad residual funcional) y aparece la llamada "hiperinsuflación pulmonar". Estas zonas pulmonares afectadas de enfisema pulmonar necesitan un mayor tiempo de espiración para vaciarse que otras zonas pulmonares menos afectadas de enfisema pulmonar. Cuando el paciente aumenta su frecuencia respiratoria, el tiempo de espiración se reduce y entonces el aire contenido en zonas pulmonares con menor retracción elástica no tiene suficiente tiempo para salir de ellas y queda "atrapado". El resultado es un incremento de la hiperinsuflación "dinámica" (HD), que además altera la mecánica respiratoria aplanando todavía más los diafragmas.
Hiperinsuflación dinámica, ejercicio y disnea
La respuesta ventilatoria durante la actividad física difiere en personas sanas y en pacientes con EPOC. En personas sanas, el ejercicio progresivo induce un aumento paralelo de la ventilación minuto que se consigue principalmente a expensas del volumen corriente, sin apenas cambios en la frecuencia respiratoria. A niveles muy altos de ejercicio, la frecuencia respiratoria aumenta ligeramente, pero también se reduce la capacidad residual funcional debido al reclutamiento de músculos espiratorios. De esta forma el resultado final es un aumento de la capacidad inspiratoria (IC) y, consiguientemente, de la superficie de intercambio gaseoso pulmonar. En el caso de pacientes con EPOC, el ejercicio y consiguiente aumento de la ventilación minuto se acompaña de un escaso cambio en el volumen corriente ya que la capacidad residual funcional ya está elevada, y, dado que la capacidad pulmonar total (TLC) no cambia durante el esfuerzo, los incrementos de volumen corriente se acompañan en esta situación de una sobrecarga desproporcionada de los músculos inspiratorios y del trabajo respiratorio. Para obtener un aumento de la ventilación, los pacientes con EPOC deben por tanto aumentar su frecuencia respiratoria, pero este mecanismo tiene el inconveniente de reducir el tiempo espiratorio y, como consecuencia, aumenta el atrapamiento aéreo y la HD18,19. La importancia de la HD en la génesis de la disnea de esfuerzo viene subrayada por la buena correlación encontrada entre la disminución de la disnea tras la cirugía de reducción de volumen o tras la administración de broncodilatadores y la reducción de la HD inducida por el esfuerzo producido por estas 2 intervenciones20,21.
En pacientes con EPOC, nuestro grupo demostró que, al igual que durante las pruebas de esfuerzo máximas se induce HD con un grado alto de ejercicio, durante actividades de la vida diaria que requieren un tipo de esfuerzo menor, como pasear, también se desarrolla HD18. Utilizando una prueba de la marcha de 6 min (PM6M) y midiendo la IC y el grado de disnea antes y al final de la prueba en una gran serie de pacientes con EPOC de gravedad muy amplia, pudimos observar los siguientes resultados:
1. La capacidad de ejercicio (metros recorridos en los 6 min) se relacionaba de forma directa con el FEV1 y la DLCO e inversamente con parámetros de atrapamiento como el volumen residual en relación con la TLC. Ningún otro parámetro de función pulmonar o gases arteriales se relacionó con la capacidad de ejercicio.
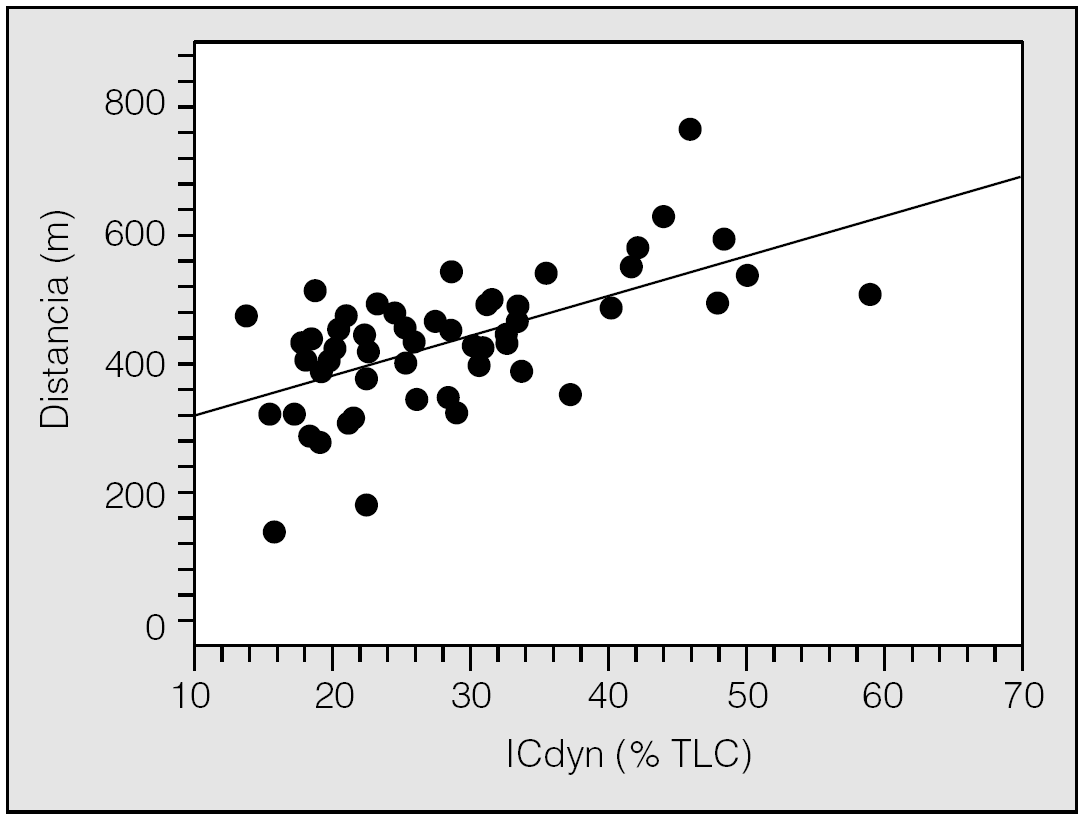
2. La IC al final de los 6 min de marcha se redujo una media del 5% del valor de la TLC. El valor de la IC al final de la PM6M (IC dinámica) se relacionó positivamente con los metros andados (fig. 1). Es decir, cuanto menor es la HD secundaria al esfuerzo, mayor es la capacidad de ejercicio.
Fig. 1. Relación estrecha y directa (p < 0,01) entre el valor de la capacidad inspiratoria (IC) alcanzado al final de la prueba de la marcha de 6 min, expresado como porcentaje de la IC en relación con la capacidad pulmonar total ICdyn (% TLC) y la capacidad de ejercicio indicada como metros de distancia recorridos. (Modificada de Marín et al18.)
3. La sensación de disnea al final del esfuerzo se relacionó de forma inversa con el cambio negativo de la IC al final del ejercicio; es decir, cuanto mayor es la HD, mayor disnea se induce.
4. La reducción de la IC registrada al final de la PM6M, es decir, el aumento de la hiperinsuflación pulmonar, se relacionó de forma muy estrecha con el grado de disnea que los pacientes perciben al realizar esfuerzos en su vida habitual.
En definitiva, no sólo durante una prueba de esfuerzo máxima realizada en el laboratorio de función pulmonar se identifica la HD como un fenómeno limitante del ejercicio, sino que también se desarrolla HD durante actividades de la vida diaria menos estresantes como caminar o vestirse. Este mecanismo claramente explica lo que sucede en la vida real, como es la disnea y cese de la actividad física inducidos por el esfuerzo y el ulterior alivio y reanudación de la actividad tras el reposo.
Valor pronóstico de la capacidad inspiratoria
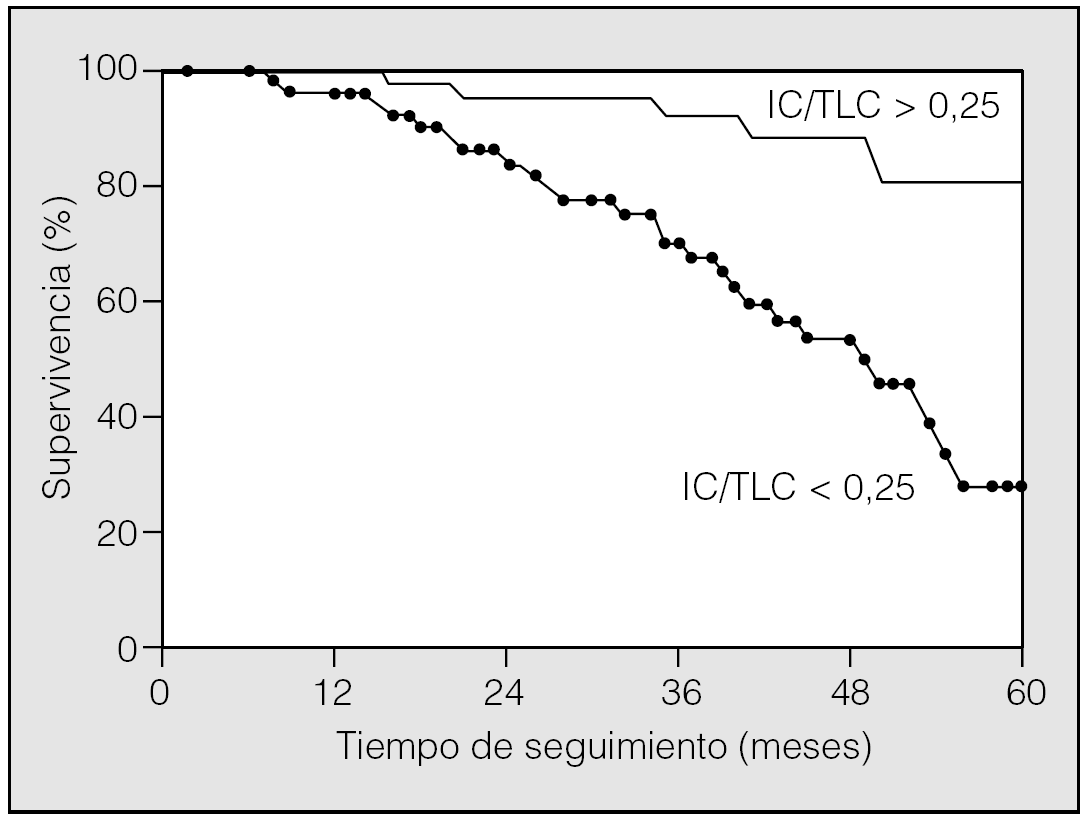
Un aspecto novedoso que reafirma el valor de la determinación de la IC en la práctica clínica es su relación inversa con la mortalidad. En pacientes con EPOC grave, un análisis factorial sobre los determinantes de mortalidad indicó que el incremento de volúmenes estáticos se asociaba con exceso de mortalidad22. Casanova et al23 han hipotetizado recientemente que, puesto que existe una relación estrecha entre la IC y la capacidad de ejercicio, la HD estimada como la relación entre la IC y la capacidad pulmonar total (IC/TLC) podría ser un predictor de la historia natural de la enfermedad. Estudiaron a una cohorte de 689 pacientes con EPOC durante más de 5 años y estudiaron otros factores de riesgo potenciales, tales como el FEV1, la capacidad de ejercicio o el grado de disnea. Un 27% de los pacientes fallecieron durante el seguimiento; este subgrupo resultó tener una edad mayor, menor índice de masa corporal, menor ejercicio en la PM6M, más disnea y mayor relación IC/TLC. Tras realizar un análisis de regresión logística, el índice IC/TLC resultó un buen factor de mortalidad independiente de otras variables estudiadas. Entre los diferentes valores de IC/TLC, el inferior a 0,25 mostró el mejor perfil en las diferentes curvas de eficacia diagnóstica estudiadas (fig. 2). Así pues, la evaluación simple mediante la IC de la HD aporta una información relevante en pacientes con EPOC y debería evaluarse al menos en el ámbito de la enfermedad manejada por especialistas.
Fig. 2. Curvas de supervivencia de pacientes con EPOC separados por el grado de atrapamiento aéreo expresado como capacidad inspiratoria/capacidad pulmonar total (IC/TLC). (Modificada de Casanova et al23.)
Evaluación integral de la EPOC como enfermedad pulmonar y sistémica
La EPOC se asocia a un amplio espectro de manifestaciones clínicas, tanto locales (respiratorias) como sistémicas, que no se relacionan necesariamente con el grado de obstrucción y, por tanto, clasificando la gravedad de la enfermedad únicamente en función del FEV1 estamos limitando nuestra capacidad de entender realmente lo que sucede en un determinado paciente. El Prof. Celli tiene el mérito de haber considerado la EPOC una entidad clínica con afectación multidimensional y lidera un grupo internacional de investigadores que valida actualmente una herramienta de medida (BODE) que incorpora la función pulmonar (FEV1), los síntomas (disnea), la capacidad de ejercicio (prueba de marcha) y el estado nutricional (índice de masa corporal)12. Con estos elementos, la idea que subyace es considerar la EPOC una entidad clínica en la que, a semejanza de las neoplasias sólidas, existiría 3 grados de afectación: a) la extensión local del tumor (T); b) la extensión regional (N), y c) la extensión extratorácica o sistémica (M). En el caso de la EPOC, el primer dominio (afectación pulmonar) estaría bien reflejado por el grado de obstrucción; el segundo componente (percepción de la enfermedad) puede describirse por la disnea, y el componente de afectación sistémica puede quedar reflejado en la prueba de marcha y en el estado nutricional del paciente. Este último aspecto puede medirse mediante el índice de masa corporal. Este índice ha mostrado una relación inversa con la supervivencia en pacientes con EPOC24,25. Este sistema pretende acercarse más a la realidad del paciente y puede servir como predictor del pronóstico de la enfermedad en un paciente concreto. Al tratarse de un instrumento multidimensional es posible que detecte los cambios inducidos por la intervención terapéutica y a los que los actuales parámetros clínicos son insensibles.
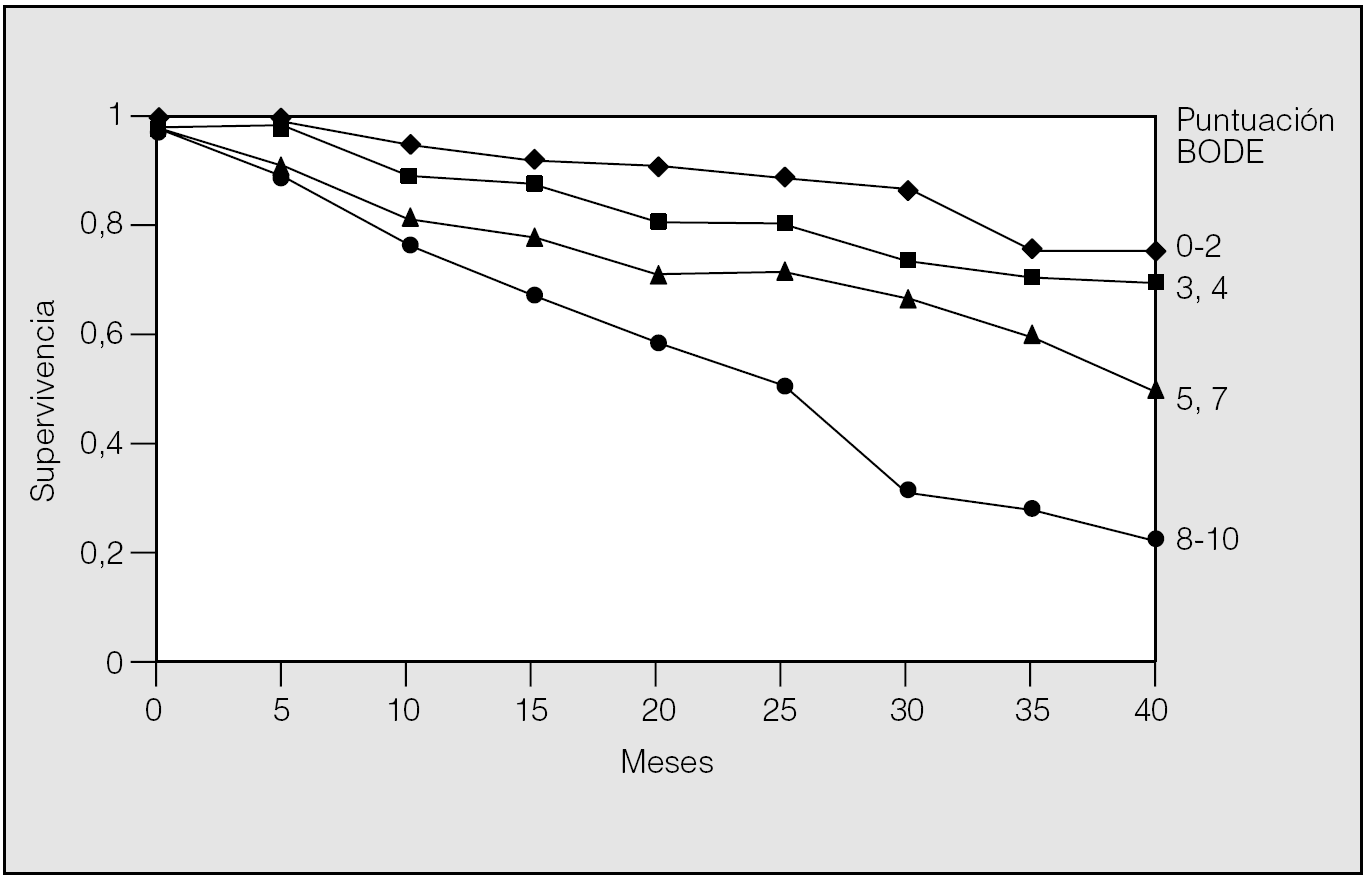
Recientemente se ha publicado la validación del modelo BODE como predictor de mortalidad en la EPOC. En este análisis se estudió a un total de 859 pacientes de forma prospectiva durante al menos un año en 3 países diferentes. Con los primeros 207 pacientes se pudo establecer las variables que mejor se relacionaban con el riesgo de muerte al año. Éstas resultaron ser el FEV1, la distancia recorrida en la PM6M, la disnea evaluada mediante la escala del Medical Research Council (MRC) y el índice de masa corporal. Cada una de estas variables se dividió en rangos a los que se les asignó un valor. A cada una de las 4 variables se le asigna una puntuación y se suman los puntos de forma que la puntuación final se encuentra entre el 0 y el 10. Cuando se analizó al conjunto de los 859 pacientes para evaluar la validez del modelo, resultó que el índice BODE fue un predictor de muerte por todas las causas y de muerte por causas respiratorias tras considerar otras posibles variables de confusión (hazard ratio de 1,32 y 1,62, respectivamente). Se construyeron curvas de supervivencia de Kaplan-Meier dividiendo a los pacientes en cuartiles según el valor del índice BODE (fig. 3). Los pacientes en el cuartil más alto (valor de BODE entre 7 y 10) presentaron una mortalidad del 80% a los 52 meses, mientras que los que se incluyeron en el cuartil 1 (índice de BODE entre 0 y 2) tuvieron una mortalidad a los 52 meses del 20%. El cálculo de la tasa de riesgo para cada punto del BODE indicó que cada uno aumenta la mortalidad total en 1,34 y la mortalidad por causas respiratorias en 1,62. Recientemente también se ha demostrado el valor predictivo del BODE para exacerbaciones y hospitalización por EPOC26.
Fig. 3. Curvas de supervivencia a 40 meses de seguimiento de pacientes con EPOC separados por la puntuación que obtuvieron en el BODE en el estudio basal. (Modificada de Celli et al12.)
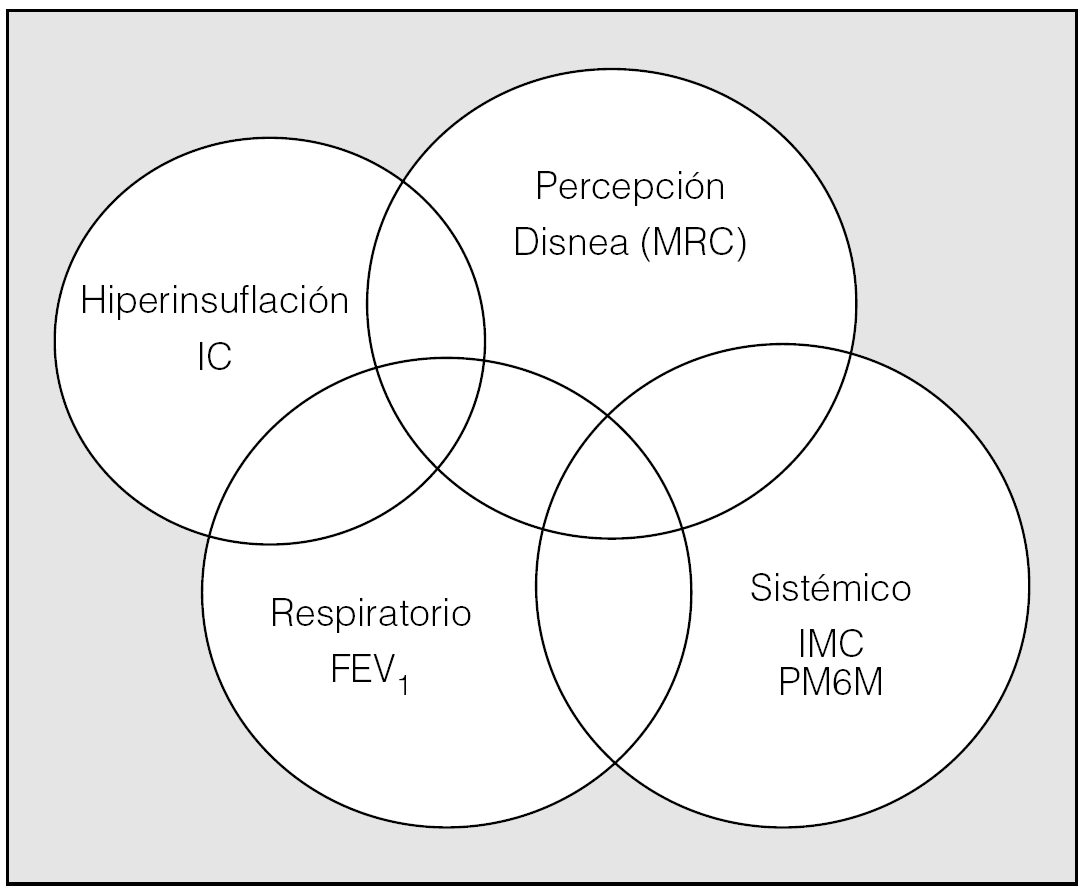
El modelo arriba propuesto de evaluación de pacientes con EPOC no debe considerarse inamovible en la composición de los componentes a evaluar. Por el contrario, debe adaptase a las circunstancias del paciente que se va a evaluar. Concretamente, en pacientes con EPOC muy grave que vayan a ser sometidos a trasplante pulmonar o cirugía de reducción de volumen, es importante la medición de los volúmenes pulmonares estáticos y específicamente de la IC, dado su valor predictivo de mortalidad. De esta forma la hiperinsuflación pulmonar, que es un fenómeno determinante de la disnea, de la capacidad de ejercicio y, en definitiva, de la calidad de vida y morbimortalidad de los pacientes con EPOC, podría incorporarse a un diagrama de 4 anillos en vez de 3 anillos (fig. 4). En la tabla II se recoge una propuesta integral para la evaluación de pacientes con EPOC. Sobre la base de la clasificación de la gravedad de la enfermedad propuesta por GOLD (Global Initiative for Chronic Obstructive Lung Disease) y por el consenso de la American Thoracic Society-European Society, se propone el manejo de los pacientes con EPOC leve o moderada por parte del médico de familia de forma preferente. En este nivel se deberían realizar, como mínimo, en el momento del diagnóstico inicial del paciente: cálculo del índice de masa corporal (talla y peso), registro y medida del grado de disnea mediante una escala (p. ej., escala MRC), espirometría y PM6M en un pasillo del centro. En la evaluación ulterior del paciente a lo largo del tiempo estas pruebas son sencillas de obtener y permiten trazar la velocidad del deterioro de la enfermedad. Los resultados de la intervención terapéutica propuesta (eliminación del tabaco, fármacos, vacunaciones, etc.) deberían evaluarse mediante el BODE y el número y tipo de exacerbaciones desde la visita previa. Los pacientes con EPOC grave y muy grave deberían ser atendidos por especialistas. En estos pacientes, además de las exploraciones ya mencionadas, se deben evaluar los gases arteriales y, en los casos con EPOC muy grave, debería evaluarse el estado de los volúmenes pulmonares (y específicamente la IC) y de la fuerza de los músculos respiratorios, además de realizar una prueba de esfuerzo cardiorrespiratoria máxima. Este último grupo de pacientes con EPOC muy grave debería incorporarse a grupos de rehabilitación respiratoria. La evaluación de la intervención terapéutica en los grupos III-IV de la GOLD, además del BODE y la morbilidad como en el caso de los grupos I y II, debería incluir la estimación mediante cuestionarios específicos de la calidad de vida y la estimación de costes de la enfermedad. En pacientes del grupo IV la evaluación adicional de los cambios en la IC, las presiones musculares y la prueba de esfuerzo cardiopulmonar puede permitir apreciar mejorías potenciales por el uso de fármacos no detectadas por otros instrumentos y, evidentemente, será imprescindible en los programas de rehabilitación respiratoria controlada, trasplante pulmonar o cirugía de reducción de volumen pulmonar por enfisema.
Fig. 4. Diagrama de Venn para la propuesta de valoración funcional y clínica de pacientes con EPOC en la práctica diaria. IC: capacidad inspiratoria, MRC: disnea evaluada por la escala del Medical Research Council; IMC: índice de masa corporal; FEV1: volumen espiratorio forzado en el primer segundo; PM6M: prueba de marcha de 6 min.
Correspondencia: Dr. J.M. Marín.
Servicio de Neumología. Hospital Universitario Miguel Servet.
Avda. Isabel la Católica, 1-3. 50006 Zaragoza. España.
Correo electrónico: jmmarint@unizar.es