El diagnóstico de la tuberculosis como infección latente (TBL) en pacientes con artritis reumatoide (AR) ha cobrado importancia con la introducción de agentes anti-factor de necrosis tumoral alfa (anti-TNF-α) y la aparición de casos de tuberculosis activa en estos pacientes.La prueba cutánea de la tuberculina (PT) tiene un valor limitado en pacientes con AR. Se están estudiando las pruebas basadas en la liberación de interferón-gamma (IFN-γ), pero su papel no ha sido bien establecido para este grupo de pacientes.
ObjetivosComparar el diagnóstico de TBL en pacientes con AR con respuesta inmune celular a la PT y T.SPOT-TB. Además, determinar los hallazgos de un estudio de tomografía compatibles con TBL.
MétodosEvaluación clínica, PT, T.SPOT-TB y tomografía computarizada de alta resolución (TCAR) en un grupo de pacientes con AR del Hospital de la Universidad Federal de Goiás.
ResultadosLa respuesta a la PT fue inferior en los pacientes con AR (13,5%), en relación a lo esperado en la población general. El T.SPOT-TB identificó un número mayor de pacientes con TBL al compararlo con la PT (36,8%). La TCAR mostró cambios compatibles con TBL en el 52,9% de los pacientes, incluyendo 8 de los 11 pacientes con PT negativo y T.SPOT-TB.
ConclusionesLa PT por sí misma no es suficiente para diagnosticar la TBL. Un mayor número de resultados positivos se obtuvieron con el T.SPOT-TB, si se lo compara con la PT, aunque fue negativo en un gran porcentaje de pacientes con hallazgos consistentes entre la tomografía y la TBL. La TCAR está disponible en la mayoría de los grandes centros y podría ser incorporada en la estrategia para el diagnóstico de TBL en pacientes con AR.
The diagnosis of latent tuberculosis (LTB) in patients with rheumatoid arthritis (RA) has become important with the introduction of anti-tumor necrosis factor (anti-TNF-α) agents and the appearance of active tuberculosis cases in these patients. The tuberculin skin test (TST) has limited value in patients with RA. Tests based on the release of interferon-gamma (IFN-γ) are being studied, but their role has not been well established for this group of patients.
ObjectivesTo compare the diagnosis of LTB in patients with RA by using cellular immune response to the TST and T.SPOT-TB. Additionally, findings of tomography studies compatible with LTB were used.
MethodsClinical evaluation, TST, T.SPOT-TB and high-resolution computed tomography (HRCT) in a group of patients with RA at the University Hospital of the Federal University of Goiás.
ResultsResponse to the TST was lower in patients with RA (13.5%) compared to the predicted values of the general population. T.SPOT-TB identified a higher number of patients with LTB than the TST (36.8%). HRCT showed changes compatible with LTB in 52.9% of the patients, including 8 of the 11 patients with negative TST and T.SPOT-TB.
ConclusionsThe TST by itself is insufficient to diagnose LTB. A higher number of positive results were obtained with T.SPOT-TB when compared to the TST. Nevertheless, it was negative in a large percentage of patients with tomography findings consistent with LTB. HRCT is readily available in most large health-care centers and it could be incorporated into the diagnostic strategy for LTB in patients with RA.
La tuberculosis (TB) continúa siendo un problema de salud pública de ámbito mundial y afecta predominantemente al segmento de población económicamente activo. Brasil es uno de los 22 países en los que se dan el 90% de los casos de TB de todo el mundo1,2. Aunque el diagnóstico y el tratamiento de la tuberculosis activa ocupan un lugar destacado en la lista de prioridades de los programas dirigidos al control de esta enfermedad de los países con una incidencia elevada de la misma, la tuberculosis latente (TBL) está adquiriendo una importancia creciente en los pacientes con un mayor riesgo de presentar una evolución a la forma activa del trastorno. La TBL se define como la que se da en individuos que se cree que albergan gérmenes vivos de Mycobacterium tuberculosis, pero no muestran ningún signo o síntoma clínico o de otro tipo que indique una enfermedad activa3.
Desde que empezaron a utilizarse los antagonistas del factor de necrosis tumoral-α (anti-TNF-α) en el tratamiento de la artritis reumatoide (AR) y otras enfermedades inflamatorias, el examen de detección de la TBL en los pacientes candidatos a estos tratamientos pasó a desempeñar un papel crucial. A pesar de que, desde entonces, se han realizado ya muchos estudios que han abordado estos objetivos, continúa sin estar claro cuál es el mejor enfoque a utilizar. Varios países han publicado guías al respecto, a través de sus sociedades médicas, y la mayoría de ellas incluyen los antecedentes de contacto con casos de tuberculosis activa, el resultado de la prueba cutánea de tuberculina (PT) y las imágenes de la radiografía de tórax4,5. Tras la introducción de las nuevas pruebas diagnósticas para la TB y los ensayos de liberación de interferón gamma (IGRA) en estudios recientes, se ha intentado establecer su utilidad en los pacientes con AR.
Los estudios en los que se ha comparado el resultado de la PT en pacientes con AR y en controles han puesto de manifiesto diferencias significativas de los resultados, con una atenuación de la respuesta en presencia de la AR6,7. Así pues, la PT no parece ser la prueba diagnóstica ideal para la TBL en pacientes con AR y adquiere más importancia aún la evaluación de nuevas estrategias novedosas. El principal objetivo de este estudio fue evaluar el papel de la tomografía computarizada de alta resolución (TCAR) del tórax en la identificación de imágenes compatibles con una TBL. Por otra parte, el estudio evaluó y comparó el rendimiento de las pruebas utilizadas para valorar la respuesta inmunitaria celular (PT y T.SPOT-TB) en el diagnóstico de la TBL, en un grupo de pacientes con AR.
Material y métodosParticipantesSe llevó a cabo un estudio descriptivo con la inclusión de 37 pacientes consecutivos de la clínica ambulatoria de reumatología del hospital docente de la Universidad Federal de Goiás (UFG). Para ser incluidos en el estudio, los pacientes debían tener más de 18años de edad y un diagnóstico confirmado de AR. Los criterios de exclusión fueron la sospecha de embarazo o el embarazo confirmado, la serología de VIH positiva y el hecho de no acudir a la cita concertada para la PT o para la lectura del resultado de dicha prueba.
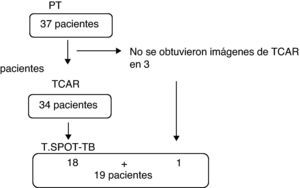
ProcedimientosSe obtuvieron los antecedentes médicos de los 37 pacientes, incluido el diagnóstico previo o el contacto con individuos con tuberculosis y la administración de bacilo de Calmette-Guérin (BCG). En todos ellos se realizó una prueba cutánea de tuberculina, y en 19 se extrajeron muestras de sangre para la obtención de células mononucleares en sangre periférica (CMSP) y para el ensayo T.SPOT-TB (en función de la disponibilidad del mismo). Se obtuvieron imágenes de TCAR del tórax en 34 pacientes (3 pacientes no acudieron para la realización de la TCAR). Todos los pacientes incluidos en el estudio firmaron un formulario de consentimiento informado. El estudio fue aprobado por el consejo de revisión interno del hospital docente UFG (Protocolo número 195/07).
Prueba cutánea de tuberculinaSe inyectaron a los pacientes 100μl (2UI) de PPDRt23 utilizando el método de Mantoux. Se determinó la induración a las 72h de la inyección. El mismo profesional se encargó de la administración y la lectura de todas las pruebas. Se consideró que había reactividad cuando el diámetro de la induración era ≥5mm. La persona que realizaba la lectura de la PT no conocía los resultados del T.SPOT-TB ni de la TCAR.
T.SPOT®-TB (Oxford Immunotec)La prueba se realizó siguiendo las directrices proporcionadas por el fabricante. Tras la obtención de las CMSP, se prepararon e incubaron con antígenos específicos de tuberculosis en una placa preparada con anticuerpos anti interferón-gamma (IFN-γ). Si se identifican antígenos y se produce IFN-γ, este es capturado por los anticuerpos y se forman manchas en la parte inferior de la placa.
Tomografía computarizada de alta resoluciónSe utilizó un escáner de TC multicorte con 6 canales (Somatom Emotion 6, Siemens) para obtener las imágenes de TCAR de 34 pacientes. Las exploraciones fueron evaluadas por un radiólogo cualificado, con experiencia en la interpretación de las imágenes de TC de tórax. El evaluador no conocía los resultados de la PT ni de otras pruebas. Se clasificó a los pacientes como pacientes con o sin imágenes de TCAR compatibles con una TBL, en función de que presentaran una de las siguientes alteraciones8:
- •
Nódulos calcificados en el parénquima pulmonar (nódulos de Ghon).
- •
Ganglios linfáticos hiliares calcificados.
- •
Engrosamiento pleural apical.
- •
Lesiones fibrosas en los lóbulos superiores, con o sin alguna reducción del volumen del lóbulo.
Se utilizó la prueba exacta de Fisher para la comparación de los resultados de la PT y del T.SPOT-TB en los pacientes que habían sido vacunados con BCG frente a los que no habían recibido la vacunación. Se calculó el valor de kappa para evaluar la concordancia entre los resultados de la PT y el T.SPOT-TB. Los valores de p inferiores a 0,05 se consideraron estadísticamente significativos.
ResultadosSe incluyó en el estudio a un total de 37 pacientes (33 mujeres y 4 varones) que cumplían los criterios diagnósticos de AR del American College of Rheumatology9. La media de edad fue de 55,4 (39-81) años. El tiempo tras el diagnóstico osciló entre 1 y 35 años, con una media de 11,3 años. Tan solo 3 pacientes no estaban siendo tratados con corticoides. Ningún paciente había recibido anteriormente tratamiento para la tuberculosis. Los datos clínicos más importantes se describen en la tabla 1.
Características clínicas de los 37 pacientes incluidos
| Mujeres/varones | 33/4 (89/11%) |
| Media de edad (mín-máx) | 55,4 (39-81) años |
| Media de tiempo desde el diagnóstico (mín-máx) | 11,3 (1 a 35) años |
| Fumadores actuales y exfumadores | 19 (51,3%) |
| Uso de corticoides en dosis >7,5mg de prednisona o equivalente | 16 (43,2%) |
| Uso de un fármaco modificador del curso de la enfermedad (metotrexato/leflunomida o azatioprina) | 29 (78,3%) |
| Uso de corticoides en dosis >7,5mg de prednisona o equivalente o de fármacos modificadores del curso de la enfermedad | 34 (91,9%) |
| Administración de BCG | 18 (48,6%) |
mín: mínimo; máx: máximo; BCG: bacilo de Calmette-Guérin.
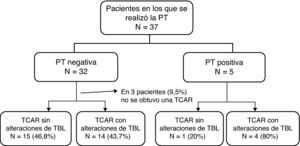
En la figura 1 se indican los procedimientos realizados. De los 37 pacientes del estudio, el 13,5% presentaron una reacción positiva y el 86,5% no presentaron reacción a la PT. Dieciocho de ellos (48,6%) habían recibido vacunación con BCG y 16 (51,4%) no habían sido vacunados. No hubo diferencias significativas en cuanto a la respuesta positiva a la PT cuando se comparó el grupo de pacientes a los que se había administrado BCG con los que no la habían recibido (p=0,39). No fue posible determinar si habían sido vacunados 3 de los pacientes. Se trataba de pacientes que afirmaban haber recibido la BCG pero en los que no se apreció la cicatriz característica que esta produce.
De los 19 pacientes en los que se realizó el ensayo T.SPOT-TB, el 36,8% (7/19) presentaron una reacción positiva y el 63,2% no presentaron reacción. Los resultados de la PT y el T.SPOT-TB fueron coincidentes en 14 pacientes (73,6%). En 4 pacientes la PT fue negativa y el T.SPOT-TB fue reactivo, y en un paciente la PT fue positiva y el T.SPOT-TB negativo. Ambas pruebas mostraron una concordancia razonable entre sí (kappa=0,379).
En 34 pacientes se obtuvieron imágenes de TCAR. En 18 pacientes había alteraciones que sugerían una TBL y en 16 había imágenes normales o con alteraciones no relacionadas con la TBL, como por ejemplo enfisema o neumopatía intersticial asociada a la AR. De los 5 pacientes con PT positiva, en 4 las imágenes de TCAR fueron compatibles con una TBL, y en uno no fue así. De los 32 pacientes con un resultado negativo de la PT en los que se obtuvieron imágenes de TCAR, 14 pacientes presentaron alteraciones que sugerían TBL (fig. 2).
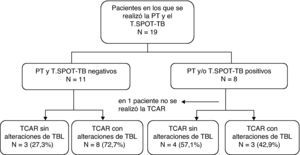
Al evaluar tan solo el grupo en el que se disponía también del T.SPOT-TB (n=19), de 11 los pacientes con respuestas negativas a ambas pruebas, 8 presentaban alteraciones que sugerían TBL (fig. 3 y tabla 2).
Alteraciones en las imágenes de TCAR de cada uno de los 8 pacientes con resultados negativos de la PT y el T.SPOT-TB e imágenes de TCAR compatibles con TBL
| Paciente | Alteraciones en las imágenes de TCAR |
| 1 | Nódulo calcificado en LSI |
| 2 | Lesiones fibrosa en LSI+ganglios linfáticos mediastínicos calcificados |
| 3 | Alteraciones pleurales fibrosas y de tejido cicatrizal apicales bilaterales, con distorsión de la arquitectura+bronquiectasias+nódulo calcificado en LSD |
| 4 | Nódulo calcificado en LID+ganglio linfático calcificado en hilio derecho |
| 5 | Alteraciones pleurales fibrosas y de tejido cicatrizal apicales+nódulo calcificado en LSD+ganglio linfático mediastínico calcificado |
| 6 | Engrosamiento pleural apical bilateral+bandas parenquimatosas en la língula+nódulo calcificado en LM+ganglio linfático mediastínico calcificado |
| 7 | Nódulo calcificado en LID |
| 8 | Nódulo calcificado en LID |
TCAR: tomografía computarizada de alta resolución; LSI: lóbulo superior izquierdo; LSD: lóbulo superior derecho; LM: lóbulo medio; LID: lóbulo inferior derecho.
En nuestro estudio observamos una PT positiva en el 13,5% (n total=37) de los pacientes evaluados. Nuestros resultados son similares a los obtenidos en otros estudios. En un estudio realizado en Brasil por Marques et al.10 se observaron respuestas positivas a la PT en el 14% de los pacientes con AR, y en el 33,3% de los individuos del grupo control (pacientes sin AR); Ponce de Leon et al.7, en Perú, observaron una respuesta positiva a la PT en el 29% de la población con AR, en comparación con el 71% en el grupo control; en Argentina, Tamborenea et al.11 observaron respuestas positivas a la PT en el 12,4% de una cohorte de pacientes con AR.
Diversos investigadores coinciden en que la PT es menos capaz de diagnosticar la TBL en los pacientes con AR, en comparación con los individuos sanos7,10,11. El mecanismo que causa la atenuación de la respuesta de la PT en los pacientes con AR no está del todo claro, pero está relacionado con una función inmunitaria celular anómala observada en esos pacientes12-14. Algunos estudios han puesto de manifiesto que la PT es más sensible en los pacientes con ciertos tipos de inmunosupresión, como la que se da en la AR, al utilizar dosis más altas de PPD15-17.
En este estudio, las respuestas positivas a la prueba cutánea de tuberculina no se vieron afectadas por los antecedentes de administración de BCG. La influencia de la vacuna BCG en el resultado de la PT se conoce desde hace mucho tiempo; sin embargo, en estudios recientes se ha considerado que este efecto es mínimo18.
En nuestro estudio, el ensayo T.SPOT-TB fue reactivo en el 36,8% de los pacientes evaluados, en comparación con el 21% de respuesta positiva a la PT en este grupo. En varios estudios previos se ha demostrado esta mayor positividad de los IGRA, en comparación con la PT, para el diagnóstico de la TBL en pacientes inmunodeprimidos. Los resultados de este estudio por lo que respecta al T.SPOT-TB son similares a los de otros estudios en los que se han comparado los IGRA y la PT en pacientes con AR, y ponen de manifiesto que el primero de estos métodos produce más resultados positivos10,19,20. Sin embargo, en un paciente con PT positiva, el T.SPOT-TB no fue reactivo. Este paciente presentaba alteraciones en las imágenes de TC que eran compatibles con TBL, lo cual sugiere que el T.SPOT-TB produjo un resultado falsamente negativo. Un reciente estudio llevado a cabo en pacientes con enfermedades inflamatorias intestinales en los que se efectuaron pruebas de detección de TBL para el uso de anti-TNF-α, la mayoría de los cuales estaban siendo tratados con inmunomoduladores (corticoides, metotrexato o tratamiento anti-TNF), se ha puesto de manifiesto que el rendimiento de los IGRA se ve afectado negativamente por el uso de inmunomoduladores (OR=0,3; 0,1-0,9)21. En nuestro estudio, a la mayor parte de los pacientes (91,9%) se les había prescrito un inmunosupresor y/o una dosis de corticoides superior a 7,5mg de prednisona o su equivalente.
Varios estudios han sugerido que los IGRA tienen una probabilidad de dar resultados falsamente positivos menor que la de la PT en el diagnóstico de TBL. Sin embargo, es de destacar que Mycobacterium leprae, el agente etiológico de la enfermedad de Hansen (lepra), que es endémico en Brasil, tiene un antígeno homólogo al ESAT-6 utilizado en los IGRA: el L-ESAT-6. En un estudio de colaboración en el que participaron investigadores de Brasil y Holanda se puso de manifiesto una reacción cruzada entre estos antígenos, que podría limitar su uso como instrumento diagnóstico en la tuberculosis y la enfermedad de Hansen en regiones en las que estas dos enfermedades son endémicas22.
Conviene señalar el número significativo de pacientes con resultados negativos de la PT y el T.SPOT-TB que fueron clasificados, por tanto, como pacientes sin TBL, y en los que las imágenes de TC mostraron alteraciones compatibles con TBL. El papel de la radiografía de tórax en el estudio diagnóstico de TBL en pacientes con AR en los que está indicado el uso de fármacos anti-TNF-α ha sido ya claramente establecido. En diversas guías se afirma que la radiografía de tórax es imprescindible, y si se determina la presencia de cualquier alteración que sugiera una TBL, está indicado el tratamiento de la infección4,5.
La mayor sensibilidad de la TCAR en comparación con las imágenes de radiografía de tórax ha sido ampliamente documentada en la literatura mundial. Este método ha ganado mayor aceptación como excelente instrumento diagnóstico, sobre todo en casos seleccionados, como los de los pacientes con síntomas respiratorios y un frotis de esputo negativo, los posibles casos de tuberculosis en los que la imagen de la radiografía de tórax es normal o no es concluyente, los pacientes en los que es necesario un examen del mediastino, los que tienen una enfermedad diseminada o los que presentan alteraciones endobronquiales23.
En estudios previos se ha puesto ya de manifiesto que la TCAR es superior a la radiografía de tórax para detectar alteraciones que sugieren TBL o TB activa durante los brotes de tuberculosis o entre los contactos del hogar. En un estudio llevado a cabo durante un brote de tuberculosis en una escuela de Corea del Sur, los investigadores realizaron PT y radiografías de tórax a todos los estudiantes y al personal. En los individuos con PT positiva se aplicó el QuantiFERON-TB-GOLD y se obtuvieron imágenes de TC del tórax en los casos en los que el QuantiFERON-TB-GOLD fue positivo o la PT fue >20mm. De los 52 individuos en los que se obtuvieron imágenes de TC torácica, en 46 la radiografía de tórax era normal. La TC torácica mostró que 11 (23,9%) y 7 (15,2%) de estos individuos presentaban alteraciones que sugerían una TB activa y una TBL, respectivamente24.
En un estudio realizado durante un brote epidémico de tuberculosis en soldados destinados a Corea del Sur se incluyó a 87 individuos, y a 18 de ellos se les diagnosticó TB. Nueve de estos pacientes presentaban una radiografía de tórax normal pero mostraban lesiones que sugerían una TB activa en la TCAR25. En nuestro estudio se evaluó el uso de la TCAR como posible instrumento diagnóstico para la TBL en los pacientes con AR. Dado que no disponemos todavía de un método diagnóstico para la TBL que constituya un patrón de referencia y puesto que los métodos que se han introducido proporcionan todavía resultados contradictorios en el grupo de pacientes con AR, la TCAR torácica puede ser una opción útil para llegar a un diagnóstico.
Se ha puesto de manifiesto que todavía no disponemos de una prueba con una sensibilidad del 100% para el diagnóstico de la TBL, y por consiguiente es posible que la combinación de varias pruebas constituya una mejor opción. En este estudio, el 72,7% (8/11) de los pacientes con resultados negativos en la PT y el T.SPOT-TB presentaron alteraciones que sugerían la presencia de TBL en las imágenes de TCAR.
Conviene señalar que las alteraciones de las estructuras pulmonares pueden asociarse a la AR, ya sea porque sean causadas por un defecto de la inmunidad o por la inflamación crónica producida por la propia enfermedad, ya porque se deban a la medicación empleada para tratar la AR, que puede causar toxicidad pulmonar. Las manifestaciones más frecuentes son la neumopatía intersticial, la hemorragia o el engrosamiento pleurales, los nódulos pulmonares y la enfermedad de las vías respiratorias26. Tan solo los nódulos calcificados se consideraron indicativos de TBL, puesto que son muy infrecuentes en la artritis reumatoide. Además, en todos los casos de engrosamiento pleural se observaron también nódulos calcificados.
A pesar de que otras enfermedades infecciosas granulomatosas, como la histoplasmosis, pueden dejar lesiones residuales parecidas a las causadas por la tuberculosis, la mayor parte de la investigación epidemiológica realizada en Brasil sugiere que la prevalencia de la histoplasmosis es considerablemente inferior a la de la tuberculosis en la mayor parte del país27. Así pues, las alteraciones observadas en la TCAR reflejan probablemente un contacto previo con el bacilo de la tuberculosis que dejó secuelas pulmonares y que las demás pruebas (PT y T.SPOT-TB) no fueron capaces de identificar. En consecuencia, en este grupo de pacientes con resultados falsamente negativos para tuberculosis en la PT y el T.SPOT-TB debe contemplarse un tratamiento para la TBL antes del uso de fármacos anti-TNF-α. Más de la mitad de los pacientes con una PT y/o un T.SPOT-TB positivos presentaron una TCAR normal. Esta observación muestra la importancia de utilizar métodos diagnósticos que se complementen entre sí. La TCAR debe utilizarse como exploración adicional y no para sustituir a las pruebas inmunológicas.
Nuestro estudio tiene ciertas limitaciones. La primera es la falta de un grupo control formado por pacientes sin AR. Dicho grupo nos permitiría analizar diferencias de respuesta a la PT y al T.SPOT-TB. La segunda es la falta de un método diagnóstico que pueda considerarse un patrón de referencia para el diagnóstico de la TBL, con el que sería posible evaluar de manera más adecuada la sensibilidad y la especificidad de las diferentes estrategias diagnósticas. Otra limitación es que no todos los pacientes del grupo de AR fueron examinados con las tres pruebas (PT, T.SPOT-TB y TCAR), y es posible que ello haya causado un sesgo de selección. Sin embargo, creemos que esto no causó un sesgo importante, ya que la elección de los pacientes para la aplicación de las tres pruebas se realizó de forma aleatoria, en función de la disponibilidad de dichas pruebas.
En conclusión, hasta la fecha la mayor parte de los estudios indican que la prueba cutánea de la tuberculina es insuficiente para el estudio diagnóstico de la TBL en los pacientes con AR. Los nuevos métodos diagnósticos para la TBL no han sido totalmente validados en este grupo de pacientes en poblaciones con diferentes tasas de incidencia de esta enfermedad. Además, en la mayoría de países aún no se recomiendan como parte de la actuación clínica ordinaria. La TCAR del tórax es una técnica ampliamente disponible en los grandes centros y podría utilizarse como instrumento adicional para el diagnóstico de la TBL.
FinanciaciónEse artículo contó con el apoyo económico del Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq). Processo n.° 475603/2007-9.
Conflicto de interesesLos autores manifiestan no tener ningún conflicto de intereses que declarar.