Introducción
El carcinoma broncogénico representa la neoplasia más frecuente en países desarrollados y el 80% de los casos se engloban dentro del grupo carcinoma de células no pequeñas, dos tercios de los cuales en el momento del diagnóstico se encuentran en estadios avanzados, que se consideran irresecables. En esta situación, diversos ensayos clínicos han evidenciado que la administración de quimioterapia prolonga la supervivencia con respecto al tratamiento exclusivamente paliativo1, por lo que diversas sociedades científicas recomiendan su empleo en pacientes con buen grado de actividad --Karnofsky > 70%; grado de actividad, según la escala del Eastern Cooperative Oncology Group (ECOG), ≤ 2--. Sin embargo, la ganancia es modesta y ésta se mantiene hasta el sexto mes; a partir de ese momento no existen diferencias con respecto al tratamiento sintomático2,3. Debido a esta limitación, algunos autores cuestionan su empleo fuera de los ensayos clínicos4, lo que justificaría el pesimismo mostrado por los neumólogos acerca de los beneficios de este tratamiento, aunque pocas series han evaluado su repercusión en la actividad asistencial diaria5,6.
Teniendo en cuenta estas consideraciones, hemos diseñado un estudio observacional de todos los pacientes con carcinoma broncogénico no microcítico en estadios avanzados que han sido tratados en nuestro hospital, con el objetivo de analizar los factores pronósticos relacionados con la supervivencia y determinar si el tratamiento citostático influye en ella de manera independiente.
Pacientes y métodos
Se analizó de manera retrospectiva a todos los pacientes con diagnóstico citohistológico de carcinoma broncogénico no microcítico en estadios avanzados, definidos como aquéllos en estadios IV y IIIb con derrame pleural o afectación ganglionar N2-N3, de acuerdo con el sistema TNM de estadificación tumoral7. El período de estudio abarcó desde enero de 1997 hasta diciembre de 2004.
El Comité Oncológico de nuestro centro (compuesto por facultativos de Oncología Médica, Oncología Radioterápica, Cirugía Torácica y Neumología) valoró a todos los pacientes para decidir el tratamiento más adecuado. Los que recibieron tratamiento exclusivamente sintomático fue porque el propio enfermo desestimó las medidas terapéuticas propuestas o bien por decisión de dicho comité, que empleó como criterios la presencia de comorbilidad significativa (2 o más procesos asociados) y la edad avanzada.
Se excluyó del estudio a los pacientes con grado de actividad según ECOG mayor de 2, con estadio IV y metástasis única que fueron intervenidos quirúrgicamente y los que fallecieron durante el proceso diagnóstico o por causas ajenas a la enfermedad neoplásica.
Se recogieron de manera protocolizada las siguientes variables: edad, sexo, tabaquismo, comorbilidad, datos clínicos, parámetros de laboratorio, técnicas de imagen, grado de actividad según la escala ECOG, estadio TNM y tratamiento recibido.
Se establecieron las siguientes definiciones: pérdida de peso, como reducción ponderal mayor del 5% con respecto al peso habitual en los últimos 6 meses; tratamiento citostático, cuando el paciente recibía al menos 2 ciclos de quimioterapia con o sin radioterapia asociada; tratamiento sintomático, considerado como aquel que incluía medidas farmacológicas y radioterapia con intención paliativa, así como técnicas de repermeabilización endobronquial con láser o prótesis, y supervivencia, como tiempo transcurrido, en semanas, desde el momento del diagnóstico hasta la última revisión o fallecimiento, estableciéndose el censor a fecha de 30 de abril de 2005.
Análisis estadístico
Las variables cuantitativas se expresan en medias ± desviación estándar. Las variables cualitativas se recogieron de forma dicotómica. Para la comparación de medias independientes se utilizó la prueba de la t de Student, y la distribución χ² se empleó para las variables cualitativas. Se relacionaron con la supervivencia las siguientes variables: edad, sexo, comorbilidad, pérdida de peso, hemoglobina, cifra total de linfocitos, albúmina sérica, lactatodeshidrogenasa, calcio, tipo histológico, ECOG, TNM y tratamiento.
La mediana de supervivencia se calculó por el método de Kaplan-Meier y la comparación de curvas de supervivencia se realizó mediante el test de los rangos logarítmicos. Las variables con significación estadística se incluyeron en modelo de regresión de Cox de estimación de riesgo proporcional para identificar factores pronósticos relacionados con la supervivencia.
Se consideró significativo un valor de p < 0,05.
Resultados
Datos generales
Durante el período de estudio se diagnosticó a 235 pacientes, de los cuales 45 cumplían alguno de los criterios de exclusión: 28 con ECOG mayor de 2; 12 en estadio IV con metástasis única e intervenidos quirúrgicamente y 5 fallecidos. Así pues, la muestra final la constituían 190 enfermos (157 varones y 33 mujeres), con una edad media (± desviación estándar) de 61,75 ± 10,85 años (rango: 33-85). En 170 (89%) se recogieron antecedentes de tabaquismo y 93 (49%) presentaban comorbilidad asociada. Las estirpes histológicas se distribuían de la siguiente manera: carcinoma epidermoide en 79 casos, adenocarcinoma en 70 y carcinoma indiferenciado de células grandes en 41. De acuerdo con el sistema TNM, 65 pacientes se clasificaron en estadio IIIb y 125 como estadio IV.
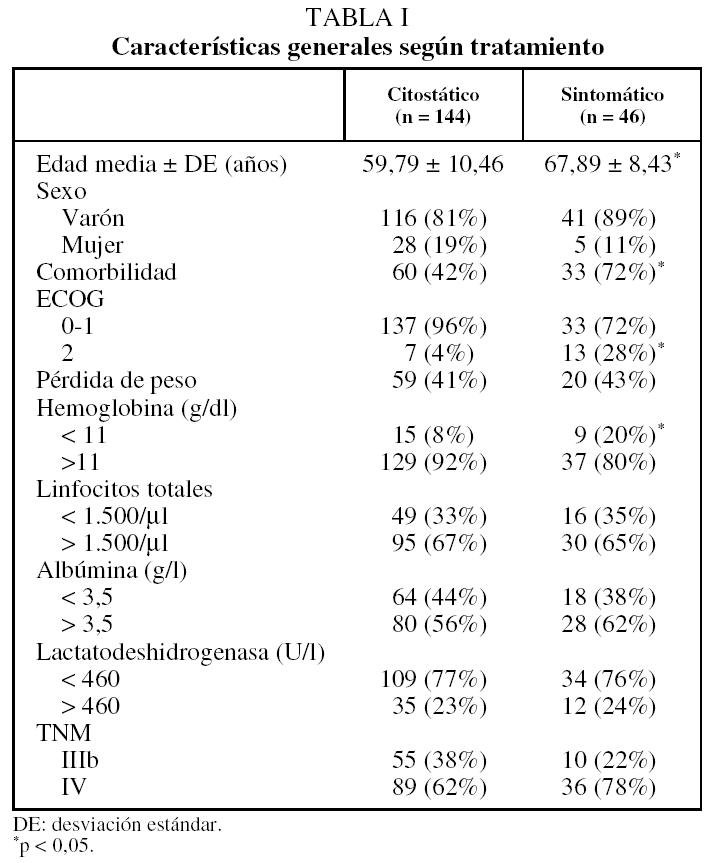
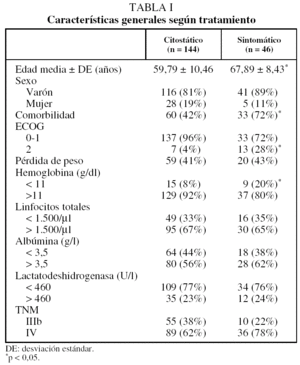
Recibieron tratamiento citostático 144 enfermos (76%). Los 46 restantes recibieron tratamiento con intenciones exclusivamente paliativas, en 4 casos porque los pacientes rechazaron las medidas terapéuticas propuestas y en 42 por decisión del Comité Oncológico, que en 16 casos lo consideró oportuno debido a la edad avanzada de los pacientes --media de 78,16 años (rango: 73-87)-- y en 26 por comorbilidad (las enfermedades involucradas fueron: cardiovasculares en 16 enfermos, nefropatía en 9, enfermedad pulmonar obstructiva crónica en 7, enfermedad neurológica en 5 y hepatopatía en 3). En la tabla I se muestran las características de los pacientes según el tratamiento administrado.
Análisis de supervivencia
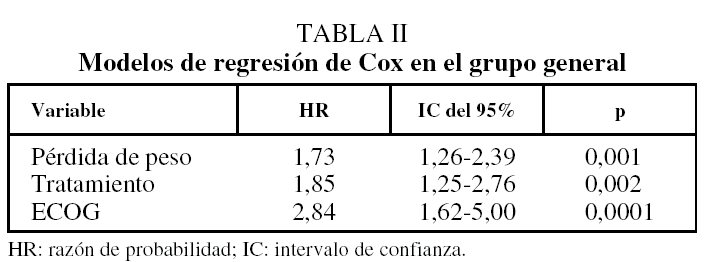
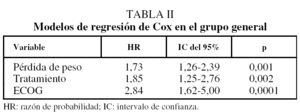
La mediana de supervivencia fue de 31 semanas (rango: 26-38): 38 semanas con quimioterapia y 17 semanas con tratamiento paliativo (p = 0,0001). En el estudio univariado las siguientes variables prolongaban significativamente la supervivencia: ECOG de 0-1 (p = 0,00001), tratamiento citostático (p = 0,0001), ausencia de pérdida de peso (p = 0,001), cifra de linfocitos totales mayor de 1.500/µl (p = 0,02) y valor de lactatodeshidrogenasa inferior a 460 U/l (p = 0,02). Al introducir dichas variables en el modelo de regresión de Cox, mantenían su implicación la ausencia de pérdida de peso, el tratamiento citostático y ECOG de 0-1 (tabla II).
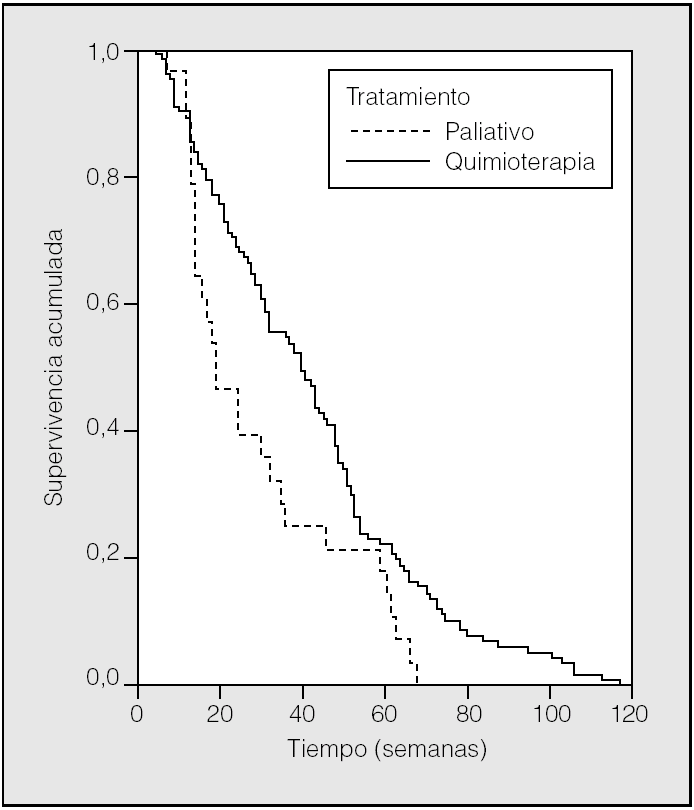
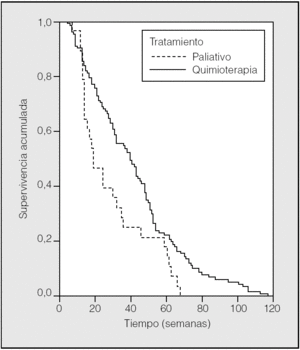
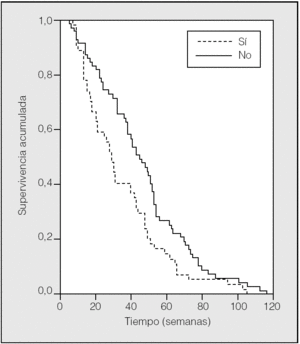
En la figura 1 se muestra la curva de supervivencia, según el tratamiento administrado, en los pacientes con ECOG de 0-1; en el caso de los que recibieron quimioterapia fue de 40 semanas, y en los de tratamiento sintomático de 21 semanas (p = 0,002). En ECOG 2, la supervivencia con quimioterapia fue de 15 semanas y con tratamiento sintomático de 11 semanas.
Fig. 1. Curva de supervivencia en ECOG 0-1 según el tratamiento administrado.
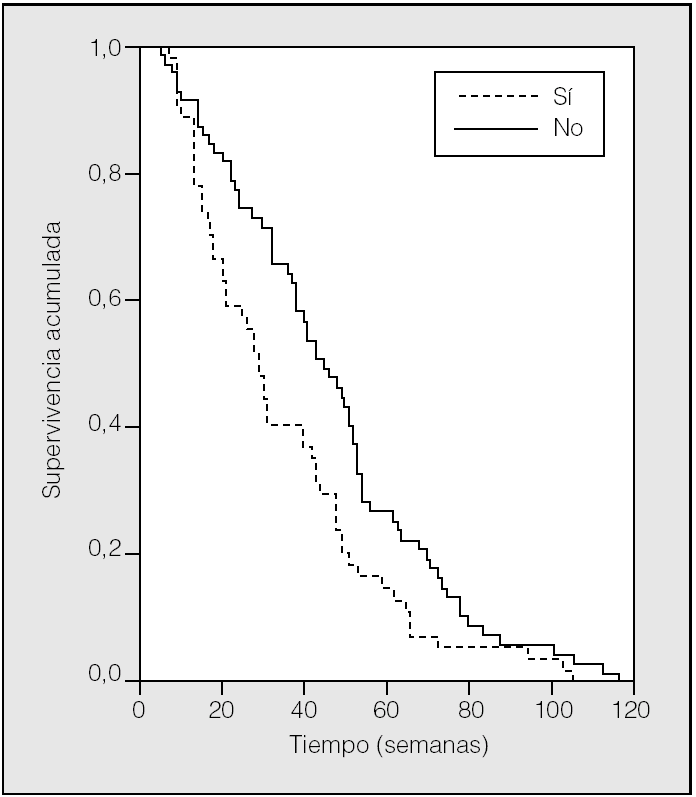
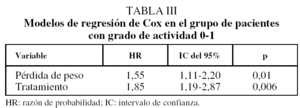
En el grupo de pacientes con grado de actividad 0-1, en el análisis univariado, una ECOG de 0 y el resto de variables mencionadas se asociaron significativamente con la supervivencia, y de ellas sólo el tratamiento y la pérdida de peso se vincularon de manera independiente en el modelo de regresión de Cox (tabla III). En la figura 2 se muestra la curva de supervivencia en pacientes con tratamiento citostático, según pérdida de peso; en los que estaba presente fue de 30 semanas, y en los que no, fue de 46 semanas (p = 0,02).
Fig. 2. Curva de supervivencia en ECOG 0-1 con tratamiento citostático, según pérdida de peso.
Discusión
Desde los primeros ensayos clínicos que demostraron que la administración de quimioterapia aumentaba la supervivencia en el carcinoma broncogénico en estadios avanzados, este tratamiento se ha venido aplicando en la actividad asistencial diaria sin que existan muchas series que hayan analizado sus posibles beneficios en este escenario. En nuestro caso hemos diseñado un estudio de factores pronósticos, en el que apreciamos que el tratamiento citostático, conjuntamente con el grado de actividad y la pérdida de peso, se relacionaban con la supervivencia. Similares conclusiones se obtuvieron ya en 2 amplias muestras en 19808 y 19919, que incluían a 5.138 y 2.531 pacientes, respectivamente, en las que se observó que estas variables se asociaban con la supervivencia. Pese a ello, el presente estudio muestra una serie de aspectos que estimamos interesantes:
1. El tratamiento citostático consigue prolongar la supervivencia mediana en aproximadamente 5 meses, lo que es llamativamente superior a los 2 meses obtenidos en diferentes metaanálisis1,3 y en un ensayo clínico publicado recientemente10, en el que no supera los 3 meses. Esto podría estar condicionado por el diseño no aleatorizado, como ya discutiremos más adelante, aunque otro aspecto a considerar es que el estudio se llevó a cabo durante un período muy amplio, de 8 años, en el cual se han desarrollando nuevos fármacos y han mejorado las medidas paliativas, lo que podría influir en la supervivencia, como han apreciado otros autores11.
2. El beneficio de la quimioterapia se circunscribe a los pacientes con grado de actividad 0 o 1, como ya se ha demostrado recientemente12,13, pese a que Spiro et al10 no encuentran diferencias llamativas con respecto al grado 2. Dadas estas discrepancias, parece lógico intentar identificar adecuadamente a los grupos de pacientes que podrían beneficiarse en mayor grado, por lo que en la práctica clínica diaria sería conveniente no incluir a los sujetos con grado de actividad superior a 1; en este punto, nuestros resultados deben interpretarse con cautela, dado el escaso número de pacientes con grado 2 incluidos en la muestra. De acuerdo con ello, resultaría interesante determinar qué aspectos influyen en los sujetos con grado de actividad 0-1, en los que, en nuestra experiencia, la ausencia de pérdida de peso condiciona una mejor respuesta a la quimioterapia, por lo que creemos que, si bien no limitante, podría ser un aspecto a considerar en presencia de otros factores que condicionaran un pronóstico peor, como ya se ha planteado14,15.
3. Parece evidente que los resultados mostrados por la quimioterapia en los ensayos clínicos son trasladables a la actividad asistencial habitual. Pese a ello, Schroen et al16 observaron que sólo un tercio de los neumólogos creía en los beneficios de la quimioterapia; en el mismo sentido, en un estudio más reciente que analizaba la opinión de diferentes médicos especialistas, Jennens et al17 apreciaron que únicamente el 16% de los neumólogos se mostraban optimistas sobre el papel del tratamiento citostático en pacientes en estadio IV, a pesar de que un 56% de ellos (porcentaje sólo superado por oncólogos y radioterapeutas) tenían un buen de conocimiento acerca de la respuesta y supervivencia con y sin quimioterapia; esta actitud no parece estar justificada a tenor de nuestros resultados. No obstante, debemos tener en cuenta que el aumento de la supervivencia es modesto, y cabe preguntarse si sería suficiente; sin duda, la respuesta a esta cuestión está mediatizada por la situación personal del paciente, que es la que más influencia ejerce en la percepción de este beneficio18.
Por tanto, debemos recomendar dicho tratamiento a nuestros pacientes con una información precisa que conjugue los beneficios que puede aportar con las expectativas del enfermo, para que la decisión final de éste sea la más adecuada.
Es necesario tener en cuenta que, al tratarse de una muestra no aleatorizada y de diseño retrospectivo, existe la posibilidad de un sesgo de selección, como parece intuirse de los datos de la tabla I, en la que se observa que los pacientes que reciben tratamiento paliativo son de edad más avanzada y presentan mayor comorbilidad. Este sesgo resulta difícil de eliminar teniendo en cuenta que ambos aspectos representan los criterios, consensuados por todos los miembros del Comité Oncológico de nuestro hospital, empleados para asignar la opción terapéutica, dada la tendencia a no administrar citostáticos a estos enfermos19,20, aunque no existan evidencias firmes acerca del significado pronóstico negativo de dichas variables, como también se demuestra en el presente estudio. Es preciso remarcar que el grupo con grado de actividad 0-1 es más homogéneo y que se mantiene la diferencia significativa entre ambos grupos de tratamiento, lo que pensamos que refuerza la validez de nuestros resultados.
Otra limitación es que no hemos analizado la calidad de vida, que es, conjuntamente con la supervivencia, un factor para definir el éxito de un tratamiento; no obstante, queremos recordar que el objetivo primordial de nuestra serie es reflejar un proceso asistencial e intentar debatir sobre cuestiones que se nos plantean en la labor diaria, lo que creemos sí queda reflejado en nuestro trabajo.
Concluimos que en la práctica clínica habitual la quimioterapia prolonga la supervivencia significativamente, aunque este beneficio se limita a los pacientes con grado de actividad inferior a 2 y es mayor si no existe pérdida de peso asociada, aspectos que deben tenerse en cuenta en el momento de informar al enfermo para decidir el tratamiento más adecuado para él. Teniendo en cuenta las consideraciones anteriores, creemos que el pesimismo mostrado por los neumólogos ante esta terapéutica no parece justificado.
Correspondencia: Dr. J.A. Gullón Blanco.
La Marina, 49, 4.° izqda. Edificio Gaviota C. 38001 Santa Cruz de Tenerife. España.
Correo electrónico: jose993@separ.es
Recibido: 26-9-2005; aceptado para su publicación: 15-11-2005.