Existe subdiagnóstico del déficit grave de alfa-1 antitripsina (DAAT) a pesar de la recomendación de realizar la determinación de AAT en pacientes con enfermedad pulmonar obstructiva crónica (EPOC).
ObjetivoEstimar la prevalencia de DAAT en pacientes con EPOC ajustada a la población del estudio de prevalencia de EPOC en la Argentina (EPOC.AR).
Material y métodosEstudio prospectivo multicéntrico de corte transversal en población≥30 años de edad con diagnóstico de EPOC. Cuantificación de AAT por toma de sangre capilar en gota seca y posterior genotipificación en aquellos sujetos con concentraciones<1,5mg/dl en sangre capilar en gota seca (<80mg/dl sérica). Se definió DAAT como la detección de las variantes ZZ o SZ por genotipificación. Se tomó la población del estudio EPOC.AR para calcular la prevalencia local ajustada.
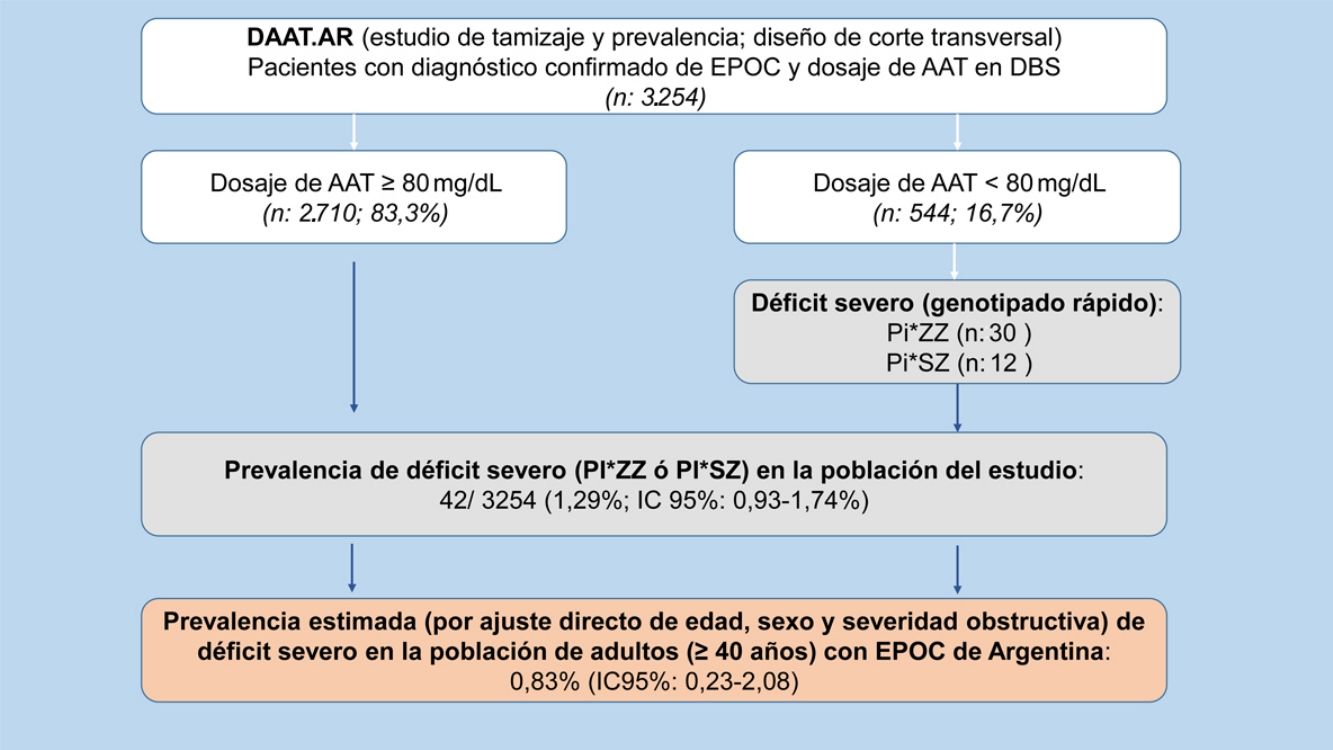
ResultadosSe incluyeron 3.254 pacientes (544 con AAT<80mg/dl) con diagnóstico espirométrico de EPOC. La prevalencia de DAAT en la población total del estudio fue de 1,29% (IC 95% 0,93-1,74), de los cuales un 0,92% (IC 95% 0,62-1,31) fueron Pi*ZZ y un 0,37% (IC 95% 0,19-0,64) Pi*SZ. La prevalencia ajustada de DAAT en pacientes con EPOC (≥40 años) fue de 0,83% (IC 95% 0,23-2,08). Encontramos asociación negativa de DAAT con la edad (OR 0,94; IC 95% 0,90-0,98; p=0,006), el consumo de tabaco (OR 0,98; IC 95% 0,96-0,99; p=0,009) y el VEF1% (OR 0,95; IC 95% 0,91-0,99; p=0,015).
ConclusionesSe estima que la prevalencia de DAAT en la población adulta con EPOC en Argentina es del 0,83%, lo cual podría representar 17.000 casos en nuestro país.
Alpha-1 antitrypsin deficiency (AATD) is still underdiagnosed, despite the recommendation to determine AAT in patients with chronic obstructive pulmonary disease (COPD).
ObjectiveTo estimate the prevalence of AATD in COPD patients adjusted according to the population of the COPD prevalence study in Argentina (EPOC.AR).
Material and methodsThis was a multicenter prospective cross-sectional study of a population aged≥30 years of age diagnosed with COPD, involving AAT quantification in dry blood spot and subsequent genotyping in subjects with<1.5mg/dL AAT in dry blood spot (<80mg/dL in serum). AAT was defined as the detection of variants ZZ or SZ on genotyping. The EPOC.AR study population was used to calculate local adjusted prevalence.
ResultsWe included 3,254 patients (544 with AAT<80mg/dL) with a spirometric diagnosis of COPD. The prevalence of AATD in the total study population was 1.29% (95% CI 0.93-1.74), of which 0.92% (95% CI 0.62-1.31) were Pi*ZZ and 0.37% (95% CI 0.19-0.64) Pi*SZ. The adjusted prevalence of AATD in COPD patients≥40 years of age was 0.83% (95% CI 0.23-2.08). We found that AATD was negatively associated with age (OR 0.94; 95% CI 0.90-0.98; P=.006), smoking habit (OR 0.98; 95% CI 0.96-0.99; P=.009), and FEV1% (OR 0.95; 95% CI 0.91-0.99; P=.015).
ConclusionsThe prevalence of AATD in the adult population with COPD in Argentina is estimated to be 0.83%, which could represent 17,000 cases in our country.
El déficit de alfa-1 antitripsina (AAT) es la enfermedad hereditaria autosómica codominante más frecuente en los pacientes adultos y se manifiesta por enfermedad pulmonar obstructiva crónica (EPOC) precoz, cirrosis hepática y con menor frecuencia paniculitis, vasculitis sistémicas y otras enfermedades raras1–3.
El déficit grave de AAT (DAAT) es habitualmente definido por una concentración sérica menor del 35% del valor esperado o de 50mg/dl determinado por nefelometría2. El DAAT está relacionado en más del 95% de los casos con genotipos Pi*ZZ y menos frecuentemente con otros genotipos producto de alelos Z, S, raros y nulos1–3.
La Organización Mundial de la Salud y guías internacionales y locales recomiendan la detección de AAT por lo menos una vez en la vida en todos los pacientes con EPOC, a pesar de lo cual existe globalmente un subdiagnóstico de esta enfermedad1–7.
La prevalencia de DAAT en la población general varía de 1:2.000-1:5.000 individuos en algunas regiones de Europa, a 1:5.000-10.000 en los Estados Unidos de América y Canadá, y es 5 veces menor en países latinoamericanos1,8. Una limitación en las estimaciones de prevalencia en pacientes con EPOC se basa frecuentemente en su cálculo teórico indirecto sin ajustar por características poblacionales o de EPOC. Por este motivo, y dada la escasa información epidemiológica en nuestro país y en la región, realizamos el presente estudio en 2 etapas. La primera etapa, previamente publicada, consistió en seleccionar 1.000 pacientes con EPOC, siendo el objetivo determinar la prevalencia de DAAT mediante la cuantificación de AAT en sangre por gota seca (DBS) con posterior genotipificación rápida en los pacientes con concentraciones por debajo de un umbral de corte9. La prevalencia encontrada de DAAT en los pacientes con EPOC en esta etapa fue de 1,5% (IC 95% 0,75-2,25)9. La primera etapa permitió definir mejor el número de pacientes, ajustar el umbral de corte (de 100 a 80mg/dl) y mejorar aspectos operativos, logísticos y de costos. La segunda etapa del estudio, que motiva la presente publicación, incluyó más pacientes en forma multicéntrica, que se analizan junto a los pacientes de la primera etapa en este artículo. El objetivo principal del estudio fue establecer la prevalencia del DAAT a través del ajuste directo. Usamos como población base la del estudio EPOC.AR, que investigó en el mismo período la prevalencia de EPOC en la Argentina utilizando una muestra probabilística representativa de la población adulta de nuestro país10. El objetivo secundario fue estudiar las características asociadas al DAAT.
MétodosDiseño y población del estudioEstudio multicéntrico realizado en 3 centros de referencia para enfermedades respiratorias de la ciudad y provincia de Buenos Aires, que además participaron en el estudio EPOC.AR. El estudio fue prospectivo, de corte transversal, e incluyó pacientes consecutivos de consulta espontánea, ≥30 años de edad, de ambos sexos, con diagnóstico de EPOC por espirometría (ver tabla de centros en material suplementario).
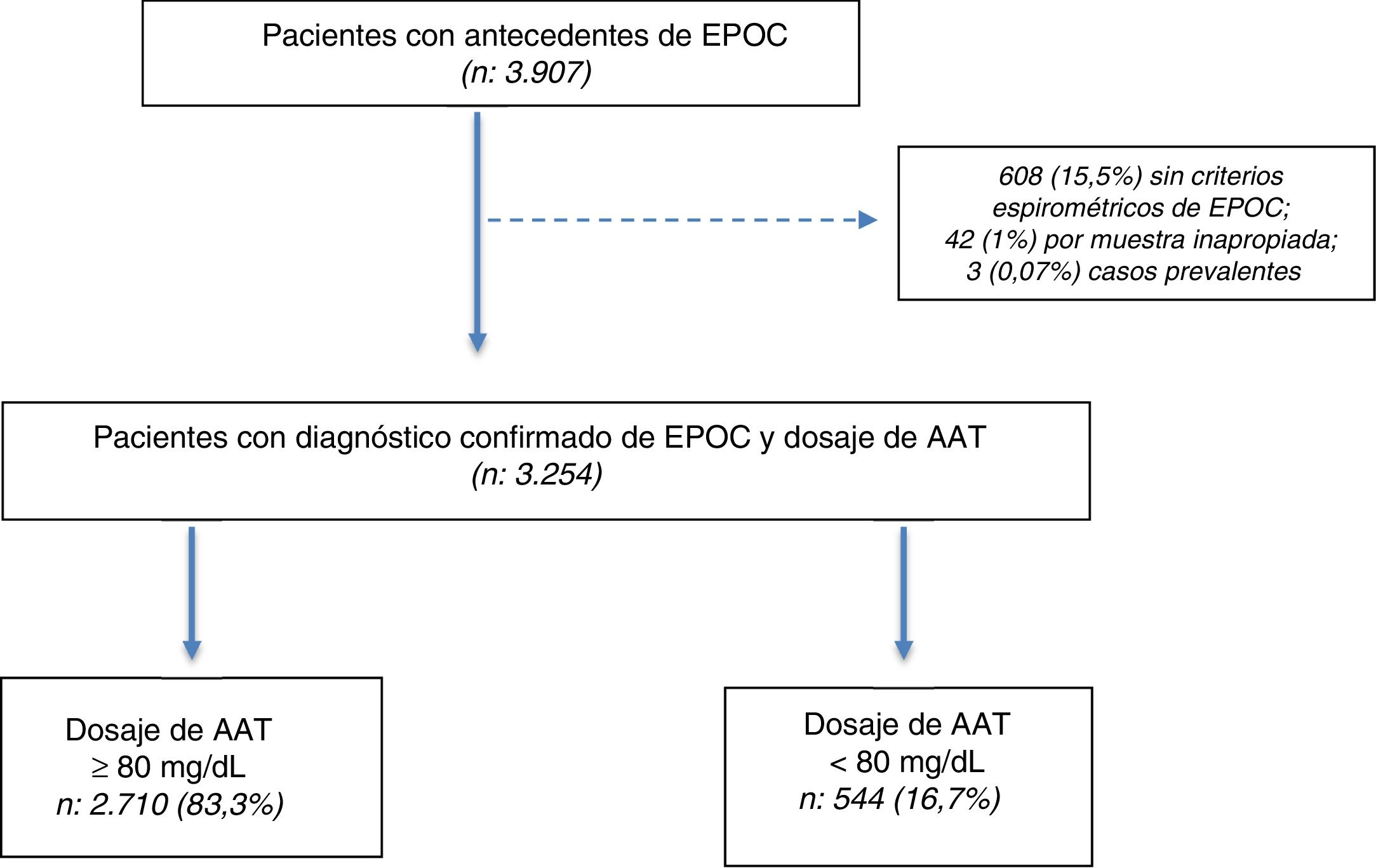
Se seleccionaron pacientes con antecedentes de EPOC a los que se les realizó una evaluación clínica, espirometría pre y posbroncodilatador con toma de sangre por punción capilar del pulpejo del dedo para realizar cuantificación de AAT en DBS. Fueron excluidos los pacientes cuya espirometría no reunía criterios de EPOC o cuya calidad era inadecuada, los pacientes con muestra insuficiente para realizar la determinación y los casos prevalentes no espontáneos de DAAT por diagnóstico previo o cribado familiar. Posteriormente se realizó una genotipificación rápida en los pacientes con concentraciones de AAT inferiores a 80mg/dl.
Definiciones y procedimientos de laboratorioSe realizó una espirometría pre y otra postinhalación de broncodilatador (400μg de salbutamol). Se definió EPOC en aquellos pacientes con un cociente VEF1/CVF posbroncodilatador<0,7 y se utilizó la clasificación GOLD 2017 para definir el grado de obstrucción11.
Las espirometrías se realizaron según las normas ATS/ERS 200512, y las ecuaciones de referencia utilizadas corresponden a NHANES III13.
Se siguió el procedimiento descrito en la primera etapa9, que resumimos a continuación. La totalidad de las muestras de sangre de todos los centros participantes fueron obtenidas por extracción de sangre del pulpejo y aplicadas a 5 discos de papel secante (DBS, número 903; Schleicher & Schuell; BioScience Inc., Keene, NH, EE. UU.). Se dejaron secar a temperatura ambiente antes de ser enviadas al laboratorio central del Hospital Italiano de Buenos Aires, donde se realizaron todas las determinaciones de laboratorio.
La cuantificación de AAT en DBS se efectuó por inmunonefelometría (Immage®; Beckman Coulter, Inc., Brea, CA, EE. UU.). Se realizó una curva de regresión, con la que fue posible estimar la concentración de AAT en suero a partir de la concentración en DBS. Se utilizó un punto de corte de 1,5mg/dl, que corresponde a 80mg/dl de AAT sérica (ver material suplementario). Se realizó una genotipificación rápida en aquellos pacientes que presentaban una concentración de AAT inferior al punto de corte. El método utilizado para realizar la genotipificación rápida fue una reacción en cadena de la polimerasa (PCR) en tiempo real (LightCycler®; Roche Diagnostics, Mannheim, Alemania) con cebadores para amplificación de 2 fragmentos de 177pb y 229pb. Se utilizaron sondas de hibridación específicas para la detección de la mutación S (E264V) y Z (E342K), respectivamente (ver material suplementario). La genotipificación rápida se realizó por PCR en tiempo real en los pacientes con determinación de AAT<80mg/dl en DBS (n=544). En 25 pacientes (4,6%) no se pudo realizar la genotipificación por motivos técnicos relacionados con la muestra.
Se clasificaron los pacientes según la combinación de alelos codominantes S y Z, y se consideraron como genotipo asociado a déficit grave (DAAT) las variantes SZ y ZZ. La fenotipificación en suero fue realizada de forma no sistemática y solo en casos seleccionados cuando existía una discordancia entre la concentración de la proteína correspondiente a déficit y el genotipo y/o ante una fuerte sospecha clínica del médico investigador y/o para reafirmar el diagnóstico.
No obstante, es necesario resaltar que una gran proporción de los pacientes citados para la fenotipificación no concurrieron por diferentes cuestiones personales, geográficas, económicas y, por ende, no se pudo realizar este estudio en todos los casos. Para la fenotipificación en suero se utilizó la técnica de isoelectroenfoque (IEF-Hydrasys®; Sebia, París, Francia). En aquellos pacientes con discordancia entre el genotipo y el fenotipo se realizó secuenciación del ADN genómico obtenido de muestras de sangre entera. La amplificación de los exones 2-5 de AAT se realizó mediante PCR con pares de cebadores específicos. Los productos de PCR purificados se secuenciaron utilizando el analizador genético Applied Biosystems® 3500 (Thermo Fisher Scientific, Foster city, CA, EE. UU.) (ver material suplementario).
Aspectos éticosEl estudio fue aprobado por los comités de revisión institucional y/o ética de los centros intervinientes. Todos los pacientes debieron firmar un consentimiento informado antes de ingresar. El estudio se realizó respetando las normativas locales para estudios observacionales (resolución 1480/2011 del Ministerio de Salud de la Nación).
Análisis estadísticoSe calculó el tamaño muestral con base en una prevalencia estimada de DAAT del 1,5% de la población adulta con EPOC, según los valores obtenidos en el análisis interino de los primeros 1.000 pacientes9. Se planteó el cálculo con una confianza del 95%, un efecto de diseño de 1,4 y una precisión total de ±0,5%, por lo que el número de pacientes con diagnóstico de EPOC confirmado por espirometría y determinación de AAT en DBS a seleccionar fue de 3.179. Estimando una tasa de pérdida inicial del 20%, el número de pacientes adultos con sospecha de EPOC a seleccionar fue de 3.740. Estimamos la prevalencia de DAAT en sujetos con EPOC de Argentina basándonos en el ajuste directo por edad, sexo y clasificación GOLD 2017 de la población del estudio EPOC.AR que fue obtenida por muestreo probabilístico10 (ver material suplementario). Para ello, excluimos de este análisis a los 52 pacientes menores de 40 años de nuestra cohorte, para que esta fuera absolutamente comparable con la población del EPOC.AR, que incluyó pacientes a partir de dicha edad.
Los intervalos de confianza del 95% (IC 95%) se calcularon por el método exacto de Clopper-Pearson basado en la distribución binomial. Se realizó un análisis bivariado, por métodos no paramétricos para variables continuas (Kruskal-Wallis) y test de chi cuadrado (o exacto de Fisher) para categóricas, a los efectos de estudiar variables asociadas al DAAT. Se realizó un análisis ajustado por regresión logística para establecer posibles factores asociados a DAAT, incluyendo en el modelo las variables con p<0,1 en el análisis bivariado. Se utilizó la odds ratio (OR) como medida de asociación, con su IC 95%. Se estableció un valor de 5% como nivel de significación.
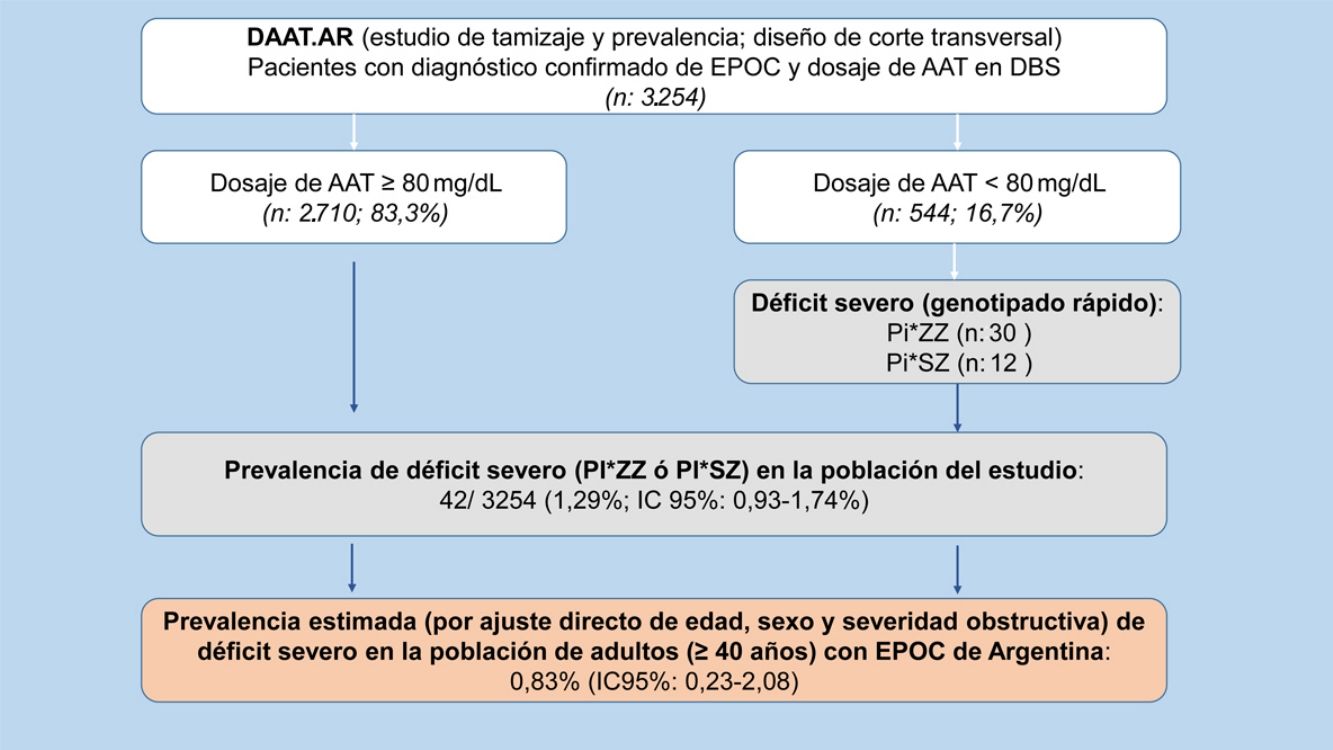
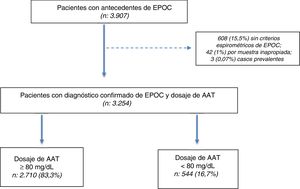
ResultadosSe seleccionaron 3.907 pacientes con una edad≥30 años y antecedentes de EPOC entre julio del 2009 y julio del 2018. De los 3.907 pacientes seleccionados, en 3.254 (83,2%) se confirmó el diagnóstico por espirometría posbroncodilatador y se obtuvo una muestra en DBS para la determinación de AAT (fig. 1).
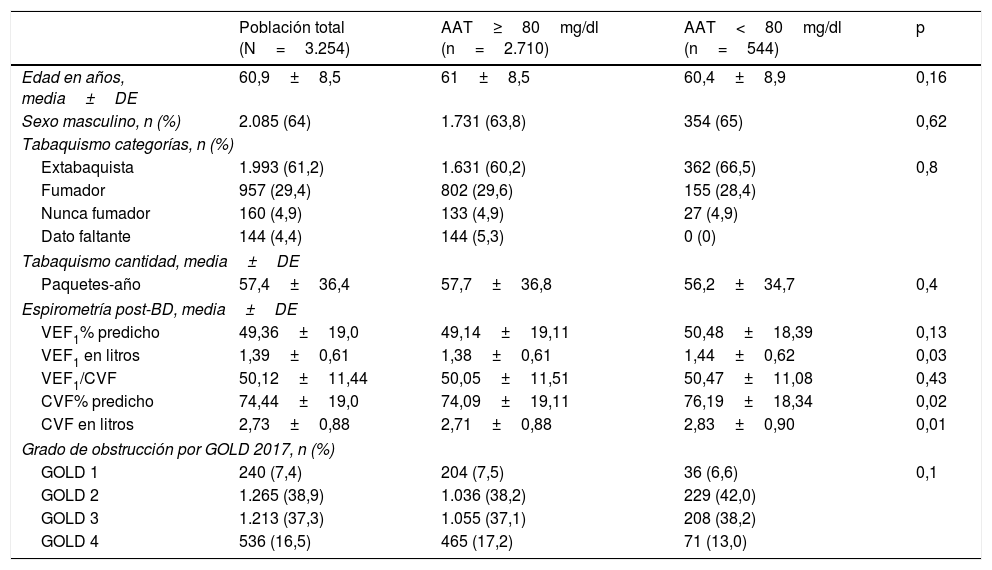
Características de la poblaciónDe los 3.254 incluidos (población total), 544 (16,7%) tuvieron concentraciones de AAT<80mg/dl. La población total se caracterizó por tener una edad promedio de 60,9±8,5 años, predominio del sexo masculino (64%), alta prevalencia de tabaquismo actual o pasado (90,6%), con preponderancia de formas graves y muy graves según la clasificación GOLD 2017 (37,3 y 16,5%, respectivamente) (tabla 1).
Características de los pacientes
| Población total (N=3.254) | AAT≥80mg/dl (n=2.710) | AAT<80mg/dl (n=544) | p | |
|---|---|---|---|---|
| Edad en años, media±DE | 60,9±8,5 | 61±8,5 | 60,4±8,9 | 0,16 |
| Sexo masculino, n (%) | 2.085 (64) | 1.731 (63,8) | 354 (65) | 0,62 |
| Tabaquismo categorías, n (%) | ||||
| Extabaquista | 1.993 (61,2) | 1.631 (60,2) | 362 (66,5) | 0,8 |
| Fumador | 957 (29,4) | 802 (29,6) | 155 (28,4) | |
| Nunca fumador | 160 (4,9) | 133 (4,9) | 27 (4,9) | |
| Dato faltante | 144 (4,4) | 144 (5,3) | 0 (0) | |
| Tabaquismo cantidad, media±DE | ||||
| Paquetes-año | 57,4±36,4 | 57,7±36,8 | 56,2±34,7 | 0,4 |
| Espirometría post-BD, media±DE | ||||
| VEF1% predicho | 49,36±19,0 | 49,14±19,11 | 50,48±18,39 | 0,13 |
| VEF1 en litros | 1,39±0,61 | 1,38±0,61 | 1,44±0,62 | 0,03 |
| VEF1/CVF | 50,12±11,44 | 50,05±11,51 | 50,47±11,08 | 0,43 |
| CVF% predicho | 74,44±19,0 | 74,09±19,11 | 76,19±18,34 | 0,02 |
| CVF en litros | 2,73±0,88 | 2,71±0,88 | 2,83±0,90 | 0,01 |
| Grado de obstrucción por GOLD 2017, n (%) | ||||
| GOLD 1 | 240 (7,4) | 204 (7,5) | 36 (6,6) | 0,1 |
| GOLD 2 | 1.265 (38,9) | 1.036 (38,2) | 229 (42,0) | |
| GOLD 3 | 1.213 (37,3) | 1.055 (37,1) | 208 (38,2) | |
| GOLD 4 | 536 (16,5) | 465 (17,2) | 71 (13,0) | |
AAT: alfa-1 antitripsina; CVF: capacidad vital forzada; DE: desviación estándar; post-BD: post broncodilatador; VEF1: volumen espiratorio forzado en un segundo.
No encontramos diferencias clínicamente relevantes entre los subgrupos de pacientes con determinación de AAT por DBS≥80mg/dl y <80mg/dl (tabla 1).
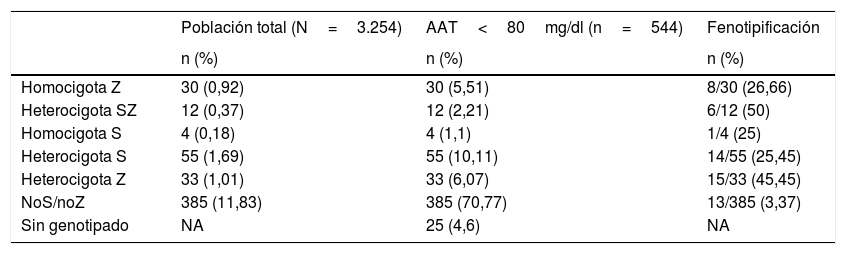
Prevalencia de déficit grave de alfa-1 antitripsinaSe encontró DAAT, definido como las variantes SZ y ZZ, en 42 pacientes (7,72%; IC 95% 5,62-10,29). A través de la extrapolación de este resultado a la población total de nuestro estudio observamos una prevalencia de DAAT de 42/3.254 (1,29%; IC 95% 0,93-1,74) en los pacientes con EPOC incluidos en el estudio, de los cuales un 0,92%(IC 95% 0,62-1,31) fueron Pi*ZZ y un 0,37% (IC 95% 0,19-0,64) Pi*SZ (tabla 2).
Características de la genotipificación rápida
| Población total (N=3.254) | AAT<80mg/dl (n=544) | Fenotipificación | |
|---|---|---|---|
| n (%) | n (%) | n (%) | |
| Homocigota Z | 30 (0,92) | 30 (5,51) | 8/30 (26,66) |
| Heterocigota SZ | 12 (0,37) | 12 (2,21) | 6/12 (50) |
| Homocigota S | 4 (0,18) | 4 (1,1) | 1/4 (25) |
| Heterocigota S | 55 (1,69) | 55 (10,11) | 14/55 (25,45) |
| Heterocigota Z | 33 (1,01) | 33 (6,07) | 15/33 (45,45) |
| NoS/noZ | 385 (11,83) | 385 (70,77) | 13/385 (3,37) |
| Sin genotipado | NA | 25 (4,6) | NA |
AAT: alfa-1 antitripsina; NA: no aplica.
La tabla muestra los porcentajes de las diferentes variantes en el subgrupo con AAT<80mg/dl y extrapolación a la población total del estudio. Porcentaje de casos con genotipificación en los que se realizó también fenotipificación (ver también tabla 3).
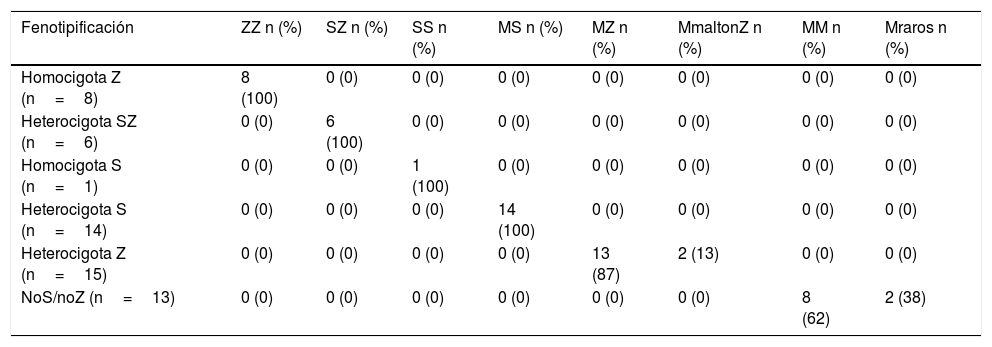
En los 15 casos con genotipo heterocigoto Z donde se realizó fenotipificación (por isoelectroenfoque), 13 (86,6%) resultaron ser MZ y 2 (13,3%) fueron formas raras MmaltonZ, confirmados por secuenciación (tabla 3).
Características de la fenotipificación por isoelectroenfoque realizada en casos seleccionados
| Fenotipificación | ZZ n (%) | SZ n (%) | SS n (%) | MS n (%) | MZ n (%) | MmaltonZ n (%) | MM n (%) | Mraros n (%) |
|---|---|---|---|---|---|---|---|---|
| Homocigota Z (n=8) | 8 (100) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| Heterocigota SZ (n=6) | 0 (0) | 6 (100) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| Homocigota S (n=1) | 0 (0) | 0 (0) | 1 (100) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| Heterocigota S (n=14) | 0 (0) | 0 (0) | 0 (0) | 14 (100) | 0 (0) | 0 (0) | 0 (0) | 0 (0) |
| Heterocigota Z (n=15) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 13 (87) | 2 (13) | 0 (0) | 0 (0) |
| NoS/noZ (n=13) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | 8 (62) | 2 (38) |
Luego del ajuste directo, por edad, sexo y grado de severidad obstructiva de la clasificación GOLD 2017, la prevalencia de DAAT en pacientes con EPOC (≥40 años) de la Argentina resultó ser del 0,83% (IC 95% 0,23-2,08).
Análisis ajustado de factores asociados con DAATUno de los objetivos secundarios del estudio fue analizar potenciales diferencias en las características demográficas y espirométricas en los pacientes con genotipificación rápida comparando los pacientes categorizados como no deficitarios (no S, no Z), déficit leve a moderado (heterocigota S o Z u homocigota S) y déficit grave (SZ y ZZ).
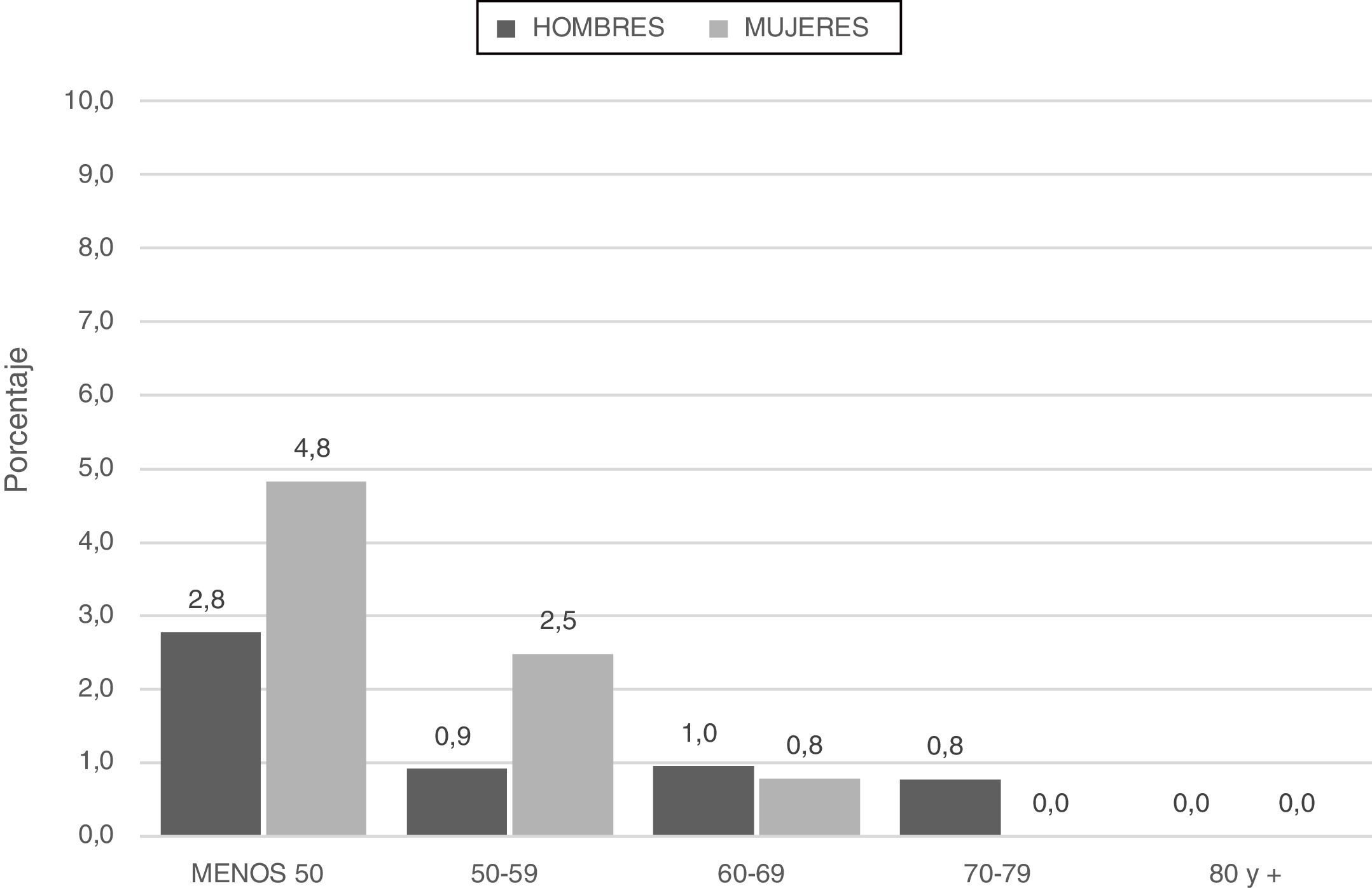
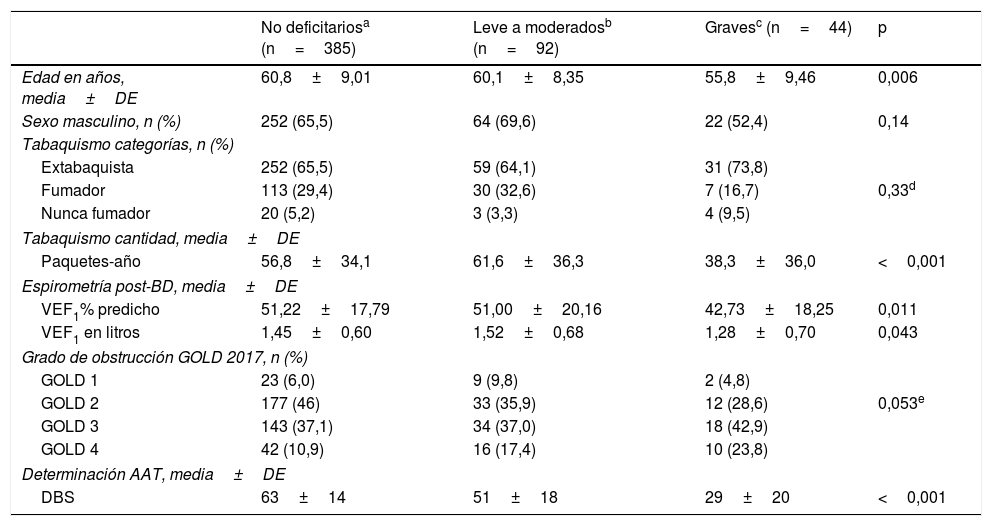
Los pacientes categorizados con déficit grave (SZ o ZZ) tuvieron menor edad y menor consumo de tabaco (paquetes-año) (fig. 2; tabla 4).
Características de los subgrupos categorizados por genotipificación rápida
| No deficitariosa (n=385) | Leve a moderadosb (n=92) | Gravesc (n=44) | p | |
|---|---|---|---|---|
| Edad en años, media±DE | 60,8±9,01 | 60,1±8,35 | 55,8±9,46 | 0,006 |
| Sexo masculino, n (%) | 252 (65,5) | 64 (69,6) | 22 (52,4) | 0,14 |
| Tabaquismo categorías, n (%) | ||||
| Extabaquista | 252 (65,5) | 59 (64,1) | 31 (73,8) | |
| Fumador | 113 (29,4) | 30 (32,6) | 7 (16,7) | 0,33d |
| Nunca fumador | 20 (5,2) | 3 (3,3) | 4 (9,5) | |
| Tabaquismo cantidad, media±DE | ||||
| Paquetes-año | 56,8±34,1 | 61,6±36,3 | 38,3±36,0 | <0,001 |
| Espirometría post-BD, media±DE | ||||
| VEF1% predicho | 51,22±17,79 | 51,00±20,16 | 42,73±18,25 | 0,011 |
| VEF1 en litros | 1,45±0,60 | 1,52±0,68 | 1,28±0,70 | 0,043 |
| Grado de obstrucción GOLD 2017, n (%) | ||||
| GOLD 1 | 23 (6,0) | 9 (9,8) | 2 (4,8) | |
| GOLD 2 | 177 (46) | 33 (35,9) | 12 (28,6) | 0,053e |
| GOLD 3 | 143 (37,1) | 34 (37,0) | 18 (42,9) | |
| GOLD 4 | 42 (10,9) | 16 (17,4) | 10 (23,8) | |
| Determinación AAT, media±DE | ||||
| DBS | 63±14 | 51±18 | 29±20 | <0,001 |
AAT: alfa-1 antitripsina; DBS: sangre capilar en gota seca; DE: desviación estándar; post-BD: post broncodilatador; VEF1: volumen espiratorio forzado en un segundo.
Al analizar las características espirométricas observamos que los pacientes con déficit grave (SZ o ZZ) se caracterizaron por menor VEF1 y una tendencia a mayor proporción de pacientes con GOLD 2017 grados 3-4 (66,7%) en relación con los pacientes con genotipo leve o no deficitario (54,4 y 48%, respectivamente) (p=0,053) (tabla 4).
Luego de ajustar por regresión logística, las variables asociadas negativamente y de forma independiente con el DAAT fueron la edad (OR 0,94; IC 95% 0,90-0,98; p=0,006), el consumo de tabaco medido a través de la cantidad de paquetes-año (OR 0,98; IC 95% 0,96-0,99; p=0,009) y el VEF1% (OR 0,95; IC 95% 0,91-0,99; p=0,015). A pesar de esto, las 3 variables mostraron un bajo poder de discriminación en el análisis del área bajo la curva ROC, que resultó de 0,64 (IC 95% 0,55-0,73) para la edad, 0,69 (IC 95% 0,60-0,79) para los paquetes-año y 0,63 (IC 95% 0,54-0,73) para el VEF1%, respectivamente.
DiscusiónLa EPOC es un problema de salud pública mundial y se espera un incremento de la mortalidad en los próximos 15 años14. Además del tabaco existen otros factores que contribuyen a su desarrollo, siendo el DAAT uno de los más relevantes1,15.
Los pacientes con DAAT y variante Pi*ZZ se caracterizan por concentraciones de AAT con niveles por debajo del 15% del valor normal y tienen mayor mortalidad, en especial en presencia de tabaquismo y deterioro del VEF1. Los pacientes con variante Pi*SZ con niveles de AAT de un 40% del valor normal tienen un mayor riesgo de desarrollar EPOC si son tabaquistas1,15. A pesar de la relevancia del diagnóstico precoz y de las recomendaciones clínicas, existe un subdiagnóstico global de esta enfermedad1–7.
Nuestro estudio se realizó siguiendo las recomendaciones internacionales y locales utilizando un programa de cribado en EPOC basado en la determinación de AAT en muestras de DBS con posterior evaluación en los pacientes con concentraciones por debajo de un umbral de corte16,17. Se incluyeron pacientes≥30 años con diagnóstico de EPOC por espirometría y encontramos 42 pacientes (1,29%) con DAAT, de los cuales 30 fueron variantes Pi*ZZ (0,92%) y 12 variantes Pi*SZ (0,37%). Estos porcentajes se hallan dentro del rango de prevalencias encontrados en diferentes megarregistros de otros países18–24, que ha variado de solo un 0,2% de variantes Pi*SZ en Alemania19 a un 7,3% de Pi*ZZ y un 1,9% de variantes Pi*SZ en Italia18, y por encima de lo reportado en Brasil, donde un estudio reciente observó un 0,64% de variantes Pi*ZZ y un 0,1% de Pi*SZ24. Las diferencias de prevalencia entre los estudios de registros son significativas y seguramente multifactoriales. Uno de los motivos más importantes está relacionado con los distintos criterios aplicados en la selección de pacientes. La inclusión de casos de DAAT prevalentes no espontáneos o conocidos versus solo los casos nuevos de presentación espontánea es un factor muy importante que puede aumentar falsamente el porcentaje de prevalencia, especialmente cuando el programa se realiza o está influenciado por centros especializados con un alto interés e historia investigando la enfermedad, que además coincidentemente son los de mayor aportación de casos. Nosotros hemos excluido la totalidad de los casos prevalentes no espontáneos, ya sea por ser de conocimiento o diagnóstico previo o por hallados a través del cribado familiar de un caso índice no espontáneo.
Los estudios mencionados también han diferido en la edad de corte para la inclusión de pacientes, las características de la EPOC y/o de la enfermedad respiratoria (incluyendo también pacientes con asma, bronquiectasias y otras afecciones respiratorias crónicas) y la metodología para el análisis de las muestras3,15,22. Hemos tratado de controlar estos potenciales sesgos a través de los criterios de selección de pacientes y seguir una metodología del análisis de las muestras en función de estudios de otros países como España21 y en línea con las recomendaciones actuales16.
Aun luego de controlar estos sesgos, la población de nuestro estudio muestra diferencias relevantes en edad, sexo y severidad de la EPOC con respecto a la población de pacientes con esta enfermedad en nuestro país. Por este motivo realizamos un ajuste directo (por edad, sexo y estadios de severidad GOLD) del cálculo de prevalencia tomando como población base la obtenida por muestreo poblacional probabilístico en el mismo período en el estudio de prevalencia de EPOC en la Argentina, estudio EPOC.AR10. A partir de estos cálculos se estimó que el 0,83% de los pacientes adultos (≥40 años) con EPOC de nuestro país tendrían DAAT. Si bien la exclusión de casos prevalentes, la unificación de los criterios de inclusión y el ajuste directo no eliminan los sesgos inherentes al tipo de diseño, creemos que la cifra de prevalencia es más cercana a la real y consistente con estudios con muestreo poblacional y análisis genético con cálculo de la prevalencia basada en la ley de equilibrio de Hardy-Weinberg25–26.
El valor de corte menor de 80mg/dl para la genotipificación fue elegido por razones operativas, administrativas y de costo; no obstante, la elección de un valor de corte de 120mg/dl, tal como se recomienda en la actualidad, podría mejorar la sensibilidad del cribado16. Una de las limitantes adicionales de nuestro estudio es que la fenotipificación en suero fue realizada de forma no sistemática y solo en algunos casos seleccionados, con una gran proporción de pacientes que no acudió a la segunda consulta para realizar el análisis. Debido a esto es posible que existan variantes raras que sean de relevancia clínica que no hayamos detectado. Esta dificultad se podría resolver en el futuro mediante la implementación de técnicas de fenotipado en DBS, que permitiría con una única muestra realizar un diagnóstico definitivo.
Al analizar posibles factores asociados con el DAAT, encontramos que las variables asociadas negativamente con el déficit grave fueron la edad, el consumo de tabaco medido a través de la cantidad de paquetes-año y el VEF1. Este hallazgo es consistente con lo descrito en otros estudios en los cuales se observaron diferencias significativas o tendencias en las mismas variables22,24,27. Tal como mencionan las guías y ha sido destacado en nuestro trabajo, la presencia de EPOC en población más joven o con menor exposición al tabaco o formas más severas con menor VEF1 debe aumentar el grado de sospecha clínica de DAAT.
ConclusionesSe estima que la prevalencia de DAAT en la población adulta con EPOC en Argentina es del 0,83%, lo cual podría representar 17.000 casos en nuestro país. La prevalencia observada en nuestro estudio confirma la estimación teórica poblacional8 e implica un alto grado de subdiagnóstico de la enfermedad. Estos hallazgos refuerzan la necesidad de acentuar las campañas dirigidas a la concienciación del DAAT asociado a EPOC, extender el programa de cribado a más centros en todo el país y redoblar los esfuerzos para contar con un registro nacional de pacientes con la enfermedad.
FinanciaciónEl presente estudio fue realizado con la ayuda financiera del laboratorio Tuteur S. A. en Argentina y la Sociedad de Tisiología y Neumonología de la Provincia de Buenos Aires (STNBA). Los financiadores no participaron en el diseño del estudio, la recogida de datos, el análisis e interpretación de los mismos ni la redacción de esta comunicación.
Conflicto de interesesGM ha recibido ayuda financiera de los laboratorios Tuteur S. A. y Grifols S. A. para la asistencia a congresos. MFA ha recibido ayuda financiera de los laboratorios Tuteur S. A. y Grifols S. A. para la asistencia a congresos. ALE ha recibido ayuda financiera del laboratorio Tuteur S. A. para la asistencia a congresos. PBS ha recibido ayuda financiera del laboratorio Teva para la asistencia a congresos. MEF ha recibido ayuda financiera de los laboratorios Tuteur S. A. y Grifols S. A. para la asistencia a congresos. El resto de los autores declara no tener ningún conflicto de intereses.
Queremos recordar y agradecer especialmente al primer autor, el Dr. Guillermo Menga, quien ha sido pionero y líder en la investigación de déficit de alfa-1 antitripsina en Latinoamérica y que lamentablemente falleció durante la redacción de este manuscrito.
Agradecemos al grupo de estudio DAAT.AR, cuyos centros e investigadores listamos a continuación: Hospital Municipal de Rehabilitación Respiratoria María Ferrer: Dres. Guillermo Menga y Martin Fernández y Dra. Melina Girbal; Hospital Especializado de Agudos y Crónicos Dr. Antonio Cetrángolo: Dres. Mariano Fernández Acquier, Orlando Lopez Jové, Wu Yu Feng y Hsueh Yu Tang; Hospital Interzonal Especializado de Agudos y Crónicos San Juan de Dios, de La Plata: Dr. Andres L. Echazarreta, Enf. María del Carmen Sanchez, Dras. Maria Fernanda Curró, Silvana Márquez, Yesica Correa, Miriam Sainz, Ana Luz Sánchez y Dr. Raul Grandi Vega; Hospital Italiano de Buenos Aires: Dras. Patricia B. Sorroche, Maria V. Lorenzon y María S. Saez.
Agradecemos especialmente a Sergio Arias y Gustavo Armando (Instituto Nacional de Enfermedades Respiratorias Dr. Emilio Coni, Santa Fe, Argentina) por proporcionar la apertura de la población base del estudio EPOC-AR para realizar el cálculo de la prevalencia por ajuste directo. También agradecemos a Raúl Bozzo (IC Projects) su colaboración en el análisis de los datos y la coordinación de la publicación.