El estándar de referencia para el diagnóstico de las enfermedades pulmonares intersticiales difusas (EPID) es la evaluación multidisciplinaria1. En ocasiones la biopsia pulmonar es necesaria para incrementar la confianza diagnóstica2. La criobiopsia transbronquial (CBTB) ha surgido como una alternativa a la biopsia quirúrgica con menor morbimortalidad3,4. Las complicaciones más frecuentes de la criobiopsia son el neumotórax y el sangrado4,5. Aunque han sido descritos tres casos de cavitación pulmonar posterior a dicho procedimiento, no existen casos reportados de neumatocele secundarios al mismo. Presentamos un caso de neumatocele como complicación de una CBTB.
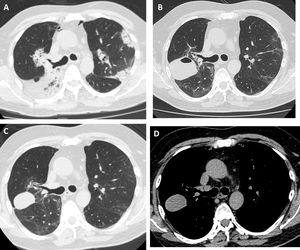
Se trata de un varón no fumador, sin antecedentes de relevancia, de 55 años que fue derivado a nuestra institución por una neumonía de lenta resolución. Un mes antes presentó tos, disnea y opacidades pulmonares bilaterales. Recibió tratamiento antibiótico empírico con amoxicilina-sulbactam y claritromicina, luego piperacilina-tazobactam y finalmente vancomicina, sin mejoría clínica y con empeoramiento de la oxigenación. Al ingreso se encontraba hipoxémico, con una saturación de oxígeno del 90% respirando aire ambiente. La analítica no arrojó resultados relevantes: recuento de eosinófilos dentro de límites normales, velocidad de eritrosedimentación de 34mm en la primera hora, serología para el VIH negativa, ANCA, FAN negativos y CPK dentro de los límites normales. La tomografía computarizada (TC) de tórax evidenció consolidaciones bilaterales, a predominio periférico, con distribución peribroncovascular y algunas zonas con signo de halo invertido (fig. 1A). Realizamos una broncoscopia con lavado broncoalveolar (LBA) y toma de biopsia transbronquial por criosonda de 1,9mm. Se tomaron 5 biopsias en el lóbulo superior derecho, tres en el segmento posterior y dos en el segmento apical. El procedimiento concluyó sin complicaciones. La anatomía patológica arrojó hallazgos característicos de neumonía en organización. Comenzamos tratamiento con prednisona en dosis de 0,5mg/kg/día. El paciente evolucionó sin fiebre y con mejoría progresiva de la disnea. Al mes de tratamiento en una radiografía de tórax de control se evidenció una cavidad en el campo superior del hemitórax derecho. Para caracterizar la imagen se realizó una TC de tórax sin contraste que mostró una formación de bordes lisos, de 3cm de diámetro en el segmento posterior del lóbulo superior derecho (fig. 1B). A pesar de encontrarse asintomático, con una analítica normal y velocidad de eritrosedimentación de 5mm en la primera hora, tomamos un LBA al segmento pulmonar afectado. Los resultados microbiológicos fueron negativos y la celularidad del LBA normal. Se interpretó que la imagen era secundaria a un neumatocele con contenido en su interior producto de la CBTB. Decidimos optar por una conducta expectante y seguimiento clínico. A los dos meses el paciente se encontraba asintomático y la TC mostró la persistencia de la cavidad con una densidad homogénea de 30-40 unidades Hounsfield, en contacto con la pleura y la cisura mayor (fig. 1C y D).
Tomografía de tórax de alta resolución. A) Antes de realizar CBTB: consolidaciones bilaterales con broncograma aéreo de distribución periférica y peribroncovascular. B) Un mes posterior a CBTB: lesión con nivel hidroaéreo en el lóbulo superior derecho. C y D) Tres meses posterior a CBTB: disminución de tamaño de la lesión con desaparición o reabsorción del contenido aéreo y persistencia del contenido hemático (hematocele).
El origen neoplásico de la lesión es poco probable debido a su morfología, el escaso tiempo de desarrollo y a la reducción de su tamaño en el seguimiento. La aparición posterior al procedimiento de CBTB y la localización en uno de los segmentos pulmonares biopsiados, sugieren que la lesión pulmonar fue una complicación de la CBTB. La ausencia de síntomas, de alteraciones en la analítica y de rescate microbiológico en el LBA, así como la evolución clínica favorable sin tratamiento antibiótico, alejaron la posibilidad de un absceso pulmonar. En la TC de tórax no se evidenció derrame pleural y el parénquima pulmonar que rodeaba a la lesión estaba sano, en virtud de estos hallazgos se desestimó la presencia de un tumor evanescente que siguiera el plano de la cisura y un hematoma pulmonar. Las características radiológicas de la lesión: cavidad hidroaérea, de pared delgada y regular, con márgenes lisos sustentan el diagnóstico de un neumatocele. La densidad de 30-40 unidades Hounsfield sugiere contenido hemático de la cavidad6 como complicación secundaria. Consideramos que el neumatocele fue producto de la necrosis generada por la criobiopsia.
A nuestro entender, este es el primer caso reportado de neumatocele posterior a una CBTB. El neumatocele es un espacio aéreo con pared fina contenido dentro del parénquima pulmonar7. Suele ser único, transitorio y en ocasiones presenta niveles líquidos en su interior. Su patogenia se ha relacionado con una combinación de necrosis y un mecanismo valvular en la vía aérea que permitiría el ingreso de aire pero no su salida8. Las causas descritas de neumatocele son: neumonía, trauma torácico, ingestión de hidrocarburos y ventilación con presión positiva9.
La CBTB es un método cada vez más utilizado para la evaluación de las EPID y este incremento puede favorecer la aparición de nuevas complicaciones. Las complicaciones que se han informado son: sangrado moderado-severo (14,2%), neumotórax (9,4%), exacerbación de EPID (0,3%), muerte (0,3%), neumomediastino, arritmias e infecciones pulmonares5,10. Existen dos reportes de casos de abscesos pulmonares11,12 y uno de una cavitación no infecciosa13, pero en ninguna de las series se describió la aparición de neumotacele.
En conclusión, el neumatocele es una complicación posible de la CBTB y debe ser considerado en aquellos pacientes que realizan dicho procedimiento.