Presentamos un análisis de incidencia de disfunción renal y mortalidad de los pacientes a quienes se practicó un trasplante pulmonar en nuestro centro según el grado de insuficiencia renal que desarrollaron en el postoperatorio inmediato, a los 30 días, a los 6 meses y al año de realizado el trasplante.
Material y métodosDurante el período definido (de marzo de 1997 a enero de 2006) se realizaron 144 trasplantes de pulmón en nuestro centro. Hubo 6 pérdidas en el seguimiento de los pacientes. Se clasificó a los pacientes en 5 grupos dependiendo del valor del filtrado glomerular en el momento de ingreso en la unidad de cuidados intensivos, al mes, a los 6 y 12 meses de realizado el trasplante, según la clasificación Chronic Kidney Disease (CKD). Se realizó un análisis estadístico descriptivo de la muestra. Se estudió la relación entre el CKD y la mortalidad, medida como odds ratios, mediante regresión logística. Se realizó un análisis de correlación entre el CKD al ingresar, al mes, a los 6 meses y al año de realizado el trasplante mediante el coeficiente de correlación de Spearman.
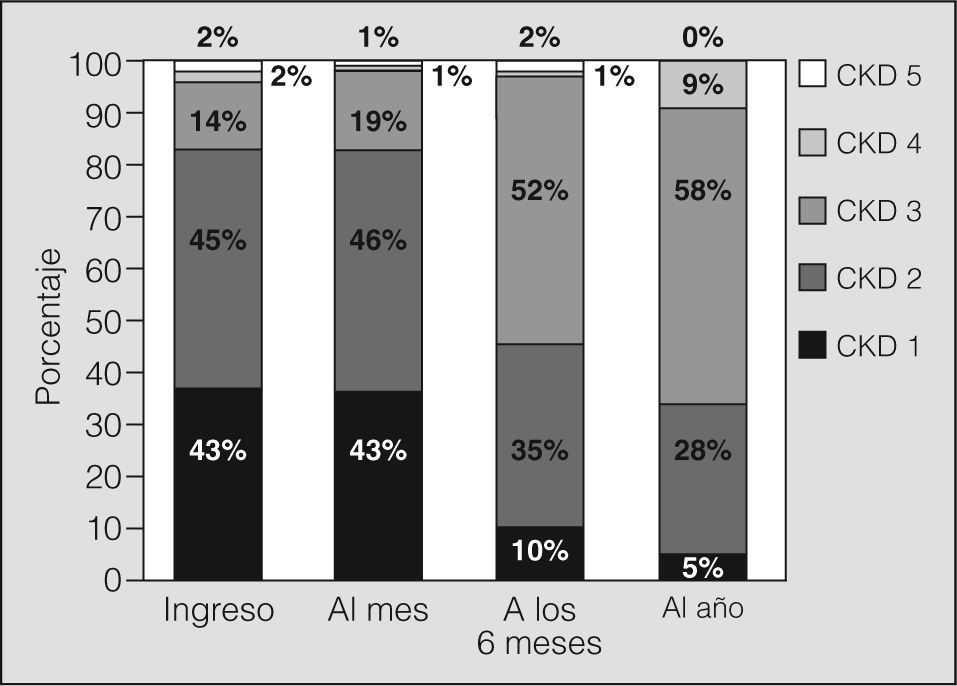
ResultadosDe los 144 pacientes analizados, se clasificó, atendiendo al filtrado glomerular, a 52 en el grupo I, a 63 en el grupo II, a 19 en el III, a 2 en el IV y a otros 2 en el V. La asociación entre mortalidad al mes y CKD al ingresar no evidenció significación estadística (odds ratio = 1,11; intervalo de confianza del 95%, 0,42-3,11; p=0,82) entre los pacientes con función renal normal (CKD 1) y aquéllos con algún grado de insuficiencia renal (CKD 2-5). No se encontró correlación entre el CKD al ingreso y el CKD al mes, a los 6 meses y al año. Sin embargo, se halló una correlación positiva (significativa) entre el CKD al mes y el CKD a los 6 meses y al año.
ConclusionesNo encontramos diferencias de asociación con la mortalidad al mes atendiendo al grado de insuficiencia renal en el postoperatorio inmediato de los pacientes con trasplante de pulmón. Existe una correlación positiva entre el grado de insuficiencia renal al mes y el observado a los 6 y 12 meses de realizado el trasplante.
We studied the incidence of postoperative renal failure and its association with mortality in lung transplant patients in our hospital classified according to the severity of renal failure in the immediate postoperative period, and at 30 days, 6 months, and 1 year after transplantation.
Material and methodsFor the period March 1997 through January 2006, 144 lung transplants were performed in our hospital. Six patients were lost to follow-up. Patients were assigned to 1 of the 5 Chronic Kidney Disease (CKD) classes according to the glomerular filtration rate on admission to the intensive care unit, and at 1 month, 6 months, and 12 months. Descriptive statistics were calculated for the sample. The relationship between the CKD classification and mortality was analyzed by calculating the odds ratio with a logistic regression model. The correlation between CKD classification on admission and at 1 month, 6 months, and 1 year after transplantation was analyzed using the Spearman correlation coefficient.
ResultsOf the 144 patients analyzed, 52 patients were in CKD class 1, 63 in class 2, 19 in class 3, 2 in class 4, and 2 in class 5, according to the glomerular filtration rate. The correlation between mortality at 1 month and CKD classification on admission was not statistically significant (odds ratio, 1.11; 95% confidence interval, 0.42-3.11; P=.82) among patients with normal kidney function (CKD class 1) and those with some degree of renal failure (CKD classes 2-5). There was no correlation between CKD classification on admission and CKD classification at 1 month, 6 months, and 1 year although a significant positive correlation was found between CKD classification at 1 month and CKD classes at 6 months and 1 year.
ConclusionsWe did not find any association between 1-month mortality and the degree of renal failure in the immediate postoperative period in lung transplant patients. There was a positive correlation between the degree of kidney failure at 1 month and that observed 6 and 12 months after the procedure.
El trasplante pulmonar se ha considerado una indicación terapéutica en los pacientes con enfermedad pulmonar progresiva en que la medicación o los tratamientos alternativos han fracasado, y en aquellas que presentan un deterioro de rápida progresión1. Sin embargo, no está exento de importantes complicaciones a corto, medio y lago plazo2–6. Permanentemente se han analizado los factores predictivos de mortalidad, como los líquidos de perfusión utilizados, el estado nutricional de los receptores o la oxigenación en el postoperatorio inicial, entre otros, con el fin de identificar factores de riesgo y mejorar los resultados del trasplante7–11. Es un hecho que un porcentaje significativo de estos pacientes desarrolla insuficiencia renal crónica después de realizado el trasplante pulmonar. Con frecuencia este fenómeno se ha atribuido al efecto tóxico de los inhibidores de la calcineurina12–15. No obstante, la incidencia y la implicación en la supervivencia de la insuficiencia renal aguda en el postoperatorio inmediato, así como la evolución posterior de la función renal en estos pacientes, no están bien establecidas.
Son varios los factores que podrían contribuir a que la disfunción renal aguda sea un hecho frecuente en el postoperatorio inmediato de estos pacientes. Por un lado, se sabe que los pacientes con insuficiencia respiratoria presentan inestabilidad hemodinámica en diferentes grados. Esta inestabilidad hemodinámica justificaría una hipoperfusión renal, que favorecería el desarrollo de insuficiencia del órgano. En segundo lugar, el uso de diuréticos para reducir el edema pulmonar también disminuiría el volumen de sangre circulante, agravando la hipoperfusión renal15,16.
Aunque varios autores han estudiado el papel de la situación hemodinámica del receptor antes del trasplante y su influencia en el filtrado glomerular (FG) postoperatorio, muy pocos han investigado el papel de la insuficiencia renal aguda en estos pacientes15,17.
Se presenta un análisis de incidencia y de asociación con la mortalidad de los pacientes sometidos a trasplante pulmonar en nuestro centro según el grado de insuficiencia renal que desarrollaron en el postoperatorio inmediato. Se ha efectuado además un análisis de correlación entre la clasificación Chronic Kidney Disease (CKD)18 al ingresar, al mes, a los 6 meses y al año de realizado el trasplante.
Material y métodosSe ha incluido en el estudio a todos los pacientes a quienes se realizó un trasplante pulmonar en el Hospital Universitario Marqués de Valdecilla entre marzo de 1997 y enero de 2006. Se revisaron retrospectivamente sus datos clínicos, analíticos y evolutivos a partir de la historia clínica procedente de los archivos de historias clínicas del hospital y de los registros de la coordinación de trasplantes en lo referente a los datos de donación.
Se obtuvo el valor de creatinina sérica en las primeras 24 h del trasplante —durante el ingreso en la Unidad de Cuidados Intensivos (UCI)—, al mes, a los 6 y 12 meses de realizado el trasplante. El FG se estimó mediante la fórmula simplificada Modification of Diet in Renal Disease (MDRD). Se clasificó a los pacientes en 5 grupos en función del valor de su FG, según la clasificación CKD18 (tabla I), en el momento del ingreso, al mes, a los 6 meses y al año de efectuado el trasplante. Se consideró la hemofiltración si este tratamiento se había aplicado en las primeras 72 h de ingreso.
Clasificación de la disfunción renal según la escala Chronic Kidney Disease (CKD)
| Grado | FG (ml/min/1,73m2) | Descripción |
| 1 | > 90 | Función renal normal |
| 2 | 60-89 | Reducción leve de la función renal |
| 3 | 30-59 | Reducción moderada de la función renal |
| 4 | 15-29 | Reducción grave de la función renal |
| 5 | < 15 | Reducción muy grave de la función renal |
FG: filtrado glomerular.
Se realizó un análisis estadístico descriptivo de la muestra. Los resultados se presentan en forma de frecuencia absoluta y porcentaje para las variables categóricas, y como media ± desviación estándar para las variables continuas. Las medias se compararon mediante la prueba de la t de Student o ANOVA; para comparar las proporciones se aplicó el test de la χ2 o la prueba exacta de Fisher. Se estudió la relación entre el grado de la clasificación CKD al ingresar y la mortalidad al mes, medida como odds ratio (OR), mediante regresión logística. Del mismo modo, se estudió la relación entre el CKD a los 6 meses y la mortalidad al año.
Se realizó un análisis de correlación entre el CKD al ingresar, al mes, a los 6 meses y al año de realizado el trasplante mediante el coeficiente de correlación de Spearman.
ResultadosDurante el período comprendido entre marzo de 1997 y enero de 2006 se realizaron 144 trasplantes pulmonares en la Unidad de Trasplantes del Hospital Universitario Marqués de Valdecilla. Se produjeron 6 pérdidas en el seguimiento. Las pérdidas en el estudio se debieron a que no pudo obtenerse todos los datos que requería el análisis mediante la búsqueda retrospectiva en la historia clínica.
Estos 144 trasplantes se realizaron en un total de 141 pacientes. La edad media ± desviación estándar de los receptores fue de 52 ± 11,7 años (mediana: 55 años; percentiles de edad 25 y 75: 48 y 60 años, respectivamente). De los 144 receptores, el 70% eran varones y el 30% mujeres. La causa del trasplante fue enfisema pulmonar en el 36%, fibrosis pulmonar idiopática en el 31%, fibrosis quística en el 4%, hipertensión pulmonar primaria en el 3%, retrasplante en el 1% y déficit de alfa-1-antitripsina en el 9%; en el 15% el trasplante obedeció a otras causas. En 92 casos se realizó trasplante bipulmonar y en 52 el trasplante fue unipulmonar. Por lo que se refiere a los donantes, la edad media fue de 37 ±13 años, el 65% eran varones y la relación entre la presión parcial de oxígeno en sangre arterial y la fracción inspirada de oxígeno media fue de 464 ± 75 mmHg. El tiempo medio de duración de la intervención quirúrgica fue de 364 ± 12 min. Los principales líquidos de preservación pulmonar utilizados fueron 2: la solución Eurocollins® (41%) y la solución Perfadex® (59%). En el momento de ingreso en la UCI después de realizado el trasplante pulmonar, la presión arterial sistólica media fue de 113 ± 22 mmHg, con una mediana de 110 mmHg, y la presión arterial diastólica media fue de 62 ± 14 mmHg, con una mediana de 60 mmHg. Por otro lado, la presión pulmonar sistólica media fue de 35 ±11 mmHg y la presión pulmonar diastólica media de 19 ±7 mmHg. El valor medio de creatinina sérica en las primeras 24 h fue de 0,98 ± 0,33 mg/dl. Se aplicó algún tratamiento de reemplazo continuo de la función renal en el 11% de los casos en las primeras 72 h.
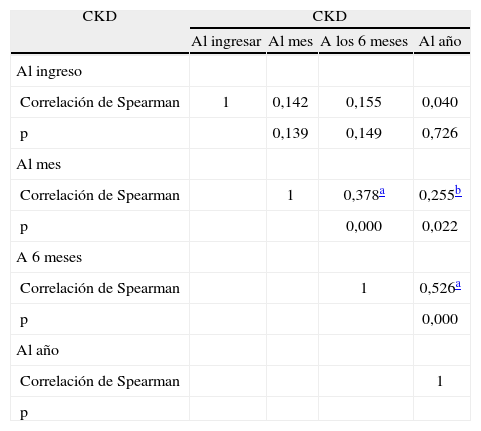
En la tabla II se muestran la clasificación de los pacientes al ingresar según el CKD y sus principales características.
Principales características de los pacientes de la muestra, divididos según el grado de insuficiencia renal por la clasificación Chronic Kidney Disease (CKD) en el momento del ingreso
| CKD 1 (n = 52) | CKD 2 (n = 63) | CKD 3 (n = 19) | CKD 4 (n = 2) | CKD 5 (n = 2) | pb | |
| Edad media (años) | 52 ± 13 | 53 ±9 | 57,7 ± 5 | 56 ± 12,7 | 46 ± 19,8 | 0,44 |
| Varones | 67% (n = 35) | 73% (n = 46) | 58% (n = 11) | 50% (n = 1) | 100% (n = 2) | 0,58 |
| CEC | 4% (n = 2) | 11% (n = 7) | 16% (n = 3) | 100% (n = 2) | 50% (n = 1) | 0 |
| PAM | 79,6 ± 19,5 | 77,7 ± 14,25 | 76 ±11,15 | 67,5 ± 17,6 | 85,8 ± 17,6 | 0,71 |
| Edema de reperfusión | 25% (n = 13) | 36% (n = 23) | 52% (n = 10) | 0% | 0% | 0,13 |
| Grupo CsAa | 52% (n = 27) | 54% (n = 34) | 73% (n = 14) | 50% (n = 1) | 50% (n= 1) | 0,57 |
| Causa de muerte (30 días)/(anual) | NS | |||||
| Sepsis/FMO | 44% (n = 4)/52% (n = 10) | 50% (n = 5)/45% (n = 10) | 50% (n = 3)/54,5% (n = 6) | −/− | −/− | |
| Bronquiolitis obliterante | −/5% (n = 1) | −/4,5% (n = 10) | −/− | −/− | −/− | |
| FPI | −/− | 30% (n = 3)/18% (n = 4) | 17% (n = l)/9% (n = 1) | −/− | −/− | |
| PCR | 33% (n = 3)/16% (n = 3) | 10% (n = l)/9% (n = 2) | 17% (n = 1)/18% (n = 2) | 100% (n = 1)/100% (n = 1) | −/− | |
| Cáncer | −/5% (n = 1) | −/4,5% (n = 1) | −/− | −/− | −/− | |
| Otra/no filiada | 22% (n = 2)/21% (n = 4) | 10% (n = 1)/18% (n = 4) | 17% (n = 1)/18% (n = 2) | −/− | −/100% (n = 1) | |
| Enfermedad | NS | |||||
| EPOC/enfisema | 22 (42%) | 25 (39%) | 4 (21%) | 0 (0%) | 0 (0%) | |
| Fibrosis pulmonar | 13 (25%) | 18 (28%) | 9 (47%) | 2 (100%) | 0 (0%) | |
| FQP | 4 (8%) | 0 (0%) | 1 (5%) | 0 (0%) | 0 (0%) | |
| HTPP | 1 (2%) | 2 (3%) | 0 (0%) | 0 (0%) | 1 (50%) | |
| Dα1-AT | 6 (11%) | 5 (8%) | 3 (16%) | 0 (0%) | 1 (50%) | |
| Otros | 6 (11%) | 13 (20%) | 2 (10%) | 0 (0%) | 0 (0%) | |
| Tiempo de isquemia primer pulmón | 239 ± 47 | 237 ± 56 | 248 ± 44 | 312 | 269 ± 22 | 0,727 |
| Tiempo de isquemia segundo pulmón | 326 ± 59 | 346 ± 57 | 336 ± 75 | 345 | 327 ± 46 | 0,422 |
| Horas de ventilación mecánica | 111 ±256 | 180 ±300 | 172 ±212 | 1.080 | 625 ±643 | 0,06 |
| Días de estancia en UCI | 7 ± 4 | 13 ± 19 | 14 ± 17 | 43 | 27 ± 25 | 0,007 |
Resultados mostrados como media ± desviación estándar, valor absoluto (porcentaje) o porcentaje (número de pacientes). CEC: circulación extracorpórea de urgencia; CsA: ciclosporina A; Dα1-AT: déficit de alfa-1-antitripsina; EPOC: enfermedad pulmonar obstructiva crónica; FMO: fracaso multiorgánico; FPI: fibrosis pulmonar idiopática; FQP: fibrosis quística del páncreas; HTPP: hipertensión pulmonar primaria; NS: no significativo; PAM: presión arterial media; PCR: parada cardiorrespiratoria; UCI: unidad de cuidados intensivos.
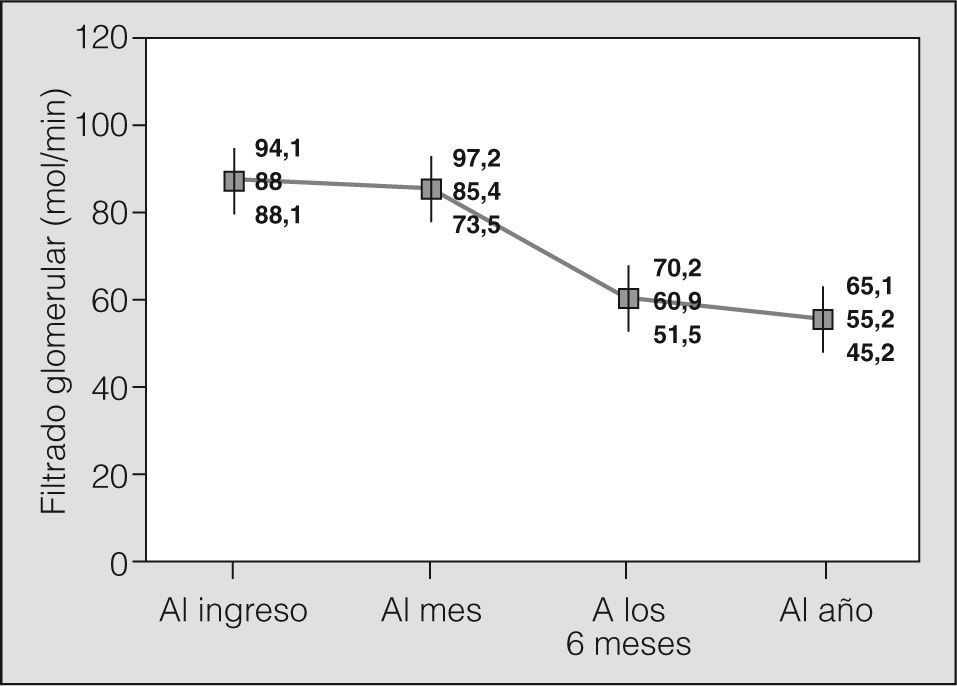
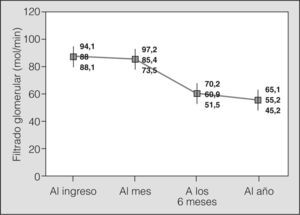
El seguimiento de los pacientes durante el primer año posterior al trasplante evidenció un empeoramiento progresivo del FG (fig. 1). El descenso de éste durante los primeros 6 meses fue de 4,5 ml/min/mes, frente a 1 ml/min/mes en la segunda mitad del primer año (fig. 2).
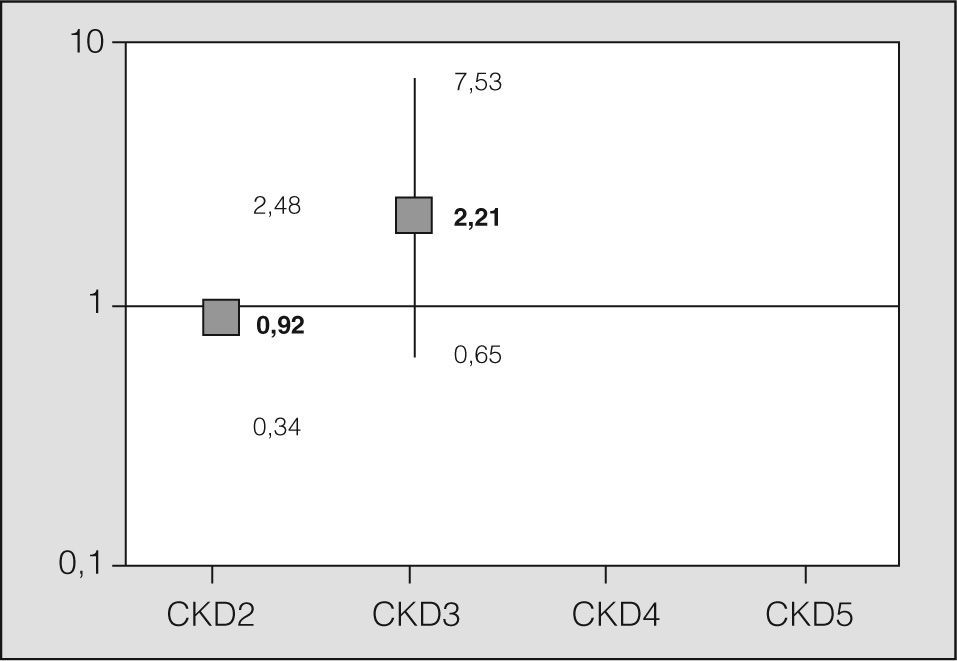
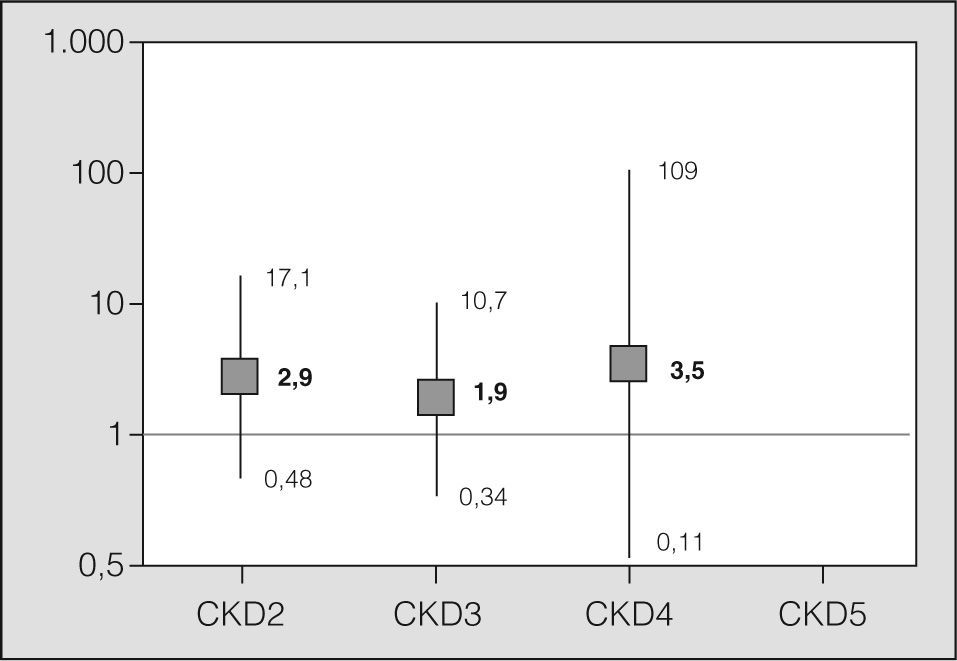
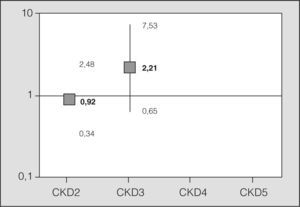
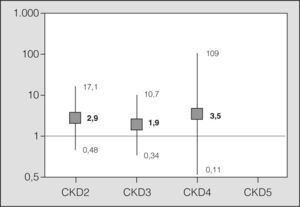
Se estudió la asociación existente entre los distintos grupos y la mortalidad a los 30 días, medida por la OR, mediante regresión logística, tomando a los pacientes del grupo de CKD 1 como referencia (fig. 3). Se incluyó a los pacientes con insuficiencia renal en un solo grupo (CKD 2–5) y se analizó la asociación entre insuficiencia renal y mortalidad a los 30 días, tomando como referencia a los pacientes sin ningún grado de insuficiencia renal (CKD 1) en el postoperatorio inmediato. Se obtuvo una OR de 1,11 (intervalo de confianza del 95%, 0,42-3,11; p = 0,82). Del mismo modo, se estudió la asociación existente entre el CKD a los 6 meses de realizado el trasplante y la mortalidad al año (fig. 4).
Se clasificó la causa de muerte en 5 categorías: a) sepsis, shock séptico, insuficiencia multiorgánica; b) insuficiencia pulmonar crónica o bronquiolitis obliterante; c) fracaso primario del injerto (precoz); d) eventos cardíacos, y e) otras. No se evidenciaron diferencias en la distribución de las causas de fallecimiento entre los 5 grupos de pacientes (tabla II).
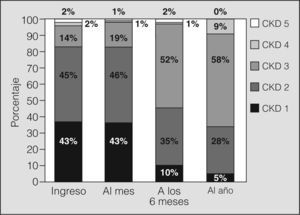
El análisis de correlación entre el CKD al ingresar, al mes, a los 6 meses y al año de realizado el trasplante mediante el coeficiente de correlación de Spearman se muestra en la tabla III.
Análisis de correlación entre la clasificación Chronic Kidney Disease (CDK) al ingresar, al mes, a los 6 meses y al año de realizado el trasplante, mediante el coeficiente de correlación de Spearman
Los pacientes que desarrollaron disfunción renal más grave (menor FG) tuvieron una mayor estancia en la UCI y estuvieron más horas conectados a ventilación mecánica. Este resultado presentó una clara tendencia hacia la significación estadística, aunque no llegó a alcanzarla (p = 0,07 y p = 0,06, respectivamente).
De los 144 pacientes, 16 recibieron tratamiento con técnicas de reemplazo renal continuo (11%). Esta indicación no siempre se basó en criterios de deterioro de la función renal. En el 31% de las ocasiones el reemplazo renal se utilizó para forzar un mayor equilibrio hídrico negativo, debido al edema de reperfusión presente. El 81% de los pacientes a quienes se aplicó la técnica de reemplazo renal continuo fallecieron durante el primer mes del postoperatorio. Se observó un riesgo relativo de 5,91 (intervalo de confianza del 95%, 4,06-34,50) de asociación con la mortalidad de los pacientes que recibieron hemofiltración.
DiscusiónLa insuficiencia renal aguda es una entidad que ha carecido de una definición consensuada. Recientemente se ha publicado un documento de consenso basado en el criterio RIFLE (Risk of renal dysfunction, Injury to the kidney, Loss of Kidney function and End-stage kidney disease), en el que se categoriza la disfunción renal en parte por los cambios de valor de la creatinina sérica y en parte por los cambios de valor del FG18. En nuestro estudio, dada la imposibilidad de conocer el FG antes del trasplante, se ha clasificado y estudiado a los pacientes valorando el FG en las primeras 24 h de ingreso en la UCI, al cabo de uno, 6 y 12 meses de realizado el trasplante pulmonar.
En este punto conviene recordar que en ocasiones el valor sérico de creatinina y/o urea puede no reflejar el verdadero estado funcional del riñón. El FG puede disminuir hasta en un 50% sin que se eleven las cifras de creatinina, pues la secreción tubular aumentada logrará compensar el déficit de la filtrada. Otras veces, la urea y la creatinina se elevan por causas ajenas al estado de la función renal (hemorragia gastrointestinal, administración de corticoides, tetraciclinas y/o cefalosporinas, aumento de la ingesta proteica, administración de aminoácidos, enfermedades hipercatabólicas y febriles). Sin embargo, en todos los casos hay un descenso de la tasa de FG19,20.
En nuestra cohorte de pacientes receptores de trasplante pulmonar, la incidencia de insuficiencia renal aguda en alguno de sus grados fue del 59% en el postoperatorio inmediato. Se han publicado pocos artículos médicos que analicen la disfunción renal aguda en el postoperatorio inmediato de estos pacientes. Recientemente Rocha et al17 han presentado sus resultados en un análisis retrospectivo de una cohorte de 296 pacientes. En su estudio la incidencia de desarrollo de disfunción renal aguda fue similar a la encontrada en nuestra cohorte: el 56 frente al 59%, respectivamente. En este punto hay que destacar que, mientras que el grupo de Rocha et al17 utilizó los criterios de RIFLE-I para definir y categorizar a los pacientes, nuestro grupo se basó en el registro del FG en las primeras 24 h. Este hecho podría hacer que nuestro grupo perdiese especificidad a la hora de diagnosticar la insuficiencia renal aguda, siendo menor la probabilidad de clasificar correctamente a los individuos sanos.
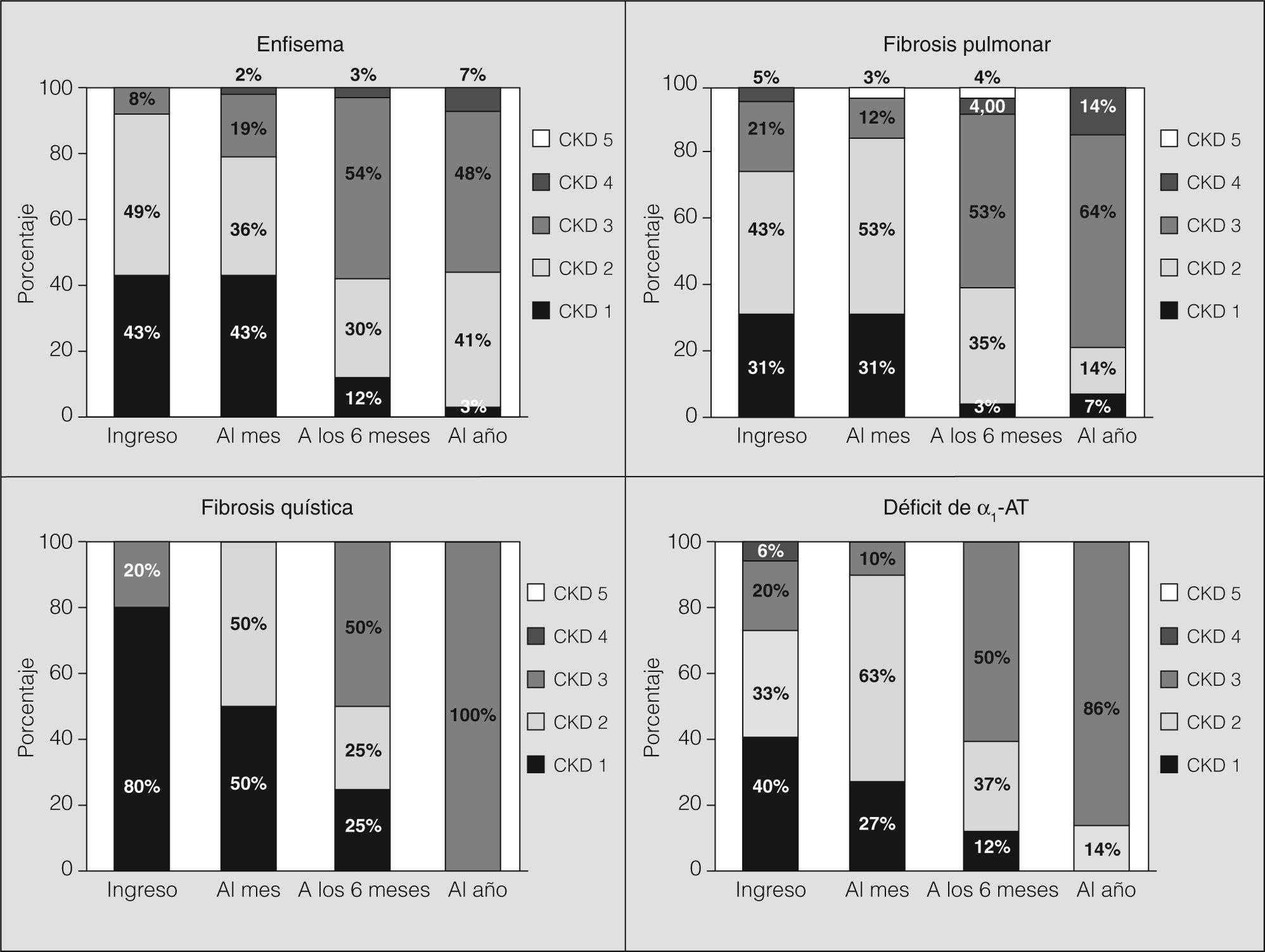
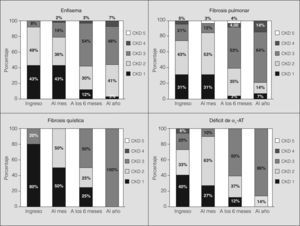
Nuestra cohorte presentó un empeoramiento progresivo del FG durante el año de seguimiento. Este empeoramiento de la función renal tuvo un carácter bifásico: el deterioro fue más acusado en la primera mitad del primer año (4,5 ml/min/mes) que en el segundo semestre (1 ml/min/mes). Broekroelofs et al21 han estudiado esta mayor caída de la función renal en los primeros 6 meses. En su estudio de 57 pacientes, la caída de la función renal en el primer período depende del diagnóstico pretrasplante de los pacientes. Así, la fibrosis quística es la enfermedad con una pérdida de la función renal más acusada en este tiempo, mientras que los receptores de trasplante debido a hipertensión pulmonar son los que mejor conservan el FG trascurridos 6 meses. Dichos autores consideran que los principales responsables de este hecho son las mayores dosis de ciclosporina y el mayor uso de antibióticos nefrotóxicos en los pacientes con fibrosis quística. En este sentido, cuando estratificamos a nuestros pacientes según la enfermedad responsable del trasplante y analizamos su distribución según el CKD (fig. 5), observamos que el 100% de los afectados de fibrosis quística se encuentran en un CKD 5 al año del trasplante. Este dato corrobora el estudio de Broekroelofs et al21, a pesar del reducido número de pacientes trasplantados por fibrosis quística en nuestra serie. Por otro lado, nuestro análisis refleja que los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) y fibrosis quística se encuadran en su mayoría en los grupos I y II de insuficiencia renal en el postoperatorio inmediato, dato ya observado en el estudio de Rocha et al17. Finalmente, los pacientes intervenidos por EPOC/enfisema son los que conservan mejor función renal al año de realizado el trasplante (fig. 5).
No hemos encontrado en nuestro análisis una correlación entre los valores de insuficiencia renal al ingresar y los diferentes grados de insuficiencia renal al mes, a los 6 meses o al año de seguimiento del FG en nuestra cohorte. Sin embargo, sí existe correlación positiva entre los diferentes grados de insuficiencia renal al mes y el CKD a los 6 meses y al año. En este sentido, Broekroelofs et al21 sí encuentran correlación entre los cambios del FG ocurridos durante el primer mes (valor de referencia pretrasplante) y el valor absoluto del FG a los 24 meses de realizada la intervención. La principal diferencia con nuestros resultados estriba en el hecho de analizar cambios en el FG y no categorizar a los pacientes en grados de insuficiencia renal, como se ha hecho en nuestro estudio.
El estudio de supervivencia de Rocha et al17 reveló que los pacientes que desarrollaban insuficiencia renal aguda presentaban una mayor probabilidad de retraso en la desconexión de la ventilación mecánica, incremento de la estancia hospitalaria y aumento de la mortalidad temprana. La principal divergencia en este sentido con respecto a nuestro estudio estriba en que dichos autores valoraron la disfunción renal en las 2 primeras semanas del postoperatorio, mientras que nuestro grupo la ha valorado en las primeras 24 h. Nuestros resultados de retraso en la desconexión de la ventilación mecánica e incremento de la estancia en la UCI están en concordancia con los presentados por Rocha et al17. Pensamos que los pacientes que desarrollaron insuficiencia renal podrían presentar un peor manejo de su equilibrio hídrico que quienes no la desarrollaron. Con un equilibrio hídrico positivo (retención de líquidos), estos pacientes presentarán mayor agua intravascular. Favorecido por unos valores de presión oncótica bajos (generalmente estados de desnutrición, depleción proteica, hipoalbuminemia), también podría aumentar el agua extravascular pulmonar. Este hecho podría dificultar una adecuada oxigenación y retrasar la desconexión de la ventilación mecánica. Sin embargo, esta posible explicación tan sólo tendría validez en los casos en que la insuficiencia renal se desarrollase antes de una posible insuficiencia respiratoria. En resumen, a diferencia de otros estu dios16,17,21 que analizan la insuficiencia renal crónica en los receptores de trasplante pulmonar en relación con el uso de la inmunodepresión, en el presente estudio se valoró la insuficiencia renal aguda en el postoperatorio inmediato. Los escasos estudios existentes a este respecto analizan principalmente la morbilidad asociada a este proceso. Por lo tanto, podemos concluir que la insuficiencia renal aguda en el postoperatorio de estos pacientes tiene una alta incidencia, pero no se correlaciona con los grados de insuficiencia renal crónica durante el primer año del trasplante. Los receptores que desarrollaron insuficiencia renal aguda en grado moderado (CKD 3) presentaron mayor asociación con la mortalidad al mes de realizado el trasplante que quienes no desarrollaron disfunción, aunque no se alcanzó la significación estadística. Se objetivó una pérdida de función renal progresiva y bifásica, más acusada en los primeros 6 meses de la intervención. El mayor grado de insuficiencia renal crónica a los 6 meses se asoció con mayor riesgo de muerte al año de realizado el trasplante.
Finalmente, cuando la insuficiencia renal aguda en el postoperatorio inmediato hizo necesario el uso de técnicas de reemplazo renal, su asociación a la mortalidad se incrementó. La incidencia de pacientes que requirieron diálisis en el grupo de Rocha et al17 fue del 8%, frente al 11% en nuestra serie. Esta diferencia podría justificarse porque en nuestro trabajo se valoró la utilización de técnicas de reemplazo renal, cuya indicación no siempre obedeció a insuficiencia renal aguda. En este punto no queda claro si el empleo de técnicas de reemplazo renal ha tenido un papel directo sobre la mortalidad o simplemente ha sido un marcador de gravedad de la enfermedad. Teóricamente un uso adecuado de estas técnicas mejoraría el control del volumen hídrico, los desequilibrios electrolíticos o del equilibrio ácido-base y, por tanto, disminuiría la mortalidad atribuible a la insuficiencia renal aguda. Sin embargo, esto no parece ser cierto. Cuando se analiza ajustando por diferentes comorbilidades y complicaciones postoperatorias, el uso de técnicas de reemplazo renal aumenta la mortalidad en la UCI22.
Por último, conviene comentar las limitaciones del presente estudio. Además del criterio utilizado para estudiar y comparar la función renal de los pacientes en un momento concreto, nuestro estudio presenta 2 importantes limitaciones. En primer lugar, se trata de una muestra de un centro trasplantador aislado, de carácter retrospectivo, en un período de 9 años. Esto hace que no se reflejen los cambios en la práctica, como ocurre con los diferentes protocolos de inmunodepresión o cambios que pudiesen darse en la técnica quirúrgica. En segundo lugar, se ha perdido información muy valiosa en el análisis de diferentes factores de riesgo, como podría ser el uso de fármacos inotrópicos durante la intervención o la situación hemodinámica durante el acto quirúrgico. Sin embargo, se cuenta con registros del uso de circulación extracorpórea de forma no programada, la hemodinámica al ingreso en la UCI y la administración de inotrópicos en el postoperatorio inmediato.
No obstante, consideramos que es necesario realizar estudios de mayor potencia estadística que corroboren nuestros resultados.