La gasometría arterial constituye una determinación imprescindible para todo aquel profesional sanitario que se dedique al aparato respiratorio. Los errores de medición e interpretación de la gasometría arterial pueden llevar a un perjuicio directo del paciente, por lo que es fundamental la exactitud en su cálculo.
Todavía estamos lejos de una estandarización tanto en la recogida como en el análisis posterior de las muestras. Si bien es cierto que todas las guías de práctica clínica existentes en la literatura coinciden en que lo ideal es realizar el análisis de la muestra lo más inmediatamente posible, no deja de resultar llamativo encontrar ambigüedades o discrepancias respecto al tiempo máximo permitido antes del análisis sin que la muestra se deteriore1–6.
En general se acepta que existen cambios en los valores de la gasometría arterial con el paso del tiempo: el oxígeno se consume y el dióxido de carbono aumenta. Se asume que el metabolismo de los hematíes continúa fuera del organismo, dando lugar a un incremento de la pCO2 en la muestra7. Es precisamente por esta teoría por lo que la mayor parte de las guías de práctica clínica recomiendan conservar la sangre en hielo, con la esperanza de que, de esta manera, el metabolismo se enlentezca y no ocasione grandes variaciones en los valores de los gases arteriales5,8.
Nuestro objetivo fue analizar la repercusión que tiene el tiempo sobre los valores gasométricos arteriales desde la extracción de las muestras hasta su análisis, así como los factores que influyen en dichas variaciones. Para ello se diseñó un estudio prospectivo, en el que se analizaron las gasometrías arteriales solicitadas por nuestro servicio durante un periodo de un mes. Todo el proceso se realizó según las recomendaciones y el protocolo SEPAR1,6. Se realizaron dos análisis de cada muestra con jeringa BD-Preset; uno basal según la demora habitual y otro a los 30 min de haber realizado el primero. En este intervalo de tiempo las muestras se conservaron en hielo según protocolos.
Se recogieron datos de diversas variables: del paciente (edad, sexo, talla, peso, hábito tabáquico, enfermedades asociadas y función pulmonar), del ambiente (presión barométrica y temperatura) y de la propia gasometría arterial (FiO2, pO2, pCO2, pH, O2Hb, COHb).
El tamaño muestral se calculó en función de la diferencia entre la pO2 final y la pO2 inicial; para una potencia del 80% y un error alfa <0,05, se obtuvo una N mínima de 439.
Se llevó a cabo un análisis intrasujeto T-test para variables dependientes, comparando además las correlaciones existentes entre las distintas variables mediante la prueba de Pearson.
Se incluyeron finalmente un total de 69 pacientes. En su medición basal, los valores medios de la gasometría fueron: pO2 63mmHg (DE 15), pCO2 45mmHg (DE 10) y pH 7,42 (DE 0,037). En cuanto a las diferencias de la medición control respecto al análisis inicial, se objetivaron unas diferencias medias de la pO2 de +2,26mmHg (66,02 final vs. 63,78 inicial, p<0,001) y de la pCO2 de -0,30mmHg (45,48 final vs. 45,78 inicial; p=0,017). El pH varió 0,007 respecto a su valor basal (7,416 final vs. 7,424 inicial; p<0,001).
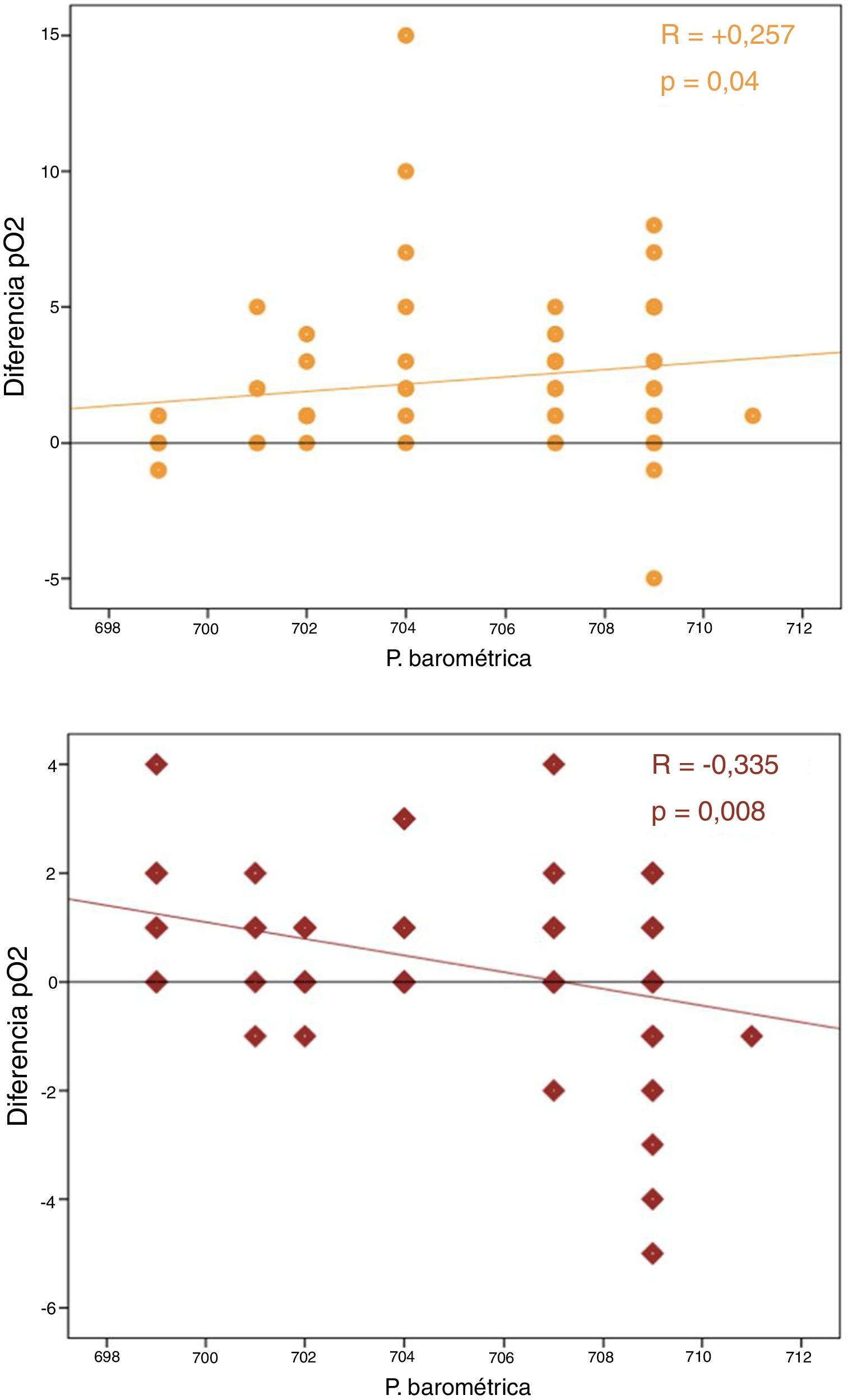
No se objetivó correlación entre las diferencias de pO2 y el tiempo transcurrido hasta el análisis. Sí se encontró, por el contrario, una correlación significativa entre la presión barométrica y las diferencias de pO2 y de pCO2 (p<0,05) (fig. 1).
No se encontraron otras asociaciones entre las diferencias en los gases y el resto de variables estudiadas, incluyendo comorbilidades y distintas patologías respiratorias.
En contra de lo recogido en algunas guías de práctica clínica y la creencia médica general, los cambios observados en los gases arteriales (pO2, pCO2 y pH) fueron en dirección opuesta a la esperada. Se encontró un incremento de pO2 y descenso de pCO2 en el segundo análisis frente al basal.
Este hecho, aunque llame la atención, es algo que ya se había descrito previamente en otros estudios: Liss y Payne8 realizaron un análisis similar al del presente artículo con resultados parejos. Knowles et al.10 Schmidt y Muller-Plathe11 y Pretto y Rochford12 fueron más allá, objetivando que la variación en los gases era diferente en función del material de la jeringa. De hecho, demostraron que en jeringas de cristal no existía tal alteración.
Existen diferentes teorías para explicar estas modificaciones en los gases de las muestras, aunque todas ellas cuentan con un denominador común: la difusión de los gases a través del material poroso de las jeringas de plástico. Quizás la propuesta más aceptada es aquella que habla de la difusión de gases en función del contenido de oxígeno existente en la muestra por un mecanismo puramente físico, como demostró Mahoney et al.9 en su estudio. Fletcher y Barber13 también justifican la difusión física en detrimento de las teorías que tienen en cuenta el metabolismo de las células sanguíneas: estudiaron los cambios existentes en la concentración de pO2 de agua oxigenada, evitando de esta manera la sangre per se, obteniendo similares resultados.
Es importante destacar que en aquellos trabajos con pO2 inicial superior a la pO2 ambiental el gradiente de difusión de los gases se invierte y la pO2 desciende con el tiempo12,14, lo que no hace más que reforzar la hipótesis de difusión simple de los gases.
Nuestros resultados también apoyan claramente esta teoría de la difusión física, ya que la variabilidad de la pO2 se incrementa en función de la presión atmosférica de forma estadísticamente significativa, algo que nunca se había analizado previamente.
En resumen, parece evidente que con el paso del tiempo el pO2 de la gasometría tiende a aumentar y que esta variación podría estar directamente relacionada con las jeringas de plástico y la difusión de los gases a través de su material poroso. Nuestro estudio apoya esta teoría, objetivando una relación directa de estas variaciones con la presión atmosférica.
A pesar de que las determinaciones de los gases sanguíneos varían significativamente con el tiempo, lo hacen en una cuantía poco relevante para la práctica clínica. En un futuro, sería planteable ampliar el estudio a diferentes tiempos.