Puntos clave:
- –
La enfermedad pulmonar obstructiva crónica (EPOC) se caracteriza por la presencia de obstrucción crónica y poco reversible al flujo aéreo, que se asocia a una reacción inflamatoria anómala, principalmente frente al humo del tabaco.
- –
La obstrucción al flujo aéreo se define por la espirometría cuando el cociente volumen espiratorio forzado en el primer segundo/capacidad vital forzada (FEV1/FVC) tras broncodilatación es menor de 0,7 (o por debajo del límite inferior de la normalidad en personas mayores de 60 años).
- –
La EPOC se asocia a inflamación crónica con remodelación que afecta a las vías aéreas, parénquima y arterias pulmonares.
- –
La gravedad de la EPOC se clasifica por el valor del FEV1 posbroncodilatador, estando también relacionada con la existencia de síntomas, atrapamiento aéreo, insuficiencia respiratoria, afectación sistémica y comorbilidad asociada.
- –
La prevalencia de la EPOC en la población adulta es del 9% en España y oscila entre el 8 y el 20% en Latinoamérica. La EPOC representa la cuarta causa de muerte en España y en el mundo.
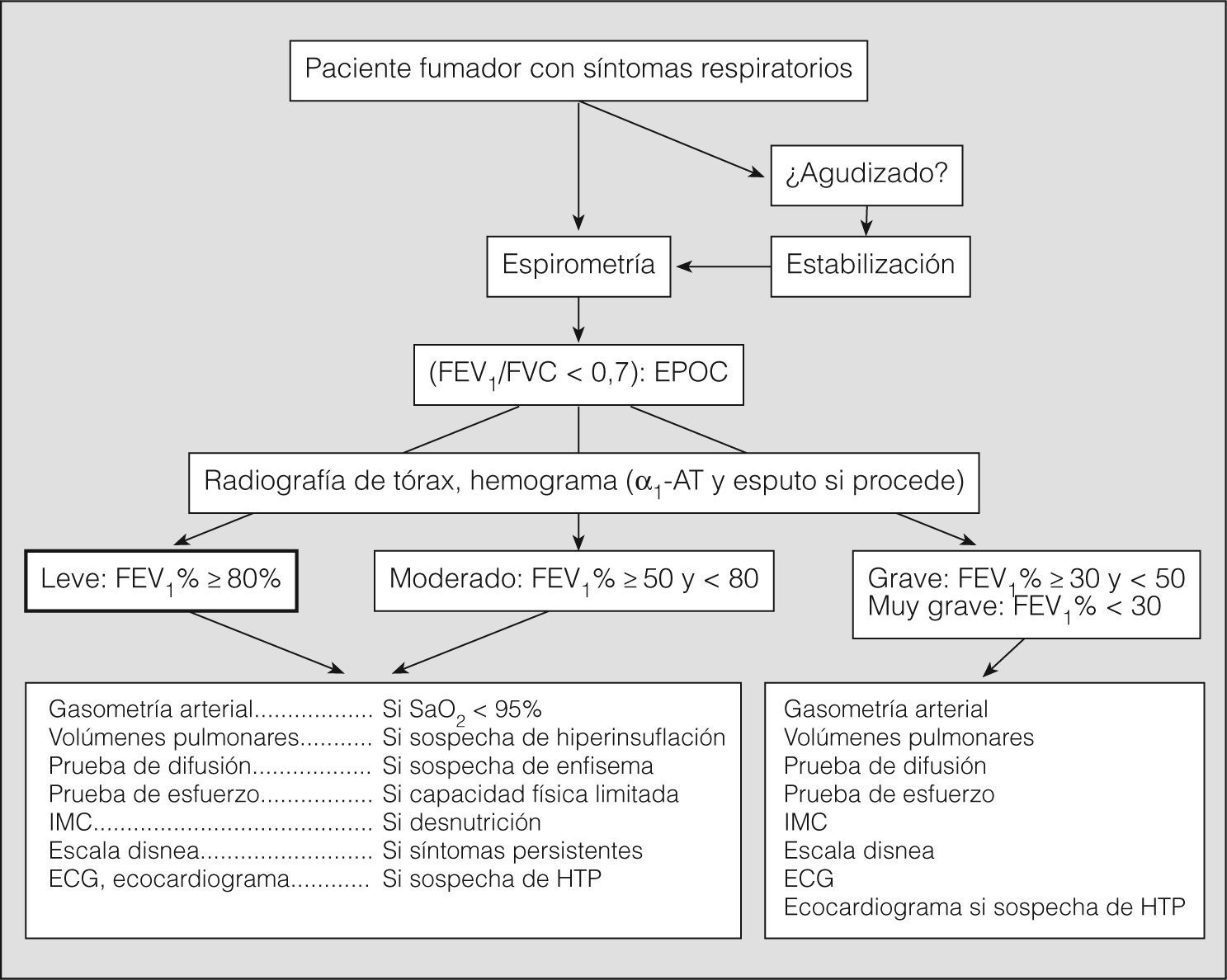
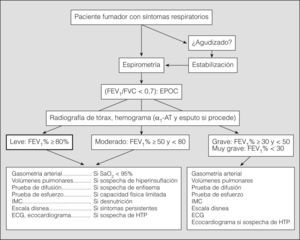
La EPOC se caracteriza por la presencia de obstrucción crónica y poco reversible al flujo aéreo, asociada a una reacción inflamatoria anómala principalmente frente al humo del tabaco, aunque sólo una cuarta parte de los fumadores desarrolla EPOC1. La exposición continuada a productos de la combustión de biomasa en ambientes cerrados también se ha asociado a EPOC2. El déficit homocigoto de alfa-1-antitripsina se asocia a enfisema precoz en fumadores3. Se considera que hay obstrucción al flujo aéreo cuando el FEV1/FVC es inferior a 0,7 tras la administración de un broncodilatador. El valor del FEV1 es el mejor indicador de la gravedad de la obstrucción al flujo aéreo y se utiliza como primer parámetro para clasificar la enfermedad (tabla I). El carácter heterogéneo y sistémico de la EPOC aconseja tener en cuenta también otras variables, aparte del FEV1, en la valoración clínica de los pacientes, como el intercambio gaseoso, los volúmenes pulmonares, la percepción de los síntomas, la capacidad de ejercicio, la frecuencia de las exacerbaciones, la presencia de alteraciones nutricionales (pérdida no intencionada de peso) o índices combinados como el BODE (índice de masa corporal, obstrucción bronquial —medida por el FEV1—, disnea y distancia caminada en 6min). En España la prevalencia de la EPOC es del 9,1% en edades comprendidas entre los 40 y los 70 años4. En Latinoamérica oscila entre el 7,8% de Ciudad de México y el 19,7% de Montevideo5.
Evaluación clínica de la EPOCPuntos clave:
- –
El paciente con EPOC es o ha sido fumador durante un tiempo prolongado y refiere síntomas de tos, expectoración y/o disnea.
- –
La disnea aparece en las fases más avanzadas de la enfermedad y se desarrolla de forma progresiva hasta limitar la actividad física diaria.
- –
La exploración de la función pulmonar en la EPOC permite: establecer el diagnóstico, cuantificar su gravedad, estimar el pronóstico, realizar el seguimiento de la evolución y valorar la gravedad de las exacerbaciones.
- –
Debe realizarse radiografía de tórax en la evaluación inicial y si aparecen nuevos síntomas durante el seguimiento. La tomografía computarizada torácica de alta resolución se recomienda en la evaluación de tratamientos quirúrgicos y para el diagnóstico de procesos concomitantes.
- –
El estudio de la calidad de vida relacionada con la salud tiene interés en trabajos de investigación. Su aplicabilidad en la práctica clínica es limitada.
- –
Se recomienda completar la evaluación inicial con la realización de hemograma y electrocardiograma. Otras pruebas diagnósticas se reservan para casos seleccionados.
- –
La evaluación inicial y el seguimiento deben efectuarse de manera coordinada entre los niveles asistenciales de atención primaria y de neumología.
- –
Toda persona mayor de 40 años con antecedente de exposición a humo de tabaco o de combustión de biomasa puede tener EPOC y debe realizarse una espirometría.
Habitualmente el paciente con EPOC es o ha sido fumador durante un tiempo prolongado y refiere el comienzo de sus síntomas a partir de los 40 años. La intensidad de la exposición al tabaco debe cuantificarse con el índice de paquetes/año (1 paquete/año equivale a haber fumado un paquete de cigarrillos al día durante un año). En los casos de EPOC por inhalación de humo de combustión de biomasa en ambientes cerrados, debe recogerse el tiempo en que la exposición se produjo durante al menos 10h al día. Los síntomas principales de la EPOC son disnea, tos y expectoración. La disnea constituye el síntoma principal, aunque puede ser percibida de forma desigual, sobre todo entre los pacientes de mayor edad. Con frecuencia los pacientes adaptan su grado de actividad física para reducir los síntomas. La disnea aparece en las fases más avanzadas de la enfermedad y se desarrolla de forma progresiva hasta limitar las actividades de la vida diaria. Hay varios instrumentos de medida de la disnea. Por su fácil registro se recomienda la escala del Medical Research Council7. La tos crónica, que frecuentemente es productiva y de predominio matutino, domina en ocasiones el cuadro clínico, a pesar de que no guarda relación con el grado de obstrucción al flujo aéreo. Las características del esputo pueden ser de utilidad clínica si aumenta su volumen o aparece purulencia, porque puede indicar exacerbación; un volumen excesivo indica la presencia de bronquiectasias, y la expectoración hemoptoica obliga a descartar otros diagnósticos, principalmente carcinoma broncopulmonar. Los pacientes con EPOC leve pueden presentar pocos síntomas o incluso no tenerlos.
También debe recogerse la presencia o ausencia de síntomas derivados de las complicaciones asociadas, los episodios de exacerbación y la existencia de comorbilidades, como la enfermedad cardiovascular, la diabetes mellitus, los trastornos de ansiedad-depresión y la osteoporosis por su impacto en la historia natural de la enfermedad.
Los signos de la exploración física son poco expresivos en la enfermedad leve-moderada. En los casos de EPOC grave se recomienda valorar periódicamente el estado nutricional mediante el índice de masa corporal y la capacidad de ejercicio. Un índice de masa corporal menor de 21kg/m2 indica mal pronóstico8 (evidencia B).
Evaluación funcional de la EPOCPuntos clave:
- –
Espirometría forzada: imprescindible para el diagnóstico, la valoración inicial y el seguimiento.
- –
Volúmenes pulmonares estáticos: tienen valor pronóstico y permiten valorar la respuesta al tratamiento.
- –
Prueba broncodilatadora: útil en la valoración inicial y para descartar asma.
- –
Gasometría arterial: indicada si el FEV1 es inferior al 50% del valor de referencia y en la prescripción de oxigenoterapia domiciliaria.
- –
Capacidad de difusión del monóxido de carbono (DLCO): indicada si el FEV1 es inferior al 50% del valor de referencia, si se sospecha enfisema y en la valoración preoperatoria de candidatos a resección pulmonar.
- –
Pruebas de ejercicio: proporcionan información integrada sobre el impacto funcional de la enfermedad. Indicadas en la valoración del riesgo quirúrgico en la resección pulmonar, evaluación de la respuesta terapéutica y valoración de la capacidad laboral.
- –
Estudios del sueño: indicados si se sospecha la coexistencia de síndrome de apneas durante el sueño.
- –
Función muscular respiratoria: sólo si se sospecha disfunción muscular respiratoria, parálisis diafragmática o si el grado de disnea es desproporcionado respecto al FEV1.
- –
Estudio de la distensibilidad: no indicado de forma sistemática.
- –
El uso de índices multicomponentes, como el BODE, predice mejor que el FEV1 el riesgo de muerte por EPOC.
La exploración de la función pulmonar en la EPOC permite: a) establecer el diagnóstico de la enfermedad; b) cuantificar su gravedad; c) estimar el pronóstico; d) seguir la evolución de la función pulmonar y la respuesta al tratamiento, y e) valorar la gravedad de los episodios de exacerbación y la respuesta al tratamiento.
La espirometría forzada es imprescindible para establecer el diagnóstico de EPOC y valorar la gravedad de la obstrucción al flujo aéreo. Su realización está indicada en cualquier fumador mayor de 40 años con o sin síntomas respiratorios. Se considera que hay obstrucción al flujo aéreo si el cociente FEV1/FVC tras broncodilatación es inferior a 0,7. En personas mayores de 60 años puede utilizarse el límite inferior de la normalidad para evitar el sobrediagnóstico, aunque, en todo caso, los valores espirométricos deben valorarse en el contexto clínico correspondiente. El valor del FEV1 expresado como porcentaje del valor de referencia establece la gravedad de la enfermedad (tabla I). Se recomienda repetir la espirometría forzada anualmente en todos los pacientes diagnosticados de EPOC (evidencia D).
La prueba broncodilatadora es imprescindible en la valoración inicial del paciente para descartar asma bronquial. La medición de volúmenes pulmonares estáticos permite valorar el grado de insuflación pulmonar y atrapamiento aéreo. Se recomienda su medición en todos los pacientes con EPOC grave o muy grave, en la valoración preoperatoria de candidatos a cirugía pulmonar y en los casos de EPOC leve o moderada con sospecha de atrapamiento aéreo. La medición de la capacidad inspiratoria es útil en la evaluación del atrapamiento aéreo y de la respuesta al tratamiento. La relación entre la capacidad inspiratoria y la capacidad pulmonar total tiene valor pronóstico. La DLCO está descendida en los casos de EPOC con predominio de enfisema y este descenso permite descartar la existencia de asma (evidencia D). Se recomienda su medición en los pacientes con EPOC grave o muy grave, en la valoración preoperatoria de candidatos a cirugía pulmonar y en cualquier caso de EPOC en que se sospeche enfisema. La gasometría arterial está indicada en pacientes con EPOC grave o muy grave para valorar la posible presencia de insuficiencia respiratoria, así como en la indicación y el seguimiento de la oxigenoterapia domiciliaria. También debe realizarse en pacientes con EPOC moderada que presenten una saturación arterial de oxígeno (SaO2) inferior al 95% a nivel del mar. La presencia de insuficiencia respiratoria confiere mayor gravedad a la EPOC y tiene valor pronóstico (tabla I). Las pruebas de ejercicio pueden realizarse con bicicleta ergométrica o tapiz rodante, o mediante pruebas simples de paseo (prueba de la marcha de 6min, prueba de lanzadera). Proporcionan información integrada sobre el impacto funcional de la enfermedad, tienen valor pronóstico y se relacionan con la capacidad física de los pacientes. La prueba de la marcha de 6min es un examen sencillo, que se correlaciona con las mediciones objetivas de la actividad física habitual. Están indicadas en los casos de EPOC grave, en la evaluación del efecto de diversas modalidades terapéuticas (farmacológicas, quirúrgicas o rehabilitación), en la valoración del riesgo quirúrgico en la resección pulmonar, en la valoración de la capacidad laboral y en cualquier paciente con EPOC muy sintomática, a pesar de tratamiento óptimo, o actividad física disminuida.
Los estudios del sueño (oximetría nocturna, polisomnografía) sólo están indicados si se sospecha la coexistencia de síndrome de apnea durante el sueño o si existe poliglobulia y/o signos de insuficiencia cardíaca derecha. La valoración de la función muscular respiratoria y periférica está indicada si se sospecha disfunción muscular respiratoria, parálisis diafragmática o si la disnea es desproporcionadamente elevada con relación al valor del FEV1. El estudio de la distensibilidad pulmonar no se aconseja en la valoración sistemática de los pacientes con EPOC. Otras mediciones, como el flujo mesoespiratorio o el flujo pico, carecen de relevancia en la valoración funcional de la EPOC. El índice BODE es una clasificación multidimensional que predice mejor que el FEV1 el riesgo de muerte en los pacientes con EPOC avanzada10. Incluye la valoración de 4 factores: B (índice de masa corporal), O (obstrucción bronquial, medida por el FEV1 como porcentaje del valor de referencia), D (disnea, medida con la escala del Medical Research Council) y E (distancia caminada en 6min). A través de una puntuación de 0 a 10 se establece un valor que es útil para evaluar la probabilidad de supervivencia. En la figura 1 se resume la evaluación inicial de la EPOC.
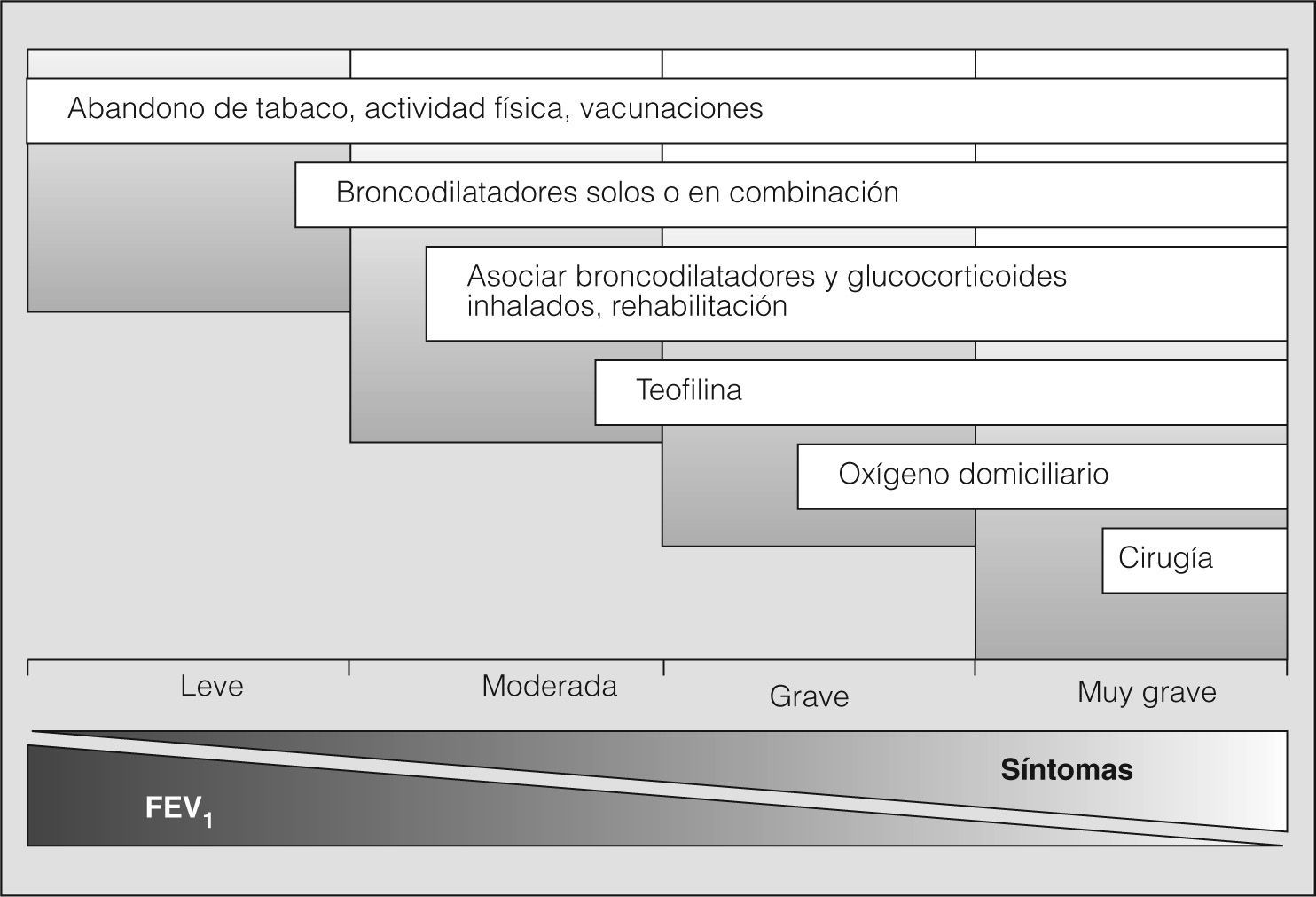
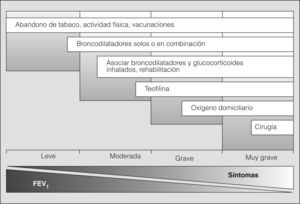
Tratamiento del paciente estable (fig. 2)Medidas generalesLa supresión del tabaco es una intervención costeeficaz y constituye la principal medida para evitar el desarrollo y progresión de la EPOC (evidencia A). El tabaquismo es una enfermedad crónica y recidivante, que tiene numerosas consecuencias biológicas. En pacientes sensibilizados y motivados para dejar de fumar, pero con un grado moderado o alto de dependencia nicotínica, es preciso tratar la dependencia tabáquica como enfermedad crónica. En estos casos es aconsejable introducir el tratamiento sustitutivo con nicotina, bupropión o vareniclina11-13 (evidencia A). No hay evidencias científicas que aconsejen el uso de otras medidas como la acupuntura o la hipnosis. La Sociedad Española de Neumología y Cirugía Torácica (SEPAR) ha emitido recomendaciones específicas para el tratamiento del tabaquismo14. La administración anual de la vacuna antigripal reduce la mortalidad y el número de hospitalizaciones durante los períodos epidémicos15, por lo que debe recomendarse a todos los pacientes con EPOC (evidencia B). La vacuna antineumocócica debe ofrecerse al paciente con EPOC de 65 años o más, ya que reduce la posibilidad de bacteriemia (evidencia B) y previene la aparición de neumonías, especialmente en pacientes con menos de 65 años y en aquéllos con obstrucción grave16 (evidencia B). No hay evidencia suficiente para recomendar el uso de vacunas frente a Haemophilus influenzae ni de vacunas microbianas polivalentes.
Tratamiento farmacológicoPuntos clave:
- –
En pacientes con síntomas ocasionales, el tratamiento con broncodilatadores de acción corta reduce los síntomas y mejora la tolerancia al esfuerzo (evidencia B).
- –
En pacientes con síntomas permanentes, los broncodilatadores de acción prolongada permiten un mayor control de los síntomas y mejoran tanto la calidad de vida como la función pulmonar (evidencia A). Además, pueden reducir el número de exacerbaciones (evidencia A).
- –
En pacientes con EPOC moderada-grave, el uso de corticoides inhalados reduce el número de exacerbaciones y mejora la calidad de vida (evidencia A).
- –
Los corticoides inhalados, asociados a los agonistas β2 de acción prolongada, tienen un efecto clínico aún mayor sobre la función pulmonar, los síntomas y las exacerbaciones (evidencia A), además de un efecto favorable sobre la supervivencia (evidencia C).
- –
La teofilina puede añadirse al tratamiento en los pacientes que permanecen sintomáticos con tratamiento óptimo o en aquellos en que sea necesario utilizar la vía oral (evidencia D).
- –
El uso de mucolíticos y/o antioxidantes puede valorarse en pacientes con expectoración habitual y/o exacerbaciones frecuentes (evidencia B).
- –
El empleo sustitutivo con alfa-1-antitripsina está indicado en pacientes seleccionados con déficit en esta enzima (evidencia B).
- –
Actualmente no hay ninguna evidencia para recomendar el uso de antitusivos, antileucotrienos, antibióticos profilácticos y estimulantes respiratorios.
Broncodilatadores. Los síntomas de la mayor parte de los pacientes con EPOC responden favorablemente al tratamiento con broncodilatadores. La mejoría de la disnea y/o la tolerancia al esfuerzo no siempre se correlacionan con los cambios espirométricos (evidencia A), pero sí parecen relacionarse mejor con la disminución del atrapamiento aéreo y la hiperinsuflación pulmonar17.
Los broncodilatadores de acción corta (bromuro de ipratropio y agonistas β2 de acción corta) son fármacos eficaces en el control rápido de los síntomas. Se recomienda su empleo a demanda cuando de forma circunstancial se observe deterioro sintomático (evidencia B). El empleo de preparados que asocian bromuro de ipratropio y agonistas β2 de acción corta produce mayor broncodilatación que cada uno de ellos por separado18.
Los broncodilatadores de acción prolongada (salmeterol, formoterol y bromuro de tiotropio) deben utilizarse en todos los pacientes que precisan tratamiento de forma regular, porque reducen tanto los síntomas como el número de exacerbaciones y mejoran la calidad de vida19-21 (evidencia A). Comparado con placebo, el tiotropio aumenta la tolerancia al ejercicio y mejora los resultados conseguidos con la rehabilitación21 (evidencia A). No se dispone de información suficiente para recomendar uno u otro broncodilatador en el inicio del tratamiento. La asociación de agonistas β2 de acción prolongada con tiotropio consigue mayor efecto broncodilatador que el empleo individual de cada uno de estos fármacos22.
Las metilxantinas producen una leve mejoría clínica y espirométrica23 (evidencia D), y deben incorporarse al tratamiento del paciente con EPOC sintomática como fármacos de segunda línea, siempre que con su introducción sea posible apreciar una mejoría clínica significativa sin la aparición de efectos secundarios destacables. La dosis deberá ajustarse en función de la respuesta y para conseguir una concentración pico en sangre de entre 5 y 15μg/ml (evidencia D).
Glucocorticoides. El tratamiento con glucocorticoides inhalados en la EPOC moderada y grave reduce el número de exacerbaciones, produce un leve incremento del FEV1 y mejora la calidad de vida24,25 (evidencia A). Aunque algunos estudios señalan un efecto favorable de los glucocorticoides inhalados sobre la mortalidad26 (evidencia C), un reciente estudio multicéntrico y controlado no lo ha demostrado27. La respuesta a los glucocorticoides inhalados no es uniforme ni puede predecirse por la respuesta a los glucocorticoides sistémicos o por el resultado de la prueba broncodilatadora28. El uso crónico de glucocorticoides por vía sistémica no está indicado.
La combinación de glucocorticoides y agonistas β2 de acción prolongada está indicada en pacientes con EPOC moderada y grave, en quienes produce una mejoría adicional de la función pulmonar y de los síntomas, así como una reducción mayor de las exacerbaciones29-31 (evidencia A). Un reciente estudio de 3 años de duración realizado en pacientes con FEV1 menor del 60% ha confirmado el impacto positivo de la combinación salmeterol-fluticasona sobre el deterioro de la calidad de vida y sobre las exacerbaciones (evidencia A). Se observó asimismo un efecto en la función pulmonar, con menor descenso del FEV1 (evidencia A), aunque la mejoría en la supervivencia no alcanzó el valor de significación estadística establecido27. La combinación de glucocorticoides inhalados con agonistas β2 de acción prolongada está indicada en los pacientes con EPOC grave, en aquellos que presentan más de una exacerbación anual y cuando su retirada produce deterioro clínico32 (evidencia A).
Otros tratamientos farmacológicos. No hay evidencias que permitan recomendar el uso de estimulantes respiratorios, antibióticos profilácticos, antileucotrienos y nedocromil sódico. El empleo de alfa-1-antitripsina purificada está indicado en pacientes con fenotipo homocigoto PiZZ que cursan con enfisema pulmonar y bajas concentraciones séricas de esta enzima3 (evidencia C). El tratamiento con agentes mucolíticos-antioxidantes reduce el número de exacerbaciones33 (evidencia B). La administración de N-acetilcisteína puede reducir el número de exacerbaciones en pacientes no tratados con glucocorticoides inhalados34 (evidencia D). La información disponible en la actualidad no es suficiente para recomendar el uso de inhibidores de la fosfodiesterasa IV35.
OxigenoterapiaPuntos clave:
- –
La oxigenoterapia continua domiciliaria (OCD) aumenta la supervivencia de los pacientes con EPOC grave e insuficiencia respiratoria (evidencia A).
- –
Los criterios para indicar OCD exigen una presión arterial de oxígeno (PaO2) menor de 55mmHg, o entre 55 y 60mmHg cuando se acompaña de poliglobulia o de signos de insuficiencia cardíaca derecha, respirando aire ambiente a nivel del mar (evidencia A). El objetivo es mantener una PaO2 por encima de 60mmHg o una SaO2 mayor del 90% (evidencia D).
- –
Los valores de gases arteriales son necesarios para establecer la indicación y proporcionan información del equilibrio ácido-base
- –
El efecto de la oxigenoterapia depende de la duración de su administración. Con 18h/día los efectos son superiores a los producidos con 15 o 12h/día (evidencia A). No se recomienda administrarla menos de 12h al día.
- –
En ausencia de criterios de OCD, la oxigenoterapia durante el ejercicio está indicada si consigue mejoría clínica en pacientes con limitación física por disnea.
- –
En ausencia de criterios de OCD, la oxigenoterapia durante el sueño está indicada si, además de desaturaciones prolongadas, hay poliglobulia o signos de insuficiencia cardíaca derecha.
El empleo de OCD durante más de 15h al día mejora el pronóstico de pacientes con EPOC e insuficiencia respiratoria36,37 (evidencia A). La OCD no disminuye la mortalidad en pacientes con hipoxemia moderada (PaO2 > 60mmHg)38. La educación del paciente sobre los efectos de la utilización de la OCD puede mejorar el cumplimiento (evidencia D). No se cuenta con información suficiente acerca de los criterios para la prescripción de la OCD en poblaciones residentes en grandes altitudes ni de su repercusión pronóstica. En los pacientes con criterios de OCD y limitación para el esfuerzo por disnea, la oxigenoterapia puede completarse con sistemas portátiles que faciliten la deambulación (evidencia C). Si no hay criterios de OCD, puede considerarse la oxigenoterapia durante el ejercicio sólo si se comprueba de manera objetiva la mejoría de los síntomas y de la tolerancia al esfuerzo (evidencia D). En pacientes con PaO2 diurna mayor de 60mmHg puede plantearse la indicación de oxigenoterapia únicamente durante el sueño si presentan durante más del 30% del tiempo de sueño una SaO2 inferior al 90% o hipertensión pulmonar, insuficiencia cardíaca derecha o poliglobulia (evidencia D).
Rehabilitación respiratoriaPuntos clave:
- –
La rehabilitación respiratoria mejora la disnea, la capacidad de ejercicio y la calidad de vida relacionada con la salud (evidencia A).
- –
La rehabilitación respiratoria disminuye la utilización de los servicios sanitarios y los ingresos hospitalarios (evidencia B), es coste-efectiva (evidencia B) y mejora el índice BODE.
- –
Los programas de rehabilitación que incluyen ejercicio y entrenamiento de las extremidades son los más eficaces (evidencia A).
- –
La aplicación de programas domiciliarios de mantenimiento es una alternativa válida a la rehabilitación realizada en el hospital desde las fases iniciales de la enfermedad (evidencia B).
- –
La actividad y el ejercicio físico diario son beneficiosos para los pacientes con EPOC (evidencia B).
- –
Se debe recomendar la rehabilitación a todo paciente con EPOC que tras tratamiento optimizado siga estando limitado por la disnea para realizar sus actividades cotidianas (evidencia A).
Evitar el sedentarismo y estimular la actividad y el ejercicio físico cotidiano es beneficioso para el paciente con EPOC y debe recomendarse de forma generalizada39 (evidencia B). La rehabilitación respiratoria mejora los síntomas, la calidad de vida y la capacidad de esfuerzo40 (evidencia A). Por ello se recomienda su empleo cuando el paciente sigue limitado por los síntomas a pesar de un tratamiento farmacológico óptimo. La aplicación de programas domiciliarios de mantenimiento es una alternativa válida a la rehabilitación realizada en el hospital desde las fases iniciales de la enfermedad41,42 (evidencia B). La SEPAR43 y la European Respiratory Society/American Thoracic Society44 han efectuado recomendaciones específicas sobre rehabilitación respiratoria.
Los programas de rehabilitación deben incluir entrenamiento de extremidades inferiores (evidencia A) y superiores (evidencia B), e incorporar componentes de educación43,44. El entrenamiento de los músculos respiratorios no debe recomendarse sistemáticamente, pero puede considerarse en situaciones de debilidad muscular respiratoria. Antes de incluir a un paciente en un programa de rehabilitación, y para valorar sus efectos, deben medirse la intensidad de la disnea, la capacidad de ejercicio y la calidad de vida. No se han demostrado mejores resultados al añadir oxígeno durante la realización de los programas en pacientes hipoxémicos.
Ventilación domiciliariaLa ventilación domiciliaria en la EPOC estable puede aplicarse de forma no invasiva (VNI) o invasiva mediante traqueostomía. Por sus menores efectos secundarios y comodidad, en la actualidad se considera de primera elección la VNI aplicada con presión positiva. Esta técnica sólo ha demostrado un ligero beneficio en algunos estudios controlados y todavía no hay suficientes evidencias científicas para recomendar de manera generalizada esta clase de tratamiento en el manejo clínico habitual de los pacientes con EPOC estable45,46.
Fases finales de la enfermedadLa asistencia al paciente con EPOC en fase muy avanzada presenta defectos derivados de la carencia de una definición adecuada para esta situación47. No obstante, estudios recientes, con una visión más global de estos pacientes, han ayudado a facilitar una estimación pronóstica para estas fases de la enfermedad10. Es fundamental realizar con suficiente antelación una planificación de las acciones a seguir, contando con la participación del paciente y sus allegados. Para ello, el paciente debe estar en situación clínica estable, tener buena capacidad cognitiva y disponer de información adecuada sobre sus futuros problemas y las opciones terapéuticas existentes. Éstas deben contemplar las distintas dimensiones de la enfermedad (respiratoria, emocional y sistémica) y los aspectos sociales, intentando favorecer la autonomía del paciente y su mejor calidad de vida. Esta planificación puede variar con la evolución de la enfermedad.
ExacerbacionesPuntos clave:
- –
Una exacerbación de la EPOC es un cambio agudo en la situación clínica basal del paciente, más allá de la variabilidad diaria, que cursa con aumento de la disnea, de la expectoración y expectoración purulenta, o cualquier combinación de estos 3 síntomas, y que precisa un cambio terapéutico.
- –
La exacerbación de la EPOC leve-moderada puede tratarse de manera ambulatoria como primera opción.
- –
Durante la exacerbación se potenciará el tratamiento broncodilatador con bromuro de ipratropio y/o con un agonista β2 de acción corta, intentando alcanzar la dosis máxima óptima.
- –
La corticoterapia sistémica es de elección en la exacerbación de la EPOC grave. En la exacerbación de una EPOC leve/moderada se recomienda su uso si hay hiperreactividad bronquial o cuando la evolución inicial no es favorable.
- –
En un 50-75% de las exacerbaciones de la EPOC se aísla en el esputo un agente infeccioso, bacteriano en cerca de la mitad de los casos y vírico en un tercio.
- –
En el paciente con exacerbaciones frecuentes o con una exacerbación que requiere ventilación asistida, la infección puede estar causada por Pseudomonas aeruginosa.
- –
La antibioterapia es recomendable en las exacerbaciones que presenten, además de disnea, aumento del volumen de la expectoración habitual y/o purulencia.
- –
Los criterios de alta hospitalaria se basan en la estabilización tanto clínica como gasométrica y en la capacidad del paciente para poder controlar la enfermedad en su domicilio.
- –
La hospitalización domiciliaria puede ser una opción de tratamiento de la exacerbación de la EPOC con eficacia equivalente a la hospitalización convencional.
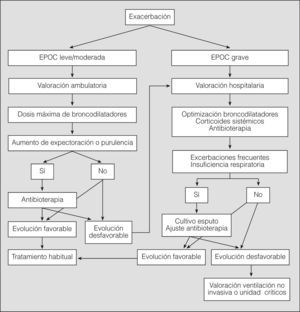
La exacerbación queda definida como un cambio agudo en la situación clínica basal del paciente, más allá de la variabilidad diaria, que cursa con aumento de la disnea, de la expectoración, expectoración purulenta o cualquier combinación de estos 3 síntomas48, y que precisa un cambio terapéutico.
En un 50-75% de las exacerbaciones de la EPOC se aísla en el esputo un agente infeccioso (virus y/o bacteria potencialmente patógenos). En el resto de los casos el agente causal está mal definido, pero la exposición a contaminación atmosférica, polvo, vapores o humos muy probablemente se relacione con estas exacerbaciones. La exacerbación de la EPOC debe distinguirse de otras entidades que pueden cursar con síntomas similares, como neumonía, insuficiencia cardíaca congestiva, neumotórax, derrame pleural, tromboembolia pulmonar y arritmias.
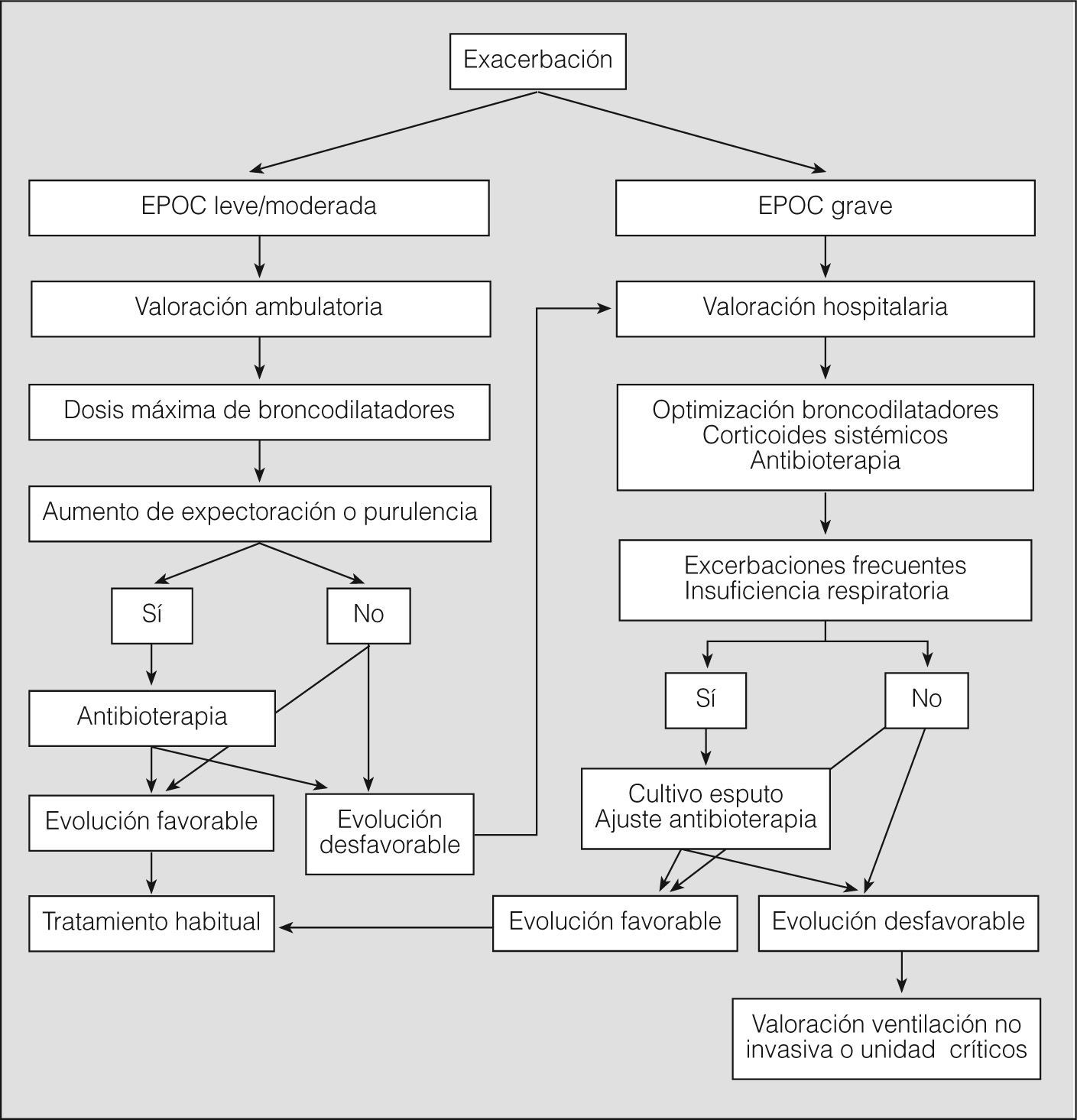
El paciente con EPOC leve o moderada será tratado ambulatoriamente como primera opción49 (evidencia D), aunque en todos los episodios de exacerbación deberá realizarse un seguimiento en las primeras 72h.
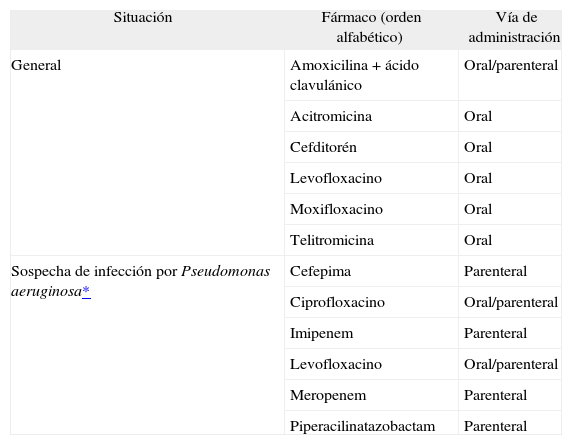
Tratamiento extrahospitalario (fig. 3)Durante la exacerbación no se interrumpirá el tratamiento que el paciente utilice habitualmente, pero deberá optimizarse el tratamiento inhalatorio para conseguir el máximo efecto broncodilatador. Los antibióticos se utilizarán sólo en las exacerbaciones que presenten, además de disnea, aumento del volumen de la expectoración habitual y/o purulencia, siempre teniendo en cuenta los patrones de resistencia bacteriana50 (tabla II). Se aconseja la administración de glucocorticoides orales (dosis iniciales no superiores a 40mg/día de prednisona durante un máximo de 10 días) en las exacerbaciones de la EPOC grave y en los casos de EPOC leve o moderada con una evolución inicial no favorable51 (evidencia D).
Antibioterapia para la exacerbación de la EPOC
| Situación | Fármaco (orden alfabético) | Vía de administración |
| General | Amoxicilina + ácido clavulánico | Oral/parenteral |
| Acitromicina | Oral | |
| Cefditorén | Oral | |
| Levofloxacino | Oral | |
| Moxifloxacino | Oral | |
| Telitromicina | Oral | |
| Sospecha de infección por Pseudomonas aeruginosa* | Cefepima | Parenteral |
| Ciprofloxacino | Oral/parenteral | |
| Imipenem | Parenteral | |
| Levofloxacino | Oral/parenteral | |
| Meropenem | Parenteral | |
| Piperacilinatazobactam | Parenteral |
En la unidad de urgencias deben realizarse hemograma, electrocardiograma, radiografía de tórax y gasometría arterial, así como una determinación plasmática de creatinina, iones y glucemia. En los pacientes con posibilidad de infección por P. aeruginosa (por exacerbaciones frecuentes o con EPOC que curse con insuficiencia respiratoria) es necesaria la recogida de una muestra de esputo antes de iniciar el tratamiento antibiótico.
La hospitalización domiciliaria es una opción de tratamiento de la exacerbación de la EPOC que ha mostrado una eficacia equivalente a la hospitalización convencional y una mejor aceptación por parte de los pacientes52, pero únicamente puede aplicarse en una cuarta parte de los pacientes, ya que cuando la exacerbación cursa con datos de gravedad, como disminución del nivel de conciencia o confusión, anomalías en la radiografía de tórax, hipercapnia con acidosis, o cuando aparece en un paciente con comorbilidad grave o falta de apoyo social, no se recomienda la hospitalización domiciliaria y es necesario el control en el hospital. El alta hospitalaria se considerará cuando se haya producido una mejoría clínica que permita alcanzar una situación próxima a la basal, haya estabilidad clínica y gasométrica, y el paciente sea capaz de controlar su enfermedad en el domicilio, aunque persistan la hipoxemia y/o la hipercapnia. Existen opciones de altas precoces que se acompañan de programas de atención domiciliaria, con resultados satisfactorios53. El tratamiento con glucocorticoides sistémicos se reducirá progresivamente hasta retirarlo tras el alta. Siempre será recomendable una visita médica a las 2 semanas siguientes al alta, ya que en este período una cuarta parte de los pacientes puede presentar un empeoramiento, principalmente cuando hay hipercapnia, puesto que ésta es una situación con elevado riesgo de mortalidad en los meses inmediatos54. Cuando el paciente requiera oxigenoterapia domiciliaria al darle el alta, la gasometría arterial deberá repetirse una vez que haya conseguido la situación de estabilidad, no antes de 2 meses después del alta, para determinar si es candidato a OCD.
Oxigenoterapia en la exacerbación de la EPOCPuntos clave:
- –
El objetivo es conseguir una cifra de PaO2 de 60mmHg o mayor sin provocar acidosis respiratoria.
- –
Una fracción inspiratoria de oxígento (FiO2) entre el 24 y el 35% es generalmente suficiente.
- –
Al inicio el oxígeno debe aportarse con una mascarilla tipo Venturi, para pasar después a gafas nasales.
- –
El seguimiento terapéutico debe ser con gasometría. Es recomendable un primer control a los 30min del inicio del tratamiento y siempre que haya un cambio en la FiO2 o signos de deterioro.
- –
La pulsioximetría ayudará en el seguimiento y ajuste posterior de los valores de FiO2.
La corrección de la hipoxemia mediante el aporte de oxígeno es uno de los objetivos prioritarios en el tratamiento de la exacerbación de la EPOC. El aporte de oxígeno a concentraciones bajas, entre un 24 y un 28%, es habitualmente suficiente para superar el umbral de seguridad clínica (PaO2 > 60mmHg o SaO2 > 90%)55. Debe prestarse también atención a los otros factores que intervienen en el transporte de oxígeno (hemoglobina y gasto cardíaco). La oxigenoterapia a dosis altas (FiO2 > 40%) puede ocasionar retención de anhídrido carbónico y acidosis respiratoria por hipoventilación central y por empeoramiento de las relaciones de ventilación-perfusión. La respuesta individual del paciente es variable, por lo que se recomienda un primer control gasométrico a los 20-30 min56. Para un mejor control de la concentración de oxígeno administrada, se recomienda utilizar sistemas de flujo elevado, como la mascarilla tipo Venturi. Una vez que el paciente mejore y la cifra de pH se normalice, la pulsioximetría permite disminuir la frecuencia de los controles gasométricos. En esta situación, la administración de oxígeno puede realizarse mediante gafas nasales, que resultarán más cómodas al paciente.
Ventilación mecánica en la exacerbación de la EPOCPuntos clave:
- –
La ventilación mecánica está indicada cuando, a pesar del tratamiento farmacológico y de oxigenoterapia, el paciente sigue presentando un pH inferior a 7,35 (evidencia A).
- –
Se puede aplicar de forma no invasiva o invasiva por vía endotraqueal.
- –
La supervivencia del paciente con exacerbación de la EPOC que requiere ventilación invasiva no es inferior a la observada cuando la ventilación invasiva se requiere por otras causas.
Los pacientes con EPOC e insuficiencia respiratoria aguda que no mejoran con tratamiento médico y oxigenoterapia pueden precisar asistencia ventilatoria. La VNI disminuye significativamente la mortalidad, evita las complicaciones de la intubación endotraqueal y acorta la estancia hospitalaria57,58, por lo que debe estar disponible las 24h en los hospitales que atiendan a estos pacientes. Debe aplicarla personal sanitario bien adiestrado y requiere un adecuado seguimiento del paciente. Debe realizarse preferentemente en una unidad de cuidados intermedios o intensivos, pero algunos casos de acidosis respiratoria no grave (pH: 7,30-7,35) pueden manejarse en una planta de hospitalización58. La combinación de presión de soporte (10-15 cmH2O) y presión telespiratoria positiva (4-6 cmH2O) ha demostrado ser la forma más efectiva de ventilación. Aunque la mayor parte de los casos pueden manejarse con VNI (preferiblemente con mascarilla facial), en determinadas circunstancias debe utilizarse la ventilación invasiva.
Tratamiento quirúrgico de la EPOCPuntos clave:
- –
Hay procedimientos quirúrgicos que pueden proporcionar mejoría clínica en pacientes con EPOC muy grave bien seleccionados.
- –
El trasplante pulmonar proporciona mejoría funcional y sintomática (evidencia C). Esta opción terapéutica puede considerarse en pacientes menores de 65 años y con enfermedad muy avanzada, que cumplan los criterios generales de trasplante.
- –
La cirugía de reducción de volumen pulmonar (CRVP) proporciona mejoría funcional y sintomática en pacientes con enfisema heterogéneo de predominio en lóbulos superiores y baja tolerancia al esfuerzo (evidencia A).
- –
En estos pacientes, la CRVP aumenta la supervivencia (evidencia B).
- –
La CRVP está contraindicada en los pacientes con enfisema homogéneo, FEV1 inferior al 20% o DLCO menor del 20% (evidencia A).
- –
En pacientes muy seleccionados, la ampulectomía puede mejorar la función pulmonar y la disnea (evidencia C).
Algunos pacientes muy seleccionados pueden beneficiarse de procedimientos quirúrgicos (trasplante pulmonar, CRVP, ampulectomía) que mejoran la función pulmonar, la tolerancia al esfuerzo, los síntomas y la calidad de vida. El trasplante pulmonar produce mejoría significativa en la función pulmonar, el intercambio de gases, la tolerancia al esfuerzo y la calidad de vida, especialmente el bipulmonar59 (evidencia C). Es objeto de controversia si el trasplante pulmonar proporciona un aumento significativo de la supervivencia en la EPOC. Si se considera la indicación de trasplante, deberán cumplirse las recomendaciones nacionales e internacionales acerca de las indicaciones y contraindicaciones generales para dicho procedimiento60,61.
La CRVP es un procedimiento quirúrgico que consiste en la resección de las áreas con mayor grado de destrucción parenquimatosa en pacientes con enfisema grave de distribución heterogénea. En pacientes seleccionados (enfisema heterogéneo de predominio en lóbulos superiores con baja tolerancia al esfuerzo, con FEV1 y DLCO > 20%), mejora los índices de flujo aéreo, aumenta la tolerancia al esfuerzo y mejora la calidad de vida (evidencia A). En un subgrupo de pacientes con enfisema heterogéneo de predominio en los lóbulos superiores y baja tolerancia al esfuerzo, además de los beneficios señalados, la CRVP también aumenta la supervivencia (evidencia B)62. En los pacientes con obstrucción muy grave del flujo aéreo (FEV1 < 20% del valor de referencia) que asocian enfisema homogéneo o DLCO por debajo del 20% del valor de referencia, la mortalidad postoperatoria es mayor y los beneficios clínicos, escasos, por lo que en dicho subgrupo de pacientes está contraindicada la CRVP (evidencia A)63. Recientemente se han descrito procedimientos de reducción de volumen pulmonar por vía endoscópica, mediante la colocación de válvulas endobronquiales64 o la instilación de agentes fibrosantes65, procedimientos que por ahora deben considerarse experimentales.
Con respecto a la ampulectomía, hay estudios no controlados que indican que algunos pacientes con grandes ampollas pueden beneficiarse de la resección quirúrgica de éstas (evidencia C)66. No se dispone de criterios de selección contrastados, aunque se ha señalado que las ampollas deben ocupar más de un tercio del hemitórax, debe haber evidencia radiológica de áreas de parénquima pulmonar comprimido y la función pulmonar ha de estar relativamente conservada66. Si la presencia de grandes ampollas se asocia a enfisema generalizado, la ampulectomía puede comportar graves complicaciones, por lo que es aconsejable considerar el trasplante pulmonar (evidencia D).
La EPOC es un factor de riesgo conocido de morbilidad posquirúrgica. La probabilidad de presentar complicaciones aumenta con la gravedad de la enfermedad y está relacionada con la localización de la intervención: es mayor en la cirugía torácica y en la que afecta al abdomen superior. La SEPAR ha elaborado recientemente recomendaciones sobre la valoración de los pacientes tributarios de resección pulmonar quirúrgica67.
- Home
- All contents
- Publish your article
- About the journal
- Metrics