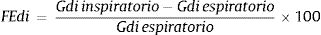La atrofia y la debilidad de los músculos respiratorios y periféricos son un problema frecuente en las Unidades de Cuidados Intensivos (UCI). Su diagnóstico es dificultoso, especialmente en las primeras etapas de la enfermedad crítica. Esto determina que en muchos casos no sea detectada hasta etapas avanzadas, por ejemplo, frente a dificultad para la desvinculación de la asistencia ventilatoria mecánica. El objetivo de esta revisión es describir las principales herramientas con las que contamos actualmente para la evaluación muscular en la UCI, tanto periférica como respiratoria. Se mencionan técnicas con distinto grado de complejidad y especificidad, haciendo particular hincapié en aquellas con mayor aplicabilidad en la práctica clínica diaria, como la ecografía.
Atrophy and weakness of the respiratory and peripheral muscles is a common problem in the intensive care unit (ICU). It is difficult to diagnose, particularly in the early stages of critical disease. Consequently, many cases are detected only in advanced stages, for example, when difficulties in mechanical ventilation weaning are encountered. The aim of this review is to describe the main tools that are currently available for evaluation of peripheral and respiratory muscles in the ICU. Techniques of varying complexity and specificity are discussed, and particular emphasis is placed on those with greater relevance in daily clinical practice, such as ultrasound.
Muchos pacientes desarrollan atrofia y debilidad muscular —periférica o respiratoria— en las Unidades de Cuidados Intensivos (UCI)1,2. Esto impacta negativamente sobre la morbimortalidad de los pacientes durante la internación y luego del egreso hospitalario, asociándose a dificultad en la desvinculación de la asistencia ventilatoria mecánica (AVM), mayor estancia en la UCI y aumento de la mortalidad a corto y largo plazo3-14.
La fisiopatología de la miopatía del paciente crítico es compleja, producto de una combinación de disfunción contráctil y atrofia muscular15. La disfunción contráctil (disminución de la capacidad intrínseca del músculo para generar fuerza) podría ser consecuencia de la acción conjunta de varios factores, como disfunción mitocondrial, estrés oxidativo, trastornos del proceso excitación-contracción y del potencial de membrana15. La atrofia (disminución de la masa muscular y tamaño de las miofibras) es resultado de un desequilibrio entre la síntesis y la degradación proteica, a favor de esta última, principalmente por activación del sistema ubiquitina-proteasoma16. Las manifestaciones clínicas resultan, por tanto, de la disminución de la masa y fuerzas musculares.
El diagnóstico y el seguimiento del compromiso muscular pueden ser difíciles en los pacientes críticos. El objetivo de esta revisión narrativa es resumir los principales métodos disponibles para la evaluación funcional y estructural de los músculos periféricos y respiratorios en la UCI.
Músculos respiratoriosLos músculos respiratorios no son habitualmente valorados en forma rutinaria, por lo que el diagnóstico de disfunción diafragmática es realizado en forma tardía, frente a la dificultad para desvincular al paciente de la AVM17,18. A continuación, repasaremos las principales técnicas disponibles para la evaluación de los músculos respiratorios en pacientes críticos.
Presión inspiratoria máximaLa presión inspiratoria máxima (PIM) permite una valoración global de la fuerza inspiratoria19. Corresponde a la máxima presión negativa generada durante un esfuerzo inspiratorio contra una vía aérea ocluida20. Requiere la colaboración del paciente, por lo que valores elevados descartan debilidad significativa, pero valores bajos pueden reflejar tanto debilidad muscular como una técnica ineficiente o esfuerzo insuficiente17. En caso de no contar con la cooperación del paciente, la maniobra puede realizarse mediante la utilización de una válvula unidireccional que permita la espiración pero no la inspiración, obteniendo la PIM en el transcurso de 20-25 s17. Valores menores a –30 cmH2O presentan elevada sensibilidad —pero baja especificidad— para predecir el fallo en la desvinculación de la AVM21.
Una medida complementaria a la PIM es la PIM durante un sniff nasal (SNIP, por su sigla en inglés)19,22. El sniff nasal consiste en una maniobra inspiratoria voluntaria, en forma de inhalación corta y rápida a través de una fosa nasal permeable. El SNIP representa una medida sencilla y reproducible para evaluar la fuerza muscular inspiratoria. Además, la maniobra de sniff nasal puede emplearse para valorar la función muscular mediante otras técnicas, como la presión transdiafragmática (Pdi) o la ecografía. En los pacientes críticos, la realización del sniff nasal suele estar condicionada por la existencia de una vía aérea artificial.
Presiones esofágica y transdiafragmáticaEl registro simultáneo de presión esofágica (Pes) y gástrica (Pga) permite el cálculo de Pdi (Pdi=Pes – Pga), medida específica de fuerza diafragmática17,19. La Pdi puede medirse durante la respiración tranquila o frente maniobras inspiratorias máximas voluntarias (Pdi máx) o sniff nasal (Pdi sn). El índice de Gilbert (Δ Pga/Δ Pdi) puede utilizarse para determinar la contribución del diafragma al esfuerzo inspiratorio total (mayor contribución cuanto más alto es)19. Otros parámetros como el producto presión-tiempo (PPT) e índice tensión-tiempo (ITT) permiten estimar el gasto energético del diafragma, aunque su análisis es complejo17. El PPT surge de la integración de la presión inspiratoria en el tiempo, normalizado con base en la presión máxima en el caso del ITT23. Su uso suele reservarse para el ámbito de la investigación17.
La estimulación eléctrica o magnética del nervio frénico (twitch, en inglés) permite obtener la Pdi máx sin la colaboración del paciente (Pditw)19,22,24. De hecho, la medida de Pditw mediante estimulación magnética anterior bilateral frénica puede ser considerado el método de referencia para evaluar la fuerza diafragmática en la UCI19,24. Como alternativa a la Pdi, el registro de presión en el extremo de la sonda traqueal tras la estimulación frénica (Ptrtw) puede emplearse como parámetro de fuerza diafragmática, sin necesidad de catéteres para el registro de Pes y Pga25. Valores de Pditw<10 cmH2O o Ptrtw<11 cmH2O son considerados parámetros de debilidad diafragmática en pacientes críticos6,7,19. La disminución de PIM, Pditw y Ptrtw se ha asociado a dificultad en la desvinculación de la AVM y aumento de la mortalidad5-8,26.
Presión de oclusiónLa presión negativa generada durante los primeros 100 ms de una inspiración tranquila contra una vía aérea ocluida (P0,1) permite valorar el estímulo ventilatorio central19,20. Valores elevados de P0,1 indican un estímulo central aumentado, mientras que valores bajos de P0,1 pueden deberse no solamente a un impulso neuromuscular disminuido, sino también a trastornos en la conducción nerviosa, debilidad o fatiga muscular19. En pacientes bajo AVM ha sido utilizado como parámetro para predecir el éxito en la desvinculación de la misma. Valores de P0,1 ≥ 6 cmH2O son predictores de fallo en la desvinculación, mientras que una P0,1 ≤ 4 cmH2O se considera favorable19. No obstante, valores muy bajos (< 0,5 cmH2O) pueden representar un impulso central reducido, insuficiente para lograr la desvinculación20.
Estudios electrofisiológicos: electromiografía y test de estimulaciónLa electromiografía (EMG) permite el estudio de la actividad muscular a través del registro de los potenciales de acción22. La EMG diafragmática puede obtenerse a través de electrodos de superficie, esofágicos o intramusculares19. La utilización de sondas nasogástricas para alimentación con electrodos esofágicos incorporados (Maquet, Suecia) permite obtener en forma continua una señal procesada denominada «actividad eléctrica diafragmática» (AEdi)17. Los test de estimulación permiten valorar la eficiencia de la transmisión nerviosa y neuromuscular mediante el registro electromiográfico del diafragma tras la estimulación del nervio frénico19.
Ecografía diafragmáticaLa ecografía diafragmática constituye una técnica no invasiva y accesible en la mayoría de las UCI, permitiendo un seguimiento evolutivo de la disfunción diafragmática al lado de la cama del paciente. Permite evaluar la masa diafragmática a través de medidas estáticas como el grosor diafragmático (Gdi) y valorar aspectos funcionales a través de medidas dinámicas como la fracción de engrosamiento (FEdi) o la excursión diafragmática (Edi)27,28.
Su realización es posible en la mayoría de los pacientes críticos con una excelente reproducibilidad intra e interobservador27. Si bien la evaluación ecográfica puede realizarse tanto en el hemidiafragma derecho como en el izquierdo, este último presenta una mayor complejidad técnica, dificultando su visualización en ciertos pacientes y disminuyendo su reproducibilidad29.
Grosor diafragmáticoLa medida del Gdi mediante ecografía permite evaluar la masa muscular, presentando una excelente correlación con la medida directa del grosor muscular realizada en necropsias30,31. La medida basal del Gdi se realiza al final de una espiración pasiva, es decir, a capacidad residual funcional (CRF). En adultos sanos los valores medios de Gdi varían entre 1,7±0,4 y 3,3±1,0mm30,32-36. En pacientes críticos bajo AVM se han reportado valores basales de entre 1,3±0,3 y 2,4±0,8 mm29,37.
Resulta difícil establecer un punto de corte por debajo del cual se pueda considerar que el diafragma se encuentra atrofiado. No obstante, la realización de ecografías seriadas a partir del inicio de la AVM permite poner en evidencia la disminución precoz y progresiva del Gdi durante la internación en la UCI37-40. Por otro lado, la determinación del Gdi como medida estática no ha resultado útil como parámetro para predecir el éxito en la desvinculación de la AVM14,41-43.
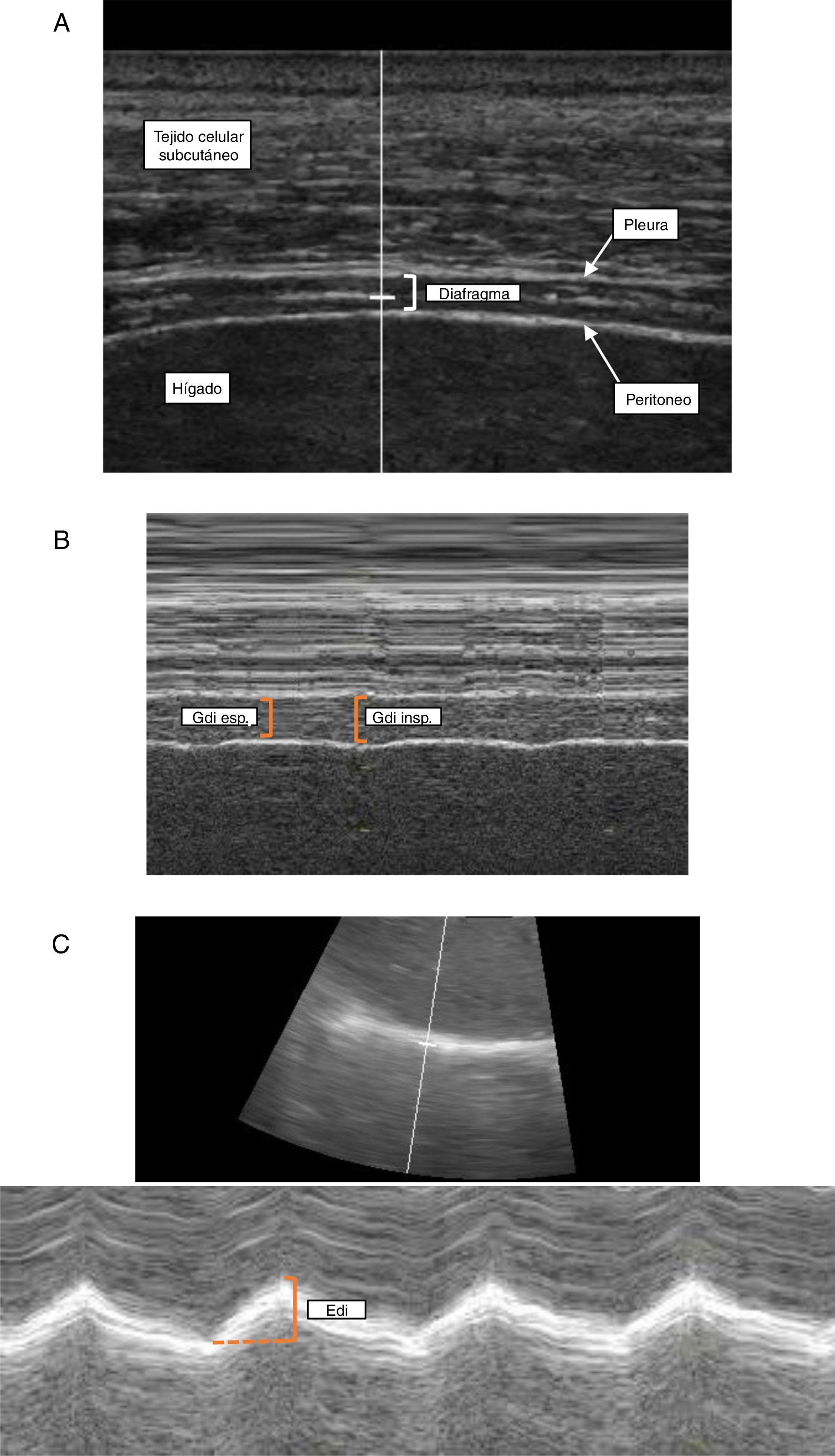
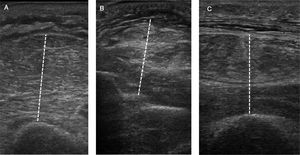
Técnica. La medición del Gdi mediante ecografía se realiza en el hemidiafragma derecho a nivel de la zona de aposición diafragmática. Esta zona corresponde al área de la pared torácica donde el contenido abdominal alcanza el sector inferior de la cavidad torácica y se topografía entre el 8° y 10° espacio intercostal, a nivel de la línea axilar media. Con el paciente en decúbito dorsal (30-45°), se emplea un transductor lineal de alta frecuencia (≥ 10MHz) colocado paralelo al espacio intercostal y perpendicular a la piel27. Se utiliza inicialmente el modo bidimensional (modo B) para obtener el mejor enfoque y seleccionar la línea de exploración (fig. 1A). En esta área el diafragma se identifica como una estructura formada por 3capas paralelas (aproximadamente a 1,5-3,0cm de profundidad): una capa central hipoecoica (el diafragma propiamente dicho) delimitada por 2capas ecorrefringentes (peritoneo y pleura parietal)44. Puede observarse además cómo el artefacto pulmonar (correspondiente al ángulo costofrénico) borra la imagen del diafragma durante la inspiración36. Manteniendo el transductor en posición, se utiliza el modo M para determinar el Gdi correspondiente a la distancia comprendida entre ambas capas ecorrefringentes, medida aproximadamente a 2cm del ángulo costofrénico (fig. 1B). Como mencionamos previamente, la medida basal del Gdi se realiza al final de la espiración pasiva. No obstante, la determinación del Gdi durante distintas etapas del ciclo respiratorio permite evaluar parámetros funcionales como la FEdi.
Ecografía diafragmática. Determinación del grosor diafragmático a nivel de la zona de aposición con la pared torácica en modo B (A) y modo M (B) y evaluación de la excursión diafragmática (C).
Edi: excursión diafragmática; Gdi esp: grosor diafragmático espiratorio; Gdi insp: grosor diafragmático inspiratorio.
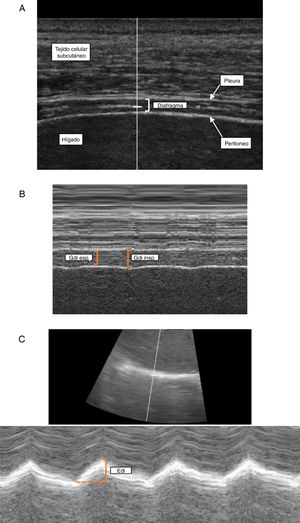
Durante la ventilación espontánea el volumen pulmonar aumenta a medida que el diafragma se contrae, acorta e incrementa su grosor30,45. El engrosamiento diafragmático durante la inspiración representa un parámetro de la actividad contráctil del diafragma y su capacidad para generar presión27,40,45. Esto puede valorarse ecográficamente a través de la FEdi, la cual corresponde al porcentaje de cambio en el Gdi entre el final de la espiración pasiva y el final de la inspiración (esfuerzo máximo inspiratorio en ventilación espontánea, o de no ser posible pico inspiratorio durante la AVM)40.
La FEdi ha demostrado una buena correlación con parámetros de función muscular inspiratoria como la PIM, SNIP, Ptd, PPT y AEdi29,34,42,45-47.
En pacientes bajo AVM, la FEdi disminuye progresivamente a medida que aumenta el nivel de soporte ventilatorio aportado, siendo mínima en ventilación controlada con bloqueo neuromusular29,34,37. En otras palabras, cuanto más trabajo respiratorio genere el diafragma, mayor será la FEdi. La misma podría ser utilizada para monitorizar la actividad diafragmática durante la AVM37. Goligher et al. demostraron que bajos niveles de FEdi se asocian a una mayor atrofia diafragmática (disminución del Gdi) en pacientes con AVM40. La presencia de una FEdi disminuida se ha asociado a falla en la extubación, dificultad en la desvinculación de la AVM y estancia prolongada en UCI9,14,41. Si bien resulta difícil establecer puntos de corte, distintos trabajos han empleado valores de FEdi entre 20-36% para definir la presencia de disfunción diafragmática4,9,41,42.
Técnica. La determinación de la FEdi requiere la medida del Gdi al final de la espiración y al final de la inspiración. En términos prácticos, esto corresponde a los valores mínimo y máximo, respectivamente, durante la medición del Gdi en modo M (fig. 1 B)27,29.
Excursión diafragmáticaLa Edi constituye otro parámetro dinámico capaz de brindar información acerca de la función diafragmática. Consiste en la visualización y medida del desplazamiento céfalo-caudal del domo diafragmático entre espiración e inspiración. En individuos con ventilación espontánea, la Edi puede evaluarse en respiración tranquila, inspiración profunda y frente a una maniobra de sniff nasal (en todos los casos a partir de CRF). La Edi durante una inspiración profunda se correlaciona con la PIM, SNIP, capacidad vital forzada y volumen espiratorio forzado en el primer segundo46,48. Según la mayor serie reportada en voluntarios sanos, la Edi es algo mayor en hombres que en mujeres: 1,8±0,3cm vs. 1,6±0,3cm en respiración tranquila, y 7,0±1,1cm vs. 5,7±1,0cm en inspiración profunda, respectivamente48. Valores similares han sido hallados en otros trabajos46,49,50. En ventilación espontánea, una amplitud de movimiento disminuida traduce debilidad diafragmática, mientras que la ausencia de desplazamiento o el movimiento paradojal es indicador de parálisis diafragmática50,51. No obstante, en pacientes con AVM la Edi es producto no solamente de la contracción muscular, sino también del movimiento pasivo provocado por el soporte ventilatorio44. En concordancia con esto, en pacientes bajo AVM no se ha logrado correlacionar la Edi con otros parámetros de función diafragmática47. Sin embargo, la Edi (menor de 1,0-1,1cm en ventilación tranquila) ha demostrado utilidad para predecir el fallo en la extubación al ser realizada en pacientes durante la prueba de ventilación espontánea3,52,53.
Técnica. Con el paciente semisentado (30-45°) se emplea un transductor convexo (3,5-5MHz) ubicado a nivel subcostal derecho entre la línea medio clavicular y la línea axilar anterior27,48. El mismo será dirigido en sentido medial, cefálico y dorsal, de manera que el haz ultrasónico alcance perpendicularmente el tercio posterior del hemidiafragma44. Inicialmente, se emplea el modo B para obtener el mejor enfoque y seleccionar la línea de exploración. En este modo identificaremos el diafragma como una línea hiperecogénica que se relaciona directamente con el hígado por debajo y con el parénquima pulmonar por encima. Una vez identificadas las estructuras en modo B, utilizaremos la línea de exploración lo más perpendicular posible al diafragma y activaremos el modo M con el objetivo de evaluar el movimiento de las estructuras anatómicas a lo largo de la línea seleccionada (fig. 1 C). La Edi se medirá como el desplazamiento del diafragma desde el fin de la espiración hasta el fin de la inspiración. Empleando esta técnica también pueden determinarse otros parámetros como velocidad de contracción y relajación (cm/s), tiempos inspiratorio, espiratorio y duración total del ciclo27,49.
Músculos periféricosEl estudio de las fuerzas musculares periféricas en la UCI puede realizarse a través de la evaluación muscular manual del Medical Research Council (MRC) o la dinamometría de prensión manual. Ambos métodos requieren la colaboración del paciente, por lo que su aplicación durante las primeras etapas de la enfermedad crítica es habitualmente limitada. Es precisamente en esta etapa que el compromiso muscular comienza a desarrollarse, por lo que otros métodos son necesarios para detectarlo precozmente54. En este sentido, el estudio electrofisiológico y la ecografía pueden brindar información sobre alteraciones funcionales y estructurales antes de que la debilidad se haga clínicamente evidente.
Evaluación muscular manualLa valoración global de la fuerza a través de la evaluación muscular manual (MRC) es considerada actualmente el método de referencia para el diagnóstico de debilidad muscular adquirida en la UCI (DMA-UCI)55. La escala del MRC evalúa la fuerza de 3 grupos musculares en cada miembro superior e inferior, otorgando un valor a cada grupo muscular entre 0 (parálisis) y 5 (fuerza normal), y un valor total de 0 a 60 (tabla 1)56. La evaluación se lleva a cabo mediante determinadas maniobras estandarizadas (tabla 2)57.
Escala del MRC para evaluación muscular manual
| Grado 0 | Sin contracción visible o palpable |
| Grado 1 | Contracción visible o palpable, sin movimiento |
| Grado 2 | Movimiento al eliminar la gravedad |
| Grado 3 | Movimiento (distancia casi total) que vence la gravedad |
| Grado 4 | Movimiento que vence resistencia moderada |
| Grado 5 | Movimiento que vence resistencia completa (fuerza normal) |
MRC: Medical Research Council.
Protocolo de evaluación muscular manual (MRC) en la UCI
| Movimiento | Procedimiento |
|---|---|
| Abducción del hombro | Levantar el brazo extendido hacia el costado hasta el nivel del hombro. Colocar una mano por encima del codo y la otra en el hombro, ejercer resistencia (grado 3, 4 o 5). Si el grado es<3, acostar al paciente en supino, sostener el brazo por encima del codo y en la muñeca y pedirle que lo mueva hacia el costado. Si lo puede mover al eliminar la gravedad corresponde a grado 2. Si no lo mueve, palpar el deltoides para discriminar entre grado 1 y 0 |
| Flexión del codo | Flexionar el antebrazo (supinado)>90°. Colocar una mano proximal a la muñeca y la otra en el hombro para ejercer resistencia (grado 3, 4 o 5). Si el grado es<3, abducir el hombro a 90° con el brazo extendido y el pulgar apuntando hacia arriba, sostenerlo a la altura del codo y la muñeca y pedirle al paciente que lo flexione. Si lo puede mover al eliminar la gravedad corresponde a grado 2. Si no lo mueve, colocar el brazo hacia el costado, con el antebrazo supinado, flexionado a 45° y palpar tendón del bíceps para discriminar entre grado 1 y 0 |
| Extensión de la muñeca | Brazo al costado con el codo flexionado a 90°, antebrazo pronado y mano extendida (sostener el codo). Solicitar al paciente que extienda la mano lo más posible. Colocar una mano sobre la mano del paciente, distal a la muñeca, la otra sostiene el antebrazo. Ejercer resistencia (grado 3, 4 o 5). Si el grado es<3, con el codo flexionado a 90° y el pulgar apuntando hacia arriba, sostener el codo y muñeca del paciente y solicitar que extienda la mano. Si la puede extender al eliminar la gravedad corresponde a grado 2. Si no la mueve, en la misma posición palpar los tendones extensores en la muñeca para discriminar entre grado 1 y 0 |
| Flexión de la cadera | Flexionar la cadera con la rodilla doblada. Colocar una mano proximal a la rodilla y la otra en la cadera para ejercer resistencia (grado 3, 4 o 5). Si el grado es<3, el paciente debe acostarse sobre el lado contralateral al que se estudia. Sostener la pierna con la mano debajo de la rodilla, la otra mano mantiene la alineación con la cadera. Solicitar al paciente que flexione la cadera hacia el tórax. Si la puede flexionar al eliminar la gravedad corresponde a grado 2. Si no la mueve, con el paciente en decúbito supino, palpar el tendón del iliopsoas y solicitar que flexione la cadera para discriminar entre grado 1 y 0 |
| Extensión de la rodilla | Extender la rodilla (sentado). Una mano agarra el tobillo para ejercer resistencia, la otra se coloca debajo del muslo, proximal a la rodilla (grado 3, 4 o 5). Si el grado es<3, el paciente debe acostarse sobre el lado contralateral al que se estudia. Sostener la pierna con una mano debajo de la rodilla y la otra en el tobillo. Solicitar al paciente que extienda la pierna; si lo logra al eliminar la gravedad, corresponde a grado 2. Si no la mueve, con el paciente en decúbito supino, palpar el tendón del cuádriceps y solicitar que empuje la rodilla hacia abajo para discriminar entre grado 1 y 0 |
| Dorsiflexión del pie | Sentado con el talón apoyado en el suelo (o decúbito supino si no puede sentarse), dorsiflexión del pie. Ejercer resistencia con una mano en el dorso del pie, la otra mano agarra la pierna proximal al tobillo (grado 3, 4 o 5). Menor que grado 3 pero con movimiento parcial contra gravedad, asignar grado 2. Si es menor a grado 2, palpar tendón del tibial anterior para determinar grado 1 o 0 |
MRC: Medical Research Council; UCI: Unidad de Cuidados Intensivos.
Un valor total de MRC<48 (promedio<4 en los grupos musculares evaluados) se considera diagnóstico de DMA-UCI55,58. La necesidad de contar con un paciente despierto y colaborador constituye la primera limitante para su aplicación. Por otra parte, la variabilidad interobservador reportada ha sido diversa59-61. No obstante, la presencia de un MRC<48 se asocia a dificultad en la desvinculación de la AVM, mayor estancia en la UCI y hospitalaria, mayores costos y mortalidad11,12.
Dinamometría de prensión manualLa dinamometría de prensión manual ha demostrado ser una herramienta útil para el estudio de las fuerzas musculares en la UCI. Esta técnica presenta muy buena reproducibilidad interobservador59,62-64. Para realizar la maniobra el paciente debe tener un MRC ≥ 3 en la flexión del codo y la extensión de la muñeca. Si bien existen valores de referencia para individuos sanos, en pacientes críticos se han utilizado valores de fuerza de prensión (en la mano dominante) <11kg para hombres y <7kg para mujeres para definir DMA-UCI11,65. La presencia de debilidad muscular diagnosticada por este método se ha asociado a dificultad en la desvinculación de la AVM, estancia prolongada en la UCI y mayor mortalidad hospitalaria11,13.
Estudios electrofisiológicosLa evaluación electrofisiológica incluye el estudio de conducción nerviosa, la EMG y el estudio de la unión neuromuscular58,66. Pueden ayudar a definir si la debilidad es causada por afectación muscular, nerviosa o combinada. Sin embargo, la necesidad de equipamiento y personal especializado, así como dificultades técnicas propias de los pacientes críticos (edema tisular, etc.), determina que no sea fácilmente aplicable en la mayoría de las UCI. Recientemente, la aplicación de estudios electrofisiológicos simplificados como el test del nervio peroneo demostraron elevada sensibilidad y especificidad en el diagnóstico de neuromiopatía en pacientes críticos67.
Ecografía muscular periféricaLa ecografía se ha convertido en una herramienta valiosa para la evaluación estructural de los músculos periféricos en la UCI, con una excelente reproducibilidad interobservador68-70. Numerosos trabajos han utilizado el grosor o el área de sección transversal (AST) de distintos grupos musculares como parámetro de masa muscular en pacientes críticos, demostrando un desarrollo progresivo de atrofia durante la estancia en la UCI54,71-77.
Diferentes músculos han sido evaluados, tanto en miembros superiores como inferiores. Campbell et al. reportaron que el análisis combinado del grosor muscular en cara anterior del brazo, antebrazo y muslo es el que tiene mejor correlación con la masa corporal magra (en individuos sanos), siendo empleado posteriormente por varios autores en pacientes críticos73,74,77,78. Se ha descrito la existencia de una correlación entre el grosor o AST y la fuerza muscular en individuos sanos y pacientes críticos75,77,79. La asociación entre atrofia y debilidad muscular ha sido demostrada en pacientes sépticos, en los cuales una mayor reducción del AST del cuádriceps se correlacionó con menor fuerza en el momento de egresar de la UCI75. Sin embargo, en un estudio reciente una única medida aislada del grosor muscular en el momento del despertar no permitió discriminar entre pacientes con y sin DMA-UCI80. Recientemente, Puthucheary et al. compararon específicamente la variación del grosor del cuádriceps con el AST del recto anterior, evidenciando que este último constituye una medida más sensible y confiable para valorar la atrofia y debilidad muscular en la UCI81. Por otra parte, la ecogenicidad muscular aumenta en pacientes críticos, lo que podría corresponder a edema, inflamación, fibrosis, infiltración grasa o necrosis71,78,82,83. Precisamente, el aumento de ecogenicidad muscular predice el desarrollo de mionecrosis (histológica) en la UCI83. Si bien en pacientes no críticos se ha establecido una correlación inversa entre ecogenicidad y fuerza muscular, en el marco de la UCI este vínculo no es tan evidente71,78.
Técnica. Diversos sitios anatómicos y variantes técnicas han sido empleados para la evaluación muscular periférica, dificultando la comparación de resultados entre los distintos estudios. Si bien valores de referencia para grosor y ecogenicidad se han reportado en individuos sanos, la evolución temporal de los mismos parece ser un parámetro más valioso en pacientes críticos84. Es fundamental identificar y estandarizar precisamente el sitio y posición en donde se realizará la medida. Es importante evitar la compresión del músculo durante la medida, para lo cual debe emplearse un exceso de gel conductor y realizar con el transductor la mínima presión que permita obtener la imagen.
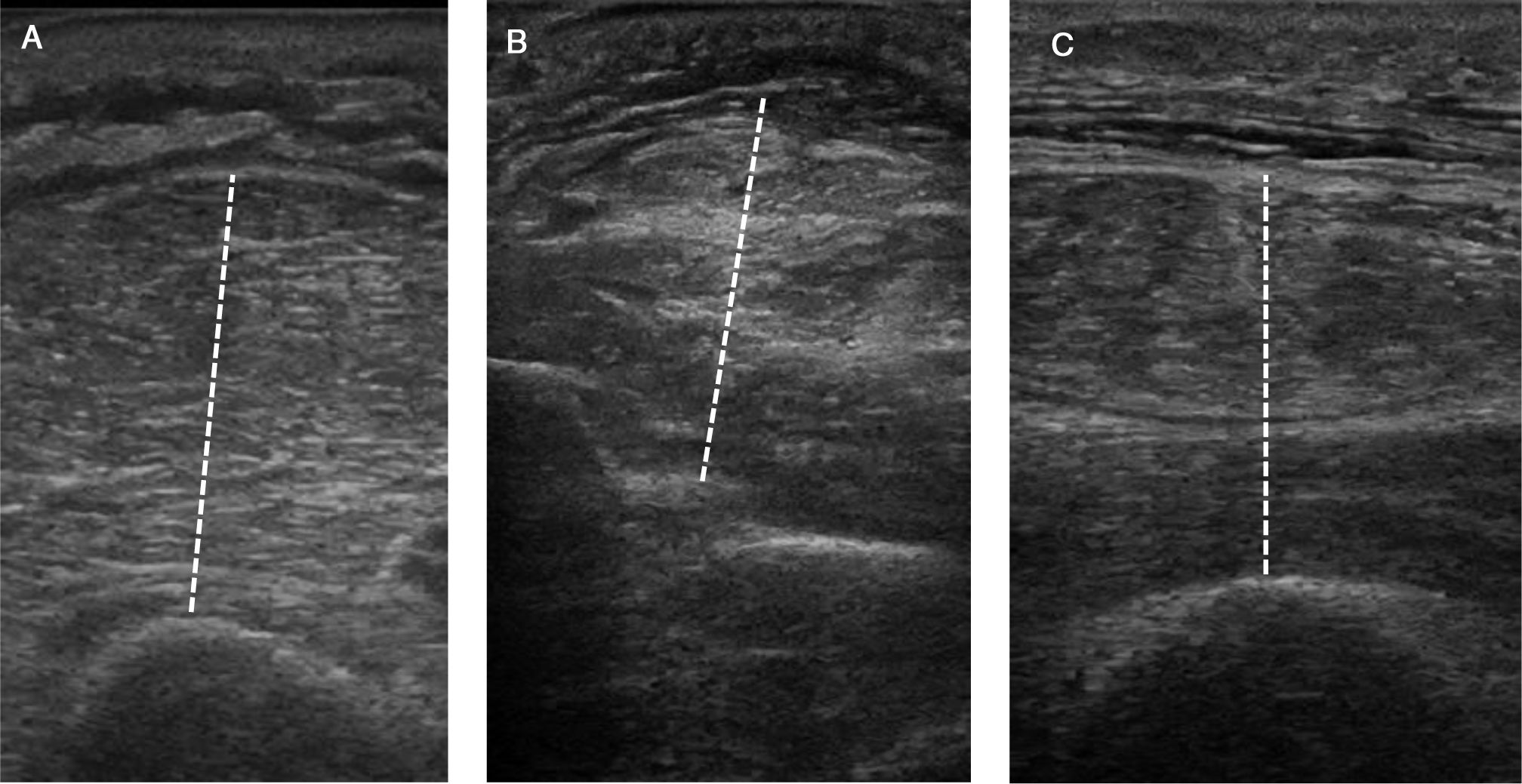
Los registros se obtienen con un transductor lineal (≥ 10MHz) posicionado en sentido transversal y perpendicular al hueso subyacente. El ángulo de insonación puede afectar a las medidas, por lo que debe mantenerse constante. El grosor se mide como la máxima distancia entre la interfase grasa-músculo y el hueso o membrana interósea (fig. 2). En la tabla 3 se detalla la técnica para brazo, antebrazo y muslo33,73,85,86.
Protocolo de ecografía muscular periférica
| Brazo | Con el codo flexionado a 90° se debe buscar el punto equidistante entre el acromion y el olécranon. Posteriormente, con el codo extendido y el antebrazo supinado, colocar el transductor lineal en la cara anterior, a nivel del punto medio previamente identificado. Posicionar el transductor en sentido transversal y perpendicular a la piel. Medir, en el sitio de máximo espesor, el compartimento muscular flexor entre la interfase grasa-músculo y el húmero |
| Antebrazo | Con el codo extendido y el antebrazo supinado identificar el punto equidistante entre el pliegue del codo y la apófisis estiloides cubital. Colocar el transductor lineal en la cara anterior sobre dicho punto, en sentido transversal y de forma perpendicular a la piel, midiendo el espesor del compartimento flexor entre la interfase grasa-músculo y la membrana interósea |
| Muslo | Con la rodilla extendida, marcar el punto equidistante entre el trocánter mayor y la línea articular de la rodilla. Colocar el transductor lineal en la cara anterior sobre dicho punto, en sentido transversal y de forma perpendicular a la piel. Medir el espesor del grupo muscular del cuádriceps a este nivel como la distancia entre la interfase grasa-músculo y el fémur. La medida del AST del recto femoral se obtiene mediante técnica planimétrica, luego de delimitar su margen interno (línea ecogénica) con el cursor |
AST: área de sección transversal.
La evaluación de la ecogenicidad muscular puede realizarse en forma semicuantitativa (escala de Heckmatt) o cuantitativa mediante un análisis de la escala de grises70,71,78,82,87.
Tomografía computarizadaLa tomografía computarizada (TC) es un método validado para determinar la masa muscular69. El AST del tejido muscular en un único corte (habitualmente a nivel de la tercera vértebra lumbar) ha demostrado representar fielmente la masa muscular corporal88-90. Por otra parte, alteraciones musculares estructurales, como la infiltración grasa, pueden ser detectadas mediante el análisis de la densidad muscular en la TC. En pacientes críticos evaluados por TC, la presencia de atrofia, la disminución de la densidad muscular y el aumento de la grasa intermuscular se asocian a un incremento de la mortalidad90,91. La necesidad de traslados y la exposición a radiación constituyen las principales limitantes de esta técnica.
Bioimpedancia eléctricaLa bioimpedancia eléctrica (BIE) permite determinar al lado de la cama del paciente masa corporal magra, aunque no cuantifica directamente la masa muscular92. Esta puede estimarse a partir de ecuaciones de regresión diseñadas para individuos sanos93. Un estudio reciente demostró una aceptable capacidad de la BIE para detectar pacientes con reducción de la masa muscular en la UCI, aunque nuevos trabajos son necesarios para validar esta técnica en pacientes críticos94.
BiomarcadoresLa utilización de biomarcadores podría facilitar el diagnóstico precoz y seguimiento del compromiso muscular en la UCI. Distintas sustancias han sido evaluadas con este fin (mioglobina, creatincinasa, troponina i, etc.). Si bien sus niveles se han encontrado elevados en el contexto de daño o sobrecarga muscular, aún no se ha demostrado su utilidad para detectar atrofia o debilidad muscular en los pacientes críticos. Los micro-ARN podrían constituir una nueva clase de biomarcadores con enorme potencial. Se ha sugerido la participación de distintos micro-ARN en la patogenia de la DMA-UCI95-98. Su determinación a nivel plasmático podría ser capaz de diagnosticar precozmente o incluso predecir el desarrollo del compromiso muscular en pacientes críticos96. Más aún, el perfil de expresión de micro-ARN podría variar según exista compromiso muscular respiratorio, periférico o combinado.
ConclusionesEl compromiso muscular es un problema frecuente en las UCI. Su diagnóstico y seguimiento puede constituir un verdadero desafío. La utilización de distintos parámetros clínicos y métodos complementarios pueden facilitar su detección precoz. Nuevas herramientas no invasivas, accesibles y reproducibles, como la ecografía, han surgido como opciones válidas para la evaluación tanto de músculos periféricos como respiratorios. El descubrimiento de biomarcadores específicos constituye un tópico de enorme interés en el que enfocar futuras investigaciones. La evaluación seriada de los pacientes críticos mediante técnicas ecográficas y la determinación de biomarcadores plasmáticos podría constituir un nuevo paradigma en el estudio del compromiso muscular en la UCI.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.