Introducción
Debido al carácter multidimensional de la enfermedad pulmonar obstructiva crónica (EPOC), su evaluación funcional abarca un amplio espectro de alteraciones, entre las que destacan la obstrucción al flujo aéreo, el desequilibrio de la relación ventilación/perfusión, la limitación de la tolerancia al ejercicio, la afectación de los músculos respiratorios y sus repercusiones sistémicas. Debido a la necesaria limitación de este capítulo y a que otras alteraciones fisiopatológicas serán tratadas de forma más específica en otros apartados de esta monografía, a continuación nos centraremos exclusivamente en la obstrucción y en su consecuencia más inmediata, el atrapamiento aéreo. Ambos trastornos reflejan las alteraciones morfológicas del parénquima y las vías aéreas de los pacientes con EPOC y, aunque el primero parece más relacionado con el flujo aéreo y el segundo con los volúmenes pulmonares, representan distintas repercusiones de alteraciones patológicas similares.
Obstrucción al flujo aéreo
La obstrucción o limitación al flujo aéreo podría considerarse como una reducción del flujo aéreo máximo desproporcionada con respecto al volumen de aire que el paciente puede desplazar desde los pulmones1. Suele reflejar una obstrucción difusa de las vías aéreas y, como es conocido, también está presente en otras enfermedades distintas de la EPOC, como el asma, la fibrosis quística, la bronquiolitis u otras.
En condiciones normales, el flujo aéreo es una función de la resistencia de las vías aéreas y del gradiente de presiones (o presión de conducción)2. La resistencia al flujo aéreo depende sobre todo de la luz de las vías aéreas y de los volúmenes pulmonares. Aunque el diámetro de los bronquiolos terminales es mucho menor que el de la tráquea (0,5 mm frente a 2 cm, aproximadamente), por ser cerca de 50.000 determinan una área mayor para el flujo aéreo, por lo que el flujo turbulento de la tráquea se hace laminar al alcanzar las ramificaciones bronquiales más distales1. Por otra parte, la resistencia al flujo aéreo mantiene una relación inversamente proporcional con los volúmenes pulmonares. A bajos volúmenes, hay menos fuerza de retracción elástica y mayores resistencias2.
Los cambios patológicos más característicos de la EPOC son la obstrucción de las vías aéreas y la pérdida de tracción elástica del pulmón3. En este caso, la obstrucción de las vías aéreas se debe a su colapso, secundario a la pérdida de la tracción elástica del parénquima pulmonar, por destrucción de la matriz de colágeno-elastina del pulmón, y a la obstrucción intraluminal. Esta última es originada por el engrosamiento de las paredes bronquiales, la contracción del músculo liso bronquial y el depósito intraluminal de moco y detritos celulares3.
Puesto que, según la ley de Pouiselle, el flujo laminar a través de un tubo es directamente proporcional a la cuarta potencia de su radio, la disminución del calibre de las vías aéreas tiene un marcado efecto en la resistencia de las pequeñas vías aéreas. De hecho, la limitación al flujo aéreo que experimentan los fumadores con EPOC ha sido clásicamente atribuida a la afectación de las vías aéreas más periféricas4. No obstante, debe recordarse que puede existir un notable incremento en las resistencias periféricas sin que sea detectado por las pruebas habituales de función pulmonar. Esto se justifica por la limitada contribución de las pequeñas vías aéreas a la resistencia total (menor del 20%). En consecuencia, para que se detecte obstrucción al flujo aéreo la enfermedad producida en las pequeñas vías aéreas debe alcanzar una extensión mínima4.
Como ya se ha mencionado, el estrechamiento de la luz de las pequeñas vías aéreas, que resulta proporcional a la gravedad de la EPOC, se debe a la infiltración por células inflamatorias (linfocitos y macrófagos, sobre todo), tanto de la pared de las vías aéreas como de su luz, así como de diversos cambios estructurales, que incluyen el incremento del músculo liso y la fibrosis subepitelial y del exterior de la pared4.
La contracción del músculo liso de las vías aéreas es otro de los mecanismos implicados en la limitación al flujo aéreo. Está presente en todas las enfermedades con obstrucción y explica las bruscas variaciones del calibre bronquial que se producen en algunas de ellas. Este mecanismo es susceptible de ser rápidamente modificado, lo que tiene obvia trascendencia desde el punto de vista terapéutico. Sin embargo, no está claro que los cambios del flujo aéreo se deban a anomalías funcionales del propio músculo liso. El efecto que un grado determinado de activación y acortamiento del músculo liso tiene sobre el calibre de las vías aéreas depende de factores geométricos del propio músculo y de la pared bronquial, del grado de contracción del músculo y del grosor de toda la pared, de la presencia de exudado o secreciones en la luz bronquial, de la existencia de edema en la pared y del régimen de flujo a través de las vías aéreas5. Por tanto, se puede producir un estrechamiento de las vías aéreas sin necesidad de que la contracción del músculo sea anormal. El engrosamiento de la pared bronquial facilita en parte la oclusión de la luz cuando el músculo liso se acorta y, además, el edema peribronquial impide la retracción elástica que mantiene al bronquio abierto y permite que la mucosa siga pasivamente a la contracción muscular5. La contracción se debe a la estimulación por diferentes agonistas, como acetilcolina liberada por el sistema colinérgico, o diferentes mediadores inflamatorios, como histamina, leucotrienos y prostaglandinas. Mientras que se presume que en el asma estarían implicados todos los mediadores, en la EPOC parece tener mayor trascendencia el sistema colinérgico5.
Sin embargo, atribuir todo el protagonismo de la obstrucción al flujo aéreo a las pequeñas vías aéreas (inflamación, remodelado, hipersecreción mucosa y contracción del músculo liso) subestima la contribución de la disminución de la transmisión de la presión de conducción del flujo aéreo originada por la destrucción del parénquima pulmonar. En realidad, las alteraciones de las vías aéreas y el papel del parénquima pulmonar en la obstrucción al flujo aéreo no deberían considerarse factores independientes, sino que es preciso entenderlos de forma conjunta.
Evaluación de la obstrucción al flujo aéreo
De forma prácticamente universal, la obstrucción al flujo aéreo es valorada mediante la espirometría. Aunque en algunas circunstancias pueden resultar más sensibles otras técnicas de estudio de la mecánica pulmonar, como la conductancia específica de las vías aéreas, la distensibilidad pulmonar o curvas flujo-volumen parciales, la espirometría se plantea como un procedimiento simple, barato, reproducible y con abundantes y contrastados valores de referencia1,3.
El volumen espiratorio forzado en el primer segundo (FEV1), la capacidad vital forzada (FVC) y la relación FEV1/FVC son los parámetros más empleados en la espirometría y resultan fundamentales para el diagnóstico de limitación al flujo aéreo5,6. Las principales guías internacionales8,9 establecen como criterio de EPOC un cociente FEV1/FVC ≤ 0,7, puesto que resulta mejor que el FEV1, que puede estar reducido por un descenso paralelo de la capacidad vital. Además, se trata de un índice sencillo, que precisa de una sola maniobra para su determinación y que no requiere valores teóricos. Sin embargo, desciende ligeramente con la edad9 y es menos sensible que el cociente FEV1/capacidad vital lenta (VC)6. En cualquier caso, en la EPOC leve-moderada se obtienen similares valores de FVC y VC. Mientras que en la EPOC grave, la FVC resulta considerablemente menor que la VC, por la dependencia negativa del esfuerzo y por el atrapamiento aéreo7. Esto justifica que el cociente FEV1/FVC subestime la gravedad de la EPOC y que, en algunas ocasiones, se proponga sustituirlo por el FEV1/VC.
Además de la comentada utilidad diagnóstica del FEV1, este parámetro presenta muchas otras ventajas. De forma general, se utiliza para clasificar la gravedad de la EPOC1,6,8,9. Además, la realización periódica de espirometrías a pacientes de alto riesgo constituye un procedimiento fiable para la detección precoz de la enfermedad. Recientemente, se ha demostrado que el FEV1 resulta sensible en la identificación de EPOC en sujetos fumadores mayores de 40 años10. Aunque con ciertas reservas, el FEV1 también tiene un valor pronóstico. En un trabajo clásico, ya se establecía que la supervivencia a los 5 años de pacientes con EPOC y un FEV1 > 1,2 l era del 80%, mientras que se reducía al 40% en los que tenían un FEV1 < 0,75 l11.
Otra importante ventaja del FEV1 como parámetro de elección en la valoración de la EPOC proviene de su utilidad como indicador de la historia natural de la enfermedad. Desde el clásico estudio de Fletcher y Peto12, se ha establecido la historia natural de la EPOC a partir del declinar anual del FEV1. La caída del FEV1 en no fumadores resulta de aproximadamente 25 ml/año, mientras que en los fumadores oscila en 25-50 ml/año. Una reducción anual superior a 50 ml se considera criterio de progresión acelerada de la enfermedad13. Por tanto, el FEV1 es el parámetro mejor conocido para valorar la progresión de la enfermedad y resulta especialmente relevante para valorar el efecto de ciertas intervenciones terapéuticas sobre su historia natural, en particular la supresión del tabaquismo.
El FEV1 también es el parámetro empleado en la evaluación de otras actuaciones farmacológicas en estos pacientes. Los últimos consensos internacionales recomiendan considerar respuesta positiva a los esteroides cuando después de 6 semanas a 3 meses de administración de corticoides inhalados se produce un incremento del FEV1 > 200 ml y ≥ 15% con respecto al previo posbroncodilatador8,9. Por último, el FEV1 sigue siendo, junto con la FVC, el parámetro más valorado para el estudio de reversibilidad.
En definitiva, el FEV1 es un parámetro útil para valorar limitación al flujo aéreo y con una elevada rentabilidad clínica en la EPOC. Sin embargo, y pese a estas indiscutibles aplicaciones, plantea algunas limitaciones. Al igual que la FVC, en pacientes con EPOC grave el FEV1 puede presentar una dependencia negativa del esfuerzo. Esto es, al aumentar el esfuerzo inspiratorio se produce un incremento de la compresión del gas intratorácico, por lo que disminuye el volumen torácico y, en consecuencia, se reduce el flujo espiratorio. Para obviar este problema, se ha intentado recurrir a la realización de curvas flujo-volumen parciales, pero este procedimiento no se ha generalizado.
En pacientes con EPOC moderada, el FEV1 tiene una pobre correlación con la clínica, principalmente con la intensidad de la disnea y con la tolerancia al ejercicio7. Además, en pacientes con EPOC grave, el FEV1 tiene poco valor predictivo aislado7. En definitiva, aunque el FEV1 y el cociente FEV1/FVC son los parámetros estándar para definir obstrucción, no siempre guardan una buena relación con los síntomas, la calidad de vida y la tolerancia al ejercicio de los pacientes con EPOC14,15.
Otra limitación ya comentada del FEV1 y del cociente FEV1/FVC es su poca sensibilidad para detectar obstrucción de las pequeñas vías aéreas. Por este motivo, se ha valorado la utilidad de otros parámetros espirométricos, a los que se puede recurrir en estos casos. Puesto que las pequeñas vías carecen de revestimiento cartilaginoso, su calibre depende de la retracción elástica pulmonar y, dado que la presión de retracción disminuye al descender el volumen, su resistencia aumenta al final de la espiración. Por tanto, los flujos instantáneos (FEF25%, FEF50% y FEF75%) o los flujos mesoespiratorios (FEF25-75%) parecen más sensibles para detectar alteraciones incipientes de la pequeña vía, puesto que miden el flujo a bajos volúmenes pulmonares16. Sin embargo, tienen un amplio coeficiente de variabilidad, por lo que resulta difícil establecer un punto de corte para identificar su reducción3. Además, si la capacidad pulmonar total y el volumen residual están por debajo de sus valores de referencia, la capacidad vital disminuirá y estos flujos pueden estar reducidos en ausencia de obstrucción. Por tanto, sólo se deberían utilizar en la evaluación de enfermedad de la pequeña vía en condiciones isovolumétricas, con respecto a los valores de referencia3.
Cuando la alteración obstructiva se acompaña de un desequilibrio en la distribución de la ventilación entre vías aéreas paralelas, las vías obstruidas necesitan más tiempo que las normales para vaciarse durante la espiración forzada. Esta desigualdad en el vaciado pulmonar puede valorarse mediante el denominado tiempo de tránsito medio (MTT) y la distribución de los tiempos de tránsito de la espirometría forzada. Este análisis puede ser de utilidad para detectar mínimas anomalías, ya que está influido por la porción final de la espirometría, que es la parte más dependiente de la edad y la que se afecta en los estadios precoces de las enfermedades obstructivas6. Sin embargo, también muestra una elevada variabilidad intersujeto e intrasujeto.
La realización de curvas flujo-volumen con gases de distinta densidad permite evaluar mejor la obstrucción al flujo aéreo dependiente de las pequeñas vías. Esta técnica se basa en que al ser el helio menos denso que el aire, si un sujeto normal respira una mezcla de helio (80%) con oxígeno (20%) las turbulencias en las vías aéreas superiores disminuyen. Como a medida que disminuye el volumen en el pulmón durante la espiración, en las vías periféricas el flujo es más laminar y menos dependiente de la densidad del gas, el flujo al final de la inspiración resultará independiente de la mezcla de gas que se respire6. En la curva flujo-volumen realizada con una mezcla de helio y oxígeno, se observa un marcado incremento del flujo cuando los volúmenes son mayores, un punto donde se igualan los flujos, que es el denominado punto de isoflujo, y el volumen al que se igualan, que se denomina volumen de isoflujo. Cuando la obstrucción al flujo es dependiente de las pequeñas vías aéreas, el incremento del flujo inicial que produce el helio está atenuado o ausente y, por tanto, aumenta el volumen de isoflujo17.
Evaluación de la limitación al flujo espiratorio
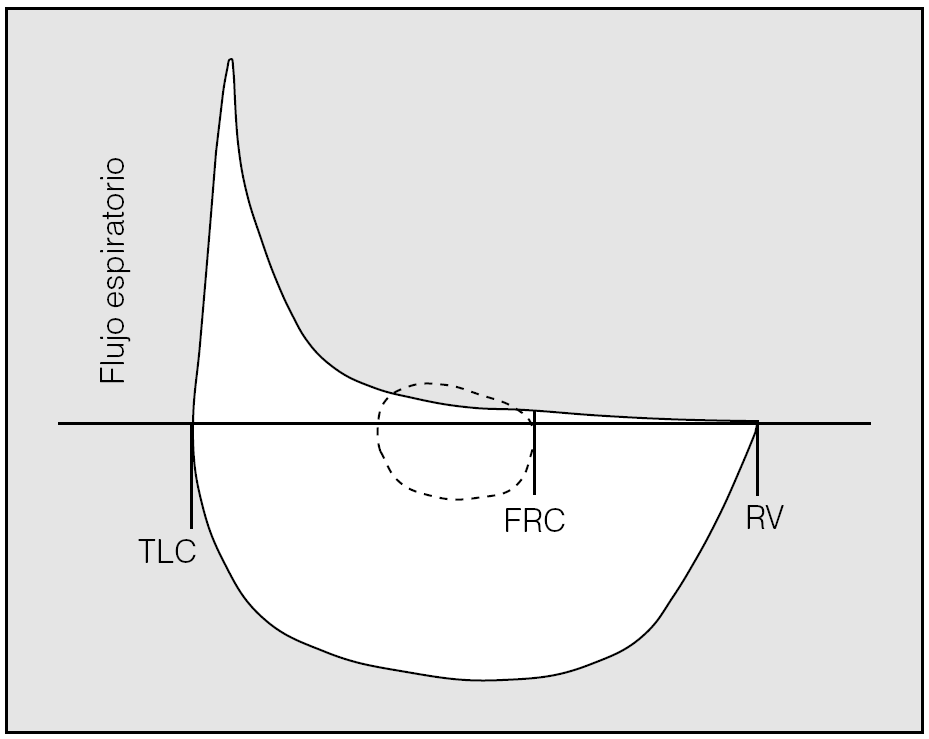
La representación de la curva flujo-volumen a volumen corriente sobre la curva obtenida durante una maniobra de espiración forzada aporta una interesante información adicional. En ocasiones, el flujo espiratorio en reposo a volumen corriente supera al forzado (fig. 1), lo que evidencia una limitación al flujo espiratorio. Algunos pacientes pueden no manifestar limitación al flujo espiratorio en reposo, pero desarrollarla a flujos más elevados durante el ejercicio.
Fig. 1. Cuando el flujo espiratorio a volumen corriente excede al flujo alcanzado durante una maniobra forzada se evidencia limitación al flujo espiratorio. FRC: capacidad residual funcional; TLC: capacidad pulmonar total; RV: volumen residual. Tomado de Corne y Anthonisen3.
Sin embargo, este tipo de aproximación para detectar limitación al flujo tiene considerables limitaciones3. El aumento de la presión intratorácica durante la maniobra de FVC origina compresión del gas dentro del tórax. Por tanto, la medida de los volúmenes pulmonares puede subestimar la reducción real de éstos y, en consecuencia, subestimar los flujos espiratorios forzados a cualquier volumen pulmonar. El esfuerzo inspiratorio previo también puede modificar los resultados. En la maniobra de FVC, se ha comprobado que la inspiración máxima previa reduce la retracción elástica de los pulmones y aumenta la resistencia de la vía aérea en sujetos con limitación al flujo3. Otra fuente de error puede deberse a diferencias en el comportamiento viscoelástico dependiente del tiempo de los tejidos pulmonares entre las dos maniobras. Tampoco debe olvidarse que los pulmones son heterogéneos con unidades que tienen distintas constantes de tiempo. En pacientes con EPOC, durante la espiración forzada participarán sobre todo las unidades pulmonares con constantes de tiempo rápidas, mientras que las unidades con constantes de tiempo lentas apenas se vacían. Por el contrario, durante la espiración a volumen corriente participan todas las unidades pulmonares, por lo que el flujo espiratorio alcanzado puede ser mayor18. Por último, el flujo espiratorio forzado puede verse alterado por la compresión de gas en las vías aéreas3.
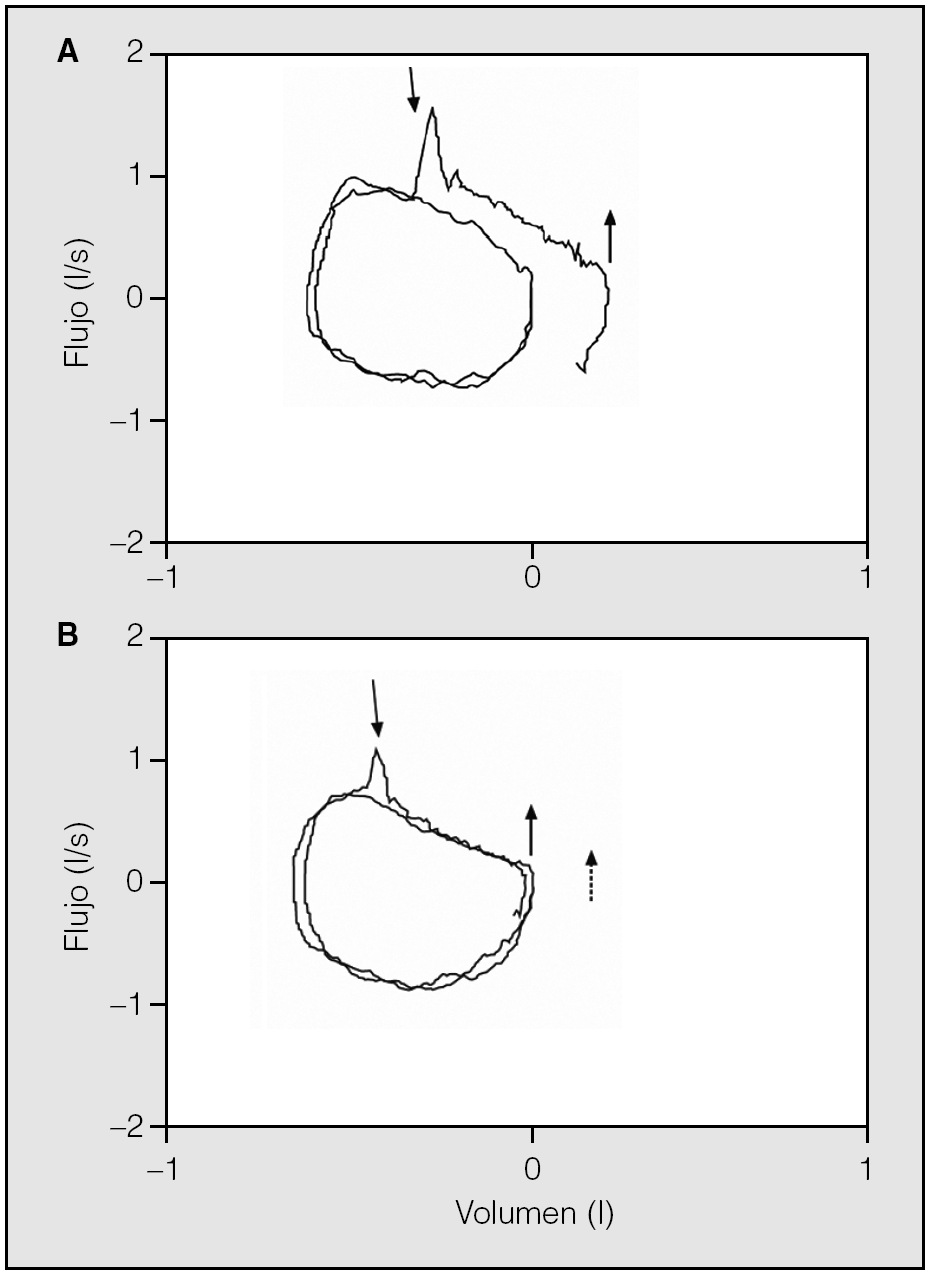
Con objeto de superar estas limitaciones, se ha desarrollado la técnica de presión espiratoria negativa (NEP) que consiste en aplicar una presión negativa de unos 3 a 5 cm de H2O en la boca del paciente durante la espiración a volumen corriente en reposo (fig. 2)19. La ausencia de incremento del flujo con respecto a una espiración sin aplicación de NEP sugiere limitación al flujo espiratorio. Se trata de un procedimiento sencillo y de fácil aplicación, que no requiere la colaboración del paciente y que se puede efectuar en cualquier postura, durante la realización de ejercicio y durante la ventilación mecánica19,20. Además, efectúa las determinaciones en las mismas condiciones de volumen, tiempo y presión intratorácica. Estudios recientes han mostrado la correlación de este parámetro con la disnea y con el FEV121.
Fig. 2. Representación esquemática de la técnica de presión espiratoria negativa (NEP) y un registro sin limitación al flujo aéreo (A) y otro con limitación (B). Modificado de Calverley y Koulouris19.
Otra técnica propuesta para detectar la limitación del flujo espiratorio durante el reposo es la oscilación forzada (IOT). La IOT mide el grado de obstrucción en condiciones de respiración espontánea. Consiste en la aplicación de una pequeña oscilación de presión en la boca mientras el paciente respira espontáneamente. La presión genera una oscilación de flujo de la misma frecuencia superpuesta al flujo respiratorio del paciente. La relación entre la presión oscilatoria que se aplica y el flujo oscilatorio resultante es lo que se denomina impedancia respiratoria, que caracteriza la carga mecánica del sistema respiratorio a la ventilación. La impedancia está constituida por dos componentes: la resistencia y la reactancia6. La primera representa la resistencia al flujo de las vías aéreas, mientras que la segunda refleja las propiedades elásticas del sistema respiratorio y los cambios proporcionales de volumen pulmonar, así como la inercia al movimiento de la columna de aire en el árbol bronquial. La maniobra se realiza mientras el sujeto respira por la boca a volumen corriente, aunque opcionalmente se puede llevar a cabo durante una inspiración y espiración máximas no forzadas. Necesita muy poca colaboración de los pacientes y es más sensible que la espirometría6. A través de ella, se obtiene información de gran relevancia en función del análisis de una amplia variedad de parámetros, aunque básicamente se usa para el diagnóstico diferencial de enfermedades pulmonares obstructivas centrales y periféricas6.
En su conjunto, estos métodos son más sensibles que el FEV1 para detectar limitación al flujo y parecen guardar mejor correlación con la disnea y la tolerancia al ejercicio3. Aunque la evaluación de la limitación al flujo espiratorio es de interés en la valoración de la obstrucción al flujo aéreo, su utilidad clínica es incierta. No obstante, el campo de la ventilación mecánica ya constituye una clara excepción en el momento actual, puesto que en pacientes con EPOC e hiperinsuflación dinámica, la aplicación de presión positiva teleespiratoria (PEEP) sólo parece resultar beneficiosa cuando se evidencia limitación al flujo espiratorio22.
Atrapamiento aéreo
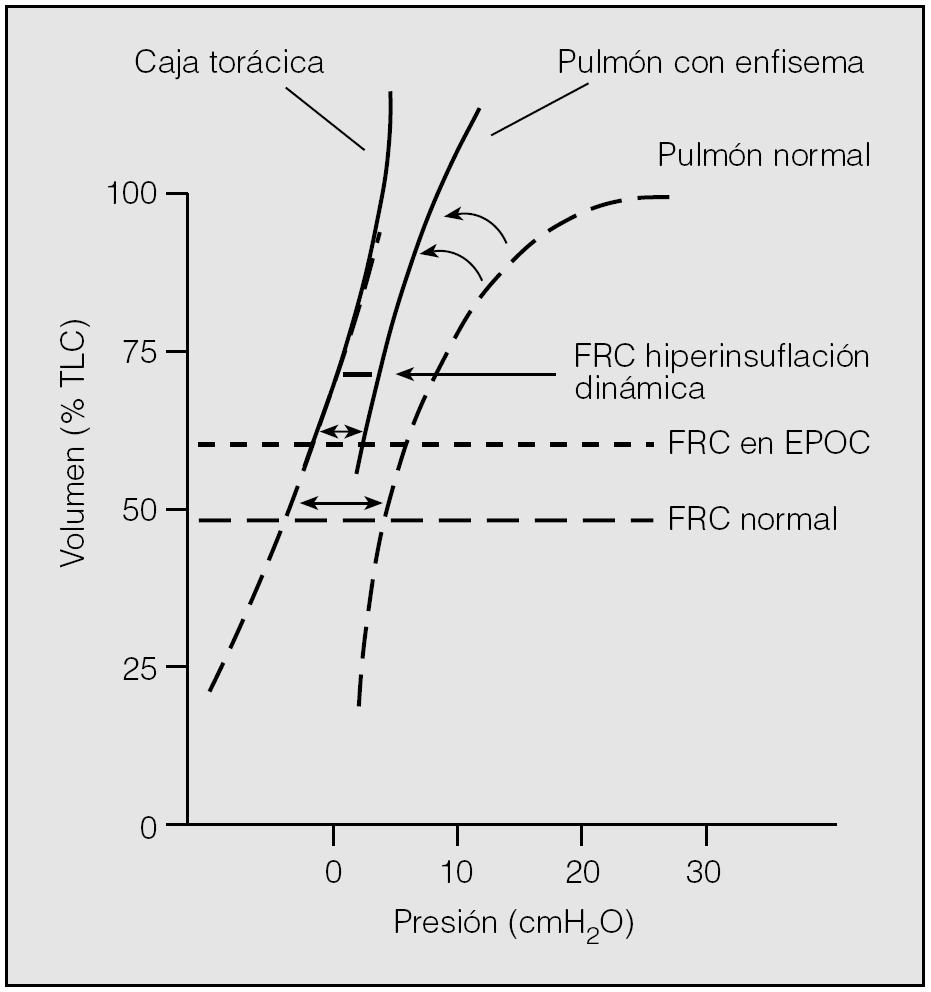
Durante la respiración relajada a volumen corriente, los pulmones tienden a volver a su posición de reposo después de la inspiración, que se denomina capacidad residual funcional (FRC) o volumen pulmonar teleespiratorio (EELV)3. En pulmones normales, este volumen representa el punto en el que todos los músculos respiratorios están en reposo y se alcanza un equilibrio entre las presiones de retracción elástica del pulmón y de la caja torácica (fig. 3)23. Este volumen fisiológico también se denomina volumen de relajación (Vr)24.
Fig. 3. Curvas presión-volumen pulmonares y de la caja torácica en un sujeto sano y en un paciente con enfermedad pulmonar obstructiva crónica (EPOC). FRC: capacidad residual funcional; TLC: capacidad pulmonar total. Modificado de Ferguson23.
La mayor colapsabilidad de los alvéolos y de los bronquiolos respiratorios y el incremento de las resistencias de las vías aéreas determinan que durante un ciclo respiratorio normal los alvéolos tengan dificultades para vaciarse durante la fase espiratoria, por lo que resultan incapaces de retornar a la situación previa a la inspiración3. Este trastorno, conocido como atrapamiento aéreo, sucede en prácticamente todas las formas de EPOC, con independencia de su gravedad15. La consecuencia más inmediata del atrapamiento aéreo en la EPOC es el desarrollo de hiperinsuflación.
Desde un punto de vista conceptual, el atrapamiento aéreo corresponde a un aumento del volumen residual (RV) o del cociente RV/capacidad pulmonar total ([TLC] total lung capacity) mientras que la hiperinsuflación refleja la elevación de la FRC o del EELV sobre su valor de referencia25. Un aumento del RV siempre origina un incremento de la FRC, pero un aumento del cociente RV/TLC es menos específico, puesto que puede reflejar tanto un incremento del RV como una disminución de la TLC.
A su vez, la hiperinsuflación se suele dividir en estática y dinámica. La primera es consecuencia de la pérdida de retracción del parénquima pulmonar y resulta más frecuente en pacientes con enfisema23. La destrucción del tejido elástico altera la retracción elástica del pulmón, y modifica la relación entre el volumen pulmonar y la presión de distensión (curva presión-volumen). La pérdida de retracción elástica pulmonar altera el equilibrio entre las fuerzas de retracción del pulmón y de la caja torácica24, de tal modo que para compensar la retracción elástica de la caja torácica los pulmones necesitan situarse en una porción más elevada de la curva presión-volumen, aumentando la FRC (fig. 3). De todas formas, la hiperinsuflación estática asociada con el enfisema resulta modesta, salvo en enfermos muy graves o en pacientes con enfisema por déficit de alfa-1 antitripsina.
La hiperinsuflación dinámica puede ocurrir de forma independiente o asociada a la hiperinsuflación estática y puede verse en enfermos con cualquier nivel de gravedad23. Se produce cuando un paciente comienza la inspiración antes de alcanzar una espiración completa, lo que determina que en cada respiración quede atrapada cierta cantidad de aire en los pulmones. El EELV no se sitúa en el punto pasivo de relajación de la caja torácica y de los pulmones, sino que se establece a una PEEP, antes de que la espiración pueda llegar al Vr (fig. 3)23.
La hiperinsuflación dinámica depende de los flujos espiratorios y del tiempo espiratorio. En sujetos sanos, el flujo aéreo espiratorio resulta suficiente para lograr una espiración completa del volumen inspirado antes de iniciar la siguiente inspiración, incluso cuando la ventilación se aproxima a la máxima. Así, por ejemplo, durante el ejercicio, aumenta la respiración para tratar de satisfacer las demandas metabólicas, y el volumen corriente se expande más. Por tanto, el EELV no sólo no aumenta, sino que incluso se reduce ligeramente.
En pacientes con EPOC, el flujo aéreo espiratorio está limitado por la obstrucción de las vías aéreas, secundaria al incremento del tono colinérgico, la inflamación y los tapones de moco. Esto, asociado al incremento de la colapsabilidad de las vías aéreas, aumenta su resistencia y prolonga el tiempo necesario para completar la espiración. Los enfermos leves pueden ser capaces de lograr una espiración completa en reposo, cuando respiran a una frecuencia baja. Sin embargo, si la demanda de una mayor ventilación minuto aumenta el volumen corriente y la frecuencia respiratoria, el tiempo disponible para la espiración puede resultar incompleto, por lo que aumentaría el EELV23. Por el contrario, los pacientes con EPOC grave desarrollan hiperinsuflación pulmonar a bajos volúmenes pulmonares.
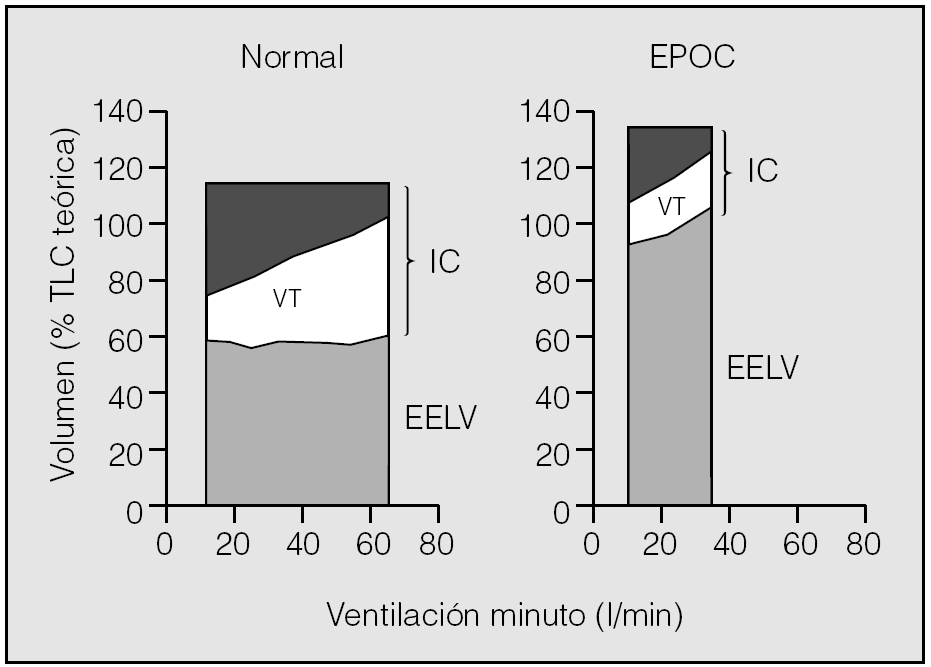
En la figura 4 se representa el comportamiento de los volúmenes pulmonares durante el ejercicio en sujetos sanos y en pacientes con EPOC. Se puede apreciar que los enfermos con EPOC parten de un EELV elevado, por la hiperinsuflación dinámica y estática, pero éste todavía aumenta más durante el ejercicio15. En esta situación, cualquier deseo de incrementar el volumen corriente resulta limitado por la incapacidad de expandirse a grandes volúmenes, dado que el EELV está muy próximo a la TLC. Además, la limitación al flujo aéreo evita incluso un incremento a partir del ERV. Por tanto, sólo es posible aumentar la ventilación minuto a expensas de incrementar la frecuencia respiratoria. Sin embargo, esto acorta todavía más el tiempo espiratorio, por lo que se potencia el círculo vicioso y la hiperinsuflación dinámica/atrapamiento aéreo se hace más progresiva23.
Fig. 4. Cambios dinámicos en los volúmenes pulmonares durante el ejercicio en sujetos sanos y pacientes con enfermedad pulmonar obstructiva crónica (EPOC). TLC: capacidad pulmonar total; IC: capacidad inspiratoria; EELV: volumen pulmonar teleespiratorio; VT: volumen corriente. Tomado de O'Donnell et al15.
Por definición, la intensidad de la hiperinsuflación dinámica en cualquier momento dependerá del grado de limitación al flujo aéreo y de la frecuencia respiratoria. Por tanto, la hiperinsuflación se puede intensificar durante las exacerbaciones y reducirse en períodos de reposo en fase estable. Dado este carácter reversible, constituye una atractiva diana terapéutica.
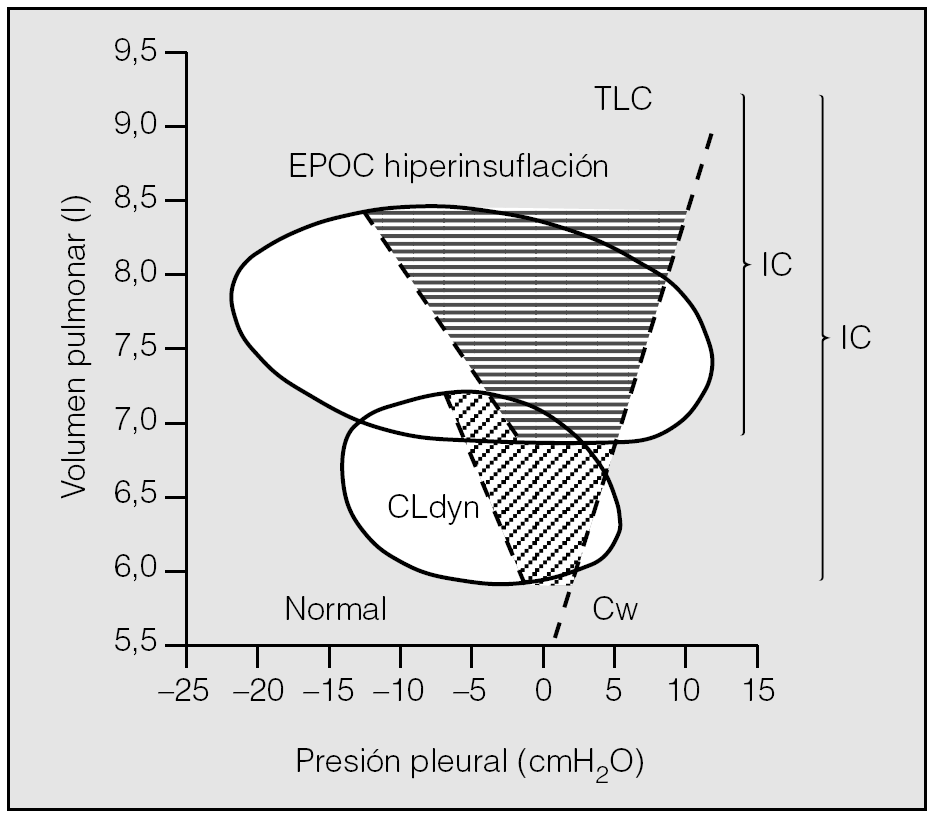
Por otra parte, en los pacientes con EPOC, la hiperinsuflación mantiene una mejor relación con la disnea, limitación al ejercicio e hipoventilación alveolar que la obstrucción al flujo aéreo, evaluada a través del FEV126. El desplazamiento en la curva presión-volumen del sistema respiratorio condiciona un aumento de la carga elástica de los músculos, que incrementa el trabajo mecánico y el coste de oxígeno de la respiración (fig. 5). La hiperinsuflación supone una carga inspiratoria de tipo umbral. Dado que en estos pacientes la inspiración comienza cuando aún no se ha producido un vaciamiento pulmonar completo, los músculos inspiratorios deben superar primero la presión de retracción elástica del pulmón que todavía favorece la espiración23,26. Este comportamiento supone una auto-PEEP o una PEEP intrínseca. También se altera la relación longitud-tensión de los músculos respiratorios, particularmente del diafragma, lo que empeora su capacidad para generar presión26. Además, la taquipnea y el incremento de la velocidad de acortamiento muscular durante el ejercicio potencian la debilidad funcional de los músculos. El incremento del trabajo respiratorio que origina la hiperinsuflación dinámica y la debilidad muscular determinan que en estos enfermos las presiones inspiratorias a volumen corriente representen una fracción muy elevada de la máxima capacidad para generar fuerza muscular, suponiendo un mayor riesgo de fatiga26.
Fig. 5. Diagrama de Campbell que representa el trabajo total de la respiración como el área contenida en las curvas presión-volumen de un paciente con enfermedad obstructiva crónica (EPOC). CLdyn: compliancia pulmonar dinámica; Cw: compliancia de la caja torácica; IC: capacidad inspiratoria; TLC: capacidad pulmonar total. Modificado de Ferguson23.
Evaluación de la hiperinsuflación pulmonar
Al aumentar la FRC, disminuye el movimiento anteroposterior del abdomen durante la respiración a volumen corriente, mientras que se conserva, o incluso aumenta, el movimiento anteroposterior de la caja torácica superior, probablemente debido al uso de músculos intercostales y accesorios25. En pacientes con hiperinsuflación pulmonar, es posible apreciar el signo de Hoover, o movimiento paradójico lateral del margen costal, que corresponde a una distorsión de la caja torácica durante la inspiración, atribuida a la tracción directa del diafragma aplanado sobre los márgenes costales laterales27.
No obstante, el procedimiento clásico de evaluación funcional, tanto del atrapamiento aéreo como de la hiperinsuflación pulmonar, consiste en la medida de los volúmenes pulmonares estáticos. En general, se acepta que los métodos dilucionales subestiman los volúmenes pulmonares de los pacientes con EPOC, puesto que no miden el atrapamiento aéreo o el gas contenido en bullas. Con respecto al método pletismográfico, se han descrito unas diferencias medias en los volúmenes pulmonares de 0,6 l, que pueden llegar a los 2 l13.
Aunque la pletismografía proporciona una medida más aproximada de los volúmenes pulmonares de pacientes con EPOC que los métodos dilucionales, también está sujeta a algunos errores. La compresión de la vía aérea extratorácica durante las maniobras de panting puede hacer que la presión en boca no refleje exactamente la presión alveolar, lo que lleva a una sobrestimación de la TLC y del RV3. Además, el uso de músculos intercostales y accesorios durante las maniobras de panting puede obstruir la glotis y también contribuye a una sobrestimación de los volúmenes pulmonares3. Por otra parte, este procedimiento requiere cierto grado de sofisticación técnica, que limita su aplicación de forma generalizada fuera de un laboratorio de función pulmonar.
Ante esta limitación, ha cobrado importancia un parámetro determinado mediante la espirometría lenta: la capacidad inspiratoria (IC), que corresponde a la suma del volumen corriente y del volumen de reserva inspiratorio. Como en un mismo individuo los cambios de la TLC en un corto período no son relevantes23, es posible inferir qué pasa con la FRC o con el EELV a partir de la IC (fig. 4). En un sujeto sano, la IC aumenta durante el ejercicio, mientras que su reducción en un enfermo con EPOC sugiere el desarrollo de hiperinsuflación dinámica (fig. 4).
La IC alcanza una buena reproducibilidad, tanto en reposo como en ejercicio14, y representa el verdadero límite operativo para la expansión del volumen corriente durante el ejercicio, circunstancia que no sucede con la capacidad vital14,26. Puesto que constituye un indicador del desarrollo de hiperinsuflación, a diferencia de lo que sucede con el FEV1, la IC muestra una buena relación con la disnea y con la capacidad de ejercicio en los pacientes con EPOC26.
A modo de conclusión, la obstrucción al flujo aéreo y el atrapamiento aéreo/hiperinsuflación constituyen las dos alteraciones más habituales de la mecánica pulmonar en pacientes con EPOC. Pese a que mantienen cierto grado de relación, reflejan trastornos diferenciados y se evalúan por parámetros distintos. Mientras que la obstrucción al flujo aéreo sigue siendo esencial para el diagnóstico y la clasificación de gravedad de la EPOC, la hiperinsuflación guarda mejor relación con los síntomas percibidos por el paciente, como la disnea o la intolerancia al ejercicio, y también parece tener capacidad pronóstica independiente.
Correspondencia: Dr. F. García Río.
Alfredo Marqueríe, 11, izqda., 1.º A.
28034 Madrid. España.
Correo electrónico: fgr01m@gmail.com