Introducción
La enfermedad pulmonar obstructiva crónica (EPOC) y la bronquitis crónica constituyen causas importantes de morbilidad en pacientes de países desarrollados y se encuentran entre las causas más importantes de muerte en el mundo1. Además, las agudizaciones de la bronquitis crónica (ABC) tienen una notable influencia en el sistema sanitario, tanto en atención primaria de salud como en el medio hospitalario, pues son una causa importante de consumo de antibacterianos y de hospitalización, y también de costes indirectos debidos a aspectos relacionados con el trabajo2. La implicación de la infección bacteriana en las ABC y la utilidad de los cultivos de esputo en el diagnóstico etiológico son controvertidas en el abordaje clínico de estos pacientes3. Streptococcus pneumoniae, Haemophilus influenzae y Moraxella catarrhalis representan más de la mitad de los aislamientos bacterianos de las muestras respiratorias de estos pacientes y pueden llegar incluso a suponer el 75%4. Otros patógenos se han implicado en las ABC, como los virus respiratorios y las bacterias atípicas5-8. Se ha observado que la contribución de estos organismos varía entre las series analizadas y depende mayoritariamente de la gravedad de la enfermedad obstructiva subyacente en estos pacientes9.
Más del 90% de los pacientes con ABC reciben tratamiento con antibióticos10, aunque el efecto de muchos antimicrobianos es incierto como resultado de la emergencia de la resistencia antibacteriana durante los últimos 15 años entre los microorganismos que con mayor frecuencia causan infecciones del tracto respiratorio. Las tasas de resistencia de S. pneumoniae a algunos antibacterianos han aumentado, principalmente frente a los antibióticos utilizados de forma empírica. Aunque se observa en la actualidad una elevada tasa de resistencia frente a los macrólidos11,12, éstos siguen siendo antibióticos que se utilizan a menudo en el tratamiento de las infecciones respiratorias.
El objetivo principal del presente estudio es conocer la prevalencia de las bacterias respiratorias más comunes en pacientes con ABC tratados ambulatoriamente. Además, como objetivos secundarios nos planteamos conocer las tasas de resistencia de los gérmenes respiratorios a los antimicrobianos más comúnmente utilizados en atención primaria, y analizar la prescripción antibiótica dada por el profesional.
Pacientes y métodos
Se efectuó un estudio observacional de pacientes con ABC durante una semana en noviembre de 2001 y otra en enero de 2002, con la participación de 650 médicos de atención primaria distribuidos por la geografía española, con representación de todas las comunidades autónomas peninsulares (no hubo participación de Canarias, Baleares, Ceuta ni Melilla). Los médicos participantes debían reclutar consecutivamente a 3 pacientes con clínica de bronquitis crónica; es decir, historia de tos y expectoración continuada durante 3 meses en 2 años consecutivos, según los criterios de la American Thoracic Society13, y que además presentasen una agudización de su enfermedad, definida como un aumento de la disnea, un aumento claro de las secreciones respiratorias y/o un cambio en la apariencia del esputo, y al menos uno de los siguientes 3 criterios: aumento de la frecuencia de la tos, incremento de la gravedad de la tos y/o fiebre (> 37 °C). Se excluyó a los pacientes que habían recibido algún antibiótico en los últimos 30 días, los que presentaban sospecha de neumonía, asma bronquial, fibrosis quística o presentaban bronquiectasias postuberculosas o por cualquier otra enfermedad definida.
Se recogieron datos relacionados con la edad, el sexo y el consumo de tabaco, y se registró asimismo el antibiótico que había prescrito el médico participante. De cada uno de los pacientes analizados se procedía a recoger un cultivo de esputo, que se guardaba en nevera hasta el envío, que debía efectuarse en un plazo máximo de 12 h a un laboratorio central, concretamente, al Instituto Valenciano de Microbiología. Las muestras de esputo se enviaban refrigeradas mediante mensajería desde cada centro de salud al laboratorio central. Tras evaluar el aspecto macroscópico y el volumen de la muestra, los esputos se sometían a 2 lavados con solución salina fisiológica. Se realizaron alícuotas para tinción de Gram y cultivo, y el resto de la muestra se distribuyó en 2 partes y congeló a -20 °C. La calidad microscópica de los esputos se evaluó según la proporción de células inflamatorias y células epiteliales; se consideraron aptas para estudio aquellas que mostraron menos de 10 células epiteliales y más de 25 leucocitos polimorfonucleares por campo microscópico, de acuerdo con los criterios de Murray y Washington14 y de Heineman et al15. La identificación de los aislamientos bacterianos se realizó según los métodos microbiológicos convencionales.
A fin de determinar la sensibilidad a los antimicrobianos se realizaron pruebas de microdilución para conocer la concentración mínima inhibitoria (CMI) de cada uno de los antimicrobianos testados, prueba de doble disco para conocer el fenotipo de resistencia a los macrólidos de S. pneumoniae, prueba para detectar la presencia de betalactamasas en H. influenzae y M. catarrhalis y pruebas para detectar los genes de resistencia a macrólidos en S. pneumoniae. Las pruebas de microdilución para conocer la CMI se realizaron en penicilina, amoxicilina, ácido clavulánico, cefuroxima acetilo, eritromicina, claritromicina, azitromicina, telitromicina, ciprofloxacino y levofloxacino, siguiendo las directrices de los National Committee for Clinical Laboratory Standards del año 2001 (2003 para telitromicina).
Se efectuó un análisis estadístico descriptivo de los resultados.
Resultados
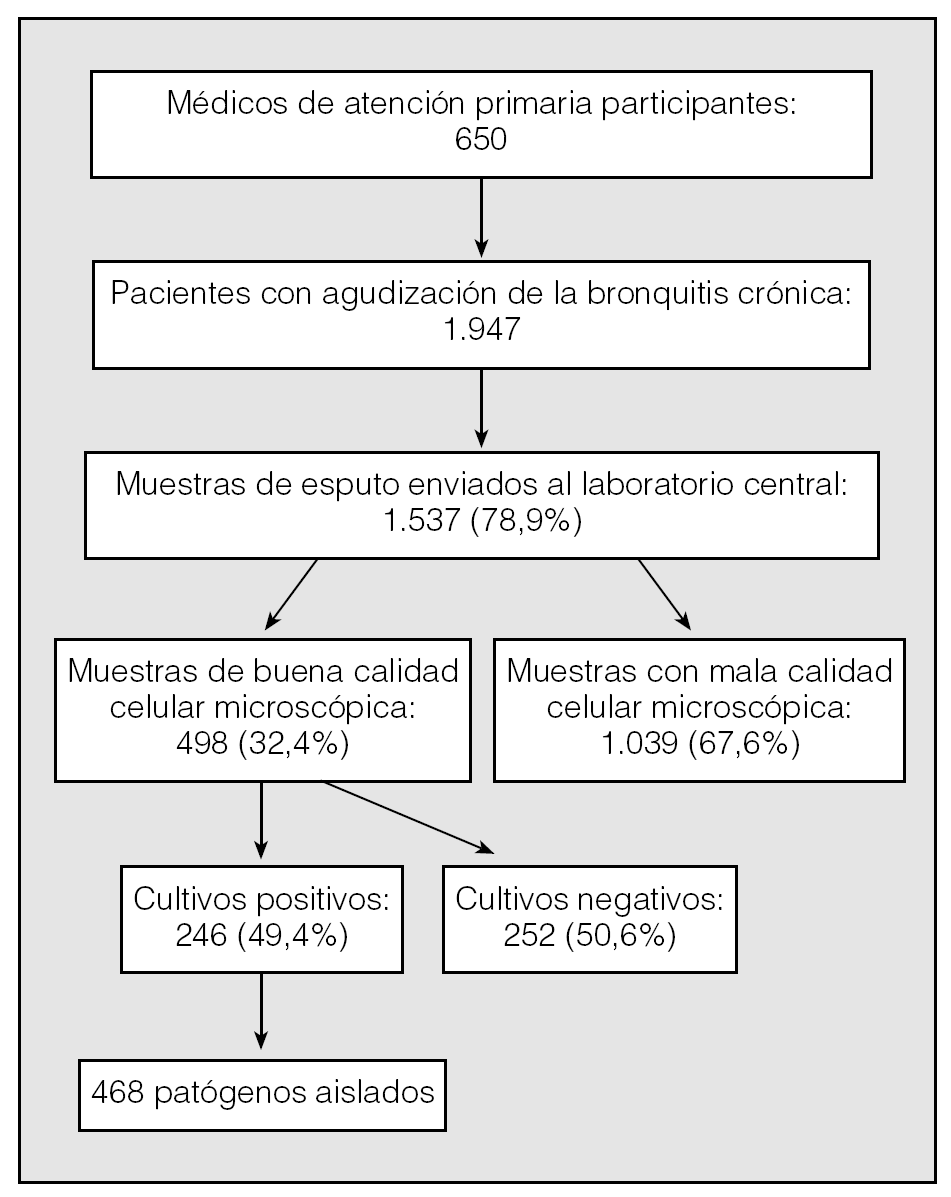
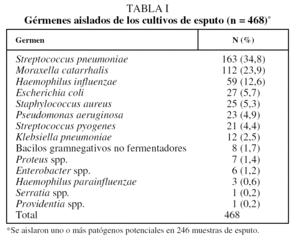
Los 650 médicos de atención primaria participantes reclutaron a un total de 1.947 pacientes; de éstos, no se pudieron recoger muestras de esputo en 410 sujetos, de modo que se envió al Instituto Valenciano de Microbiología un total de 1.537 muestras de esputo (78,9%) (fig. 1). La edad media (± desviación estándar) de los 1.537 pacientes participantes fue de 60,3 ± 16,6 años; un 67,7% eran varones y un 31,4% de ellos eran actualmente fumadores. Tuvieron buena calidad celular microscópica 498 muestras de esputo (32,4%). Las 1.039 restantes (67,6%) no se consideraron para el estudio microbiológico y, aunque en 222 de ellas (21,4%) se detectaron microorganismos, de los que S. pneumoniae y M. catarrhalis fueron los más frecuentes (el 38 y el 20%, respectivamente), no se consideraron agentes etiológicos y, por tanto, se descartaron también para los estudios de sensibilidad. De las 498 muestras de esputo de calidad óptima analizadas, se aisló flora normal en 252 casos, mientras que se aislaron uno o más patógenos respiratorios en 246 muestras de esputo (49,4%). En 168 casos se aisló un solo germen (67,5%), mientras que en el resto se aislaron 2 o más. Del total de aislamientos (n = 468), el germen más comúnmente aislado fue S. pneumoniae (34,8%), seguido de M. catarrhalis (23,9%) y H. influenzae (12,6%) (tabla I).
Fig. 1. Esquema general del estudio.
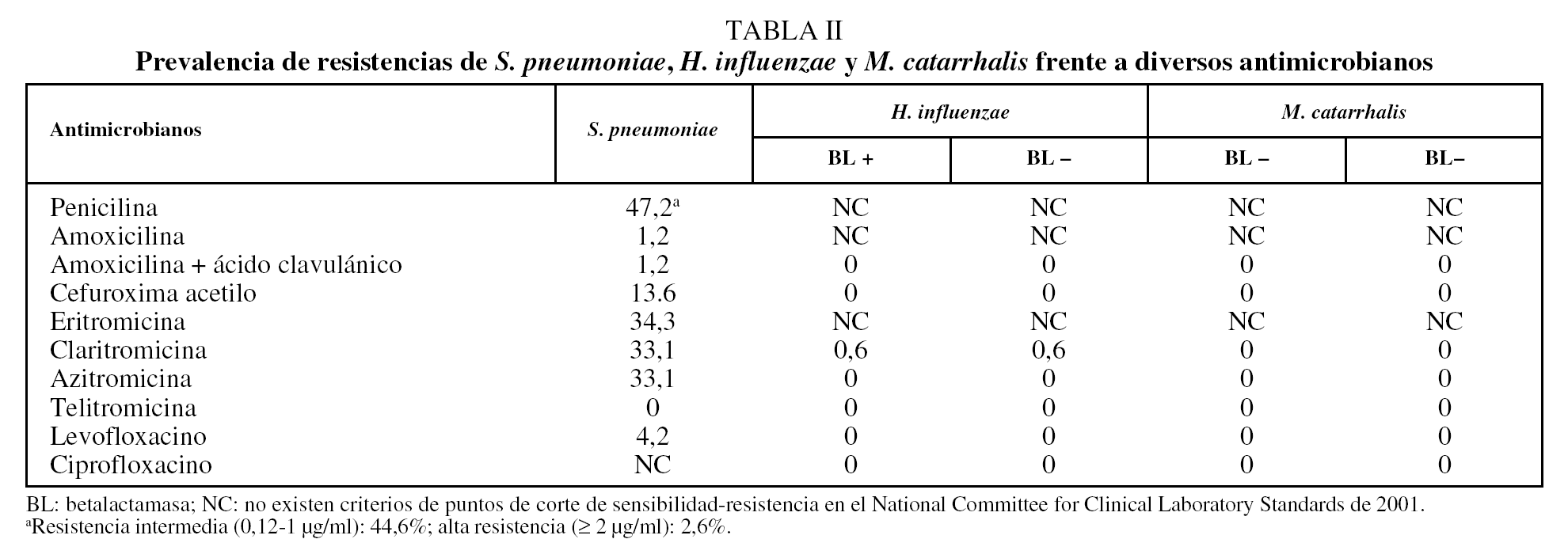
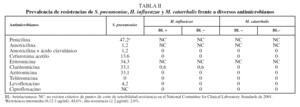
Se encontró resistencia de S. pneumoniae a penicilina en el 47,2% de los aislamientos, aunque la resistencia fue de alto nivel en el 2,6% de los casos. No obstante, las tasas de resistencia a amoxicilina fueron del 1,2%. El 34,3% de los aislamientos de neumococo fueron resistentes a los macrólidos, sin diferencias entre eritromicina, claritromicina y azitromicina (tabla II). El 87,5% de los neumococos resistentes a los macrólidos mostraron un fenotipo constitutivo y el 12,5% fenotipo M o de eflujo; no se encontró ningún aislamiento con resistencia inducible. Se observó un 4,2% de cepas neumocócicas resistentes a levofloxacino, con una CMI de 8 µg/ml o superior, todas ellas sensibles a penicilina y amoxicilina. La producción de betalactamasas por H. influenzae y M. catarrhalis se encontró en el 25,5 y el 82%, respectivamente, de los aislamientos clínicos. No se halló ninguna cepa de H. influenzae y M. catarrhalis resistente a la asociación de amoxicilina y ácido clavulánico. En 3 casos no se registró el tratamiento antibiótico administrado. En 12 casos no se prescribió antibiótico alguno y en los 1.342 casos restantes se administró algún tratamiento antibiótico (un 99,1% de los casos); los macrólidos fueron el grupo antibacteriano más prescrito, en 518 exacerbaciones (el 38,3% de los casos), seguidos de la asociación de amoxicilina y ácido clavulánico, con 401 (29,6%) (tabla III).
Discusión
Antes de discutir los resultados de este estudio es fundamental tener en cuenta sus limitaciones. Se trata de un estudio multicéntrico efectuado en centros de atención primaria peninsulares y en pacientes con diagnóstico clínico de bronquitis crónica, no en pacientes con EPOC, ya que no se pedía la realización de una espirometría. Es importante tener esto en cuenta ya que no todos los pacientes con bronquitis crónica presentan obstrucción al flujo aéreo y, en ausencia de esta limitación, la agudización suele ser de menor gravedad. Otra limitación del estudio es la propia definición de exacerbación utilizada. Se consideraron sólo aquellos individuos con clínica de bronquitis crónica que tuvieran concomitantemente aumento de la disnea y al menos uno de los 2 criterios siguientes: aumento del volumen de expectoración o cambio de coloración del esputo; además, debían cumplir uno de los criterios siguientes: aumento de la frecuencia de tos, mayor gravedad de ésta, o bien fiebre. Todos los pacientes reclutados presentaban en efecto 2 o más de los criterios de Anthonisen et al16 y, por lo tanto, eran tributarios de tratamiento antimicrobiano; de ahí que no nos extraña que el 99,1% de los pacientes lo recibieran. Se pedía que tuvieran más tos o bien fiebre. Aunque los porcentajes de cada uno de ellos no están disponibles en el presente trabajo, es lógico pensar que la mayoría de estos pacientes presentaran lo primero. Aunque se pidió a todos los investigadores que excluyeran a los pacientes con sospecha de proceso neumónico, no puede descartarse que se incluyera alguna neumonía por el hecho de que algunos pacientes podían presentar fiebre. De todas formas, debido a la propia definición de fiebre tenida en cuenta en este trabajo (presencia de una temperatura axilar mayor de 37 °C) y al hecho de que se indicó a los investigadores que excluyeran a los pacientes dudosos, la posibilidad de haber incluido alguna neumonía es francamente marginal. Este hecho es fundamental, ya que en este trabajo el germen más frecuentemente aislado fue el neumococo. Además, la fiebre elevada en la ABC, una vez descartado el proceso neumónico, es más indicativa de infección vírica17.
Otra limitación a tener en cuenta es la escasa rentabilidad de las muestras enviadas. Se descartó a 410 pacientes porque no se recogió muestra de ellos; de ahí que el análisis efectuado en este estudio se base en 1.537 pacientes. El hecho de que el trabajo se llevara a cabo en las consultas de atención primaria puede explicar por qué sólo un 32,4% de las muestras enviadas cumplía criterios para ser consideradas procedentes de las vías respiratorias bajas y el 67,6% restante tuviera un aspecto mucosalivar. Este porcentaje tan bajo de buena calidad microbiológica no nos sorprende, ya que en condiciones normales no se efectúan cultivos de esputo en el medio extrahospitalario, salvo en situaciones muy concretas. La rentabilidad es naturalmente mayor en el medio hospitalario, ya que los profesionales están más preparados y acostumbrados a recoger este tipo de muestra. A pesar de ello, prácticamente la mitad de las muestras de esputo enviadas por los médicos de atención primaria que cumplían los criterios de calidad establecidos por las normativas internacionales fueron positivas, al igual que sucede en otras publicaciones6,18,19. Curiosamente, en nuestro estudio, en un tercio aproximadamente de las muestras positivas se aislaron 2 o más gérmenes. Este porcentaje es ligeramente superior al observado en otras series8,9,20, aunque parecido al comunicado por Soler et al21 en pacientes hospitalarios con enfermedad grave. Durante los últimos años algunos estudios han demostrado la relación entre la agudización y el aumento del número de unidades formadoras de colonias bacterianas6,21, la adquisición de nuevas cepas bacterianas22 y el aumento de la inflamación bronquial debida a la presencia bacteriana23, lo que apoya la etiología bacteriana de algunas o de la mayor parte de las ABC. Estudios que han analizado con detalle la microbiología de la exacerbación de la bronquitis crónica han implicado una o más bacterias en la etiología de más de la mitad de los episodios24. Cuando se utilizan técnicas diagnósticas invasivas y sofisticadas, como el cepillado protegido del árbol traqueobronquial por vía endoscópica, pueden aislarse gérmenes potencialmente patógenos en alrededor del 65% de las exacerbaciones6. Teniendo en cuenta que en condiciones estables entre el 29 y el 35% de estos pacientes están crónicamente colonizados por bacterias6,25, cabe concluir que sólo se identifican nuevas bacterias en el 30-35% de las agudizaciones. Además, la colonización bacteriana residual después del tratamiento antibacteriano de la agudización influye en la frecuencia y gravedad de las agudizaciones posteriores26.
En nuestro estudio, las bacterias que más frecuentemente se aislaron de los cultivos de esputo remitidos por los médicos de atención primaria fueron S. pneumoniae, M. catarrhalis y H. influenzae, por este orden, que representaron entre las 3 el 71,3% de los aislamientos bacterianos. S. pneumoniae fue el microorganismo aislado con mayor frecuencia, en lugar de H. influenzae. Esto representa una diferencia con respecto a otros estudios donde H. influenzae es el agente bacteriano más común3,6,25,27. Viejo et al28 observaron un 39% de prevalencia de Haemophilus en un estudio efectuado en diversos hospitales del norte de España. Este hecho puede deberse a la menor gravedad de la enfermedad respiratoria en nuestro grupo de pacientes, ya que todos eran pacientes con criterios clínicos de bronquitis crónica que tenían agudizaciones que podían tratarse ambulatoriamente. Se sabe que la frecuencia de aislamiento de patógenos es mayor entre los pacientes con un estadio más grave de la enfermedad pulmonar y entre aquellos que siguen fumando. Eller et al8 aislaron más enterobacterias y Pseudomonas aeruginosa en las agudizaciones de la EPOC grave y más neumococos y H. influenzae en pacientes menos graves. En otras investigaciones, los bacilos gramnegativos, que habitualmente no forman parte de la flora respiratoria, como Escherichia coli, Proteus mirabilis, Serratia marcescens y P. aeruginosa, se han aislado en el esputo o en muestras broncoscópicas de las exacerbaciones que requerían ventil ación mecánica o con enfermedad avanzada, con un volumen espiratorio forzado en el primer segundo (FEV1) menor del 50% del teórico21. En un estudio de 40 pacientes con EPOC estable de diversos grados de gravedad se observó que la tasa de portadores de bacilos gramnegativos en la orofaringe aumentaba con la gravedad de la alteración respiratoria subyacente; fue nula en la leve, del 7,7% en la moderada y del 29,4% en pacientes con un FEV1 menor del 50%29. Zalacaín et al30 observaron que un 40% de sus 88 pacientes con EPOC estable, con un FEV1 medio del 55%, estaban colonizados y que en la mayor parte de los casos el germen responsable era H. influenzae. Además, encontraron que la obstrucción bronquial grave suponía un riesgo relativo de colonización de 5,1 respecto a la obstrucción leve. En la misma línea, Monsó et al31 hallaron colonización solamente en el 22% de sus pacientes, probablemente debido a que eran pacientes más leves, ya que presentaban un FEV1 medio del 74%. Quizás el mayor exponente en nuestro país es el trabajo de Miravitlles et al9, quienes observaron en pacientes con EPOC grave un riesgo 6 veces superior de sufrir una agudización causada por H. influenzae o P. aeruginosa respecto de aquellos con un FEV1 mayor del 50%. En este trabajo, al igual que en el nuestro, tanto S. pneumoniae como M. catarrhalis eran más prevalentes que H. influenzae entre los pacientes con FEV1 mayor del 50%9. De igual forma, Eller et al8 aislaron entre los pacientes con exacerbación de EPOC leve-moderada preferentemente neumococos en lugar de Haemophilus, al igual que en el presente trabajo.
En cuanto a las tasas de resistencia observadas en el presente estudio, un dato muy interesante aportado lo constituye la actividad de la amoxicilina frente al neumococo, cuya tasa de resistencia ha sido del 1,2%, cifra significativamente menor a la de otros estudios publicados en nuestro país11,12. De forma similar, la tasa de alta resistencia frente a penicilina fue muy baja en nuestro estudio. En cambio, se observaron elevados porcentajes de resistencia de S. pneumoniae frente a los distintos antimicrobianos, excepto penicilina, la mostraron los macrólidos, sin diferencias entre la eritromicina, claritromicina y azitromicina. Un dato inquietante, sin embargo, es el hallazgo de un 4,2% de cepas de neumococo resistentes a levofloxacino. Este hallazgo confirmaría la tendencia observada en nuestro país al incremento de las tasas de resistencia de S. pneumoniae a las denominadas fluoroquinolonas respiratorias.
Aunque en este estudio --y ésta es otra de sus limitaciones-- no evaluamos la eficacia clínica y bacteriológica del tratamiento antibiótico prescrito empíricamente, consideramos importante analizar su adecuación en relación con las tasas de resistencia de S. pneumoniae encontradas a los distintos antibióticos. Aunque los gérmenes atípicos y los virus también pueden estar implicados en las ABC32, el tratamiento antibiótico debe prescribirse tomando en consideración sobre todo los 3 microorganismos más frecuentes, M. catarrhalis, H. influenzae y S. pneumoniae, y en especial la posibilidad de resistencia del neumococo frente a los macrólidos. En este sentido puede considerarse excesivo el 38,3% de los pacientes tratados con estos antibióticos, y se ha visto un mayor coste por riesgo de fracasos cuando se utilizan estos antibióticos33; en cambio, menos del 30% de los casos fueron tratados con la asociación de amoxicilina y ácido clavulánico, antibacteriano considerado de elección en estos pacientes de acuerdo con las guías existentes34-37. Otro dato preocupante desde el punto de vista terapéutico ha sido el casi 17% de pacientes tratados con fluoroquinolonas, cifra que nos parece excesiva teniendo en cuenta que se trataba de pacientes con exacerbación leve o moderada de su bronquitis crónica.
En conclusión, es importante que el médico de atención primaria conozca la etiología más frecuente en la exacerbación de una bronquitis crónica/EPOC en el medio comunitario y las tasas de resistencia de los gérmenes que se aíslan en los pacientes no hospitalizados para saber qué antimicrobiano hay que recomendar en estos episodios. El antimicrobiano debe cubrir necesariamente el mayor número de cepas de neumococo, por lo que los macrólidos, que cuentan hoy día con aproximadamente un 35% de resistencias de este microorganismo, no deberían recomendarse.
Agradecimientos
A todos los médicos de atención primaria participantes en este estudio. A Juan García-de-Lomas, Encarnación Esteban y Concepción Gimeno, del Instituto Valenciano de Microbiología de Valencia, por el estudio microbiológico. A Aventis Pharma por la financiación de la logística de este estudio.
Estudio financiado por Sanofi-Aventis.
Correspondencia: Dr. C. Llor.
Foixarda, 95. 43008 Tarragona. España.
Correo electrónico: cllor.tarte.ics@gencat.net
Recibido: 22-6-2005; aceptado para su publicación: 13-12-2005.