Es frecuente observar lesiones trombóticas persistentes en los pacientes que sufren una embolia pulmonar. Estas lesiones pueden cursar con un espectro clínico amplio, desde un curso asintomático con recuperación funcional completa hasta la hipertensión pulmonar tromboembólica crónica. En los últimos años ha emergido el concepto de enfermedad tromboembólica crónica pulmonar para designar al subgrupo de pacientes con lesiones trombóticas persistentes que presentan síntomas con el esfuerzo y disfunción vascular pulmonar, pero que no muestran hipertensión pulmonar en reposo. La prevalencia de esta entidad es desconocida y los criterios para diagnosticarla no están definidos. El objetivo del presente artículo es analizar las secuelas que se producen tras una embolia pulmonar y revisar la información disponible sobre la enfermedad tromboembólica crónica, con especial énfasis en su diagnóstico y abordaje terapéutico.
Persistent thrombotic lesions are common in patients with pulmonary embolism. These lesions occur on a clinical spectrum, ranging from an asymptomatic course with complete functional recovery to chronic thromboembolic pulmonary hypertension. The concept of chronic thromboembolic disease has emerged in recent years to describe a subgroup of patients with persistent thrombotic lesions who have symptoms on exertion and pulmonary vascular dysfunction, but no pulmonary hypertension at rest. The prevalence of this entity is unknown and the criteria for diagnosing it are not defined. The aim of this article is to analyze post- pulmonary embolism sequelae and review existing evidence on chronic thromboembolic disease, with special emphasis on its diagnosis and therapeutic approach.
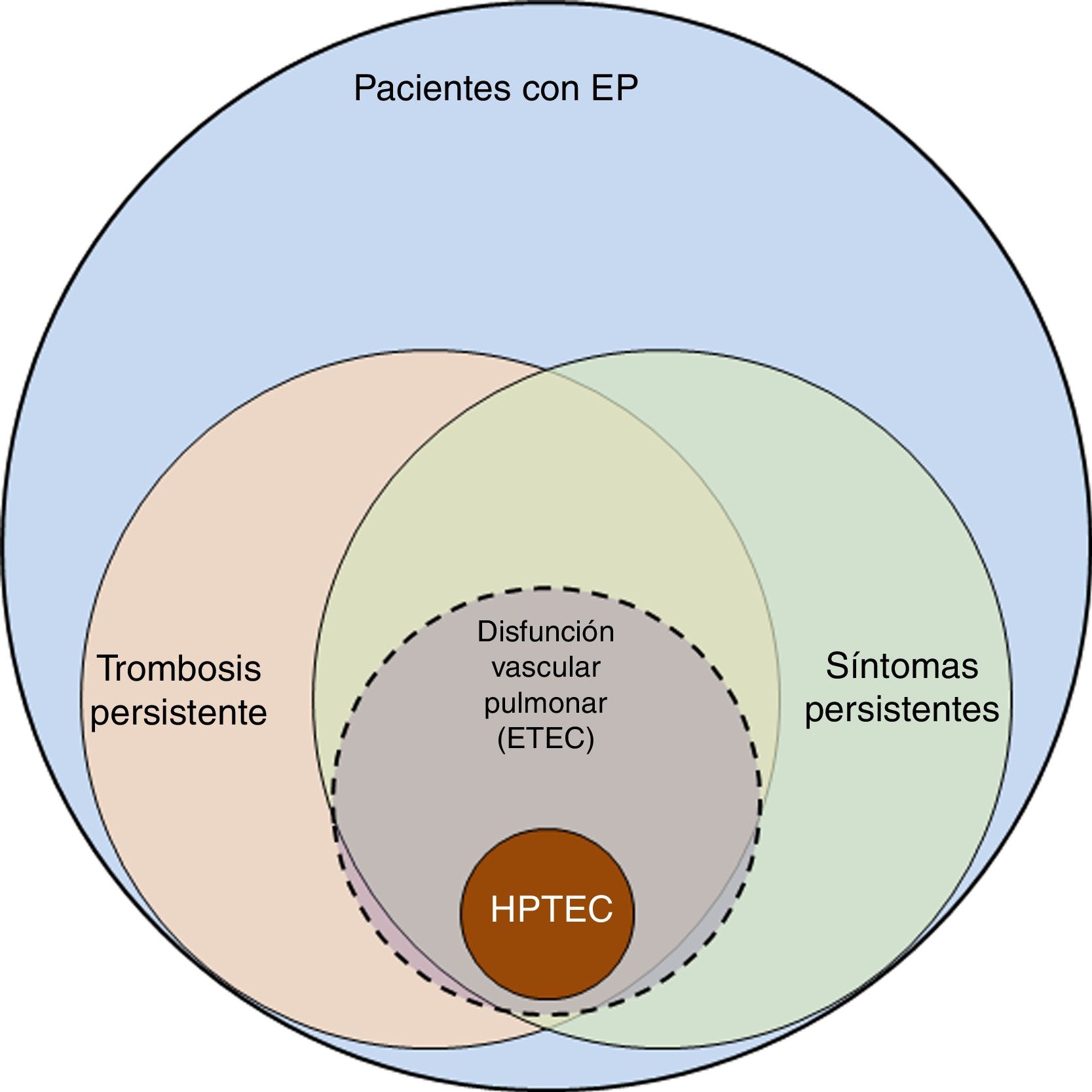
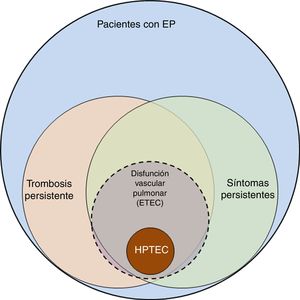
La incidencia de la embolia pulmonar (EP) en España ha aumentado de 20,4 a 32,7 casos por 100.000 habitantes/año desde 2002 a 2011. Los pacientes son cada vez más complejos, con mayor número de enfermedades concomitantes asociadas a la EP, lo que incrementa el coste del tratamiento, aunque con menor mortalidad1. Estos datos indican mejoría en el diagnóstico y tratamiento de la EP, aunque ponen de manifiesto el reto que supone el seguimiento de dichos pacientes, ya que se ha incrementado el número de supervivientes que pueden presentar secuelas tras la EP aguda. El espectro de estas secuelas abarca desde la trombosis pulmonar persistente asintomática hasta la hipertensión pulmonar tromboembólica crónica (HPTEC) (fig. 1). La HPTEC, la complicación más grave tras la EP, está bien definida y su diagnóstico y tratamiento claramente establecidos2,3. Sin embargo, escapa a la definición de HPTEC un subgrupo de pacientes que refieren disnea de esfuerzo y/o limitación funcional que no tenían antes de la EP y presentan trombosis residual, pero con presión arterial pulmonar (PAP) en reposo normal. Se considera que en estos pacientes la obliteración producida por la trombosis persistente causa disfunción vascular pulmonar, que se manifiesta fundamentalmente como intolerancia al esfuerzo4. El mecanismo fisiopatológico de esta disfunción, sus implicaciones clínicas y terapéuticas, así como los factores de riesgo que determinan la falta de resolución del trombo no están bien establecidos y son objeto de investigación. El reconocimiento de este subgrupo de pacientes ha llevado a definir una nueva entidad denominada enfermedad tromboembólica crónica (ETEC) pulmonar.
Espectro de complicaciones tras la embolia pulmonar. Representación gráfica del espectro de complicaciones tras la embolia pulmonar (EP), desde la trombosis persistente hasta la hipertensión pulmonar tromboembólica crónica (HPTEC). Entre los pacientes con trombosis persistente existe un subgrupo que presenta síntomas atribuibles a disfunción vascular pulmonar, entendiendo por tal la falta de adaptación del lecho vascular pulmonar a los cambios que se producen durante el ejercicio. Se considera que estos pacientes tienen enfermedad tromboembólica crónica (ETEC) pulmonar.
En la presente revisión se analiza el espectro de secuelas que pueden surgir tras la EP, que abarca desde la trombosis pulmonar residual asintomática hasta la HPTEC, y se exponen las bases para considerar la ETEC como una entidad clínica diferenciada, su diagnóstico y eventual tratamiento.
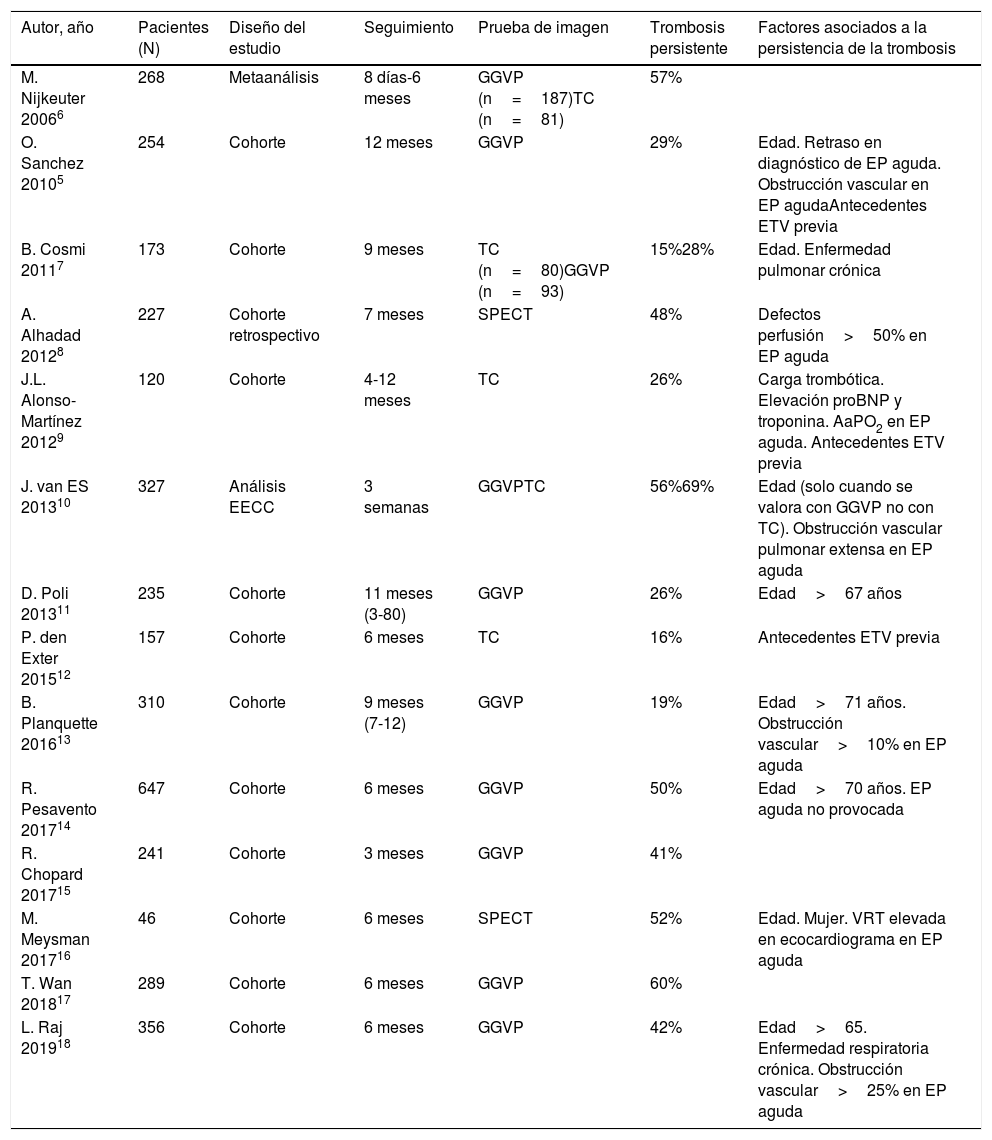
Trombosis residualEl concepto de trombosis residual o persistente carece de definición precisa. La recanalización de un trombo dentro de un vaso sanguíneo es un proceso dinámico, dependiente del tiempo. La prevalencia de trombosis residual es variable según el momento evolutivo en que se estudie después de la EP. No está determinado en qué tiempo los trombos deben ser considerados residuales. La herramienta diagnóstica utilizada también afecta al número de trombosis residuales observadas5. En la tabla 1 se resumen los estudios publicados al respecto5–18.
Persistencia de trombosis residual tras una embolia pulmonar aguda
| Autor, año | Pacientes (N) | Diseño del estudio | Seguimiento | Prueba de imagen | Trombosis persistente | Factores asociados a la persistencia de la trombosis |
|---|---|---|---|---|---|---|
| M. Nijkeuter 20066 | 268 | Metaanálisis | 8 días-6 meses | GGVP (n=187)TC (n=81) | 57% | |
| O. Sanchez 20105 | 254 | Cohorte | 12 meses | GGVP | 29% | Edad. Retraso en diagnóstico de EP aguda. Obstrucción vascular en EP agudaAntecedentes ETV previa |
| B. Cosmi 20117 | 173 | Cohorte | 9 meses | TC (n=80)GGVP (n=93) | 15%28% | Edad. Enfermedad pulmonar crónica |
| A. Alhadad 20128 | 227 | Cohorte retrospectivo | 7 meses | SPECT | 48% | Defectos perfusión>50% en EP aguda |
| J.L. Alonso-Martínez 20129 | 120 | Cohorte | 4-12 meses | TC | 26% | Carga trombótica. Elevación proBNP y troponina. AaPO2 en EP aguda. Antecedentes ETV previa |
| J. van ES 201310 | 327 | Análisis EECC | 3 semanas | GGVPTC | 56%69% | Edad (solo cuando se valora con GGVP no con TC). Obstrucción vascular pulmonar extensa en EP aguda |
| D. Poli 201311 | 235 | Cohorte | 11 meses (3-80) | GGVP | 26% | Edad>67 años |
| P. den Exter 201512 | 157 | Cohorte | 6 meses | TC | 16% | Antecedentes ETV previa |
| B. Planquette 201613 | 310 | Cohorte | 9 meses (7-12) | GGVP | 19% | Edad>71 años. Obstrucción vascular>10% en EP aguda |
| R. Pesavento 201714 | 647 | Cohorte | 6 meses | GGVP | 50% | Edad>70 años. EP aguda no provocada |
| R. Chopard 201715 | 241 | Cohorte | 3 meses | GGVP | 41% | |
| M. Meysman 201716 | 46 | Cohorte | 6 meses | SPECT | 52% | Edad. Mujer. VRT elevada en ecocardiograma en EP aguda |
| T. Wan 201817 | 289 | Cohorte | 6 meses | GGVP | 60% | |
| L. Raj 201918 | 356 | Cohorte | 6 meses | GGVP | 42% | Edad>65. Enfermedad respiratoria crónica. Obstrucción vascular>25% en EP aguda |
AaPO2: gradiente alvéolo-arterial de oxígeno; BNP: péptido natriurético cerebral; EECC: ensayos clínicos; EP: embolia pulmonar; ETV: enfermedad tromboembólica venosa; GGVP: gammagrafía de ventilación-perfusión pulmonar; SPECT: tomografía de emisión por fotón único; TC: tomografía computarizada; VRT: velocidad de regurgitación tricuspidea.
La prevalencia de trombosis residual a los 6 meses de una EP oscila entre el 16% y el 69%. La gammagrafía de ventilación y perfusión (V-Q) tiene mayor sensibilidad que la angioTC en la detección de trombosis pulmonar persistente, por lo que se la considera la prueba de imagen de primera línea19. Esta alta sensibilidad explica un mayor porcentaje de diagnósticos con esta técnica. Esto contrasta con los estudios diagnósticos de EP aguda, donde la gammagrafía V-Q no aporta mayor sensibilidad diagnóstica que la angioTC20.
Varios factores pueden contribuir a la persistencia de la trombosis pulmonar (tabla 1). Datos recientes identifican varios factores predictores independientes de trombosis residual tras una EP aguda no provocada, concluidos 6 meses de tratamiento anticoagulante18. La edad mayor a 65 años, el consumo de tabaco y la enfermedad respiratoria crónica se encuentran entre ellos21,22. También son factores predictores de persistencia de trombosis la concentración elevada de factor viii18 y la obstrucción vascular extensa (>25%) en el episodio de EP aguda5,8,13.
Especial mención merece, por las implicaciones clínicas que pueda tener, el efecto de la duración del tratamiento anticoagulante sobre la trombosis residual. Se desconoce el número de pacientes correctamente tratados en la mayoría de los estudios de incidencia de HPTEC, pero se asume que el paciente anticoagulado inadecuadamente sería más susceptible de desarrollar HPTEC23. En otros estudios la trombosis persistente se asocia a mayor tiempo de anticoagulación6,24, aunque esto puede ser debido al efecto confusor de que los pacientes anticoagulados durante más tiempo son aquellos que presentan disnea persistente, lo cual puede ser una consecuencia de la trombosis residual o de las comorbilidades cardiorrespiratorias, que igualmente se asocian a irregularidades en la perfusión pulmonar.
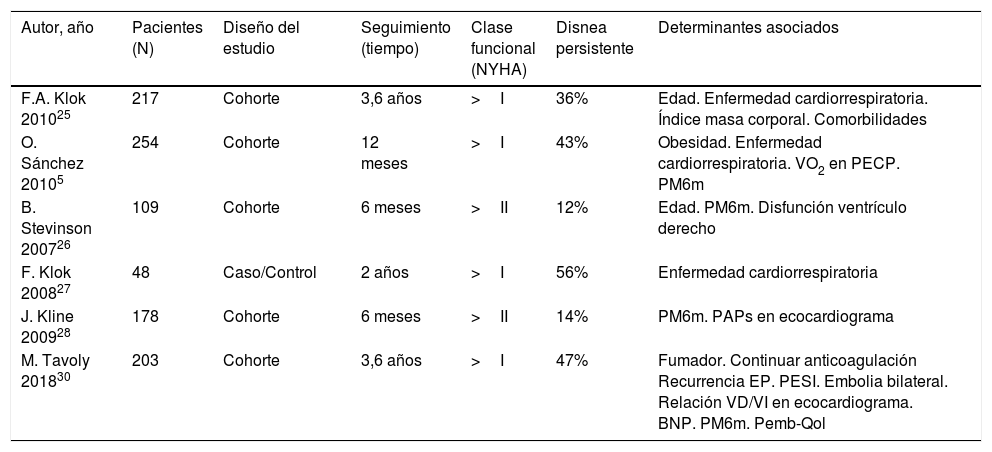
Persistencia de síntomas tras la embolia pulmonarDistintos estudios ponen de manifiesto que un porcentaje de pacientes refieren empeoramiento de su disnea basal o persistencia de la misma tras un episodio de EP aguda entre los 6 meses y los 3 años posteriores a la EP5,25–29 (tabla 2). Según Klok et al.25 más de un tercio de los pacientes refieren disnea a los 3,5 años después de una EP aguda, y hasta el 76% de los mismos refiere que la disnea había aparecido o empeorado tras la EP25. Sanchez et al.5 describen que un 30% de los pacientes presentaban defectos de perfusión persistentes tras una EP, hallazgo que se asoció a un empeoramiento de la disnea y menor distancia recorrida en la prueba de marcha de 6 minutos, así como al incremento de la PAP sistólica estimada por ecocardiografía5.
Disnea persistente tras una embolia pulmonar
| Autor, año | Pacientes (N) | Diseño del estudio | Seguimiento (tiempo) | Clase funcional (NYHA) | Disnea persistente | Determinantes asociados |
|---|---|---|---|---|---|---|
| F.A. Klok 201025 | 217 | Cohorte | 3,6 años | >I | 36% | Edad. Enfermedad cardiorrespiratoria. Índice masa corporal. Comorbilidades |
| O. Sánchez 20105 | 254 | Cohorte | 12 meses | >I | 43% | Obesidad. Enfermedad cardiorrespiratoria. VO2 en PECP. PM6m |
| B. Stevinson 200726 | 109 | Cohorte | 6 meses | >II | 12% | Edad. PM6m. Disfunción ventrículo derecho |
| F. Klok 200827 | 48 | Caso/Control | 2 años | >I | 56% | Enfermedad cardiorrespiratoria |
| J. Kline 200928 | 178 | Cohorte | 6 meses | >II | 14% | PM6m. PAPs en ecocardiograma |
| M. Tavoly 201830 | 203 | Cohorte | 3,6 años | >I | 47% | Fumador. Continuar anticoagulación Recurrencia EP. PESI. Embolia bilateral. Relación VD/VI en ecocardiograma. BNP. PM6m. Pemb-Qol |
BNP: péptido natriurético cerebral; NYHA: New York Heart Association; PAPs: presión arterial pulmonar sistólica; PECP: prueba de esfuerzo cardiopulmonar; Pemb-Qol: cuestionario específico de calidad de vida en pacientes con embolismo pulmonar; PESI: pulmonary embolism score index; PM6m: prueba de marcha de 6 minutos; VD/VI: relación tamaño ventrículo derecho/ventrículo izquierdo; VO2: consumo pico de oxígeno.
El empeoramiento o aparición de disnea de esfuerzo tras la EP también ha sido evaluado mediante cuestionarios de calidad de vida29,30. Asimismo, se observa que resultados peores en los cuestionarios de calidad de vida se asocian a menor distancia recorrida en la prueba de marcha de 6 minutos29.
Disminución de la capacidad de ejercicioEn los pacientes que presentan disnea tras una EP, la prueba de esfuerzo cardiopulmonar (PECP) puede ser útil para poner de manifiesto de manera objetiva los mecanismos que la producen. La PECP identifica patrones que permiten establecer el mecanismo de la limitación de la tolerancia al esfuerzo, que tras la EP puede ser debida a disfunción vascular, desacondicionamiento físico o la presencia de comorbilidades. En pacientes con trombosis residual, la PECP puede detectar precozmente aquellos en los que la obstrucción del lecho vascular pulmonar condiciona una respuesta vascular al ejercicio anómala y/o ineficiencia ventilatoria4,31.
Algunos pacientes con trombosis residual presentan menor capacidad de reclutamiento y distensión del lecho vascular pulmonar como mecanismo de adaptación al incremento de volumen sistólico que se produce durante el esfuerzo. Como consecuencia, durante el esfuerzo aumenta la PAP y la relación PAP/gasto cardiaco, situación que define la disfunción vascular pulmonar. Este aumento de la poscarga del ventrículo derecho puede condicionar la disminución del volumen sistólico y el aumento de la respuesta cronotrópica compensatoria4,32.
Al mismo tiempo, la presencia de oclusiones vasculares puede limitar la perfusión de las unidades alveolares dependientes de dichos vasos y dar lugar a desequilibrio ventilación-perfusión e ineficiencia ventilatoria, que es más evidente durante el esfuerzo. Esta ineficiencia se refleja en un aumento de la pendiente de la relación entre ventilación y producción de CO2 (VE/VCO2), la disminución de la presión parcial de CO2 al final de la espiración (PETCO2) en el umbral anaeróbico y el aumento del espacio muerto fisiológico (VD/VT)4,31,32.
El comportamiento durante el esfuerzo de los pacientes con ETEC es similar al que presentan los pacientes con HPTEC32,33 y difiere claramente del de los sujetos sanos31,32. Ambos grupos de pacientes presentan menor consumo de O2 y carga tolerada, ineficiencia ventilatoria y alteración del intercambio gaseoso durante el esfuerzo31,32. El compromiso de la función del ventrículo derecho es superior en la HPTEC, en comparación con la ETEC, lo que se refleja en un menor pulso de O2 (consumo de O2/frecuencia cardiaca) en el esfuerzo máximo32.
Asimismo, la PECP permite descartar que el origen de la sintomatología sea por una limitación de origen ventilatorio, secundaria a enfermedad respiratoria, o por desacondicionamiento físico31,34.
Cambios hemodinámicos tras la embolia pulmonarMediciones no invasivasLa realización sistemática de ecocardiografía tras una EP se ha empleado para el cribado de la HPTEC, aunque a la hora de interpretar los resultados hay que tener en cuenta que esta prueba no está exenta de errores por ser operador-dependiente y solo proporciona una estimación indirecta de la PAP sistólica (PAPs). En el estudio clásico de Ribeiro et al.35, solo el 56% de los pacientes mostraban una PAPs normal (<30mmHg) transcurrido un año de la EP. En un estudio realizado en 744 pacientes consecutivos, se encontró que a los 36 meses tras la EP el 67,7% de los pacientes presentaba valores de PAPs estimada inferiores a 36mmHg, considerados de baja probabilidad de HP36. La incidencia de PAPs estimada>50mmHg fue del 8,3%36. En un análisis del Registro Internacional de Enfermedad Tromboembólica Venosa (RIETE) se hallaron cifras similares, el 11,1% de los pacientes presentaron PAPs estimada>50mmHg37. En dicho estudio los pacientes con PAPs elevada fueron predominantemente mujeres mayores de 70 años, con antecedentes de insuficiencia cardiaca o enfermedad pulmonar obstructiva crónica, insuficiencia renal y varices37, por lo que es posible que en una parte de los pacientes este aumento de PAPs sea debido a las comorbilidades observadas. Otros estudios prospectivos en los que se ha realizado ecocardiografía sistemática reflejan que solo un pequeño porcentaje de pacientes presentan una ecocardiografía alterada durante el seguimiento tras una EP aguda38. En un análisis efectuado en 2.256 pacientes con EP del registro RIETE, en el que se excluyeron pacientes con antecedentes de enfermedad cardiaca o pulmonar, se constató que a los 6-12 meses de la EP el 26% de los pacientes presentaban hallazgos ecocardiográficos de riesgo moderado o alto de HP39, cifra que claramente sobreestima la incidencia de HPTEC tras la EP y cuestiona la ecocardiografía sistemática como herramienta de detección precoz de HPTEC38. A día de hoy no existe información acerca del posible papel de la ecocardiografía de esfuerzo en la detección de HP de esfuerzo en los pacientes con secuelas post-EP.
Mediciones invasivasNo existen estudios en los que se haya evaluado de forma sistemática la hemodinámica pulmonar mediante cateterismo cardiaco derecho tras la EP aguda, dado el carácter invasivo de dicha medición. Habitualmente, la evaluación hemodinámica se ha circunscrito a los casos en que el ecocardiograma mostraba datos sugestivos de HP.
Un metaanálisis reciente sobre la incidencia de HPTEC en pacientes seguidos durante 2 años tras un episodio de EP muestra una prevalencia de HP, diagnosticada mediante estudio hemodinámico, del 0,6% entre todos los pacientes que sufrieron EP23. Sin embargo, entre los supervivientes tras la EP la prevalencia fue significativamente superior, del 3,2%. Y si se considera solamente a los supervivientes sin comorbilidades mayores, la prevalencia fue del 2,8%23.
Se desconoce la prevalencia de pacientes con valores anormales de PAP media (>20mmHg), acorde con la nueva definición de HP propuesta en el 6th World Symposium on Pulmonary Hypertension (WSPH)40, o de aquellos que presentan HP de esfuerzo, tras la EP.
En un estudio efectuado en 14 pacientes con trombosis persistente, sin HP en reposo, van Kan et al.4 demostraron que estos pacientes presentaban un comportamiento anormal de la hemodinámica pulmonar durante el ejercicio, con mayor ineficiencia ventilatoria, aumento de la relación PAP media/gasto cardiaco y disminución de la distensibilidad vascular pulmonar4, hallazgos que concuerdan con el concepto de disfunción vascular.
Hipertensión pulmonar tromboembólica crónicaLa HPTEC constituye la complicación más grave dentro del espectro de complicaciones tras la EP. Se define por la presencia de HP asociada a defectos de perfusión pulmonar tras al menos 3 meses de anticoagulación efectiva40. Entre los pacientes con HPTEC hay un porcentaje significativo, alrededor de 25%41, en los que no existe antecedente de un episodio de EP aguda. Los mecanismos patogenéticos de la HPTEC no son bien conocidos. En los mismos intervienen, por un lado, las propias lesiones trombóticas como reflejo del fracaso de la trombólisis endógena42,43, y por otro, los cambios en la microvasculatura pulmonar de las zonas no ocluidas, donde se produce remodelado y disfunción vascular. Estos cambios son similares a los observados en la hipertensión arterial pulmonar y se atribuyen al hiperaflujo sanguíneo relativo al «desviarse» el flujo pulmonar de las zonas ocluidas hacia las zonas no ocluidas2,42.
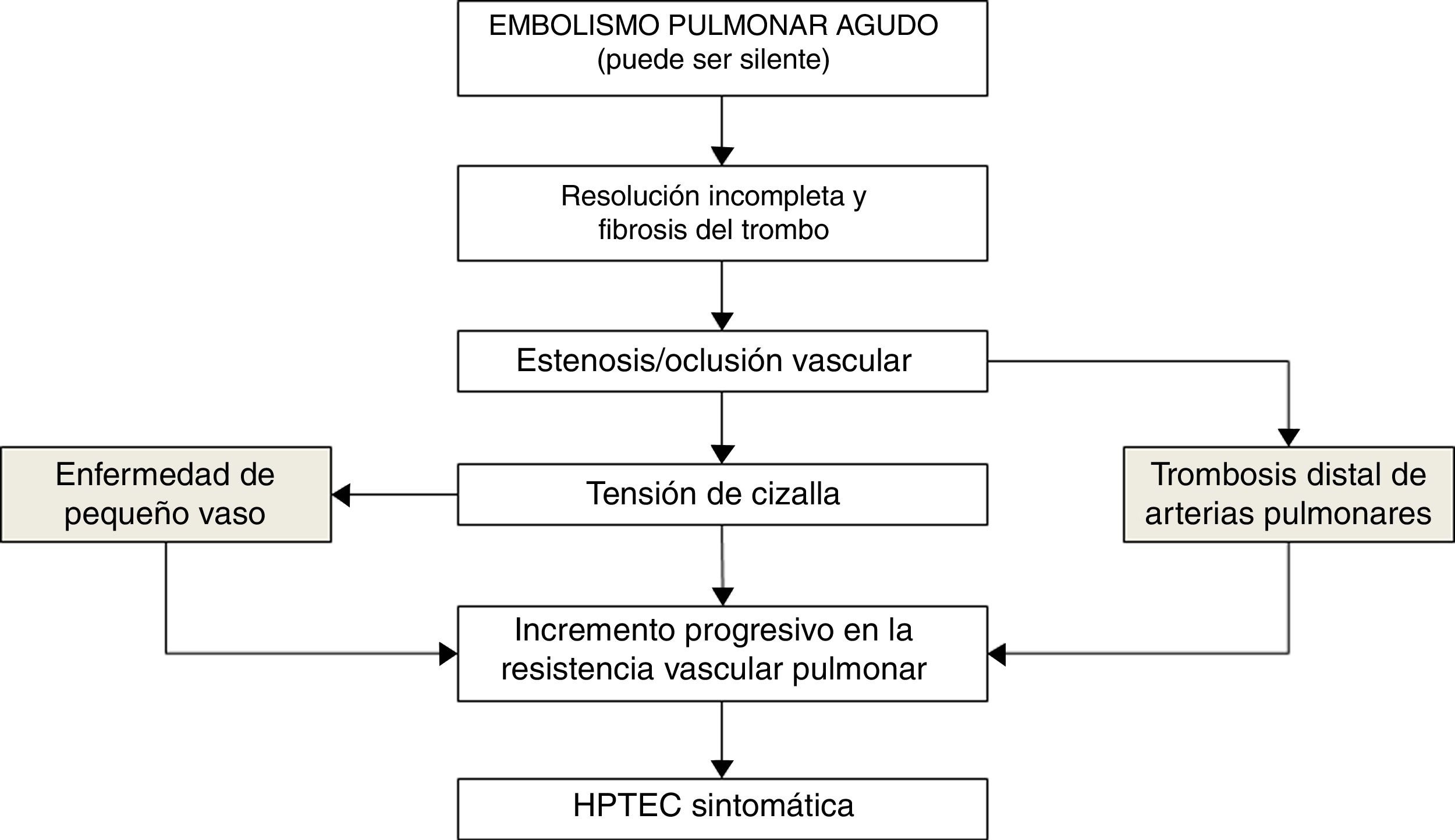
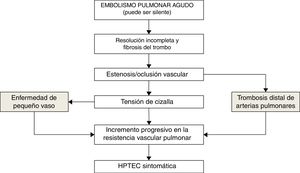
El porqué solo una proporción reducida de los pacientes que han sufrido una EP desarrollan HPTEC es desconocido. Factores protrombóticos como la concentración elevada de factor viii y anticuerpos antifosfolipídicos se han asociado al desarrollo de HPTEC44,45. También se han implicado factores relacionados con la angiogénesis como el factor de crecimiento del endotelio vascular y la vía de señalización Notch46. Recientemente se ha sugerido la implicación de la circulación bronquial en el desarrollo de la HPTEC a partir de la demostración de anastomosis entre arterias bronquiales y arteriolas precapilares o venas pulmonares. El gradiente de presión entre la circulación bronquial (sistémica) y la pulmonar puede dar lugar a cambios en la microvasculatura pulmonar con incremento de las fibras musculares y engrosamiento fibrótico de la pared47 (fig. 2).
En la última guía clínica de diagnóstico y tratamiento de la EP de la European Society of Cardiology (ESC)-European Respiratory Society (ERS) se recogen como factores de riesgo para el desarrollo de HPTEC tras una EP: a) los asociados al evento agudo: episodio previo de trombosis venosa, extensión del trombo en la imagen, presencia de disfunción del VD en ecocardiografía y hallazgos en la angioTC sugestivos de cronicidad19; y b) factores concomitantes predisponentes: cortocircuito ventrículo-auricular, infección crónica de catéter, portador de marcapasos, esplenectomía, estados de hipercoagulabilidad, grupo ABO distinto del O Rh−, hipotiroidismo tratado con hormona tiroidea, antecedentes de cáncer, síndromes mieloproliferativos, enfermedad inflamatoria intestinal y osteomielitis crónica19.
La HPTEC debe descartarse siempre como causa de HP, por lo que se recomienda el cribado con gammagrafía V-Q en todos los casos de HP3. Si esta es anormal, la evaluación diagnóstica de los pacientes con HPTEC incluye cateterismo cardiaco derecho para caracterizar la situación hemodinámica y pruebas de imagen para identificar la localización de las lesiones (angiografía pulmonar selectiva por sustracción digital y/o angioTC)3,48.
El tratamiento de elección de la HPTEC es la endarterectomía pulmonar (EAP), por lo que todos los pacientes con HPTEC deberían ser evaluados por un comité multidisciplinar en un centro con experiencia en dicha cirugía48. En los pacientes no tributarios de EAP está indicado el tratamiento farmacológico con fármacos específicos de hipertensión arterial pulmonar. En algunos casos puede plantearse la realización de angioplastia pulmonar con balón en centros especializados con experiencia en el procedimiento3,48.
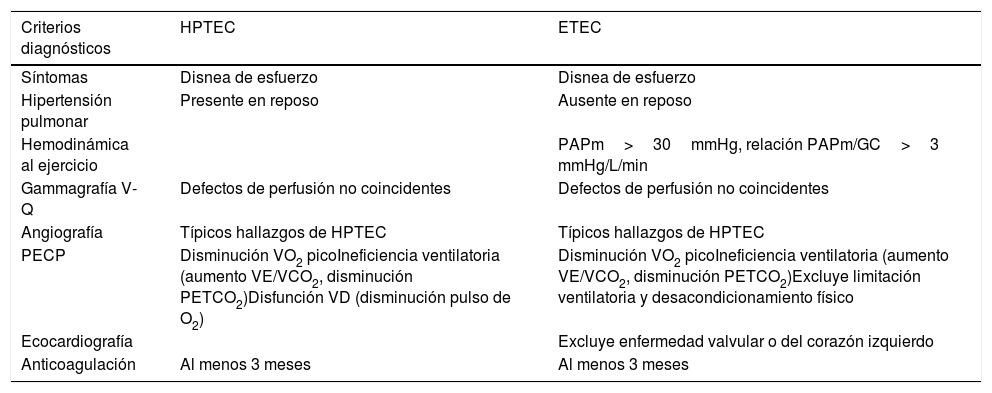
Enfermedad tromboembólica crónicaLa ETEC se caracteriza por síntomas, limitación al esfuerzo y trombosis residual tras una EP, similares a los de la HPTEC, pero sin HP en reposo3. Esta entidad también ha sido designada con otros nombres como síndrome post-trombótico pulmonar3 o enfermedad vascular pulmonar tromboembólica crónica3,49. Nosotros preferimos el nombre de enfermedad tromboembólica crónica pulmonar, acorde con lo propuesto en el 6WSPH (tabla 3)3 y la última guía clínica de EP de la European Society of Cardiology-European Respiratory Society19. El concepto de ETEC surgió cuando la HP venía definida por una PAP media≥25mmHg. La propuesta actual del 6WSPH de reducir el umbral para definir HP a una PAP media>20mmHg (con resistencia vascular pulmonar>3 unidades Wood)3 conlleva que pacientes anteriormente diagnosticados de ETEC puedan ser ahora diagnosticados de HPTEC.
Diferencias entre hipertensión pulmonar tromboembólica crónica y enfermedad tromboembólica crónica pulmonar
| Criterios diagnósticos | HPTEC | ETEC |
|---|---|---|
| Síntomas | Disnea de esfuerzo | Disnea de esfuerzo |
| Hipertensión pulmonar | Presente en reposo | Ausente en reposo |
| Hemodinámica al ejercicio | PAPm>30mmHg, relación PAPm/GC>3 mmHg/L/min | |
| Gammagrafía V-Q | Defectos de perfusión no coincidentes | Defectos de perfusión no coincidentes |
| Angiografía | Típicos hallazgos de HPTEC | Típicos hallazgos de HPTEC |
| PECP | Disminución VO2 picoIneficiencia ventilatoria (aumento VE/VCO2, disminución PETCO2)Disfunción VD (disminución pulso de O2) | Disminución VO2 picoIneficiencia ventilatoria (aumento VE/VCO2, disminución PETCO2)Excluye limitación ventilatoria y desacondicionamiento físico |
| Ecocardiografía | Excluye enfermedad valvular o del corazón izquierdo | |
| Anticoagulación | Al menos 3 meses | Al menos 3 meses |
ETEC: enfermedad tromboembólica crónica; Gammagrafía V-Q: gammagrafía ventilación-perfusión; GC: gasto cardiaco; HPTEC: hipertensión pulmonar tromboembólica crónica; PAPm: presión arterial pulmonar media; PECP: prueba de esfuerzo cardiopulmonar; PETCO2: presión parcial de dióxido de carbono al final de la espiración; VE: ventilación; VE/CO2: equivalente ventilatorio de dióxido de carbono; VO2: producción de dióxido de carbono; VO2 pico: consumo pico de oxígeno.
Adaptada de: Kim et al.3.
Si la ETEC representa una fase previa a la HPTEC o se trata de pacientes con trombosis pulmonar persistente en quienes no se ponen en marcha los mecanismos que condicionan el desarrollo de HPTEC es objeto de debate. En cualquier caso, los pacientes con ETEC presentan síntomas y limitación de la tolerancia al esfuerzo atribuible a disfunción vascular pulmonar. Esta disfunción vascular se pone de manifiesto durante el esfuerzo, por lo que las pruebas diagnósticas realizadas en reposo suelen estar dentro de los límites de la normalidad, ya que carecen de la sensibilidad necesaria para detectar la vasculopatía pulmonar. Sin embargo, el comportamiento durante el esfuerzo de los pacientes con ETEC se asemeja al que presentan los pacientes con HPTEC31,45.
Por consiguiente, la ETEC es aquella situación que se produce como consecuencia de la persistencia de trombos en el lecho vascular pulmonar que condiciona vasculopatía pulmonar, la cual limita la distensibilidad del lecho vascular pulmonar y da lugar a ineficiencia ventilatoria durante el esfuerzo. Por consiguiente, la detección de la ETEC debe ir enfocada a poner de manifiesto la persistencia de trombos y el compromiso de la circulación pulmonar en el esfuerzo. De un lado, se ha de constatar la presencia de trombosis residual, para lo cual la gammagrafía V-Q es la prueba con mayor sensibilidad, tal y como se recoge en los documentos del 6WSPH3, y de otro, precisa poner en evidencia la disfunción vascular pulmonar, la cual puede objetivarse mediante la PECP. Esta demuestra un patrón de limitación de la tolerancia al esfuerzo de origen cardiovascular (disminución del consumo pico de O2, umbral anaeróbico precoz, pulso de O2 disminuido), acompañado de signos de ineficiencia ventilatoria por la obliteración vascular (aumento de la pendiente VE/VCO2, y aumento del equivalente de CO2 y disminución de la PETCO2 en el umbral anaeróbico), descartando un patrón de limitación de origen ventilatorio.
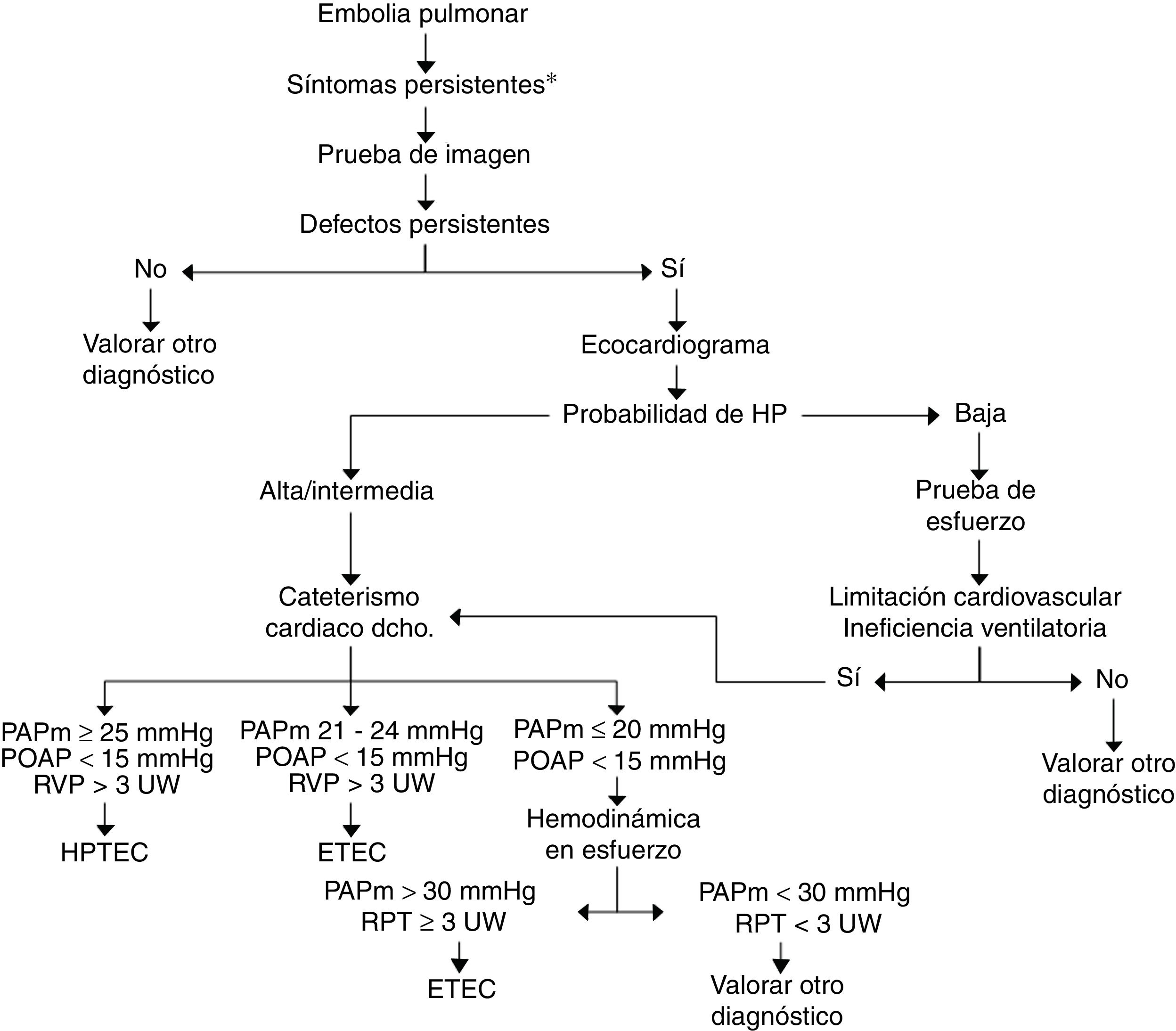
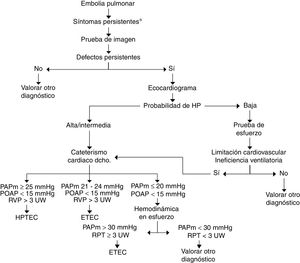
No existen aún en la literatura criterios para el diagnóstico de la ETEC y su detección tras una EP. En la figura 3 efectuamos una propuesta de algoritmo de seguimiento tras la EP dirigido a detectar HPTEC o ETEC. En pacientes sintomáticos con trombosis residual, objetivada preferentemente mediante gammagrafía V-Q, se efectuará ecocardiograma que informará sobre la probabilidad de HP. Si la probabilidad es alta se efectuará cateterismo cardiaco derecho. Si es baja, se efectuará PECP. Si esta pone de manifiesto un patrón de limitación de la tolerancia al esfuerzo de origen cardiovascular con criterios de ineficiencia ventilatoria, se aconseja realizar cateterismo cardiaco derecho, con o sin mediciones en esfuerzo50. El diagnóstico de ETEC se establecerá en los casos con PAPm de 21-24mmHg en reposo, o en aquellos con HP de esfuerzo (PAPm>30mmHg y resistencia pulmonar total>3UW).
Algoritmo diagnóstico de la enfermedad tromboembólica crónica. *Síntomas persistentes: persistencia de la disnea tras la embolia pulmonar, incremento de la misma y/o aparición de limitación a la tolerancia al esfuerzo sin causa alternativa que lo justifique.
ETEC: enfermedad tromboembólica crónica; HP: hipertensión pulmonar; HPTEC: hipertensión pulmonar tromboembólica crónica; PAPm: presión arterial pulmonar media; POAP: presión de oclusión de la arteria pulmonar; RPT: resistencia pulmonar total; RVP: resistencia vascular pulmonar; UW: unidades Wood (mmHg/L/min).
En los últimos años se han publicado pequeñas series de casos de pacientes con tromboembolia pulmonar crónica, sintomáticos, pero sin HP, lo que se corresponde con el perfil clínico de ETEC, en quienes se realizó EAP51,52. Donahoe et al.52 recogen una serie de 179 pacientes en quienes se practicó EAP, de los cuales 22 tenían ETEC con una PAP media de 21mmHg y resistencia vascular pulmonar de 252din.s·cm-5, que fueron seguidos durante 23 meses tras la intervención. Tras la cirugía la PAP media disminuyó a 17mmHg y mejoró la clase funcional. Las complicaciones en la ETEC fueron menos frecuentes y menos severas que en la HPTEC1. De los pacientes con ETEC en quienes no se realizó EAP, uno de ellos progresó a HPTEC.
Taboada et al.51 describen 20 pacientes con un perfil similar: tromboembolia pulmonar crónica, PAP media<25mmHg en reposo, limitación funcional y síntomas con el esfuerzo, e incremento del espacio muerto en la PECP. Tras la cirugía los pacientes presentaron mejoría de los síntomas, de la capacidad funcional y de la puntuación en los cuestionarios de calidad de vida, comparables a los pacientes con HPTEC.
La EAP en los pacientes con ETEC e HP de esfuerzo mejora de forma significativa la clase funcional y la tolerancia al esfuerzo a expensas de una mejoría en la eficiencia ventilatoria4.
Todavía no se dispone de datos acerca del tratamiento de la ETEC con fármacos específicos de hipertensión arterial pulmonar. Recientemente se ha publicado una pequeña serie de 10 pacientes con ETEC tratados mediante angioplastia pulmonar con balón en los que se observó mejoría clínica y hemodinámica53.
En cualquier caso, a falta de mayor evidencia en relación con el tratamiento de esta entidad y la estandarización de los procedimientos diagnósticos durante el esfuerzo, se recomienda que la valoración de estos pacientes, al igual que en la HPTEC, se efectúe en centros de referencia con experiencia en el tratamiento quirúrgico de la HPTEC.
A pesar de los potenciales efectos positivos de la rehabilitación cardiopulmonar en pacientes con ETEC54, aun no existen evidencias que permita generar recomendaciones.
ConclusiónLas lesiones trombóticas persistentes en los pacientes que sufren una EP son frecuentes. El espectro clínico asociado a estas lesiones es amplio, oscilando desde un curso asintomático con recuperación funcional completa hasta la HPTEC. En los últimos años ha emergido el concepto de ETEC pulmonar para designar al subgrupo de pacientes con lesiones trombóticas persistentes que presentan síntomas, limitación a la tolerancia al esfuerzo y disfunción vascular pulmonar, pero que no muestran HP en reposo. La prevalencia de esta entidad es desconocida y los criterios para diagnosticarla no están claramente definidos. La demostración de lesiones trombóticas persistentes, el desarrollo o empeoramiento sintomático tras la EP y la demostración de intolerancia al esfuerzo de origen cardiovascular, junto con una hemodinámica pulmonar normal en reposo, constituyen a día de hoy los elementos de mayor consenso para el diagnóstico de ETEC. En base a pequeñas series de casos con ETEC que se han beneficiado de EAP, es aconsejable que los pacientes con ETEC sean valorados en centros con experiencia en HPTEC y EAP a fin de considerar la posible indicación de dicha cirugía, o la realización de procedimientos terapéuticos análogos a los empleados en la HPTEC, cuya relación riesgo/beneficio deberá ser analizada individualmente. En cualquier caso, es recomendable el seguimiento estrecho de estos pacientes, ya que no es descartable que puedan evolucionar a HPTEC.
FinanciaciónFinanciado por: Instituto de Salud Carlos III (España): PI15/00582 y PI15/01085.
Conflicto de interesesPRM: declara haber recibido ayudas para la asistencia a Congresos y reuniones científicas de Actelion, Bayer Healthcare y MSD. Ha participado en comités asesores de Actelion, Bayer y ha recibido ayudas para la formación de Glaxo Smithkline, Actelion.
ROC: declara haber recibido ayudas para la asistencia a Congresos y reuniones científicas de Sanofi, Leo-Pharma, Rovi, Glaxo Smithkline, Actelion, Bayer Healthcare y MSD. Ha participado en comités asesores de Actelion, Bayer, Rovi y Leo-Pharma y ha recibido ayudas para proyectos de investigación de Leo-Pharma y Bayer Healthcare.
JAB: declara haber recibido honorarios por conferencias y participación en comités asesores de Actelion, Arena Pharmaceuticals, GSK y MSD; y ayudas para la investigación a través de su institución de Actelion, GSK, MSD y Ferrer.