La enfermedad pulmonar obstructiva crónica (EPOC) es uno de los procesos patológicos de mayor prevalencia en el mundo occidental1,2. Afecta al 9% de las personas con más de 40 años y a un 20% de las mayores de 65 años3. En España supone la cuarta causa de muerte y aumenta el riesgo de enfermedad tromboembólica venosa (ETEV)4. Además de la propia EPOC, otros factores de riesgo para la ETEV, como el cáncer, la insuficiencia cardíaca congestiva y la inmovilización, aumentan el riesgo de trombosis venosa profunda o de tromboembolia de pulmón (TEP) en este grupo de pacientes5. En los afectados de EPOC que desarrollan un evento trombótico sintomático, los síntomas y signos de la enfermedad respiratoria crónica pueden solaparse con los de la TEP, lo que dificulta y retrasa el diagnóstico6.
En un estudio con 15.531 pacientes dados de alta con el diagnóstico de TEP en Pensilvania, la enfermedad pulmonar crónica multiplicó por 3 la mortalidad por todas las causas durante los 30 días posteriores al diagnóstico7. Más aún, la TEP se ha identificado como variable predictora independiente de mortalidad y rehospitalización en los pacientes con EPOC8.
El objetivo del presente estudio ha sido evaluar: a) la repercusión de la EPOC en el diagnóstico de una serie consecutiva de pacientes con TEP aguda sintomática, y b) el significado pronóstico de la EPOC en estos pacientes.
Pacientes y métodosDiseñoSe trata de un estudio prospectivo de cohorte, que se llevó a cabo en un hospital terciario universitario entre enero de 2003 y diciembre de 2007. El estudio fue aprobado por el Comité de Ética del Hospital y los pacientes firmaron el consentimiento informado.
Pacientes y criterios de selecciónSe incluyó en el estudio a todos los pacientes ambulatorios diagnosticados de forma consecutiva de TEP aguda sintomática en el Servicio de Urgencias del Hospital Ramón y Cajal (Madrid). Los únicos criterios de exclusión fueron la participación en otro estudio o la imposibilidad para el seguimiento del paciente. La presencia de TEP se confirmó por métodos objetivos. El diagnóstico mediante angiotomografía computarizada se realizó demostrando un defecto intraluminal parcial rodeado de contraste o una oclusión completa de una arteria pulmonar en 2 cortes consecutivos de tomografía computarizada9. El diagnóstico se efectuó por gammagrafía de ventilación/perfusión en los casos de alta probabilidad, definidos según criterios PIOPED10 (al menos un defecto de perfusión segmentario o 2 subsegmentarios con ventilación normal), o en los casos con sospecha clínica de TEP, gammagrafía no concluyente y ecografía de miembros inferiores diagnóstica que mostrase un defecto de compresibilidad de la luz venosa como signo de trombosis venosa profunda11.
IntervencionesDurante un mínimo de 5 días se administró a los pacientes tratamiento con heparinas de bajo peso molecular (HBPM), a dosis ajustadas al peso, cada 12 h. Se inició la administración de antagonistas de la vitamina K junto con la HBPM entre el primer y el tercer días de tratamiento, y esta última se retiró cuando el cociente internacional normalizado era estable y superior a 2,0. El seguimiento del cociente internacional normalizado se realizó de acuerdo con las prácticas locales del centro.
Se administró tratamiento fibrinolítico a los pacientes con shock cardiogénico, definido como presión arterial sistólica menor de 100 mmHg asociada a signos clínicos de hipoperfusión tisular. La inserción de un filtro de vena cava inferior se indicó en los pacientes con contraindicación para el tratamiento anticoagulante.
DefinicionesSe clasificó a los pacientes como afectados de EPOC si presentaban síntomas respiratorios crónicos y la espirometría detectaba de forma constante obstrucción crónica al flujo aéreo (volumen espiratorio forzado en el primer segundo/capacidad vital forzada<0,7)12. En caso contrario, se les clasificó como pacientes sin EPOC. Se definió la inmovilización como aquella que había durado 4 días o más debido a una enfermedad médica aguda en el mes anterior al diagnóstico de la TEP. El antecedente de cáncer se consideró en los pacientes con una neoplasia activa o tratada en el año previo al diagnóstico de TEP. La hemorragia reciente fue aquélla clínicamente significativa que se produjo en el mes anterior al diagnóstico de TEP.
La probabilidad clínica de TEP se determinó a priori en todos los pacientes utilizando la escala modificada de Wells13.
Episodios analizadosSe definió como parámetro de valoración principal la mortalidad por todas las causas durante los 3 meses posteriores al diagnóstico. El parámetro secundario fue la mortalidad por TEP durante el mismo período de tiempo. La asignación de la causa de la muerte se realizó por consenso entre 2 investigadores (D.J. y D.M.), sin información sobre las características clínicas de los pacientes.
Análisis estadísticoLas variables continuas, que se expresan como media±desviación estándar, se compararon con el test de la t de Student para datos emparejados y no emparejados. Las variables categóricas, que se representan como porcentajes, se compararon con la prueba de la χ2 o con el test exacto de Fisher en caso necesario. Las variables con diferencias estadísticamente significativas entre los pacientes con y sin EPOC se introdujeron en un modelo de regresión logística multivariable. Los valores de p<0,05 se consideraron estadísticamente significativos. Se utilizó el método de Kaplan-Meier para analizar el tiempo sin fallecimiento por TEP en el período de seguimiento, y con el test de rangos logarítmicos se compararon las curvas de los grupos de pacientes con y sin EPOC. El análisis estadístico se realizó con el paquete estadístico SPSS versión 14.0.
ResultadosEntre enero de 2003 y diciembre de 2007 se diagnosticó a 937 pacientes de TEP aguda sintomática en el Servicio de Urgencias del Hospital Ramón y Cajal. Se excluyó a 36 (4%) por participar en otros estudios sobre ETEV y 19 se perdieron en el seguimiento (2%). Así pues, la población final fue de 882 pacientes (94%) con diagnóstico de TEP aguda sintomática.
En los 3 primeros meses de seguimiento fallecieron 128 pacientes (14%; intervalo confianza del 95%, 12–17%), 47 de ellos por TEP. Las otras causas de defunción fueron: cáncer (n=37), infección (n=18), hemorragia (n=6), causa desconocida (n=5), EPOC (n=4), insuficiencia cardíaca (n=3) y otros (n=8).
A 67 pacientes se les había diagnosticado de EPOC previamente a la TEP (8%; intervalo de confianza del 95%, 6-9%). Las características de los pacientes con y sin EPOC se comparan en la tabla 1. Los pacientes con EPOC fueron con mayor frecuencia varones y significativamente mayores que aquéllos sin EPOC; tenían antecedentes de inmovilización con más frecuencia. La insuficiencia cardíaca congestiva y el antecedente de hemorragia en el mes anterior al diagnóstico de TEP fueron más frecuentes en el grupo de pacientes con EPOC, mientras que el cáncer fue menos frecuente (aunque sin alcanzar la significación estadística). En el momento del diagnóstico, los pacientes con EPOC presentaban disnea e insuficiencia respiratoria más frecuentemente que los pacientes sin EPOC. Sin embargo, el síncope y el dolor torácico fueron menos frecuentes. Los pacientes con EPOC presentaron con más frecuencia una probabilidad clínica baja (según la escala de Wells) y mayor retraso diagnóstico que los pacientes sin EPOC. No hubo diferencias en la inserción de un filtro de vena cava o en la necesidad de tratamiento trombolítico entre los 2 grupos.
Tabla 1. Características basales de los 882 pacientes
| EPOC (n=67) | Sin EPOC (n=815) | p | |
| Características clínicas | |||
| Edad >65 años | 59 (88%) | 535 (66%) | <0,001 |
| Sexo: varón | 59 (88%) | 336 (41%) | <0,001 |
| Factores de riesgo para ETEV | |||
| Cáncer | 10 (15%) | 205 (25%) | 0,06 |
| Cirugía | 4 (6%) | 85 (10%) | 0,243 |
| Inmovilización≥4 días | 21 (31%) | 144 (18%) | 0,006 |
| ETEV previa | 10 (15%) | 84(10%) | 0,24 |
| Hemorragia recientea | 6 (9%) | 36 (4%) | 0,094 |
| Comorbilidad | |||
| Insuficiencia cardíaca | 8 ((12%) | 52 (6%) | 0,082 |
| Presentación clínica | |||
| Retraso diagnóstico >3 días | 39 (58%) | 356 (44%) | 0,022 |
| Probabilidad clínica bajab | 42 (63%) | 152 (19%) | <0,001 |
| Síncope | 3 (4%) | 123 (15%) | 0,017 |
| Disnea | 61 (91%) | 575 (71%) | <0,001 |
| Dolor torácico | 22 (33%) | 372 (46%) | 0,042 |
| SaO2<90% | 37 (55%) | 190 (23%) | <0,001 |
| FC >100 lat/min | 16 (24%) | 194 (24%) | 0,961 |
| Tratamiento | |||
| Inserción de filtro VCI | 0 (0%) | 16 (2%) | 0,246 |
| Trombólisis | 1 (1%) | 19 (2%) | 0,655 |
ETEV: enfermedad tromboembólica venosa; FC: frecuencia cardíaca; SaO 2: saturación arterial de oxígeno; VCI: vena cava inferior.
a En el mes previo.
b Escala de Wells modificada 13.
Las variables que en el análisis bivariable se asociaron con la mortalidad por todas las causas en los 3 meses posteriores al diagnóstico se describen en la tabla 2. Tras ajustar por las variables clínicas predictoras en el análisis bivariable, los antecedentes de cáncer y de inmovilización médica, la hipotensión arterial y la saturación de oxígeno menor del 90% se asociaron de forma significativa a la mortalidad por todas las causas. De igual forma, las variables asociadas con la mortalidad por TEP a los 3 meses se muestran en la tabla 3. En este caso, el antecedente de EPOC se asoció de forma significativa a la mortalidad por TEP en el análisis de regresión logística.
Tabla 2. Predictores pronósticos de muerte por todas las causas a 3 meses
| Univariable | Multivariable | |||||
| Muerte (n=128) | Vivos (n=754) | RR (IC del 95%) | p | RR (IC del 95%) | p | |
| Características clínicas | ||||||
| Edad >65 años | 93 (73%) | 501 (66%) | 1,3 (0,9–2,0) | 0,17 | – | |
| Sexo: varón | 67 (52%) | 328 (43%) | 1,4 (1,0–2,1) | 0,06 | 1,3 (0,9–1,9) | 0,18 |
| Factores de riesgo para ETEV | ||||||
| Cáncer | 65 (51%) | 150 (20%) | 4,1 (2,8–6,1) | <0,001 | 4,6 (3,0–6,9) | <0,001 |
| Inmovilización≥4 días | 35 (27%) | 130 (17%) | 1,8 (1,2–2,8) | 0,007 | 2,4 (1,5–3,8) | <0,001 |
| Comorbilidad | ||||||
| EPOC | 10 (8%) | 57 (8%) | 1,0 (0,5–2,1) | 0,92 | – | |
| Insuficiencia cardíaca | 13 (10%) | 47 (6%) | 1,7 (0,9–3,2) | 0,10 | – | |
| Presentación clínica | ||||||
| Disnea | 100 (78%) | 536 (71%) | 1,4 (0,9–2,3) | 0,92 | – | |
| Dolor torácico | 48 (37%) | 346 (46%) | 0,7 (0,5–1,0) | 0,07 | 0,9 (0,6–1,3) | 0,50 |
| SaO2<90% | 65 (51%) | 296 (39%) | 1,6 (1,1–2,3) | 0,01 | 1,5 (1,0–2,2) | 0,05 |
| FC >110 lat/min | 32 (25%) | 145 (19%) | 1,4 (0,9–2,2) | 0,13 | – | |
| PAS<100 mmHg | 20 (16%) | 59 (8%) | 2,2 (1,3–3,8) | 0,004 | 1,9 (1,0–3,3) | 0,04 |
ETEV: enfermedad tromboembólica venosa; FC: frecuencia cardíaca; IC: intervalo de confianza; PAS: presión arterial sistólica; RR: razón de riesgo; SaO 2: saturación arterial de oxígeno.
Tabla 3. Predictores pronósticos de muerte por tromboembolia de pulmón a 3 meses
| Univariable | Multivariable | |||||
| Muerte (n=51) | Vivos (n=830) | RR (IC del 95%) | p | RR (IC del 95%) | p | |
| Características clínicas | ||||||
| Edad >65 años | 40 | 554 | 1,8 (0,9–3,6) | 0,08 | – | |
| Sexo: varón | 22 | 373 | 0,9 (0,5–1,6) | 0,81 | – | |
| Factores de riesgo para ETEV | ||||||
| Cáncer | 20 | 195 | 2,1 (1,2–3,8) | 0,01 | 2,7 (1,4–5,1) | 0,002 |
| Inmovilización≥4 días | 22 | 143 | 3,6 (2,0–6,5) | <0,001 | 3,8 (2,0–7,2) | <0,001 |
| Comorbilidad | ||||||
| EPOC | 8 | 59 | 2,4 (1,1–5,4) | 0,02 | 2,2 (1,0–5,1) | 0,05 |
| Insuficiencia cardíaca | 5 | 55 | 1,5 (0,6-4,0) | 0,38 | – | |
| Presentación clínica | ||||||
| Disnea | 40 | 596 | 1,4 (0,7––2,8) | 0,30 | – | |
| Dolor torácico | 18 | 376 | 0,6 (0,4–1,2) | 0,16 | – | |
| SaO2<90% | 31 | 330 | 2,3 (1,3–4,2) | 0,003 | 1,9 (1,1–3,5) | 0,03 |
| FC >110 lat/min | 15 | 162 | 1,7 (0,9–3,2) | 0,09 | – | |
| PAS<100 mmHg | 13 | 66 | 4,0 (2,0–7,8) | <0,001 | 3,3 (1,6–6,8) | 0,001 |
ETEV: enfermedad tromboembólica venosa; FC: frecuencia cardíaca; IC: intervalo de confianza; PAS: presión arterial sistólica; RR: razón de riesgo; SaO 2: saturación arterial de oxígeno.
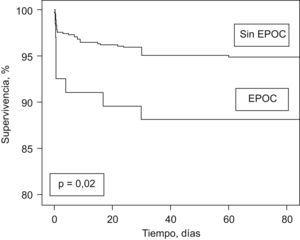
Al final del período de seguimiento la supervivencia sin fallecimiento por TEP en el grupo de pacientes sin EPOC fue del 95%, frente al 88% en el grupo con EPOC (rangos logarítmicos, p=0,02; fig. 1).
Figura 1. Curvas de supervivencia en función de la presencia o ausencia de EPOC.
Discusión
En este trabajo hemos analizado el significado pronóstico de la EPOC en una serie consecutiva de pacientes con diagnóstico objetivo de TEP aguda sintomática. Del estudio se derivan 2 hallazgos fundamentales: a) la sospecha de TEP es menor y el retraso diagnóstico mayor en los pacientes con EPOC, y b) los pacientes con diagnóstico de EPOC que desarrollan una TEP tienen más riesgo que los pacientes sin EPOC de fallecer por la propia TEP en los 3 meses posteriores al diagnóstico.
En nuestra serie el 8% de los 882 pacientes estudiados presentaba EPOC confirmada de forma objetiva. Este resultado es similar al de otras series de la literatura médica en las que la prevalencia oscila entre el 8 y el 9%14–17. En el estudio de Aujesky et al7, la prevalencia de enfermedad pulmonar crónica fue de un 18%. Mientras que en dicha serie se consideraban todos los trastornos respiratorios crónicos, en nuestro registro se requiere una confirmación funcional de la EPOC, lo que explica la diferencia en la prevalencia observada.
Los pacientes con antecedentes de EPOC presentaron con más frecuencia que los pacientes sin EPOC una probabilidad clínica baja de TEP cuando se utilizó una escala clínica estandarizada13. Este hallazgo ya se había descrito en una serie de 4.444 pacientes incluidos de forma consecutiva en el registro RIETE18. En los pacientes con EPOC y TEP, la disnea puede atribuirse erróneamente a la enfermedad respiratoria crónica. Además, la disnea y los signos de insuficiencia cardíaca derecha no son infrecuentes en los pacientes con EPOC19. En nuestra serie, a los pacientes con EPOC se les diagnosticó con más retraso que a los pacientes sin EPOC. Aunque un estudio reciente no ha logrado demostrar ningún valor pronóstico en el retraso diagnóstico de la TEP20, las guías del American College of Chest Physicians recomiendan el diagnóstico y tratamiento precoz de la enfermedad tromboembólica21.
La mortalidad por todas las causas no fue diferente en el grupo de pacientes con EPOC, pero la mortalidad por TEP fue significativamente mayor después de ajustar por posibles variables de confusión. La embolia de pulmón masiva es el resultado de la interacción entre la carga trombótica y la reserva cardiopulmonar del paciente22. Nuestros resultados confirman que los pacientes con EPOC toleran peor el evento trombótico, posiblemente debido a una reserva cardiopulmonar limitada.
A la vista de estos resultados, creemos que las implicaciones prácticas de nuestro estudio son importantes. En primer lugar, la estratificación pronóstica de los pacientes con TEP aguda sintomática permite identificar a aquéllos de bajo riesgo de muerte por todas las causas (en quienes se puede considerar el alta precoz o el tratamiento ambulatorio)23, así como a pacientes de alto riesgo de muerte por TEP (que requieren vigilancia más estrecha y en quienes podría considerarse el tratamiento trombolítico)24. En este sentido, el antecedente de EPOC en pacientes con TEP aguda sintomática permite identificar a un subgrupo con peor pronóstico en el que deberían valorarse alternativas al tratamiento anticoagulante convencional. En segundo lugar, las medidas de prevención de la ETEV cobran especial importancia en los afectados de con EPOC. Un estudio ha evaluado la eficacia de la HBPM (bemiparina) como forma de tromboprofilaxis primaria en estos pacientes25, pero los resultados no han sido concluyentes26. Se requieren nuevos estudios con un diseño riguroso que evalúen el impacto de la tromboprofilaxis en este escenario.
Nuestro estudio tiene algunas limitaciones que deben tenerse en cuenta. En primer lugar, se trata de un registro de pacientes con diagnóstico de TEP. Por lo tanto, es posible que no se hayan controlado algunas variables que pueden influir en los resultados. En segundo lugar, no podemos evaluar el impacto del tratamiento anticoagulante (en cuanto a dosis y calidad de la anticoagulación) en la evolución de los pacientes. En tercer lugar, no hemos podido analizar si existe una relación entre la gravedad de la EPOC (determinada por el volumen espiratorio forzado en el primer segundo) y el pronóstico de los pacientes con TEP aguda sintomática.
En conclusión, el diagnóstico de TEP pasa con frecuencia inadvertido en los pacientes con EPOC. La mortalidad por TEP es significativamente mayor en los afectados de EPOC, por lo que resulta imprescindible optimizar la tromboprofilaxis en este grupo de pacientes.
Autor para correspondencia.
David Jiménez
Dirección: djc_69_98@yahoo.com