El síndrome de apnea obstructiva del sueño (SAOS) puede fomentar la hiperglucemia y la resistencia a la insulina. Nuestro objetivo es investigar el efecto del SAOS sobre la glucosa plasmática en ayunas, la hemoglobina glucosilada (HbA1c) y la proteína C reactiva (PCR) en pacientes no diabéticos.
Material y métodosSe determinaron los parámetros de analítica hemática de 90 pacientes no diabéticos consecutivos en los que se realizaron evaluaciones polisomnográficas en nuestro laboratorio del sueño. Un total de 61 de estos pacientes con una glucemia en ayunas normal fueron clasificados según el índice de apnea-hipopnea (IAH) como casos leves (n=16, 26,2%), moderados (n=18, 29,5%) o graves (n=27, 44,2%) de SAOS. Se efectuaron determinaciones de la glucosa plasmática en ayunas, la HbA1c y la PCR.
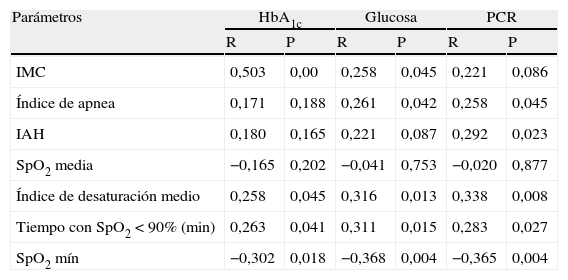
ResultadosLa media de edad de los pacientes fue de 47,7±11,2 años, y el 72% eran varones. Los niveles de HbA1c y de glucosa en ayunas presentan una correlación positiva con el IMC (r=0,503, p=0,00; r=0,258, p=0,045). No se detectó relación alguna de la HbA1c con el índice de apnea ni con el IAH, mientras que sí se observó una correlación positiva de la glucosa en ayunas con la PCR (r=0,262, p=0,042; r=0,258, p=0,045). Los niveles de HbA1c, glucosa en ayunas y PCR muestran una correlación negativa con los valores de SpO2 mínima (con valores de r=–0,302, p=0,018; r=–0,368, p=0,004; r=–0,365, p=0,004, respectivamente). Los niveles de HbA1c, glucosa en ayunas y PCR muestran una correlación positiva con el índice de desaturación medio (tiempo durante el que la SpO2 es<90% según la pulsioximetría) (r=0,263, p=0,041; r=0,311, p=0,015; r=0,283, p=0,027).
ConclusionesAunque no se detectó relación alguna entre el aumento de los niveles de HbA1c o de glucosa y la gravedad del SAOS en los pacientes con SAOS no diabéticos, sí se detectó una correlación con la hipoxia nocturna. Esto podría poner de manifiesto el efecto de la hipoxia nocturna sobre el metabolismo de la glucosa en los pacientes con SAOS.
Obstructive sleep apnea syndrome (OSAS) may promote hyperglycemia and insulin resistance. Our aim is to investigate the effect of OSAS on the fasting plasma glucose, glycosylated hemoglobin (HbA1c), and C reactive protein (CRP) in nondiabetic patients.
Material and methodsBlood parameters of consecutive 90 non diabetic patients whom polysomnografic evaluations were done in our sleep laboratory was evaluated. Among these 61 patients with normal fasting blood glucose were classified due to their apne-hipopnea index (AHI) as mild (n=16, 26.2%), moderate (n=18, 29.5%) and severe (n=27, 44.2%) OSAS. The fasting plasma glucose, HbA1c and CRP were measured.
ResultsMean age of the patients was 47.7±11.2 years, 72% male. HbA1c, fasting glucose levels show positive correlation with BMI (r=.503, P=.00; r=.258, P=.045). No relation of HbA1c to apnea index nor AHI was detected while positive corelation of fasting glucose and CRP was detected (r=.262, P=.042; r=.258, P=.045). HbA1c, fasting glucose and CRP levels show negative correlation with minimum SpO2 levels (by order of r=–.302, P=.018; r=–.368, P=.004; r=–.365, P=.004). HbA1c, fasting glucose levels and CRP levels show positive correlation with mean desaturation index (time duration in which SpO2<90% by pulse oxymeter) (r=.263, P=.041; r=.311, P=.015; r=.283, P=.027).
ConclusionsAlthough no relation in between increased HbA1c or glucose levels and severity of OSAS was detected in nondiabetic OSAS patients, the correlation with the night hypoxia was detected. This could also show the effect of night time hypoxia on glucose metabolism in OSAS patients.
El síndrome de apnea obstructiva del sueño (SAOS) y la diabetes son trastornos frecuentes en todo el mundo. Se estima que el 8% de los estadounidenses adultos padecen diabetes, y que en el 90% de ellos se trata de una diabetes mellitus (DM) tipo21. Por su parte, la alteración de la respiración durante el sueño se observa en el 4% de las mujeres y en el 9% de los varones en la población general2. La obesidad es un importante factor de riesgo para el desarrollo de la DM tipo2 y también para el desarrollo del SAOS3. Como resultado de este factor de riesgo común, es frecuente que ambos trastornos coexistan. En estudios recientes, la prevalencia de la alteración de la respiración en el sueño (índice de apnea-hipopnea [IAH]>20) ha sido del 36% en los pacientes con DM, en comparación con el 15% en los individuos normoglucémicos, mientras que la prevalencia de la DM tipo2 es de aproximadamente el 30% en los pacientes con SAOS4,5.
En los primeros estudios se observó una asociación entre el SAOS y la resistencia a la insulina, mientras que en otros no se observó una relación clara entre ambos factores6-10. Los posibles mecanismos de la relación entre el SAOS y la resistencia a la insulina fueron la hipoxia intermitente, los despertares del sueño con actividad simpática concomitante y la fragmentación del sueño11. De todos modos, en el SAOS no puede determinarse si la intolerancia a la glucosa se debe a una desaturación de oxígeno nocturna o a una alteración del sueño o a la duración de este.
Aunque se ha investigado la relación entre el SAOS y la DM, la asociación entre el control de la glucemia y la gravedad del SAOS en pacientes no diabéticos no ha sido tan bien evaluada12. El objetivo de este estudio fue explorar la asociación entre hemoglobina glucosilada (HbA1c), glucosa en ayunas, proteína C reactiva (PCR) y características del sueño en pacientes con SAOS no diabéticos.
Material y métodosPacientesSe examinaron las historias clínicas de 90 pacientes no diabéticos consecutivos a los que se había diagnosticado recientemente un SAOS (IAH>5/h) mediante polisomnografía entre julio y octubre de 2011. El examen médico fue normal en todos ellos. Se excluyó a los pacientes con una DM conocida o con una glucemia en ayunas elevada (glucosa en ayunas ≥126mg/dl), así como a los que presentaban otras enfermedades crónicas (como enfermedad renal, hepática, cardiovascular o cerebrovascular crónicas), y a los que estaban recibiendo medicación sistémica o los que tenían un diagnóstico/tratamiento previo de un SAOS. Aplicando los criterios de inclusión y exclusión antes citados, se incluyó en el estudio a 61 pacientes. Se obtuvo la aprobación del comité ético del hospital y el consentimiento informado de todos los pacientes.
ProcedimientoSe evaluaron todos los registros existentes de los pacientes respecto a sus antecedentes, exploración física e historia clínica detallada. Se realizó, además, una evaluación de la somnolencia diurna con la Epworth Sleepiness Scale (ESS)13. En todos los pacientes se llevó a cabo una polisomnografía estándar (durante una noche) con el empleo de un sistema de obtención y análisis de datos Embla A-10 (Embla; Medcare Flaga; Reikiavik, Islandia) en el contexto de un laboratorio del sueño, en condiciones basales. Los registros fisiológicos monitorizados fueron los siguientes: EEG (C4-A1, C3-A2, O2-A1, O1-A2); EOG; EMG submentoniano; esfuerzo de la caja costal y abdominal medido con pletismografía inductiva respiratoria (PIR) (XactTrace Medcare Flaga; Reikiavik, Islandia); posición corporal medida con un sensor calibrado; flujo nasal medido con una cánula de presión nasal (Medcare Flaga; Reikiavik, Islandia), SpO2 (8.000J, Nonin Medical, Plymouth, MN, EE.UU.) con el tiempo medio fijado en 3s; ECG (derivación ii) con registro de muestras a 512Hz. Las fases del sueño y los despertares se puntuaron con el programa informático Somnologica Studio (Medcare Flaga; Reikiavik, Islandia) con la aplicación de criterios estándares (criterios AASM 2007) por parte de 2 evaluadores experimentados en cada individuo. Los episodios respiratorios se puntuaron de la siguiente forma: la apnea se definió como el cese del flujo aéreo durante un periodo ≥10s, y se clasificó como obstructiva en presencia de un movimiento continuo de la PIR y como central en ausencia de movimiento en la PIR. Las hipopneas se definieron como una reducción ≥50% en la amplitud del flujo oronasal ≥10s, acompañado de una desaturación ≥3% y/o un despertar. Las hipopneas se clasificación como obstructivas si había alguna evidencia indicativa de una resistencia de vías aéreas altas, como los ronquidos, un movimiento paradójico de las bandas respiratorias y una limitación del flujo inspiratorio en el registro de presión nasal.
Análisis de sangreSe obtuvieron muestras de sangre venosa en ayunas el día siguiente a la polisomnografía, entre las 7 y las 9 de la mañana, tras una noche en ayunas. Se realizaron análisis bioquímicos (incluidos los de PCR y glucosa) en un ABX Pentra 120 (Biochem, Tokio, Japón) y la HbA1c se determinó mediante cromatografía líquida de alto rendimiento (Siemens Advia 1800; Arkray, Kyoto, Japón).
Análisis estadísticoLos análisis se llevaron a cabo con la versión 16.0 del programa SPSS para Windows (SPSS, Chicago, IL, EE.UU.). Se evaluó la distribución normal de todas las variables con la prueba de Kolmogorov-Smirnov. Las variables continuas con una distribución normal se expresan en forma de media±desviación estándar (DE). Las variables continuas con una distribución no normal se resumen en forma de mediana (rango intercuartílico [RIC]).
Las variables discretas se expresan en forma de número (porcentaje). Los parámetros con una distribución no normal y las comparaciones de grupos independientes se basaron en la prueba de la U de Mann-Whitney. Las correlaciones entre las variables no continuas se estudiaron con el empleo de la correlación de Spearman. Las correlaciones entre las variables continuas se estudiaron con la correlación de Pearson. Las comparaciones de los grupos se realizaron con un ANOVA de una vía y aplicando el método de Bonferroni. Un valor de p<0,05 se consideró estadísticamente significativo.
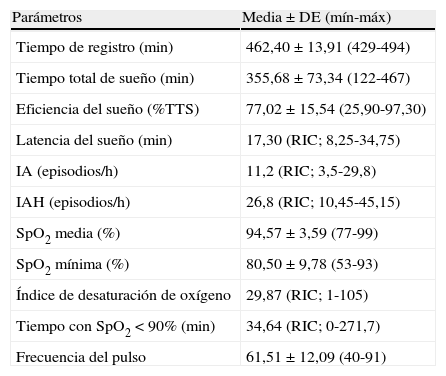
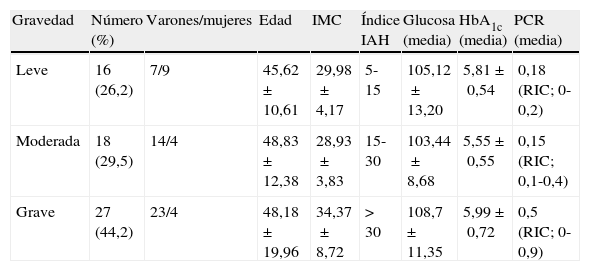
ResultadosSe evaluó a un total de 90 pacientes, de los que 61 fueron incluidos en el estudio. La media de edad del grupo de estudio fue de 47,7±11,2años (18-75años) y 44 (72%) de los pacientes eran varones. La media del índice de masa corporal (IMC) fue de 31,6±6,9kg/m2 (21,6 y 68,4kg/m2). Las características del sueño de los pacientes se resumen en la tabla 1 y la media de glucosa, HbA1c y PCR en relación con las clasificaciones del SAOS se muestran en la tabla 2.
Características del sueño de los pacientes
| Parámetros | Media±DE (mín-máx) |
| Tiempo de registro (min) | 462,40±13,91 (429-494) |
| Tiempo total de sueño (min) | 355,68±73,34 (122-467) |
| Eficiencia del sueño (%TTS) | 77,02±15,54 (25,90-97,30) |
| Latencia del sueño (min) | 17,30 (RIC; 8,25-34,75) |
| IA (episodios/h) | 11,2 (RIC; 3,5-29,8) |
| IAH (episodios/h) | 26,8 (RIC; 10,45-45,15) |
| SpO2 media (%) | 94,57±3,59 (77-99) |
| SpO2 mínima (%) | 80,50±9,78 (53-93) |
| Índice de desaturación de oxígeno | 29,87 (RIC; 1-105) |
| Tiempo con SpO2<90% (min) | 34,64 (RIC; 0-271,7) |
| Frecuencia del pulso | 61,51±12,09 (40-91) |
DE: desviación estándar; IA: índice de apnea; IAH: índice de apnea-hipopnea; RIC: rango intercuartílico; SpO2: saturación de oxígeno de hemoglobina medida con pulsioximetría; TTS: tiempo total de sueño.
Clasificaciones del SAOS y parámetros de glucemia de los pacientes
| Gravedad | Número (%) | Varones/mujeres | Edad | IMC | Índice IAH | Glucosa (media) | HbA1c (media) | PCR (media) |
| Leve | 16 (26,2) | 7/9 | 45,62±10,61 | 29,98±4,17 | 5-15 | 105,12±13,20 | 5,81±0,54 | 0,18 (RIC; 0-0,2) |
| Moderada | 18 (29,5) | 14/4 | 48,83±12,38 | 28,93±3,83 | 15-30 | 103,44±8,68 | 5,55±0,55 | 0,15 (RIC; 0,1-0,4) |
| Grave | 27 (44,2) | 23/4 | 48,18±19,96 | 34,37±8,72 | >30 | 108,7±11,35 | 5,99±0,72 | 0,5 (RIC; 0-0,9) |
HbA1c: hemoglobina glucosilada; IAH: índice de apnea-hipopnea; IMC: índice de masa corporal; PCR: proteína C reactiva.
El IMC mostró una correlación positiva con el índice de apnea, el IAH y el índice de desaturación de oxígeno (IDO) (p=0,012, r=0,321; p=0,001, r=0,400; p=0,001, r=0,411, respectivamente) mientras que hubo una correlación negativa con la SpO2 mínima (p=0,00, r=–0,481). El IMC mostró también una correlación positiva con los niveles de HbA1c y con los niveles de glucosa en ayunas (p=0,00, r=–0,503; p=0,045, r=–0,258) pero no se detectó correlación alguna con la PCR.
No hubo diferencias significativas entre los grupos leve y moderado ni entre los grupos leve y grave por lo que respecta a los valores de HbA1c, glucosa o PCR, pero la HbA1c mostró una diferencia significativa entre los grupos moderado y grave (p=0,038). Tampoco se observaron diferencias significativas entre los 3 grupos en estos parámetros (p=0,187, p=0,646, p=0,237, respectivamente). Se observó una correlación entre los niveles de HbA1c y glucosa y los parámetros relacionados con la apnea y con la desaturación del oxígeno en el sueño y la PCR, tal como se muestra en la tabla 3. Todas estas correlaciones desaparecen cuando se corrige el efecto como factor del IMC, mediante análisis de correlación parciales (p>0,05).
Correlaciones entre los parámetros relacionados con la apnea y los niveles de la HbA1c, glucosa y PCR
| Parámetros | HbA1c | Glucosa | PCR | |||
| R | P | R | P | R | P | |
| IMC | 0,503 | 0,00 | 0,258 | 0,045 | 0,221 | 0,086 |
| Índice de apnea | 0,171 | 0,188 | 0,261 | 0,042 | 0,258 | 0,045 |
| IAH | 0,180 | 0,165 | 0,221 | 0,087 | 0,292 | 0,023 |
| SpO2 media | −0,165 | 0,202 | −0,041 | 0,753 | −0,020 | 0,877 |
| Índice de desaturación medio | 0,258 | 0,045 | 0,316 | 0,013 | 0,338 | 0,008 |
| Tiempo con SpO2<90% (min) | 0,263 | 0,041 | 0,311 | 0,015 | 0,283 | 0,027 |
| SpO2 mín | −0,302 | 0,018 | −0,368 | 0,004 | −0,365 | 0,004 |
HbA1c: hemoglobina glucosilada; IAH: índice de apnea-hipopnea; IMC: índice de masa corporal; PCR: proteína C reactiva; SpO2 media: saturación de oxígeno media de la hemoglobina medida con pulsioximetría; SpO2 mín: saturación de oxígeno mínima de la hemoglobina medida con pulsioximetría.
El IMC, el IDO y la SpO2 mínima fueron estadísticamente significativos en las comparaciones entre 2 grupos a causa de los niveles de glucosa plasmática en ayunas inferiores a 100mg/dl (19 casos) o de entre 100mg/dl y 125mg/dl (42 casos) (p=0,045, p=0,002, p=0,006).
DiscusiónEn este estudio se evaluó la posible correlación de las alteraciones de la respiración durante el sueño con el metabolismo de la glucosa en pacientes con SAOS no diabéticos sin comorbilidades. Nuestros resultados sugieren que, en pacientes no diabéticos, la hipoxia durante la noche se asocia a un aumento de los niveles de glucosa en ayunas y de HbA1c, pero esta relación desaparece cuando se introduce una corrección respecto al IMC. Cabría proponer que, aparte de la gravedad de la enfermedad y el IAH, la hipoxia intermitente puede desempeñar un papel e influir en el metabolismo de la glucosa en los pacientes con SAOS, pero esto podría causar también obesidad.
La intolerancia a la glucosa y el aumento de las tasas de DM se han observado con frecuencia en pacientes con SAOS y podrían estar relacionados con la obesidad, como se ha documentado también en el estudio de Tasali en su grupo de pacientes14. Sin embargo, algunos estudios sugieren que el SAOS podría ser un factor de riesgo para la DM, con independencia de la presencia concomitante de obesidad15,16. La hipótesis es que los trastornos respiratorios nocturnos incluyen el metabolismo de la glucosa a causa de una desaturación de oxígeno repetida o a causa de una alteración del sueño. Como en estudios previos, la relación entre el índice de desaturación medio y el tiempo durante el que el paciente se encuentra por debajo del 90% de SpO2 y los niveles de HbA1c y glucosa desaparece tras introducir una corrección para la obesidad en nuestro estudio. Esto puede tener relación con el hecho de que incluyéramos a todos los pacientes no diabéticos con un diagnóstico de SAOS consecutivos de nuestro laboratorio del sueño y que la mayoría de nuestros pacientes fueran obesos (mediana de IMC de 31,2). Esto podría explicarse porque el SAOS fuera también un componente del síndrome metabólico.
En estudios recientes se ha observado que la relación de la HbA1c y la hipoxia en los pacientes con SAOS euglucémicos fue significativa. En un estudio, la gravedad de la hipoxemia en los pacientes no diabéticos con apnea del sueño muestra una relación con los niveles de HbA1c, y el tratamiento con CPAP durante 3-5meses reduce los niveles de HbA1c en los pacientes con una apnea del sueño grave17. Al igual que en otro estudio realizado en 56 pacientes euglucémicos con SAOS de nuevo diagnóstico, se observó que la hipoxia nocturna puede afectar a los niveles de insulina en ayunas. Una buena adherencia a más de 6meses de tratamiento con CPAP puede reducir significativamente los niveles de HbA1c, pero carece de efecto sobre los marcadores de la resistencia a la insulina18. En un reciente metaanálisis se ha observado que el SAOS se asocia a una potenciación de la actividad simpática y a una disminución de la tolerancia a la glucosa, y que ambas alteraciones revierten después de un tratamiento con CPAP19. Sin embargo, estos estudios fueron de corta duración y la cuestión no se ha abordado todavía en ensayos controlados y aleatorizados a largo plazo.
Nuestro estudio respaldó esta hipótesis y mostró que la hipoxia nocturna está relacionada con los niveles de glucosa y HbA1c en los pacientes con SAOS euglucémicos no diabéticos. Los parámetros de hipoxia intermitente estaban correlacionados también con la PCR. La hipoxia intermitente afecta al metabolismo de la glucosa al inducir una activación sistemática, aumentar la inflamación sistémica, elevar las hormonas contrarreguladoras y los ácidos grasos, y causar una disfunción de las células beta pancreáticas20. No obstante, en el presente estudio no observamos una relación significativa entre los valores de PCR y los niveles de HbA1c y glucosa, lo cual podría deberse a que no utilizamos la PCR de alta sensibilidad, que es una medida de la inflamación más sensible.
Se ha observado un efecto nocivo del SAOS grave sobre los niveles de glucosa en sangre en pacientes hipertensos ancianos, y se ha identificado un aumento significativo de los niveles de glucosa en ayunas y HbA1c en esos pacientes21. Nosotros no observamos relación alguna de la glucosa en ayunas con el IAH ni con la gravedad del SAOS. Por otro lado, observamos que el índice de desaturación de oxígeno y el índice de desaturación mínima eran significativamente superiores en los pacientes con valores de glucosa en ayunas de entre 100 y 125mg/dl, lo cual constituye un marcador del deterioro de la glucemia en ayunas, en comparación con los que tenían valores de glucosa en ayunas inferiores a 100mg/dl22,23. Los pacientes con valores de glucosa en ayunas de entre 100 y 125mg/dl fueron remitidos a una evaluación más detallada de una posible DM. La razón de la alteración de los valores de la glucosa en ayunas podría ser un efecto de la hipoxia intermitente. El efecto de los ciclos de hipoxia y reoxigenación podría ser una causa del deterioro del metabolismo de la glucosa al producir una disfunción endotelial, la cual desencadenaría la formación de citoquinas inflamatorias, una elevación de la liberación de hormonas vasoactivas y un fomento del estrés oxidativo24-26. El otro factor causante del deterioro de la glucosa en ayunas podría ser un efecto de la activación del sistema simpático sobre la homeostasis de la glucosa, al aumentar la degradación del glucógeno muscular, la producción de glucosa y la liberación de ácidos grasos a través de la estimulación de la lipólisis, tal como ha mostrado el estudio de Iiyori et al.27.
No solamente se han realizado estudios que muestran una relación inversa entre la gravedad del SAOS y los niveles de HbA1c en los pacientes con DM tipo2, sino que también hay estudios que ponen de manifiesto la misma relación en pacientes con SAOS no diabéticos12,28. Se observó una correlación significativa entre la HbA1c y el IAH, el índice de despertares y la gravedad de la hipoxemia nocturna en el estudio realizado por Papanas et al.12, pero estos autores no observaron relación alguna entre el IMC y los niveles de HbA1c y de glucosa en ayunas. En nuestro estudio, el IMC mostró una correlación con la gravedad de la hipoxia y el IAH. Se identificó también una relación positiva entre el IMC y los niveles de HbA1c y glucosa en ayunas, a diferencia de lo observado en el estudio de Papanas et al. Es probable que la gravedad del SAOS se incremente con el aumento del IMC. En un estudio realizado en pacientes con obesidad mórbida se observó que con el aumento de la gravedad del IAH se producía un empeoramiento progresivo de los parámetros metabólicos29. Esto apunta a un síndrome metabólico que se sabe que acelera la aterosclerosis, la DM y la dislipidemia, como el SAOS30.
En la literatura médica se ha indicado que los pacientes con SAOS tienen una mayor probabilidad de sufrir una intolerancia a la glucosa en comparación con los controles sanos14. En comparación con los controles, la media de HbA1c aumentó en los pacientes con SAOS y el porcentaje de valores situados por encima del nivel de referencia tanto de la HbA1c como de la glucosa plasmática en ayunas indicó un aumento del riesgo de DM en los pacientes con SAOS (20 veces), respectivamente10. En el presente estudio no hubo un grupo control, pero observamos una diferencia significativa entre los grupos de SAOS moderado y grave en cuanto a los valores medios de HbA1c. Sin embargo, dado que nuestro tamaño muestral es bajo, resulta difícil extraer conclusiones estrictas acerca de nuestros resultados.
La apnea obstructiva del sueño y el síndrome metabólico tienen factores de riesgo etiológicos comunes, como la obesidad central y la edad. El aumento de la función de las células beta causado por la hipoxia ejercerá un efecto sobre la disfunción endotelial en ambas enfermedades. Tal como se ha definido en estudios previos, la hipoxia nocturna puede influir en los niveles de glucosa en ayunas, pero el tratamiento con CPAP reduce solamente la HbA1c17. Al igual que en nuestro estudio, estos autores no observaron una relación entre el IAH y la HbA1c y, como en nuestro estudio, este efecto puede explicarse por la corrección de la hipoxia producida por la CPAP.
Hay pocos estudios que hayan evaluado la relación entre la apnea del sueño y la HbA1c, y esta cuestión está adquiriendo una importancia creciente. A diferencia del estudio de Steiropoulos et al.18, nosotros observamos una relación entre la HbA1c y las características del sueño. A diferencia de lo observado en el Sleep Heart Health Study, en el que los pacientes con una alteración de la respiración en el sueño de carácter moderado o grave mostraron valores superiores del índice HOMA, con independencia de la edad, el IMC, el sexo o el tabaquismo, nosotros utilizamos la HbA1c para evaluar el metabolismo de la insulina, que es más fácil y más barato de determinar en la práctica clínica8.
En conclusión, el presente estudio examinó la posible correlación de las alteraciones de la respiración en el sueño con el metabolismo de la glucosa en pacientes con SAOS no diabéticos. Nuestros resultados sugieren que, en los pacientes con SAOS no diabéticos y sin comorbilidades, la hipoxia nocturna se asocia a un aumento de los niveles de glucosa en ayunas, HbA1c y PCR, aunque no hay relación con el IAH. Podría proponerse que, aparte de la gravedad de la enfermedad, la hipoxia intermitente desempeña un papel en la hiperactividad simpática, el deterioro de la función endotelial y la influencia del metabolismo de la glucosa en los pacientes con SAOS. Por otro lado, dado que un buen número de nuestros pacientes eran obesos, y teniendo en cuenta que la relación desaparece tras introducir una corrección para el IMC, no está claro si la hipoxia es la causa primaria y principal de la intolerancia a la glucosa en los pacientes con SAOS. Nuestros datos sugieren que podría recomendarse un estudio más detallado de valoración de la DM en los pacientes obesos con hipoxia intermitente durante la noche.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.