El diagnóstico del mesotelioma pleural maligno presenta 3 importantes retos: es necesario distinguir entre hiperplasia mesotelial benigna y mesotelioma, entre mesotelioma maligno (con subtipos) y carcinoma metastásico, y también se requiere demostrar la invasión de estructuras vecinas a la pleura. Para aclarar los 2 primeros aspectos hay que basarse en un panel de anticuerpos monoclonales con adecuado estudio inmunohistoquímico —realizado por manos muy expertas— y para el tercero hay que apoyarse en biopsias suficientemente amplias y profundas, y la toracoscopia es la técnica de elección. La biopsia con aguja guiada con técnicas de imagen en tiempo real puede ser de gran ayuda cuando existe marcado engrosamiento nodular difuso y derrame pequeño o ausente. Dadas las dificultades de un diagnóstico precoz, es infrecuente que se consiga un tratamiento curativo mediante cirugía radical (pleuroneumonectomía), por lo que en los últimos años está ganando adeptos la liberación de masa tumoral mediante pleurectomía/decorticación, con asociación de quimio y radioterapia a las técnicas quirúrgicas (terapia multimodal). En los casos en que la cirugía no es factible se plantea la quimioterapia (combinando pemetrexed y compuestos de platino en la mayoría de los casos), con pleurodesis o colocación de un catéter pleural tunelizado si se requiere el control del derrame pleural, y se reserva la radioterapia para el tratamiento del dolor asociado a infiltración de la pared torácica o cualquier otra estructura vecina. En todo caso, es esencial un completo tratamiento de soporte para el control del dolor (que adquiere particular protagonismo en esta neoplasia) en unidades especializadas.
There are three major challenges in the diagnosis of malignant pleural mesothelioma: mesothelioma must be distinguished from benign mesothelial hyperplasia; malignant mesothelioma (and its subtypes) must be distinguished from metastatic carcinoma; and invasion of structures adjacent to the pleura must be demonstrated. The basis for clarifying the first two aspects is determination of a panel of monoclonal antibodies with appropriate immunohistochemical evaluation performed by highly qualified experts. Clarification of the third aspect requires sufficiently abundant, deep biopsy material, for which thoracoscopy is the technique of choice. Video-assisted needle biopsy with real-time imaging can be of great assistance when there is diffuse nodal thickening and scant or absent effusion. Given the difficulties of reaching an early diagnosis, cure is not generally achieved with radical surgery (pleuropneumonectomy), so liberation of the tumor mass with pleurectomy/decortication combined with chemo- or radiation therapy (multimodal treatment) has been gaining followers in recent years. In cases in which surgery is not feasible, chemotherapy (a combination of pemetrexed and platinum-derived compounds, in most cases) with pleurodesis or a tunneled pleural drainage catheter, if control of pleural effusion is required, can be considered. Radiation therapy is reserved for treatment of pain associated with infiltration of the chest wall or any other neighboring structure. In any case, comprehensive support treatment for pain control in specialist units is essential: this acquires particular significance in this type of malignancy.
El mesotelioma es un tumor que deriva de la superficie mesodérmica de la cavidad celómica embrionaria, que posteriormente dará lugar a la pleura, al pericardio, al peritoneo y a la tunica vaginalis del testículo. Este origen mesodérmico le confiere la potencialidad de desarrollar un componente epitelioide y otro sarcomatoso. Desde la década de los 50 del pasado siglo se conoce la asociación de este tumor con el asbesto1, particularmente en sus formas de «amianto azul» (o crocidolita) y «amianto blanco» (crisotilo), y también es bien conocida su relación con la exposición a erionita, que es un contaminante natural del suelo en varias regiones del mundo, particularmente en la región de Capadocia (Turquía), donde se observa una incidencia muy elevada de mesotelioma, probablemente asociada también a una cierta susceptibilidad genética2. En aproximadamente el 80% de los casos de mesotelioma hay una relación causa-efecto con exposición laboral a asbesto, con un amplio espectro de profesiones implicadas3, pero también hay que tener en cuenta la posible exposición ambiental, en general por vecindad con minas o fábricas donde se manipula el mineral o por contaminación a través de la ropa de trabajadores del asbesto4. Se ha demostrado una relación dosis-respuesta entre exposición acumulada a asbesto (altos niveles de exposición, duración de la exposición, o ambos) y mesotelioma maligno, y no hay ningún umbral por debajo del cual se descarte el riesgo de contraer la enfermedad5–7. El mesotelioma puede aparecer en cualquiera de las estructuras de origen mesodérmico mencionadas más arriba, pero la presentación más frecuente (en más del 90% de los casos) es la pleural, aunque su incidencia es relativamente baja, y oscila entre los 7 casos por millón de habitantes/año en Japón y los 40 en Australia, dependiendo fundamentalmente de la exposición a asbesto en décadas pasadas8. En Europa se estima la incidencia en 20 casos por millón/año, con notable variación entre países (también en relación con la historia de exposición a asbesto en el pasado), pero en todo caso se prevé un aumento global, en función del largo período de latencia entre exposición y manifestación de la enfermedad, que se sitúa alrededor de los 40 años, con un amplio margen entre los valores extremos (hasta 75 años en la serie de Bianchi et al.)9. Basándose en el consumo de asbesto se ha estimado que el pico de máxima incidencia de mesotelioma se registrará alrededor del año 2020 en Europa, con marcadas diferencias entre países10.
Para preparar el presente artículo se ha hecho una búsqueda en PubMed (http://www.ncbi.nlm.nih.gov/pubmed) (actualizada el 18 de marzo de 2014) combinando los términos malignant+pleural+mesothelioma, y se han encontrado 4.670 artículos (736 revisiones entre ellos). Los estudios prospectivos detallados y con series amplias, las guías clínicas basadas en la evidencia y algunos trabajos sobre aspectos muy concretos, como biomarcadores o técnicas novedosas con perspectivas de futuro, han constituido la base para incluir los artículos más relevantes en la presente revisión sobre mesotelioma pleural maligno.
Diagnóstico del mesotelioma pleural malignoEl mesotelioma puede presentar inicialmente un cuadro clínico de disnea, generalmente relacionada con el desarrollo de derrame pleural, y también es muy frecuente que se acompañe de dolor pleural, que no suele guardar clara relación con los movimientos respiratorios. En etapas precoces es rara la pérdida de peso o cualquier otra sintomatología, aunque más adelante suele aparecer marcada retracción del hemitórax, y el dolor adquiere especial intensidad y persistencia.
Técnicas de imagen en el diagnóstico del mesoteliomaAunque la radiografía de tórax constituye el primer paso y nos puede proporcionar información sobre la presencia de derrame, engrosamiento pleural difuso o masas, la tomografía computarizada (TC) —preferiblemente con contraste— es esencial para la correcta evaluación del paciente y la elección de los pasos diagnósticos a seguir: un engrosamiento pleural difuso y con prominencias nodulares sugiere mesotelioma, especialmente en un paciente con historia de exposición a asbesto en cualquiera de sus modalidades11. No obstante, la TC es poco sensible para valorar una posible afectación ganglionar mediastínica o la existencia de afectación pleural contralateral o peritoneal. Para investigar estos aspectos, y la presencia de posibles metástasis a distancia, es mucho más útil la tomografía de emisión de positrones (positron emission tomography [PET]), especialmente si se combina con TC (PET-TC)12. La PET-TC desempeña un papel relevante en la estadificación preoperatoria del mesotelioma pleural maligno, en la valoración de la respuesta al tratamiento y para detectar la posible aparición de recidivas13. No obstante, su sensibilidad y especificidad son bajas para detectar enfermedad N2 en el mesotelioma14, y pueden observarse falsos positivos en pleuritis tuberculosa15, empiema16 o en pacientes con historia de pleurodesis previa17.
La resonancia magnética nuclear (RMN) proporciona un mejor contraste que la TC para definir la invasión de la pared torácica por el mesotelioma, pero no es capaz de detectar fiablemente la presencia de enfermedad metastásica18.
Estudio del líquido pleuralLa toracocentesis puede proporcionar algunos datos sugestivos —pero rara vez diagnósticos— de mesotelioma: niveles altos de ácido hialurónico (>100.000ng/ml) son altamente sugestivos de mesotelioma pleural maligno19, y también se le atribuye un marcado valor pronóstico, de modo que un ácido hialurónico elevado se relaciona con mayor supervivencia20.
Los niveles de adenosín-deaminasa (ADA) pueden encontrarse elevados en pacientes con mesotelioma21, pero antes de etiquetarlos como falsos positivos del ADA hay que tener en cuenta que en ocasiones pueden coexistir mesotelioma maligno y pleuritis tuberculosa, y por ello se recomienda hacer cultivo para M. tuberculosis en estos casos22.
La citología del líquido pleural puede evidenciar la presencia de mesotelioma, pero con frecuencia plantea problemas entre hiperplasia mesotelial benigna y maligna23, y además es incapaz de demostrar el carácter invasivo del tumor (que actualmente se considera una característica esencial para el diagnóstico definitivo)24. No obstante, en algunos casos excepcionales se pueden combinar citología y técnicas de imagen para valorar la invasión extrapleural25. Por otro lado, las técnicas inmunocitoquímicas/histoquímicas son siempre necesarias para establecer la distinción entre mesotelioma y adenocarcinoma metastásico en la pleura26, y para ello se requiere tejido obtenido mediante biopsia, o bloques celulares preparados mediante inclusión en parafina del botón celular tras centrifugado de un volumen suficiente de líquido pleural (>100ml). La combinación de todos los siguientes supuestos puede proporcionar con suficiente fiabilidad el diagnóstico de mesotelioma: proliferación mesotelial atípica en el líquido pleural+estudios inmunohistoquímicos compatibles con mesotelioma en bloques celulares+engrosamiento pleural difuso con nodulaciones+ausencia de masas en el pulmón o en cualquier otro órgano que sugieran otro tumor primario27. No obstante, y especialmente por las implicaciones legales que supone el diagnóstico de mesotelioma maligno en la mayoría de los casos, y también cuando se plantea intervención quirúrgica, hay que intentar siempre obtener muestras amplias de tejido para tipificar con mayor seguridad el tumor28.
Diagnóstico histológico del mesotelioma pleural malignoClásicamente se distinguen los tipos epitelioide, sarcomatoso y bifásico en el mesotelioma pleural maligno, pero también hay raros subtipos, como el mesotelioma desmoplásico (que se puede confundir con pleuritis fibrosa benigna), el mesotelioma de células pequeñas y el mesotelioma linfohistiocitoide (que podría confundirse con un linfoma), y los estudios inmunohistoquímicos son esenciales para establecer la distinción entre ellos. No obstante, no existe ningún marcador con un 100% de sensibilidad y especificidad para mesotelioma, y por ello es imprescindible acudir a distintos paneles de anticuerpos monoclonales, incluyendo al menos 2 marcadores positivos para mesotelioma (en el subtipo epitelioide serían preferibles calretinina [particularmente útil si tiñe el núcleo, además del citoplasma]), Wilms tumor antigen 1 (WT-1) o epithelial membrane antigen (EMA) o citoqueratinas de amplio espectro y bajo peso molecular, como las CK5 o CK6 y 2 marcadores negativos, como el Ber-EP4 (marcador de membrana) y el thyroid transcription factor 1 (TTF-1, marcador nuclear). El carcinoembryonic antigen (CEA) es muy útil para distinguir carcinoma metastásico —especialmente de origen pulmonar— de mesotelioma (en el que prácticamente siempre es negativo), y en caso de sospecha de mesotelioma en una mujer es conveniente investigar también la expresión de endoplasmic reticulum (ER), que nunca aparece en mesotelioma y sí en tumores metastásicos de mama28 (tabla 1). Cuando el tumor presenta un componente sarcomatoso es en muchas ocasiones necesario distinguirlo de tumores metastásicos, como el escamoso de pulmón o el carcinoma de células transicionales. Aunque algunos de los anticuerpos usados para el mesotelioma epiteliode son también válidos para el sarcomatoso, con frecuencia hay que apoyarse en otros diferentes, como p63 y MOC 31 (tabla 2).
Marcadores inmunohistoquímicos para diferenciar mesotelioma epitelioide de otros tumores pleurales metastásicos
| Anticuerpo | Valor diagnóstico | Mesotelioma epitelioide | Adenocarcinoma |
|---|---|---|---|
| Calretinina | Esencial | +++ (núcleo y citoplasma) | ± (citoplasma) |
| WT-1 | Útil | ++ (nuclear) | (Pulmón) |
| EMA | Útil | ++ (membrana) | +++ (citoplasma) |
| Queratinas CK5/CK6 | Útil | ++ (citoplasma) | - |
| CEA monoclonal | Muy útil | - | ++ (citoplasma) |
| Ber-EP4 | Muy útil | ± (membrana) | +++ (membrana) |
| TTF-1 | Muy útil | - | ++ (núcleo, pulmón) |
| B72.3 | Muy útil | - | +++ (citoplasma, pulmón) |
| ER | Muy útil | - | ++ (núcleo, mama) |
CEA: carcinoembryonic antigen; EMA: epithelial membrane antigen; ER: endoplasmic reticulum marker; TTF-1: thyroid transcription factor-1;WT-1: Wilms tumor antigen 1. Adaptada de Scherpereel et al.28.
Marcadores inmunohistoquímicos para diferenciar mesotelioma sarcomatoso de carcinoma escamoso o de células transicionales
| Anticuerpo | Valor diagnóstico | Mesotelioma sarcomatoso | Carcinoma escamoso o transicional |
|---|---|---|---|
| Calretinina | Útil | +++ (núcleo y citoplasma) | + (citoplasma) |
| WT-1 | Útil | ++ (núcleo) | |
| Queratinas CK5/CK6 | No útiles | ++ (citoplasma) | +++ (citoplasma) |
| p63 | Muy útil | - | +++ (núcleo) |
| Ber-EP4 | Muy útil | ± (membrana) | +++ (citoplasma) |
| MOC 31 | Útil | ± (membrana) | +++ (membrana) |
p63: homólogo de p53, pero más útil para el diagnóstico diferencial; WT-1: Wilms tumor antigen 1. Adaptado de Scherpereel et al.28.
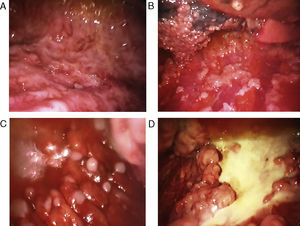
La biopsia pleural «ciega» con aguja (sin uso de técnicas de imagen en tiempo real) proporciona resultados poco satisfactorios para el diagnóstico de mesotelioma, no solo por la falta de control en cuanto al punto exacto de donde se obtienen las muestras, sino también por el pequeño tamaño de estas. Cuando hay engrosamiento pleural nodular difuso el rendimiento de la biopsia con aguja puede mejorar considerablemente si se realiza con la ayuda de TC29,30 o ecografía en tiempo real31. En un estudio se alcanzó un rendimiento diagnóstico del 75% en los casos en que las biopsias eran>10mm, mientras que solo se obtuvo el 8% cuando eran menores32, y esto aboga claramente por la toracoscopia como técnica diagnóstica en el mesotelioma pleural maligno. La toracoscopia (o pleuroscopia) se puede realizar con anestesia local y analgesia/sedación intravenosa33, y nosotros hemos diagnosticado más de 80 mesoteliomas pleurales con este método34 (fig. 1). La video-assisted thoracoscopic surgery (VATS) permite una mejor estadificación del tumor (especialmente en el área mediastínica) e incluso hacer pleurectomía/decorticación, pero requiere más recursos, incluyendo anestesia general e intubación traqueal35. El rendimiento de la pleuroscopia (también llamada «toracoscopia médica») es subóptimo en el mesotelioma con componente sarcomatoso36, y entonces es preferible obtener muestras más representativas mediante VATS o minitoracotomía37.
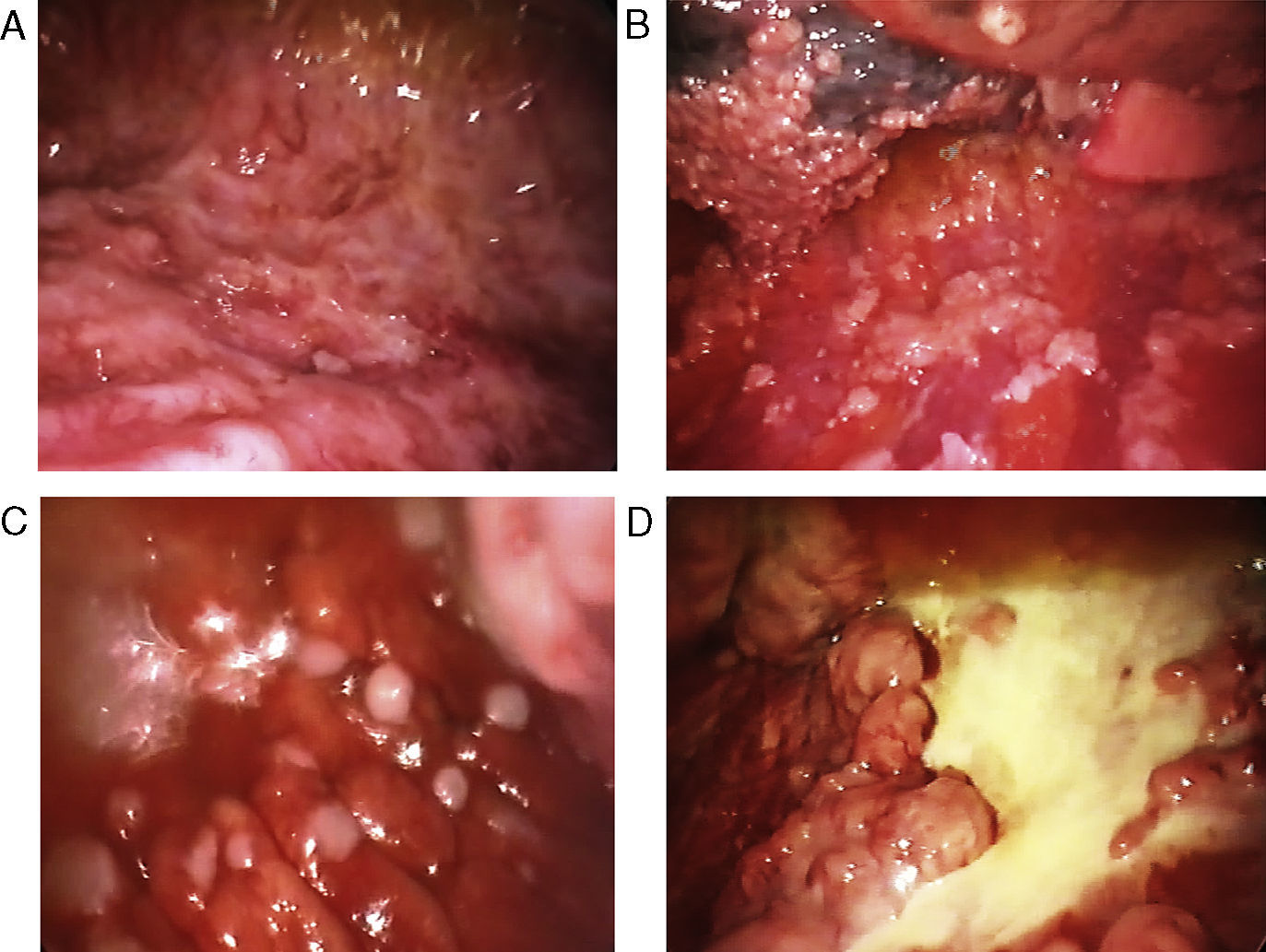
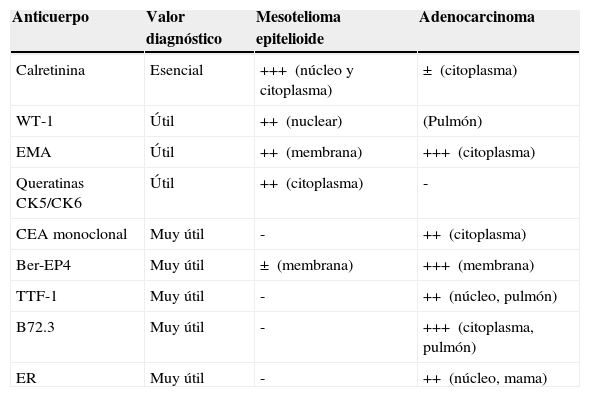
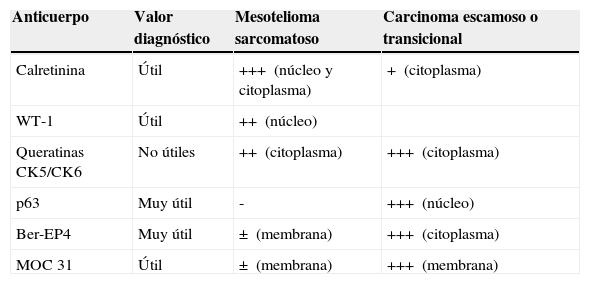
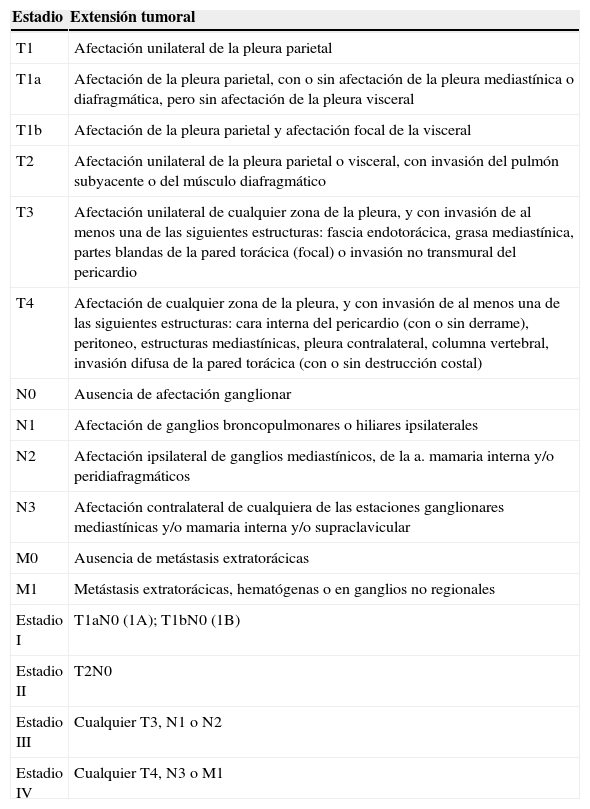
Variados aspectos toracoscópicos del mesotelioma pleural maligno. A. Infiltración masiva de la pleura parietal por mesotelioma maligno de tipo epitelioide. B. Infiltración difusa de la pleura parietal y visceral por mesotelioma maligno de tipo epitelioide. C. Nódulos «perlados» en afectación masiva de la pleura parietal por mesotelioma de tipo epitelioide. D. Placas pleurales y masas de mesotelioma de tipo sarcomatoso en la pleura parietal.
Uno de los principales retos con que nos enfrentamos radica en el hecho de que, si bien tenemos identificada la población de riesgo (individuos expuestos de una u otra forma a asbesto), carecemos en la actualidad de herramientas para conseguir un diagnóstico suficientemente precoz que permita aplicar un tratamiento radical en el mesotelioma. Esto implica la necesidad de biomarcadores capaces de detectar la enfermedad antes de que se desarrolle derrame o engrosamiento pleural difuso, y por ahora tampoco se dispone de técnicas de imagen con suficiente sensibilidad y especificidad para lograr ese objetivo.
Biomarcadores en el diagnóstico de mesotelioma malignoEl biomarcador que más atención ha recibido en los últimos años es la mesotelina soluble, la cual guarda una estrecha correlación con el tamaño y progresión tumoral en el mesotelioma de estirpe epitelioide (no sarcomatoso, en el que suele ser negativo)38. No obstante, sus valores se influyen por la función renal, y uno de sus mayores problemas radica en la identificación de un punto de corte adecuado para distinguir entre afectación pleural benigna y maligna39. En todo caso, parece claro que los niveles de mesotelina son más útiles en líquido pleural que en suero, y esto viene a limitar mucho su valor para el diagnóstico precoz en sujetos con historia de exposición a asbesto pero sin derrame pleural. Ante una baja probabilidad pretest de padecer mesotelioma, niveles bajos de mesotelina pueden ayudar a descartarlo, mientras que niveles altos refuerzan el uso de técnicas diagnósticas más invasivas en un paciente con sospecha de mesotelioma40–42. En todo caso, parece que la mesotelina es más útil para monitorizar el tratamiento que para el diagnóstico diferencial en los derrames pleurales43.
Tratando de superar los problemas de la mesotelina y otros marcadores se ha publicado recientemente que la fibulina-3 es capaz de distinguir entre personas sanas con historia de exposición a asbesto y pacientes con mesotelioma, e incluso entre mesotelioma y otros procesos malignos o benignos de la pleura. En un estudio de Pass et al. la fibulina en plasma presentó una sensibilidad del 96,7% y una especificidad del 95,5% para un punto de corte de 52,8ng/ml. Cuando se compararon pacientes con mesotelioma en fase relativamente temprana e individuos expuestos a asbesto pero sin evidencia de enfermedad, la sensibilidad fue de un 100% y la especificidad de 94,1% para un punto de corte de 46ng/ml de fibulina-344. Estos excelentes resultados requieren adecuada validación externa todavía, y también hay que tener en cuenta que el modo en el que se extraen y procesan las muestras puede influir significativamente en los resultados: en el caso de la fibulina su determinación en plasma (en la que no se ha activado el proceso de coagulación) es mucho más fiable que en suero, debido a las interacciones entre trombina y fibulina, como también ocurre con otros marcadores45.
En los últimos años se está trabajando intensamente en estudios de expresión génica en mesotelioma46, y se pone bastante énfasis en la expresión de determinadas proteínas como la aquaporina-1, que está relacionada con el transporte selectivo de agua a través de la membrana y con la proliferación celular47, y también destaca el estudio de micro-RNA (miRNA) en mesotelioma. Los miRNA son RNA cortos (17 a 22 nucleótidos) —no codificantes de proteínas— que regulan la expresión génica y desempeñan un importante papel en la oncogénesis48. Tienen alta especificidad tisular para detectar el origen de un tumor y también para distinguir mesotelioma de otros tumores metastásicos de la pleura49. Por otra parte, la detección de miRNA en sangre periférica podría convertirlos en excelentes marcadores de mesotelioma en un próximo futuro50.
Tratamiento del mesotelioma pleural malignoEl mesotelioma pleural suele tener escasa respuesta a quimioterapia y a radioterapia, y la cirugía es raramente curativa, porque el tumor se diagnostica en general demasiado tarde, y por ello tiene especial importancia la cuidadosa evaluación de cada paciente antes de elegir la mejor modalidad terapéutica. Si se está considerando la aplicación de un tratamiento radical es crítico evaluar la función pulmonar y cardíaca, la presencia de otros factores de comorbilidad y el estado físico y psicológico del paciente. La elección entre las distintas opciones terapéuticas viene dictada por la situación clínica y los estudios de extensión tumoral (TNM) mediante técnicas de imagen. No obstante, ninguna de las técnicas disponibles en la actualidad es suficientemente precisa para asegurar la «T» y la «N» en el mesotelioma pleural maligno, y es muy frecuente que la estadificación posquirúrgica supere ampliamente a la previa51. Hasta que se consiga una estadificación TNM más robusta se aconseja seguir la establecida por la Union Internationale contre le Cancer (UICC)52 (tabla 3).
Estadificación TNM del mesotelioma pleural maligno
| Estadio | Extensión tumoral |
|---|---|
| T1 | Afectación unilateral de la pleura parietal |
| T1a | Afectación de la pleura parietal, con o sin afectación de la pleura mediastínica o diafragmática, pero sin afectación de la pleura visceral |
| T1b | Afectación de la pleura parietal y afectación focal de la visceral |
| T2 | Afectación unilateral de la pleura parietal o visceral, con invasión del pulmón subyacente o del músculo diafragmático |
| T3 | Afectación unilateral de cualquier zona de la pleura, y con invasión de al menos una de las siguientes estructuras: fascia endotorácica, grasa mediastínica, partes blandas de la pared torácica (focal) o invasión no transmural del pericardio |
| T4 | Afectación de cualquier zona de la pleura, y con invasión de al menos una de las siguientes estructuras: cara interna del pericardio (con o sin derrame), peritoneo, estructuras mediastínicas, pleura contralateral, columna vertebral, invasión difusa de la pared torácica (con o sin destrucción costal) |
| N0 | Ausencia de afectación ganglionar |
| N1 | Afectación de ganglios broncopulmonares o hiliares ipsilaterales |
| N2 | Afectación ipsilateral de ganglios mediastínicos, de la a. mamaria interna y/o peridiafragmáticos |
| N3 | Afectación contralateral de cualquiera de las estaciones ganglionares mediastínicas y/o mamaria interna y/o supraclavicular |
| M0 | Ausencia de metástasis extratorácicas |
| M1 | Metástasis extratorácicas, hematógenas o en ganglios no regionales |
| Estadio I | T1aN0 (1A); T1bN0 (1B) |
| Estadio II | T2N0 |
| Estadio III | Cualquier T3, N1 o N2 |
| Estadio IV | Cualquier T4, N3 o M1 |
Adaptada de Van Meerbeeck et al.52.
El principal objetivo de la cirugía es resecar macroscópicamente todo el tumor, asumiendo que con ello se obtiene una mejor supervivencia, y que los pacientes en los que quedan restos de tumor macroscópicamente visibles la supervivencia es menor53. Sin embargo, la evidencia acumulada sugiere que no es posible conseguir una resección completa (macro y microscópica) en este tumor, independientemente de la técnica quirúrgica que se aplique, y por ello se acepta que la cirugía se oriente a controlar localmente la enfermedad, eliminar el derrame pleural, liberar el pulmón atrapado por el tumor, mejorar los trastornos de la ventilación/perfusión y paliar el dolor provocado por la invasión de la pared torácica54. Todas estas consideraciones se aplican especialmente al mesotelioma de tipo epitelioide, ya que el de componente sarcomatoso o bifásico tiene peor pronóstico y es en consecuencia un peor candidato para cualquier tipo de cirugía51.
Neumonectomía extrapleuralImplica la resección en bloque del pulmón y la pleura parietal, y habitualmente se completa con resección pericárdica y del diafragma de ese lado, además de disección sistemática de las cadenas ganglionares mediastínicas. Aunque la mortalidad perioperatoria se sitúa alrededor del 5% en centros con amplia experiencia, tiene alta morbilidad, incluyendo complicaciones cardíacas, respiratorias (que pueden adquirir especial relevancia por la situación unipulmonar en que queda el paciente tras la neumonectomía extrapleural [NEP]), fístula broncopleural, empiema y sangrado, entre otras55,56. En todo caso, y a causa de la habitual persistencia de residuos macro o microscópicos de tumor, esta intervención se ha de plantear en el marco de una terapia multimodal, que se apoya en el uso combinado de cirugía, quimioterapia y radioterapia57. Ocasionalmente se ha usado también la hipertermia —combinada con quimioterapia— o la terapia fotodinámica locales58. En muchos de los protocolos de terapia multimodal se administra quimioterapia como tratamiento de inducción antes de la cirugía (quimioterapia neoadyuvante), y tras la resección se aplica radioterapia sobre el hemitórax afecto59. No obstante, las guías clínicas más recientes recomiendan no intervenir quirúrgicamente si se observa progreso de la enfermedad tras la quimioterapia neoadyuvante y, en todo caso, recomiendan que la NEP se realice solo en el contexto de ensayos clínicos bien controlados y por grupos especializados en esta técnica27,28.
Pleurectomía/decorticaciónAunque está asociada a mayor riesgo de recidiva local que la NEP, presenta menos complicaciones que aquella60, y se orienta fundamentalmente a liberar el pulmón y la pared torácica de la constricción provocada por el tumor. Los pacientes con presencia macroscópica difusa de tumor en la pleura parietal, pero solo focal en la visceral, son los mejores candidatos para este tipo de cirugía54. Puede realizarse mediante VATS, que presenta la ventaja de minimizar la morbilidad asociada a la toracotomía61 y la posibilidad de hacer pleurodesis en el mismo acto si no se puede completar la resección.
La NEP plantea un abordaje más radical, pero en los últimos años se han cuestionado ampliamente sus ventajas sobre la pleurectomía/decorticación62,63, y en un reciente estudio aleatorizado en el Reino Unido (estudio Mesothelioma and Radical Surgery [MARS]) no se demostró la superioridad de una sobre otra64. Por otro lado, el estudio MARS ha sido duramente criticado por las importantes desviaciones que se produjeron sobre el protocolo planteado inicialmente y por el número de pacientes que finalmente quedaron incluidos en cada una de las ramas del estudio65. En todo caso, y aunque para algunos grupos con amplia experiencia en ambas técnicas se considera inadecuado dejar sin resecar el tumor macroscópicamente visible (lo que conlleva un peor pronóstico)54, va ganando adeptos la idea de resecar el mayor volumen posible del tumor, pero preservando el pulmón subyacente, y combinando en todo caso la cirugía con quimioterapia y radioterapia, en el marco de una terapia trimodal66.
Radioterapia en el mesotelioma pleural malignoLa radioterapia radical aplicada a todo un hemitórax está seriamente limitada por el riesgo de dañar órganos críticos como el pulmón, el hígado, el corazón, la médula espinal y el esófago, y para paliarlo se están optimizando las técnicas de aplicación67, aunque no hay evidencias convincentes de que por sí sola prolongue la supervivencia de los pacientes con mesotelioma68. Por otro lado, la radioterapia paliativa desempeña un papel importante para el control del dolor provocado por la infiltración de la pared torácica69,70. Clásicamente se había recomendado administrar radioterapia profiláctica para evitar la siembra tumoral en las cicatrices de toracoscopia o toracotomía71,72, pero esta práctica no está soportada por las evidencias disponibles, y se desaconseja en la actualidad27,28.
Quimioterapia, inmunoterapia y otras terapias personalizadasEn las guías clínicas recientes se recomienda no demorar la administración de quimioterapia, y se debería tomar en consideración antes de que aparezca deterioro funcional del paciente27,28. La combinación de varios agentes (incluyendo pemetrexed y compuestos de platino) produce en general mejores resultados que la monoterapia73,74. La tendencia actual se orienta a investigar nuevas dianas terapéuticas centradas en controlar angiogénesis y vías apoptóticas a través de ligandos específicos, incluyendo platelet derived growth factor (PDGF, que se sobreexpresa con bastante frecuencia en el mesotelioma y se asocia a menor supervivencia) y mesotelina (que se expresa solo en el subtipo epitelial) entre otros75,76. También dentro de la terapia multimodal la inmunoterapia puede ejercer un importante papel en el tratamiento del mesotelioma, porque este tumor es capaz de evadir el sistema inmune a través de células T-reguladoras (Treg) y macrófagos M2, y nuevas estrategias terapéuticas que combinan la citorreducción quirúrgica, quimioterapia, inmunoterapia y radioterapia pueden conseguir un mejor control de la enfermedad77. Desde la inmunoterapia pasiva (usando citoquinas o anticuerpos específicos) hasta la modulación de la respuesta inmune mediante células dendríticas u otras, hay un amplio espectro de posibilidades para conseguir efectos antitumorales marcadamente sinérgicos78–80.
PleurodesisEl control del derrame pleural es prioritario en la mayoría de los pacientes con mesotelioma pleural maligno, y la pleurodesis con talco puede ser una buena opción. No obstante, en nuestra experiencia suelen producirse más fallos de la pleurodesis en este tumor que en otros, y ello podría atribuirse a la imposibilidad de re-expandir adecuadamente el pulmón, enclaustrado por el tumor81. Así, estudios previos de nuestro grupo evidencian que la extensión del tumor en la cavidad pleural influye negativamente sobre la pleurodesis82. No obstante, es probable que influyan también otros factores biológicos no bien conocidos hasta la fecha. Según recientes experimentos realizados in vitro por nuestro grupo, las células mesoteliales malignas son más resistentes a la acción del talco que otras líneas celulares, y esto se pone de manifiesto tanto en la modulación/bloqueo de la angiogénesis como en la proliferación celular (datos no publicados).
Cuando falla la pleurodesis, o si se considera poco factible por la presencia de pulmón atrapado masivamente por el tumor, la mejor opción es la colocación de un catéter pleural tunelizado, que permite la evacuación domiciliaria del líquido pleural e induce pleurodesis espontánea en una considerable proporción de casos83–86.
Es importante tener en cuenta que la realización de pleurodesis previa no impide la resección quirúrgica en el caso del mesotelioma, independientemente de la técnica que se emplee (NEP o pleurectomía/decorticación)54.
Perspectivas futurasCombinando técnicas de biología molecular y nanotecnología, está emergiendo en los últimos años el concepto de theranostics, que pretende unir diagnóstico y tratamiento en el mismo procedimiento mediante el uso de fármacos dirigidos específicamente a cada fenotipo de neoplasia. Si se consiguiera encontrar los ligandos adecuados se podrían aplicar para el diagnóstico precoz del mesotelioma mediante PET o single photon emission computed tomography (SPECT)87–89. Se han desarrollado ya sondas combinadas con técnicas biofluorescentes altamente sensibles y que son capaces de detectar tumores en modelos animales90,91, y también hay técnicas basadas en anticuerpos marcados o nanopartículas para uso con resonancia magnética nuclear92,93, y todo ello presenta un buen horizonte para su aplicación en humanos en el futuro. Hasta que esto llegue, parece más realista dedicarse a la búsqueda de marcadores detectables en sangre periférica y que posean adecuada sensibilidad y especificidad para el diagnóstico de mesotelioma maligno. Dentro de esta línea, el campo de investigación más prometedor es —junto con las técnicas de imagen— la exhaustiva búsqueda de marcadores precoces de mesotelioma usando técnicas proteómicas, que analizan simultáneamente los perfiles de gran cantidad de proteínas (más de 1.000) y permitirán preparar paneles configurados para conseguir la máxima sensibilidad y especificidad diagnósticas94,95. Como se explicó más arriba, la detección de miRNA en sangre periférica constituye también otro campo emergente para lograr un diagnóstico suficientemente precoz en el mesotelioma.
En muchos casos se ha planteado el uso de terapia génica en el mesotelioma para compensar la escasa eficacia de la inmunoterapia cuando el tumor está localmente muy avanzado. Para ello se acude a diferentes estrategias como el uso de «genes suicidas» (que transfieren al tumor la capacidad de hacerse sensible a determinados fármacos), la administración de genes oncosupresores o la transferencia de genes inmunomoduladores al espacio pleural96–99. Aunque su aplicación clínica ha obtenido hasta ahora resultados bastante desalentadores por problemas relacionados con los vectores usados y su relativa ineficiencia para controlar una gran masa tumoral, es muy probable que la inclusión de la terapia génica en la estrategia multimodal y su combinación con técnicas basadas en nanotecnología contribuyan muy significativamente a mejorar las perspectivas de tratamiento del mesotelioma pleural maligno en el futuro.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.
FinanciaciónParte de la investigación de nuestro grupo mencionada en este artículo ha sido financiada por el Proyecto PI-0358-2010, de la Consejería de Salud de la Junta de Andalucía.