Introducción
Las guías actuales sobre la enfermedad pulmonar obstructiva crónica (EPOC) coinciden en su importante afectación extrapulmonar o sistémica, que se hace más patente en los estadios avanzados de la enfermedad1-3. Este reconocimiento, está basado en múltiples estudios que evidencian la presencia de una disfunción multiorgánica, que conlleva una gran comorbilidad y tiene una gran influencia pronóstica más allá de la propia afectación pulmonar4. En la actualidad, los mecanismos o posibles vías entre la afectación pulmonar y sistémica permanecen en debate. La profundización y un mejor entendimiento de éstos constituyen aspectos prioritarios en las líneas de investigación actuales, ya que podrían suponer un avance y, posiblemente, un cambio radical en el manejo diagnóstico y terapéutico de los pacientes con EPOC5.
La revisión de la afectación sistémica en la EPOC, junto con la actualización de todos los nuevos factores pronósticos que impactan en esta enfermedad, es el objetivo principal de este capítulo.
Aspectos sistémicos
Analizaremos las posibles vías patogénicas, los factores implicados y los órganos, o sistemas, que se engloban dentro de la afectación extrapulmonar de la EPOC. Aunque es posible que esto cambie en un futuro próximo, en la actualidad consideraremos el esquema descrito en la última revisión de la GOLD (tabla I).
Vías patogénicas de inflamación sistémica
En la EPOC "la obstrucción al flujo aéreo está asociada a una respuesta inflamatoria anómala de los pulmones a gases o partículas nocivas", que afectará a las vías aéreas, el parénquima y la vasculatura pulmonar. Habrá un patrón inflamatorio característico en el que intervienen los macrófagos, los neutrófilos y los linfocitos T (CD4+ y CD8+) y B. Estas células son, a su vez, una importante fuente de mediadores inflamatorios6. Además, la inflamación pulmonar es, posteriormente, amplificada por procesos de estrés oxidativo y el aumento de proteasas en el parénquima pulmonar.
La evidencia científica de la presencia de una inflamación crónica sistémica de bajo grado en la EPOC es muy reciente, y se basa en estudios que demuestran unos valores aumentados de estrés oxidativo, de los mediadores y de las células inflamatorias en la circulación periférica. Esto fue consolidado por Gan et al7 en un metaanálisis de los artículos publicados sobre marcadores inflamatorios sistémicos en la EPOC estable (factor de necrosis tumoral alfa [TNF-α], interleucina [IL]-6, IL-8, proteína C-reactiva [PCR], fibrinógeno y leucocitos), que mostró que sus valores séricos estaban aumentados respecto a la población normal.
A pesar de que los consensos actuales aceptan la presencia de inflamación sistémica en los pacientes con EPOC, se conoce muy poco sobre los mecanismos fisiopatológicos subyacentes. La teoría más aceptada sobre la respuesta inflamatoria pulmonar anómala que ocurre en los pacientes con EPOC es la llamada "amplificación de la respuesta fisiológica" que surge frente a estímulos inflamatorios, especialmente el humo del cigarrillo. Por razones aún desconocidas, el equilibrio daño/reparación se torna aberrante, amplificándose y persistiendo a pesar del abandono del hábito tabáquico8. Esto sugiere que el proceso de inflamación crónica que ocurre en la EPOC pudiera estar asociado a un mecanismo de autoperpetuación.
Otra de las teorías que podrían explicar la inflamación sistémica de bajo grado es el fenómeno de "derramamiento" que ocurre sobre la circulación sistémica como consecuencia del intenso proceso inflamatorio que sucede en la vía aérea, el parénquima y la circulación pulmonar de los pacientes con EPOC. Los mediadores inflamatorios y productos del estrés oxidativo, originados en el pulmón son liberados a la circulación sistémica por la circulación pulmonar, y van a activar a los leucocitos de la sangre periférica. Recientemente, Oudijk et al9 demostraron que la expresión de genes que codifican la expresión de IL-1β, MIP-1β, IL-1 receptor 2 y CD83 en los neutrófilos de sangre periférica de pacientes con EPOC se correlacionaba de forma inversa con su grado de obstrucción de la vía aérea. No obstante, otros trabajos, como el de Vernooy et al10, no soportan esta hipótesis ya que ellos no encontraron correlación entre los niveles en esputo y plasmáticos de la IL-8 o de los receptores solubles del TNF-α.
Es importante destacar que los mediadores inflamatorios hallados en la circulación periférica de los pacientes con EPOC pueden originarse en células extrapulmonares (leucocitos circulantes, endotelio o células musculares). Un ejemplo de esto son los trabajos que nos muestran una relación entre los niveles de TNF-α con la hipoxemia, la malnutrición y la pérdida de masa muscular11.
Recientemente, Cosio y Agustí12 formularon la hipótesis de que la respuesta adaptativa inmunológica a epítopos alterados es un componente esencial en el proceso patológico sistémico de la EPOC. El humo de tabaco y la colonización bacteriana crónica se han reconocido como fuente de epítopos y antígenos que causarían la proliferación de células B y T con producción de anticuerpos que mantendrían la inflamación y el proceso autoinmunitario.
Es también lógico plantear que las células circulatorias de individuos predispuestos genéticamente a desarrollar una respuesta inflamatoria amplificada son más susceptibles a los efectos del humo del cigarrillo. La evidencia sugiere que esta respuesta es modulada por la carga genética13. Las alteraciones genéticas más estudiadas y comunes son los polimorfismos de un solo nucléotido (single nucleotide polymorfism, SNP) que pueden causar cambios en la función o producción de la proteína que codifican. Numerosos trabajos, publicados en los últimos años, asocian la presencia de determinados SNP en los genes que codifican los reactantes de fase aguda (PCR, fibrinógeno, etc.) o en los genes inductores de citocinas (miembros de la familia de TNF, IL-6, IL-1) asociados a la presencia de la enfermedad o de sus manifestaciones sistémicas.
Marcadores sistémicos en la EPOC
Proteína C-reactiva. La PCR es una proteína de fase aguda sintetizada en el hígado. En la EPOC estable se han observado concentraciones elevadas de PCR que se correlaciona con el mayor grado de obstrucción de la vía aérea14,15, se eleva durante las exacerbaciones16 y puede disminuir por efecto de los corticoides orales o inhalados17. Además, se ha demostrado que los niveles elevados de PCR se correlacionan positivamente con el grado de disnea, la hipertensión pulmonar e inversamente con la PaO2, la calidad de vida y los aspectos sistémicos de la enfermedad, como son la capacidad de ejercicio y el porcentaje de masa muscular o el índice de masa corporal15,18. Además, datos recientes de cohortes poblacionales demuestran que sus valores predicen la mortalidad global y cardiovascular, fundamentalmente en pacientes con obstrucción leve-moderada al flujo aéreo19. A pesar de las evidencias disponibles para postular a la PCR como un marcador sérico de la inflamación sistémica en la EPOC, se necesitan trabajos adicionales que confirmen esta hipótesis. Por último, datos preliminares sugieren la posibilidad de una influencia genética en los valores de PCR y que uno de los genes candidatos podría ser el de la proteína B del surfactante20.
Familia de los factores de necrosis tumoral
TNF-α. Es producido principalmente por los monocitos y los macrófagos. Los valores elevados de TNF-α se han hallado en biopsias bronquiales, lavado broncoalveolar, esputo inducido y suero periférico de pacientes con EPOC. La relación entre este marcador inflamatorio y los efectos sistémicos de la enfermedad se han demostrado, particularmente, en pacientes con bajo peso, pérdida de masa muscular e hipertensión pulmonar11,18. El TNF-α desempeña un papel fundamental en la activación del factor de transcripción nuclear NF-κB, el cual es el "elemento llave" en la producción de citoquinas inflamatorias. Los SNP del gen promotor del TNF-α más estudiados en pacientes con EPOC han sido el 308G/A y el 238G/A. El primero se ha asociado a la presencia de EPOC en poblaciones asiáticas, sin poder ser replicado en poblaciones europeas. Se desconoce si la presencia de esos SNP se correlacionan con valores más elevados de TNF-α circulante.
TNF-β. La linfotoxina-α (o TNF-β) es una proteína soluble secretada fundamentalmente por los linfocitos activados y se cree que actúa como modulador de la respuesta inmunitaria. Sus concentraciones séricas están elevadas en pacientes con EPOC y bajo peso11. No obstante, diferentes estudios del SNP 252A/G no han observado una asociación con la presencia de EPOC o con la pérdida de función pulmonar.
Receptores solubles de TNF (sTNF-R55 y sTNF-R75). Valores séricos elevados de ambos receptores se encontraron en pacientes con bajo peso, pérdida de masa muscular e intolerancia al ejercicio11. En la actualidad, no existen evidencias de que el SNP del TNF-R55 (36A/G) y del TNF-R75 (587T/G) esté relacionado con la EPOC.
IL-6. Algunos estudios han demostrado que las concentraciones de IL-6 están elevadas en el esputo inducido, el lavado broncoalveolar y en el condensado del aire exhalado de pacientes con EPOC, fundamentalmente, durante las exacerbaciones. Los monocitos de estos pacientes liberan mayor cantidad de IL-6 en respuesta al estímulo con lipopolisacáridos. También sus niveles séricos elevados se asocian al bajo peso, a la pérdida de masa muscular y en respuesta al ejercicio21. Al igual que sucede con los valores de PCR, los valores de IL-6 disminuyen en respuesta a corticoides inhalados o sistémicos. De los SNP más estudiados en relación con el gen promotor de la IL-6 (174G/C, 572G/C, 597G/A), sólo el SNP 174G/C se ha estudiado en pacientes con EPOC, y si no se encontraron asociaciones significativas. Nuestro grupo ha analizado la relación existente entre el SNP 572G/C y el diagnóstico de EPOC en una población canaria de 154 pacientes y 413 controles y ha observado que la presencia del alelo GC se asociaba a la presencia de la enfermedad (datos no publicados).
IL-8. Esta proteína es un importante mediador inflamatorio responsable de la migración y activación pulmonar de los neutrófilos. Su transcripción está regulada, fundamentalmente, por el TNF-α, lo que le proporcionaría un importante papel en los efectos sistémicos de la enfermedad. Hasta el momento se han descrito niveles aumentados de IL-8 especialmente durante las exacerbaciones y en aquellos pacientes con pérdida de peso o masa muscular11. En un estudio reciente, Mahler et al22 demostraron que el tratamiento con anticuerpos anti-IL-8 (ABX-IL-8), durante 6 meses, en un grupo de pacientes con EPOC moderada y severa, era seguro y bien tolerado. Se observó una mejoría de la disnea, pero no se objetivaron cambios significativos en la capacidad de ejercicio, la función pulmonar o el estado de salud. El SNP más estudiado del gen que codifica la IL-8 es el 251T/A, pero, hasta el momento, no se ha encontrado asociación con la presencia de la enfermedad o su progresión.
Afectación cardiovascular
La enfermedad cardiovascular es una de las principales causas de mortalidad en la EPOC, fundamentalmente, en pacientes con enfermedad leve a moderada23. La EPOC aumenta de manera independiente el riesgo de desarrollar enfermedad cardiovascular: arteriosclerosis, ictus, insuficiencia cardíaca (RR = 4,09), arritmias (RR = 2,81) e infarto agudo de miocardio (RR = 1,51)24. Padecer una EPOC aumenta de manera independiente el riesgo de mortalidad cardiovascular entre 3 y 4 veces25. A pesar de la estrecha asociación existente entre estas dos enfermedades (que tienen al hábito tabáquico como factor de riesgo común), no se conoce aún con exactitud los mecanismos patológicos que las relacionan. Algunos estudios apoyan la hipótesis de que la existencia de una inflamación crónica de bajo grado, en los pacientes con EPOC, favorece la formación de placas de ateroma. Moléculas como la PCR podrían estar involucradas en el proceso de amplificación de la respuesta inflamatoria junto con el aumento de la producción de citocinas, la activación del complemento y la captación de moléculas de lipoproteínas de baja densidad (LDL) por los macrófagos creando el nicho para la adhesión de leucocitos al endotelio26.
Músculos periféricos
Existe una importante información sobre anormalidades estructurales, funcionales y metabólicas en los músculos esqueléticos de los pacientes con EPOC27-37. Algunos estudios han descrito una disminución de la fuerza y de la resistencia de los músculos esqueléticos en pacientes con EPOC, siendo los miembros inferiores los más afectados. También se ha descrito que la disminución de la fuerza muscular es proporcional a su masa y se relaciona con el compromiso respiratorio, la capacidad de esfuerzo y la utilización de recursos sanitarios27,28,30.
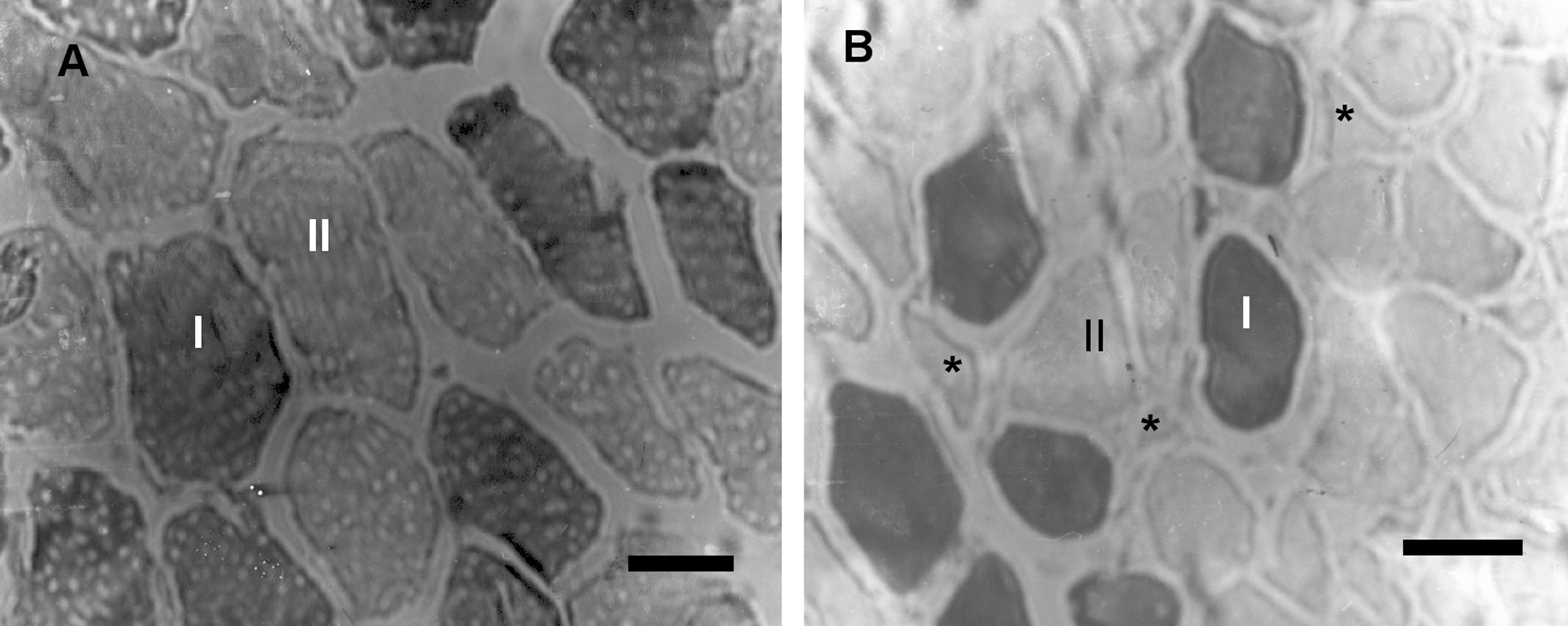
Es probable que la alteración estructural más relevante sea el cambio en la distribución de las fibras33. A diferencia de los sujetos normales, los pacientes con EPOC tienen una mayor proporción de fibras tipo II, principalmente IIb, menor proporción de fibras tipo I, disminución en el área promedio de las fibras, así como del número de capilares34,35. La figura 2 muestra las diferencias estructurales del vasto lateral (músculo cuádriceps) de un paciente con EPOC y un sujeto control.
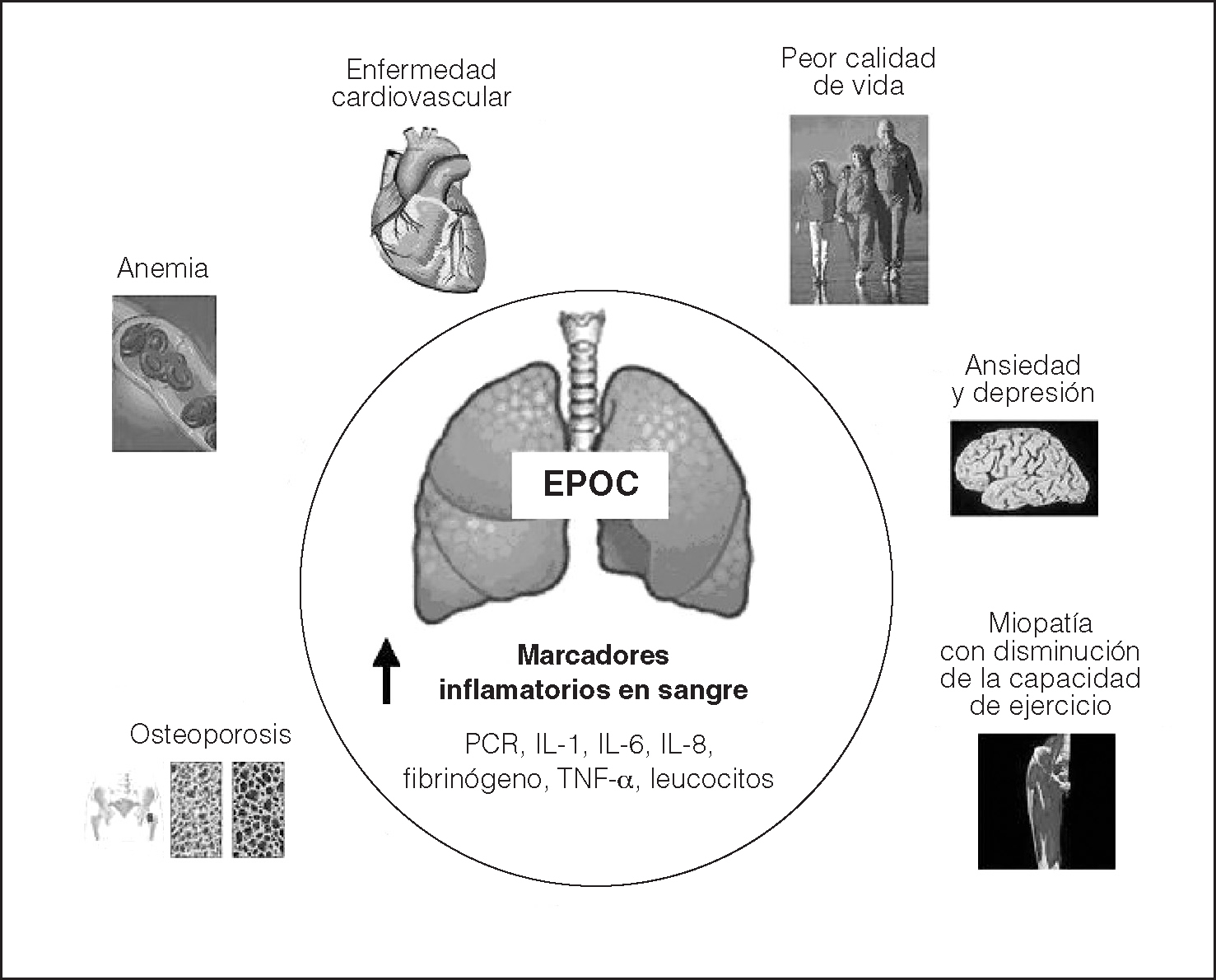
Fig. 1. La figura muestra todos los marcadores inflamatorios que se han descrito elevados en la sangre periférica de pacientes con enfermedad pulmonar obstructiva crónica (EPOC) en fase estable y los efectos sistémicos de la enfermedad conocidos hasta el momento. PCR. proteína C reactiva; IL-1: interleucina 1; IL-6: interleucina 6; IL-8: interleucina 8; TNF-α: factor de necrosis tumoral alfa.
Fig. 2. Alteraciones histoquímicas en el músculo esquelético de pacientes con enfermedad pulmonar obstructiva crónica (EPOC). Secciones transversales del músculo cuádriceps. A: sujeto control. B: paciente con EPOC. Reacción de adenosina trifosfatasa (ATP asa) con pH de preincubación de 4,37. Nótese en el paciente con EPOC la menor proporción de fibras tipo I y mayor proporción de fibras tipo II, respecto al sujeto control. *Atrofia de las fibras tipo IIb; barra: 50 μm.
La actividad de las enzimas oxidativas (citrato sintetasa, β-hidroxy-acil-CoA-deshidrogenasa, etc.) también se encuentra alterada. Los hallazgos sugieren un cambio del metabolismo aeróbico oxidativo hacia el glucolítico anaerobio. Sin embargo, el análisis de la actividad de la enzima glucolítica (LDH) ha mostrado resultados variables36,37. Existen cinco tipos de isoenzimas de LDH y es posible que el total de esta enzima no esté alterado, pero sí el patrón de distribución de las isoenzimas.
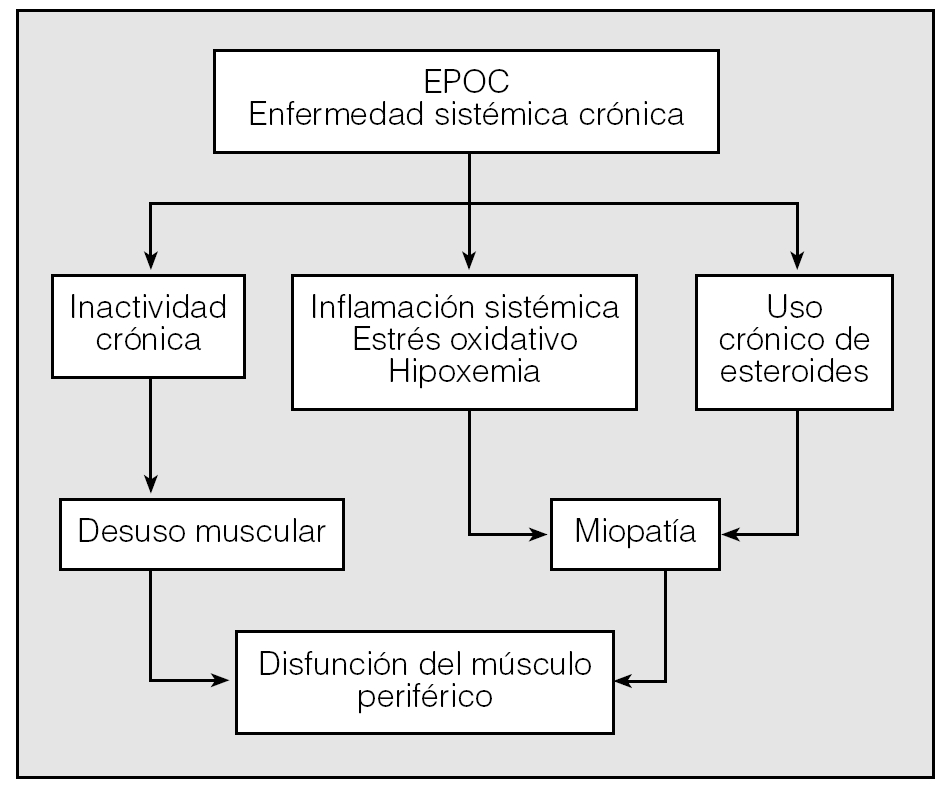
Los datos disponibles indican que las alteraciones de los músculos periféricos en EPOC se deben a un complejo proceso de origen multifactorial, en el que probablemente participan factores como la hipoxia, el desentrenamiento físico, las anormalidades nutricionales, los fármacos y el desarrollo de un proceso inflamatorio sistémico. Con frecuencia los pacientes con EPOC son forzados a vivir un estilo de vida sedentario y entran en un círculo vicioso de inactividad física y desentrenamiento, que puede conducirlos al desarrollo de anormalidades musculares. Los programas de rehabilitación respiratoria mejoran la función muscular, la capacidad oxidativa de los músculos esqueléticos y la tolerancia al ejercicio38,39. Estas observaciones apoyan la importancia etiopatogénica del desentrenamiento; sin embargo, la persistencia de algunas anormalidades tras el entrenamiento físico sugiere la participación de otros mecanismos diferentes del desuso.
En la EPOC se han observado valores elevados de mediadores inflamatorios y es posible que la inflamación sistémica contribuya en la disfunción de los músculos esqueléticos por sus efectos adversos sobre la proteólisis muscular40,41. Las anormalidades nutricionales también se han asociado con el compromiso de la masa muscular y la síntesis de proteínas. Estudios recientes sugieren la presencia de alteraciones en el metabolismo del óxido nítrico (NO) muscular en esta enfermedad42,43. El NO es una molécula que, a concentraciones bajas, participa en la regulación de procesos fisiológicos; sin embargo, a concentraciones elevadas, tiene gran capacidad oxidante y puede producir lesión celular. En la EPOC existen evidencias que sugieren la presencia de un proceso inflamatorio local y estrés oxidativo asociado a las alteraciones de los músculos esqueléticos43. Con la información expuesta, en la actualidad, la etiopatogenia de la disfunción de los músculos esqueléticos en la EPOC ("efecto del desacondicionamiento frente a una verdadera miopatía") permanece en debate (fig. 3) y es posible que tenga un origen multifactorial.
Fig. 3. Factores relacionados con la disfunción de músculos periféricos en la enfermedad pulmonar obstructiva crónica (EPOC).
Muchos factores se han relacionado con la intolerancia al esfuerzo de los pacientes con EPOC. Algunos de ellos destacan la importancia de los componentes centrales (cardiopulmonar), mientras que otros apoyan la participación del componente periférico (músculos esqueléticos). El hecho de que la capacidad de ejercicio tras un trasplante pulmonar no se normalice sería un claro argumento de que no sólo los factores centrales influyen en la tolerancia al esfuerzo.
Con frecuencia, los pacientes con EPOC tienen un compromiso de la calidad de vida relacionada con la salud, incluso en fases relativamente tempranas de la enfermedad. Los factores que determinan este aspecto son menos conocidos, pero existe información que lo relacionan con la proporción de fibras tipo I, la obstrucción del flujo aéreo y el índice de masa corporal (IMC)29.
Anormalidades nutricionales
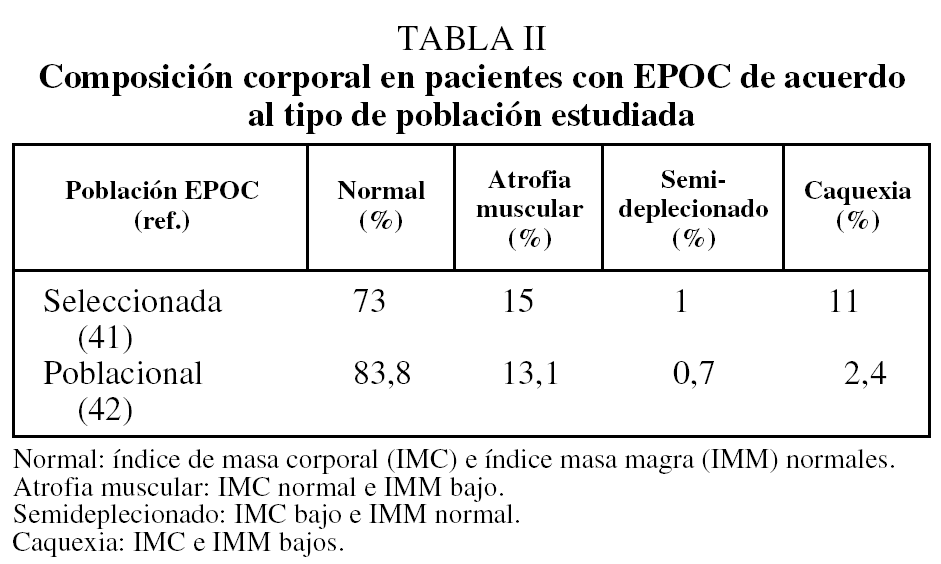
En la EPOC, la depleción nutricional puede empeorar el pronóstico (véase más adelante). Su prevalencia es variable y está relacionada con el método de evaluación nutricional y las características de la población estudiada. Esto queda bien reflejado en la tabla II, donde se aprecian las diferencias en la distribución de la composición corporal descrita en una población seleccionada de pacientes con EPOC44, y la encontrada en un estudio de base poblacional45.
El deterioro nutricional en EPOC está, aparentemente, determinado por las alteraciones en la ingesta calórica, la composición corporal y el incremento del metabolismo basal. Schols et al46 observaron que la pérdida de peso en estos enfermos está principalmente condicionada por la pérdida de masa magra o muscular, y en menor proporción por la disminución de la masa grasa.
Tradicionalmente, se ha indicado que la presencia de síntomas podría afectar a la ingesta dietética en estos pacientes. Sin embargo, en la actualidad, se cree que la disminución de la ingesta calórica no es muy prominente, excepto en los períodos de exacerbación. En contraste, se dispone de evidencias que indican un incremento del metabolismo basal y de los requerimientos metabólicos que, con frecuencia, no se acompañan de un aumento proporcional en la ingesta calórica. Las causas de este aumento son todavía inciertas y se especula con que la presencia de una respuesta inflamatoria sistémica, a través de mediadores como el TNF-α, puede ser uno de los mecanismos principales.
Anemia
Aunque la EPOC se asocia tradicionalmente a policitemia, evidencias recientes, provenientes de estudios en poblaciones seleccionadas, sugieren la presencia de anemia crónica en el 10-15% de los pacientes, en particular en aquellos con enfermedad más grave47-51. No se dispone de datos provenientes de estudios epidemiológicos que informen sobre la prevalencia de este problema en pacientes con EPOC.
Los mecanismos que influyen en el desarrollo de la anemia en la EPOC están pobremente estudiados. Los datos indican una relación con el proceso de inflamación sistémica y la interferencia de ésta a diferentes niveles de la hematopoyesis. Al igual que en otras manifestaciones sistémicas, es probable que en la patogenia de la anemia participen otros factores como la malnutrición, las pérdidas hemáticas de origen digestivo, el tabaquismo y los fármacos.
Tres estudios recientes demuestran la importancia pronóstica de la anemia en la EPOC. En el primero, en un grupo de pacientes que recibían oxigenoterapia ambulatoria el hematocrito fue un factor predictor independiente de supervivencia a los 3 años48. Posteriormente, también en un grupo seleccionado de pacientes con EPOC muy grave y fenotipo enfisematoso como es la amplia cohorte del estudio multicéntrico NETT (National Emphysema Trial Treatment) realizado en EE.UU., se observó que cifras de hemoglobina bajas (< 13,4 g/dl) fueron un factor de predicción independiente y más fuerte que el FEV150. Un tercer y ulterior estudio demuestra que la anemia, en la EPOC, también se asocia a otras consecuencias clínicas, como la disnea y la capacidad de ejercicio. Son necesarios estudios adicionales que permitan aclarar la etiopatogenia de estos hallazgos y los beneficios de una intervención terapéutica dirigida a corregir la anemia51.
Sistema osteomuscular
La osteoporosis es un problema frecuente en pacientes con EPOC. En 62 pacientes con enfermedad severa, Jorgensen et al52 observaron que el 68% de los sujetos tenía osteoporosis u osteopenia. Los resultados de este estudio indican que el uso de corticoides, por sí solo, no pudo explicar la aumentada prevalencia de osteoporosis en este grupo de pacientes.
Existen datos que asocian la pérdida de la densidad mineral con la pérdida de masa magra53 y cabría la posibilidad de especular con la participación de mecanismos comunes en la patogenia de ambos problemas. Es probable que la osteoporosis en estos enfermos sea también de origen multifactorial, a la que contribuirían mecanismos como el desuso, la malnutrición, el uso de corticoides y la inflamación sistémica.
Depresión
La presencia de depresión en los pacientes con EPOC es muy prevalente. Aunque, tradicionalmente, se ha considerado dentro de la comorbilidad asociada a la EPOC, algunos estudios han observado que su presencia se correlaciona con valores elevados de citoquinas proinflamatorias muy relacionadas con la EPOC, como el TNF-α54 y esto ha conducido a que la última revisión del consenso de la GOLD incluya a la depresión dentro de la afectación sistémica de la enfermedad1. Un trabajo reciente en una cohorte amplia de pacientes confirma su elevada prevalencia en los pacientes con EPOC que ingresan en los hospitales por exacerbación. Asimismo, durante los 12 meses de seguimiento tras su alta, los pacientes con síntomas depresivos tenían una menor supervivencia después de ajustar los datos por el FEV1, el tabaquismo, el IMC, la calidad de vida y otros factores de comorbilidad. Además, la depresión se asoció a una mayor estancia hospitalaria, persistencia del hábito tabáquico y deterioro de la calidad de vida estimada por el St. George's Respiratory Questionnaire (SGRQ)55. Este último aspecto deja abiertas algunas dudas sobre la relación entre la calidad de vida y la mortalidad, ya que en los dos principales estudios en que ésta fue analizada la presencia de depresión fue una covariante que no fue controlada en el análisis multivariable. Esto, posiblemente, también sería extensible a los estudios en los que se evaluó el valor pronóstico de la disnea.
Factores pronósticos
El concepto de la EPOC como enfermedad multidimensional se ha basado y a su vez ha favorecido la profusión de múltiples estudios que han demostrado de forma sólida cómo otros factores diferentes del FEV1 ayudan a comprender mejor la evolución de los pacientes con EPOC (tabla III). Algunos de estos factores pronósticos, como la anemia, la depresión y la PCR, se han descrito dentro del apartado de la afectación sistémica.
Volumen de aire espirado en el primer segundo
Es el mejor parámetro estudiado longitudinalmente en la EPOC, lo que ha condicionado su utilización como factor pronóstico de referencia y la clasificación de la enfermedad con sus diferentes rangos de severidad1,3,56. La disminución de la función pulmonar estimada por el FEV1 ha demostrado incrementar la mortalidad en la EPOC de causa respiratoria, cardiovascular y por neoplasia57-59. Esto ha sido observado después de ajustar por el tabaquismo y otros factores relacionados con la mortalidad no respiratoria. En relación con esta última, aunque no están claros los posibles mecanismos, la teoría de la inflamación sistémica es la más aceptada en la actualidad.
Tabaquismo
A pesar de su previsible impacto en la evolución de la enfermedad por su afectación sobre el FEV1, sólo recientemente se ha evidenciado su influencia en la mortalidad de los pacientes con EPOC a través de un ensayo clínico aleatorizado58. En este amplio estudio multicéntrico realizado en Norteamérica, el abandono del hábito tabáquico disminuyó la mortalidad en un 18%; su efecto fue mayor en la mortalidad cardiovascular y en la relacionada con el cáncer.
Índice de masa corporal
Existe una relación inversa, no lineal, entre el IMC y la supervivencia en la EPOC, que tiene un valor umbral, que la mayor parte de los estudios sitúan en 20-21, por debajo del cual la mortalidad aumenta45,60. No obstante, esta disminución severa del peso es muy poco prevalente y la proporción de pacientes afectados sólo supera el 10% en formas avanzadas de la enfermedad y en particular en el sexo femenino45. La pérdida de masa magra también puede ser relevante en pacientes45 con IMC < 25. Aunque el IMC fue uno de los parámetros pioneros que demostró su fortaleza frente al FEV1, los datos actuales de seguimiento longitudinal más prolongado de cohortes amplias y la aparición de nuevos parámetros pronósticos han disminuido su trascendencia como marcador evolutivo de la enfermedad.
Actividad física
Su disminución estimada a través de cuestionarios, aumenta el número de admisiones hospitalarias61 y la mortalidad global y respiratoria62. Con la medición más objetiva de la actividad física mediante acelerómetros se ha observado que está claramente disminuida en los pacientes con EPOC con respecto a la población normal. Esta situación se presenta conforme aumenta la disnea de esfuerzo y aunque, lógicamente, esto ocurre cuando progresa la obstrucción de la vía aérea, guarda una mayor relación con la capacidad de ejercicio63.
Capacidad de ejercicio
Su estimación mediante pruebas de esfuerzo submáximo con la prueba de la marcha de 6 min (PM6M) o tras esfuerzo máximo con la cicloergometría han demostrado ser un fuerte factor de predicción de mortalidad e independiente del FEV164,65. En la PM6M, el parámetro más estudiado es la distancia caminada en metros. Su influencia parece mayor en la EPOC severa. Valores inferiores a 350 m y descensos anuales superiores a 40 m son signos de mal pronóstico64,66. También parece que la desaturación durante la PM6M podría tener influencia pronóstica al igual que en la enfermedad pulmonar intersticial difusa o la hipertensión pulmonar primaria67. En la cicloergometría (de menor uso en la práctica clínica habitual), un VO2 máximo de 654 ml/min puede representar el umbral de riesgo, por debajo del cual se incrementa notablemente la mortalidad65.
Exacerbaciones
Aunque las formas leves pueden disminuir la calidad de vida68, sólo las que por su gravedad necesitan tratamiento hospitalario han demostrado influir en el pronóstico de la enfermedad69. Su impacto es mayor si aumenta la frecuencia de las exacerbaciones (>= 3) o si los pacientes precisaron de ingreso hospitalario69 y/o si además requirieron asistencia ventilatoria no invasiva70 o ingreso en una unidad de cuidados intensivos71.
Presión arterial de O2
El papel pronóstico de la hipoxemia severa no ha sido cuestionado después de los estudios clásicos de oxigenoterapia de la NOTT y la MRC72,73. No obstante, es probable que la cohorte de pacientes incluida en estos estudios no represente la heterogeneidad fenotípica de la EPOC. Niveles de hipoxemia moderada no han demostrado aumentar de mortalidad.
Presión arterial de CO2
La importancia de la hipercapnia como factor pronóstico en la EPOC mostró resultados discordantes en el NOTT (no influyó en la supervivencia) y en el de la MRC (sí influyó en la supervivencia). No obstante, la experiencia más reciente del grupo ANTADIR (Association Nationale pour le Traitment a Domicile de lÍnsuffisance Respiratoire Chronique) parece diferenciar dos situaciones en relación a la PaCO2: a) hipercapnia permisiva (PaCO2 ¾ 55 mmHg), como mecanismo adaptativo de los pacientes con EPOC y perfil de bronquitis crónica; b) hipercapnia progresiva (PaCO2 > 55 mmHg) que se asocia a una situación muy avanzada de la enfermedad con una elevada mortalidad a corto-medio plazo74.
Hiperinsuflación pulmonar
Expresada por la capacidad inspiratoria (CI) corregida por la capacidad pulmonar total (TLC) (CI/TLC) impacta de forma relevante en la mortalidad75. Conceptualmente, el cociente CI/TLC se describió con el término de fracción inspiratoria, ya que representa el volumen de aire inhalado después de una inspiración máxima en relación a la capacidad total de aire que pueden albergar los pulmones. Su expresión de forma más práctica, con el valor umbral del 25%, demostró una enorme capacidad pronóstica, ya que la mortalidad de los pacientes se triplicaba cuando alcanzaban cifras inferiores al mismo. La influencia de la CI/TLC en el pronóstico de los pacientes con EPOC era esperable, dada la buena correlación de la hiperinsuflación pulmonar con otros factores predictores de mortalidad de gran fortaleza como son la disnea y la capacidad de ejercicio76.
Hipertensión pulmonar
Aunque las formas severas son muy infrecuentes77, cifras de presión arterial media superiores a 25 mmHg han demostrado disminuir la supervivencia a largo plazo78.
Disnea
Valorada por la escala de la MRC, ha demostrado su papel como factor de predicción de mortalidad independiente del FEV1. Aunque el estudio fue prospectivo, y con 5 años de seguimiento, el tamaño de la muestra resultó muy pequeño en el subgrupo de mayor severidad de disnea79.
Calidad de vida
Domingo-Salvany et al80 demostraron por primera vez que un incremento de 4 puntos en la escala del SGRQ se asociaba a un aumento del 5% de la mortalidad global y a un 12% de la mortalidad respiratoria. La mortalidad aumentaba cuando la puntuación del SRGQ total era superior a 40. Estos datos fueron corroborados posteriormente por otro estudio prospectivo japonés65, aunque hubo disparidad en el impacto de los cuestionarios genéricos, ya que en este trabajo el CRQ no demostró capacidad pronóstica y el SF-36 sí lo hizo en el grupo español.
Comorbilidad
A pesar de que algún estudio a finales de la década de los años noventa mostraba su importancia81, sólo recientemente se ha reconocido su relevancia en la EPOC1. Algunas comorbilidades, como la cardiovascular y el cáncer broncogénico, son las causas principales de muerte en formas leves y moderadas de la EPOC. No obstante, en la actualidad no existe una definición clara de comorbilidad aunque se acepta la de "una patología diferente de la enfermedad con la que coexiste y que no forma parte de la historia natural de su enfermedad". Aunque algunos estudios evidencian una elevada comorbilidad en la EPOC (que se incrementa en estadios más avanzados), resulta complicado separar cuáles serían las asociadas al tabaquismo y a la edad de otras que pueden estar asociadas a la inflamación sistémica de la enfermedad y que, para algunos autores, formarían parte de la propia EPOC (dentro del concepto de enfermedad multidimensional con afectación sistémica) y que no podríamos considerarlas como comorbilidad asociada1,4.
Índice BODE
Recientemente, se ha publicado un nuevo índice multivariable (BODE) que intenta abarcar las dimensiones pulmonares y sistémicas de la EPOC60. Este nuevo instrumento utiliza variables con un gran poder pronóstico, previamente expuestas, de fácil medición, no invasivas y de bajo coste económico (disnea, FEV1, IMC y la PM6M). Su puntuación oscila entre 0 (mejor valor) y 10 (peor valor, mayor gravedad de la EPOC). El índice BODE demostró ser superior al FEV1 como factor predictor de mortalidad global y respiratoria. El incremento en una unidad de su puntuación aumentaba ambos tipos de mortalidad en un 34 y un 62%, respectivamente. Su superioridad respecto al FEV1 se refuerza en pacientes con obstrucción muy severa, donde el componente sistémico se hace más patente y otras variables que componen el índice, como la PM6M, pueden reflejar mejor este problema y adquieren una mayor relevancia pronóstica. El índice BODE también ha demostrado que puede capturar las diferencias de las dimensiones de la enfermedad asociadas al sexo82 y el impacto que las exacerbaciones producen en la evolución de la EPOC83. Además, se ha observado que este índice es sensible a modificarse por intervenciones terapéuticas como la rehabilitación pulmonar con trascendencia pronóstica84. Estas buenas expectativas del índice BODE se han confirmado por otros grupos científicos en la predicción de exacerbaciones y en la selección de pacientes para la cirugía de reducción de volumen pulmonar85 y el trasplante pulmonar. En este último grupo, se ha consolidado en las guías internacionales como el factor más importante en la selección de los pacientes que serán referidos a un centro trasplantador (índice BODE > 5) y para la decisión de efectuar el trasplante (índice BODE 7-10)86.
Correspondencia: Dr. C. Casanova Macario.
Servicio de Neumología. Unidad de Investigación.
Hospital Universitario de la Candelaria.
Carretera del Rosario, s/n. 38010 Santa Cruz de Tenerife. España.
Correo electrónico: ccasanova@canarias.org