El incremento de unidades altamente especializadas, así como la creciente implementación de programas de screening de cáncer de pulmón, los cuales han demostrado una reducción de la mortalidad de al menos un 20%1, han causado un aumento en la detección de nódulos pulmonares (NP) infracentimétricos y/o subsólidos. En muchas ocasiones pueden llegar a suponer un reto, requiriendo un abordaje multidisciplinar.
La rentabilidad diagnóstica de la punción transtorácica en nódulos periféricos <20mm es del 70%, con una incidencia de neumotórax del 9,6%2, así que la resección quirúrgica puede ser necesaria, ya sea para diagnóstico o para el tratamiento. La detección intraoperatoria de este tipo de nódulos mediante palpación digital puede resultar dificultosa mediante cirugía mínimamente invasiva y, en ocasiones, requiere la realización de una reconversión a cirugía abierta para explorar mejor el parénquima. Existen algoritmos para definir los casos que se beneficiarían de un marcaje, como el de Tamura3; la indicación debería venir dada por el equipo quirúrgico y su experiencia, así como del medio en el que se encuentre. Existen diferentes técnicas prequirúrgicas para localizar los NP: el uso de arpones, la aplicación de coils, la inyección de diferentes substancias como el lipidiol, el bario, cianoacrilato o el azul de metileno o la ecografía.
Ante la necesidad cada vez más frecuente de la localización de NP, se han desarrollado nuevas técnicas y se han sofisticado las ya existentes. Ante las numerosas técnicas disponibles, se pretende realizar una revisión de las últimas desarrolladas.
Cirugía radio guiada: macroagregados de albúmina marcados con tecnecio99 (MAATC99) mediante el uso de gamma-sonda portátil (GSP)
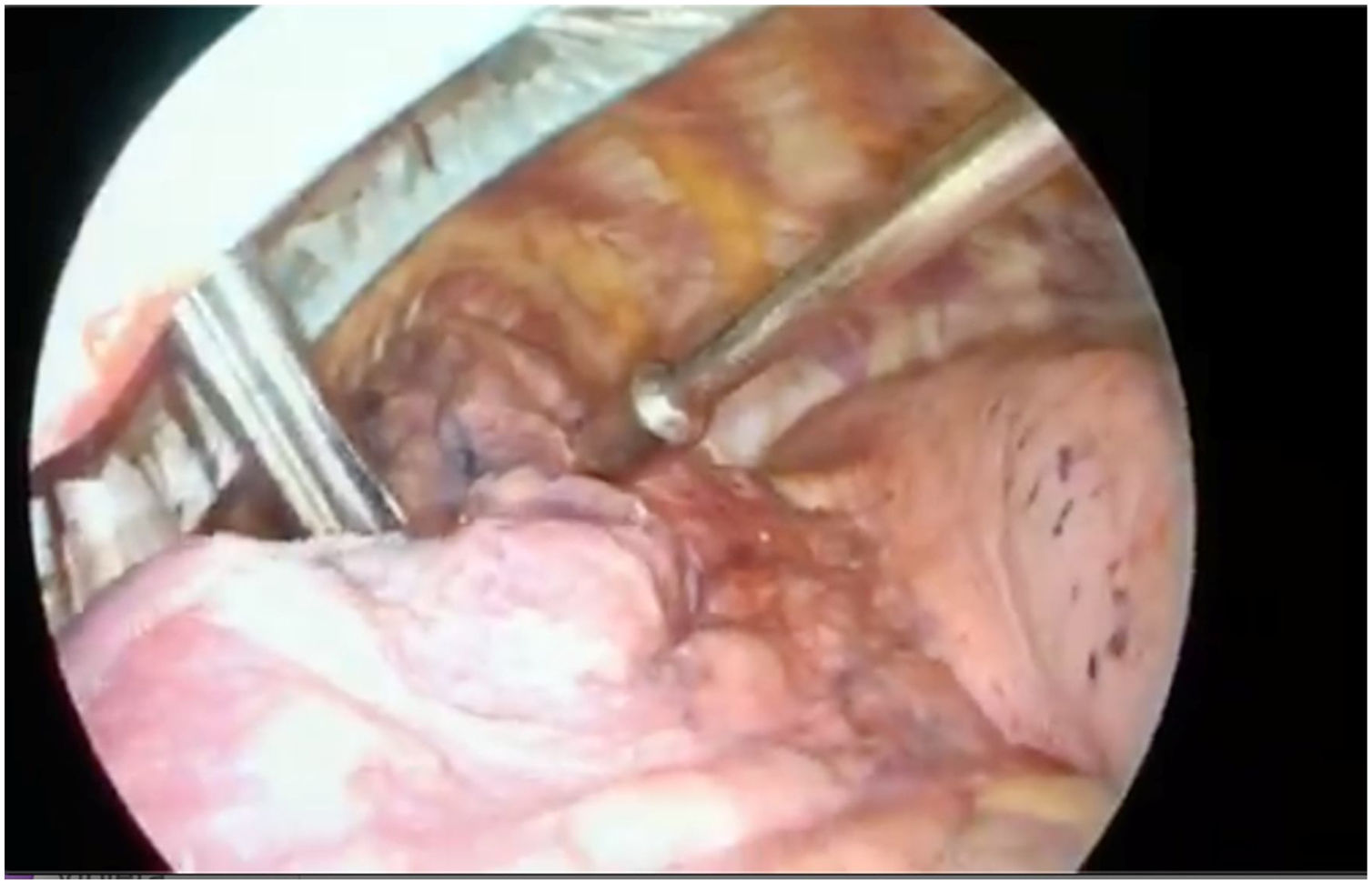
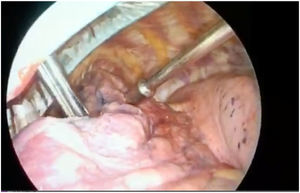
Chella et al.4 describieron en el año 2000 la detección de NP mediante la inyección de microesferas de albúmina marcadas con TC99 y su posterior localización intraoperatoria mediante una gammasonda. Describe una eficacia del 100%. Daniel et al.5 estudiaron distintos radiotrazadores, demostrando que MAATC99 eran los que presentaban una mayor persistencia y una menor difusión intraparenquimatosa debido al mayor tamaño de molécula. En el 2019, Galetta et al.6 presentaron sus 10 años de experiencia. Las complicaciones descritas fueron neumotórax asintomáticos (13,4%), hemorragias intraparenquimatosas (13,7%), en tres pacientes no localizaron el NP y en dos tuvieron reacciones alérgicas.(fig. 1)
Vollmer et al.7 adaptaron la técnica de Galetta y de la cirugía de adenomas paratiroideos, cáncer de mama y la biopsia de ganglio centinela. Incorporaron una gamma-cámara portátil (GCP) en el quirófano para comprobar los márgenes de resección, si bien la muestra debe ser analizada anatomopatológicamente. Esta técnica les ha permitido localizar el 100% de los 38 nódulos marcados. El uso de la GCP para la valoración de los márgenes aporta un elevado valor predictivo negativo.
El marcaje con radiotrazador es una técnica segura y fiable. Se ha demostrado superior a otras como el arpón o la ecografía8. Presenta un escaso porcentaje de fracasos: Galetta describe únicamente tres casos de los 262 que analiza, aún y así, la introducción que realiza Vollmer con la GCP, garantiza el éxito de la prueba siempre que el marcador esté ubicado en el nódulo o caudal al mismo.
Uso de la tecnología de imágenes de fluorescencia (FIT) y verde de indocianina (ICG).
La inyección de substancias colorantes para la detección de NP está ampliamente descrita y utilizada, si bien está limitada por la difusión y la visualización intraoperatoria.
La FIT se basa en la utilización de contrastes que emiten fluorescencia en combinación con un sistema de imágenes. El colorante fluorescente se acumulará selectivamente en los tejidos y se detectará con un sistema de imagen específico.
El ICG es una molécula que emite una longitud de onda de entre 805-830nm. Se une a las proteínas plasmáticas. Es una sustancia segura con una incidencia de toxicidad y reacciones alérgicas muy bajas (0,01%)9.
La localización se puede llevar a cabo de diferentes maneras: mediante la inyección endovenosa, punción transtorácica guiada por TC o mediante broncoscopia guiada por navegación electromagnética (FBC-EBN).
En 2015, Anayama et al. demostraron que era posible el marcaje de ICG mediante FBC-EBN en un modelo porcino10. El procedimiento se basa en la localización de la lesión por parte del software mediante un TC, previo o el mismo día de la cirugía. Si bien no existe consenso al momento en el que se debe realizar el TC para la reconstrucción, esta es más fiable cuanto más próximo sea el TC a la cirugía. El paciente se sitúa en decúbito supino encima de una mesa electromagnética. Se realiza una FBC guiada virtual en tiempo real reconstruida por el sistema. Se introducen las coordenadas donde se encuentre el NP y el broncoscopio se dirige allí para marcarlo. Se inyectan 0,5mL de ICG seguidos de 0,5mL de suero estéril para limpiar el canal de trabajo. Para localizarlo se necesita una cámara con detección de infrarrojos cercanos11.
Okusanya et al.12 realizaron el marcaje de NP con ICG mediante punción transtorácica guiada por TC y posterior resección, demostrando sus ventajas como la rapidez en el marcaje, la alta sensibilidad y su seguridad. Si bien Yang et al.13 publicaron una mayor tasa de complicaciones relacionadas con el procedimiento, como neumotórax (0 vs. 16,7%, p=0,029) o hemorragia intrapulmonar focal (3,3 vs, 26,7%, p=0,008), cuando comparan la aplicación mediante FBC-EBN y transtorácico, con dos cohortes ajustadas mediante un puntaje por propensión.
Una variante del uso del FBC-EBN es su aplicación como guía para la punción transtorácica. Este nuevo abordaje utiliza un sensor de seguimiento electromagnético intraoperatorio para la localización percutánea. La navegación electromagnética permite el seguimiento en tiempo real de la punción al detectar el estilete de la aguja gracias a la punta electromagnética. Se realiza un TC torácico preoperatorio con cortes en inspiración y espiración. Se prevé el punto de entrada gracias a un software de planificación. Se sitúa la aguja en el punto de entrada y la trayectoria hasta el nódulo es guiada por el sistema de navegación. Una vez situado en el nódulo se inyecta el material previsto, ya sea un arpón, una semilla o una tinta. Hung14 demostró que no existían diferencias si se comparaba con la punción transtorácica guiada por TC en cuanto a efectividad o complicaciones, si bien era más rápida la punción guiada por TC.
La inyección ICG es una técnica útil para la localización de nódulos pulmonares. Uno de los contras que existen es la difusión parenquimatosa con la manipulación del pulmón durante la cirugía. La técnica utilizada para su aplicación se debería ajustar a la idiosincrasia de cada centro, a pesar de que parece que el uso del FBC-EBN se asocia con una menor tasas de complicaciones. El uso de la guía electromagnética para la punción, puede ser una opción ante radiólogos poco experimentados en punciones transtorácicas, dado que se ha visto que, por el momento, no aporta ventajas respecto a la técnica clásica.
Virtual-Assisted Lung Mapping (VAL-MAP).
VAL-MAP es una técnica de marcaje pulmonar que utiliza diferentes marcas pulmonares realizadas mediante FBC. Muestra un área pulmonar a resecar marcando la superficie pleural con tintes o mediante la inserción de microcoils gracias a un TC tridimensional. Esta información no sólo ayuda a la resección del nódulo, sino que facilita un margen amplio oncológicamente correcto.15
Sato et al.16 analizaron los resultados del VAL-MAP. Demostraron que es una técnica segura, con un 0,8% de complicaciones, 3,6% neumotórax, 1,2% neumomediastino y 1,2% de hemorragia alveolar. La resección fue exitosa en el 99% de los casos. Los autores describen que una de las limitaciones es mantener márgenes seguros en los nódulos de localización profunda.
Ueda et al.17 realizaron una pequeña variante de la técnica, inyectando microcoils en VAL-MAP en vez de tintes, así la resección de nódulos profundos se realizaría de forma más segura manteniendo unos márgenes apropiados. Los resultados del estudio VAL-MAP 2.0 están pendientes de publicación.
ConclusionesExiste un gran número de técnicas que nos facilitan la localización y resección mediante técnicas mínimamente invasivas. La evolución de estas técnicas, como ha sido la introducción de la GCP en el marcaje con radioisótopos o el uso de la FBC-EBN para la inyección de substancias como el ICG, nos dirige a crear nuevos métodos menos invasivos, más seguros y fiables, gracias en muchos casos a la reconstrucción tridimensional, como el caso del VAP-MAP.