La hiperreactividad bronquial (HRB) es un hallazgo común en la fibrosis quística (FQ), que no se ha relacionado de forma concluyente con la atopia. El objetivo del estudio ha sido investigar la relación existente entre la colonización-infección crónica por Pseudomonas aeruginosa y la HRB en un grupo de pacientes con FQ.
Pacientes y métodosSe realizó la prueba de broncoprovocación inespecífica con histamina a un grupo de 32 pacientes con FQ cuya edad media ± desviación estándar era de 11,25±3,7 años. Además se investigó en estos pacientes la existencia de atopia y colonización-infección crónica por P. aeruginosa.
ResultadosDe los 32 pacientes estudiados, se encontró HRB en 9 (28,1%), cuya situación clínica era significativamente peor. Estos 9 pacientes con HRB presentaron todos colonización-infección crónica por P. aeruginosa. Tenían atopia 17 pacientes (53,1%) de la muestra estudiada, pero sólo 3 (33,3%) de los 9 con HRB. La HRB se asoció significativamente con la colonización-infección crónica por P. aeruginosa (p<0,001), pero no con la atopia (p=0,12). Entre los pacientes sin atopia, la colonización se asoció significativamente con HRB (p=0,017). Además, en el grupo de pacientes con función pulmonar normal (volumen espiratorio forzado en el primer segundo > 80%) esta asociación fue también significativa (p=0,044), mientras que la asociación entre HRB y atopia no lo fue (p=0,11).
ConclusionesLOS resultados del presente estudio indican que en pacientes con FQ la HRB podría estar relacionada con la colonización-infección crónica por P. aeruginosa, que podría ser un factor de riesgo de HRB más importante que la atopia.
In patients with cystic fibrosis, bronchial hyperreactivity is a common finding that has not been conclusively associated with atopy. The objective of the present study was to determine the relationship between chronic colonization or infection with Pseudomonas aeruginosa and bronchial hyperreactivity in a group of patients with cystic fibrosis.
Patients and methodsA nonspecific histamine bronchial provocation test was administered to a group of 32 cystic fibrosis patients with a mean (SD) age of 11.25 (3.7) years. The presence of atopy and of chronic colonization or infection with P aeruginosa was also studied.
ResultsNine of the 32 patients (28.1%) studied showed bronchial hyperreactivity. The clinical status of these 9 patients was significantly worse and all were colonized or infected with P aeruginosa. Atopy was present in 17 of the 32 patients (53.1%) in the study group, but in only 3 of the 9 patients (33.3%) with bronchial hyperreactivity. Bronchial hyperreactivity was significantly associated with colonization or infection with P aeruginosa (P<.001), but not with atopy (P=.12). In the patients without atopy, colonization was significantly associated with bronchial hyperreactivity (P=.017). In the group with normal lung function (forced expiratory volume in 1 second >80%) this association was also significant (P=.044), while the association between bronchial hyperreactivity and atopy was not (P=.11).
ConclusionsThe results of the present study suggest that in patients with cystic fibrosis, bronchial hyperreactivity may be associated with colonization or infection with P aeruginosa, and that this may be a more important risk factor for bronchial hyperreactivity than atopy.
La obstrucción bronquial es una alteración fundamental en la fisiopatología de la fibrosis quística (FQ)1, y la presencia de sibilancias es uno de los hallazgos más constantes en la auscultación en estos pacientes2, que además presentan con frecuencia una respuesta positiva a fármacos broncodilatadores3. Como se recoge en el Registro Europeo de FQ, un elevado número de pacientes tiene síntomas relacionados con el asma, que son mayores cuanto peor es la función pulmonar2,4. La dificultad radica en determinar si estos síntomas se deben a la coexistencia de asma o si, por el contrario, están ocasionados por la propia enfermedad5.
La hiperreactividad bronquial (HRB), relacionada con la inflamación crónica de la vía aérea y la existencia de alergia, es un hallazgo típico del asma. Ambos factores se encuentran también en los pacientes con FQ. En la fisiopatología de la FQ desempeña un papel importante el binomio inflamación-infección1,6. Estudios recientes indican que la interacción entre infección e inflamación se produce en etapas tempranas de la vida; ambas están relacionadas entre sí y presentes en muchos pacientes en el primer año de vida7,8. Hay una relación directa entre el grado de infección y la intensidad del proceso inflamatorio9. A pesar de las similitudes entre la inflamación de la FQ y el asma, hay también ciertas diferencias: el óxido nítrico exhalado se encuentra elevado en el asma, pero no en la FQ10. Además, los perfiles celulares obtenidos mediante lavado broncoalveolar son diferentes en ambas enfermedades: los linfocitos y eosinófilos están elevados en el asma, mientras que neutrófilos y macrófagos se encuentran más típicamente en la FQ11. Sin embargo, estas últimas células también están elevadas en el asma grave12. Por otra parte, se ha demostrado un predominio de linfocitos T helper-2 en sangre de pacientes colonizados por Pseudomonas aeruginosa13.
Se ha investigado ampliamente la presencia de HRB en la FQ. Su prevalencia oscila entre el 24 y el 100% dependiendo del método y el criterio de positividad utilizados para la prueba14. Sin embargo, está aún por establecer cuál es la relación exacta entre la colonizacióninfección bacteriana y la HRB. El objetivo del presente estudio ha sido analizar la relación entre la HRB y la colonización-infección bacteriana en una población de pacientes con FQ.
Pacientes y métodosEl estudio incluyó a 32 pacientes (19 varones) de entre 6 y 19 años —edad media ± desviación estándar: 11,25 ± 3,7 años—, diagnosticados de FQ (prueba del sudor > 60mmol/l) y con volumen espiratorio forzado en el primer segundo (FEV1) superior al 25% del teórico. Todos eran capaces de realizar una técnica espirométrica correcta, no habían presentado ninguna exacerbación clínica en los últimos 3 meses ni infección respiratoria de las vías altas en las últimas 4 semanas, no presentaban aspergilosis broncopulmonar alérgica y no tomaban fármacos ni sustancias que pudiesen alterar las pruebas de función pulmonar. A todos se les realizó una prueba de broncoprovocación inespecífica administrando histamina a concentraciones crecientes según el método de Cockcroft et al15 y utilizando el dosímetro Mefar-B3 (Mefar SRL, Bovezzo, Italia). La función pulmonar se midió con un espirómetro Datospir-92 (Sibel SA, Barcelona, España) con especificaciones de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR). La prueba de HRB se consideró positiva si hubo una caída del FEV1 de como mínimo el 20% con una concentración de histamina de 8mg/dl o inferior.
Además de las variables espirométricas —capacidad vital forzada (FVC), FEV1, FEV1/FVC, flujo mesoespiratorio forzado, pico de flujo espiratorio—, en la valoración general de cada paciente se incluyeron: escalas de Chrispin-Norman y Shwachman, existencia de mutación F508del e índice de masa corporal, calculado como puntuación z respecto a estándares de la población española. La atopia se determinó mediante la prueba de punción, en la que se utilizaron los siguien tes alérgenos: Dermatophagoides pteronyssinus, Dermatophagoides farinae, epitelios, hongos (Alternaría y Aspergillus), pólenes —árboles (Betula, Alnus y Corylus), hierbas (Dactylis, Lolium, Festuca, Poa, Phleum, avena y olivo)—, olivo y parietaria. La prueba se consideró positiva cuando se halló alguna pápula con diámetro máximo de al menos 3mm, una vez restado el valor negativo. Se interpretó que un paciente estaba colonizado-infectado crónicamente por P. aeruginosa cuando se detectó esta bacteria en al menos 3 cultivos de esputo, separados por un mes, en los últimos 6 meses16, pero no se cuantificó la colonización-infección por P. aeruginosa.
Análisis estadísticoUna vez comprobada la normalidad de las variables continuas, se usó la prueba paramétrica de la t de Student para contrastar las diferencias de medias entre los niños con y sin HRB para cada una de dichas variables. Para contrastar la asociación existente entre las variables dicotómicas de interés y la variable HRB se aplicó la prueba exacta de Fisher, ya que no era posible usar el test de la χ2 porque se incumplía que el 80% de las celdas tuvieran un valor esperado por encima de 5. No fue posible realizar una regresión logística dado que todos los pacientes con HRB estaban colonizados-infectados por P. aeruginosa. Por lo tanto, la HRB positiva predice perfectamente la colonización y no es posible construir el modelo de regresión. Para poder excluir los efectos de un mayor tiempo de evolución de la enfermedad y, en consecuencia, una peor función pulmonar, la asociación de atopia y colonización-infección con la HRB se analizó también en el subgrupo de pacientes con función pulmonar normal (FEV1 ≥ 80%). La asociación de colonización-infección e HRB se calculó además en los pacientes no atópicos. Todos estos cálculos se realizaron con el paquete estadístico SPSS versión 13.0 (SPSS Inc., Chicago, IL, EE.UU.).
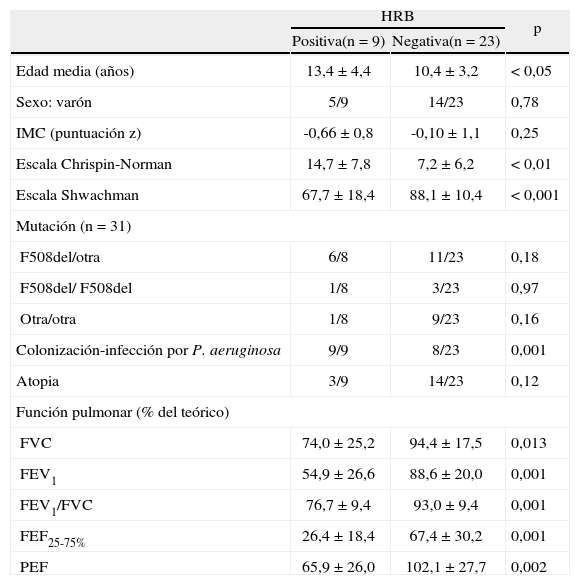
ResultadosLas características generales de los pacientes se muestran en la tabla I. De los 32 estudiados, sólo en 9 (28,1%) la prueba de HRB fue positiva. Los pacientes con HRB tenían significativamente peores escalas clínicas y radiológicas, así como una menor función pulmonar (tabla II).
Características generales de los pacientes incluidos en el estudio (n = 32)
| Edad media (años) | 11,25 ±3,7 |
| Sexo: varón/mujer | 19/13 |
| IMC (puntuación z) | -0,21 ± 1,1 |
| Escala Chrispin-Norman | 9,31 ± 1,31 |
| Escala Shwachman | 82,34 ±15,8 |
| Mutaciones (n = 31) | |
| F508del/otra | 17/31 |
| F508del/F508del | 4/31 |
| Otra/otra | 10/31 |
| Atopia | 17/32 |
| Colonización-infección por P. aeruginosa | 17/32 |
| Función pulmonar (% del teórico) | |
| FVC | 88,69 ±21,7 |
| FEV1 | 79,13 ±26,6 |
| FEV1/FVC | 88,44 ±11,9 |
| FEF25-75% | 55,88 ± 32,9 |
| PEF | 91,94 ±31,5 |
| HRB positiva | 9/32 |
Las variables numéricas se expresan como media ± desviación estándar. FEF25-75%: flujo mesoespiratorio forzado; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; HRB: hiperreactividad bronquial; IMC: índice de masa corporal; PEF: pico de flujo espiratorio.
Características de los pacientes según la hiperreactividad bronquial (HRB)
| HRB | p | ||
| Positiva(n = 9) | Negativa(n = 23) | ||
| Edad media (años) | 13,4 ±4,4 | 10,4 ±3,2 | < 0,05 |
| Sexo: varón | 5/9 | 14/23 | 0,78 |
| IMC (puntuación z) | -0,66 ± 0,8 | -0,10 ±1,1 | 0,25 |
| Escala Chrispin-Norman | 14,7 ±7,8 | 7,2 ± 6,2 | < 0,01 |
| Escala Shwachman | 67,7 ±18,4 | 88,1 ± 10,4 | < 0,001 |
| Mutación (n = 31) | |||
| F508del/otra | 6/8 | 11/23 | 0,18 |
| F508del/ F508del | 1/8 | 3/23 | 0,97 |
| Otra/otra | 1/8 | 9/23 | 0,16 |
| Colonización-infección por P. aeruginosa | 9/9 | 8/23 | 0,001 |
| Atopia | 3/9 | 14/23 | 0,12 |
| Función pulmonar (% del teórico) | |||
| FVC | 74,0 ±25,2 | 94,4 ± 17,5 | 0,013 |
| FEV1 | 54,9 ± 26,6 | 88,6 ± 20,0 | 0,001 |
| FEV1/FVC | 76,7 ± 9,4 | 93,0 ±9,4 | 0,001 |
| FEF25-75% | 26,4 ±18,4 | 67,4 ± 30,2 | 0,001 |
| PEF | 65,9 ± 26,0 | 102,1 ± 27,7 | 0,002 |
Las variables numéricas se expresan como media ± desviación estándar. FEF25-75%: flujo mesoespiratorio forzado; FEV1 volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; HRB: hiperreactividad bronquial; IMC: índice de masa corporal; PEF: pico de flujo espiratorio.
La totalidad de los pacientes con HRB presentaba colonización-infección crónica por P. aeruginosa. Sin embargo, la prevalencia de atopia entre los pacientes con HRB sólo fue del 33%. Encontramos una asociación estadísticamente significativa entre la HRB y la colonización-infección crónica (p < 0,001), mientras que la asociación entre HRB y atopia no alcanzó la significación estadística (tabla II).
Entre los pacientes con función pulmonar normal (n = 17), definida como un FEV1 igual o mayor del 80%, la HRB se asoció de nuevo a colonización-infección crónica (p = 0,044), pero no con atopia (p = 0,11). En el grupo de pacientes no atópicos se mantenía la asociación entre HRB y colonización-infección crónica (p = 0,017). En este caso hubo además una asociación entre tener una función pulmonar normal y tener una prueba de HRB negativa (tablas III y IV).
Los resultados del presente estudio indican que la colonización-infección crónica por P. aeruginosa es, con independencia de la atopia y probablemente del deterioro pulmonar, un factor de riesgo en sí mismo para la HRB medida mediante prueba de broncoprovocación inespecífica con histamina. La prevalencia de HRB entre los pacientes incluidos fue relativamente baja (28,1%) y comparable a las encontradas por Mellis y Levison17 (24%) y Tobin et al18 (35%), que figuran entre las menores publicadas. La baja prevalencia hallada en el presente estudio podría deberse, de hecho, a que en la FQ la respuesta a la histamina es peor que la mostrada para otras sustancias como la metacolina19.
En el presente estudio los pacientes con HRB tenían peores escalas clínicas y radiológicas y menor función pulmonar que aquéllos sin HRB19-22. De acuerdo con Mellis y Levison17, y probablemente como un efecto del tiempo de evolución de la enfermedad, los pacientes con HRB tienen más edad de forma estadísticamente significativa.
La HRB es un hallazgo típico pero no exclusivo del asma. Debido a la elevada prevalencia de esta enfermedad, es bastante probable que pudieran coexistir FQ y asma en un mismo individuo5. Sin embargo, se ha visto que la HRB inespecífica en pacientes con FQ difiere de la existente en pacientes asmáticos. Por un lado, la dosis de histamina necesaria para causar un descenso del 20% del FEV1 es mayor que en el asma y los pacientes asmáticos responden mejor a broncodilatadores que los pacientes con FQ. Por otra parte, el ejercicio y el suero salino hipertónico pueden provocar una respuesta broncodilatadora en pacientes con FQ debido a la movilización de moco y/o a la inestabilidad de la pared bronquial23-25.
La atopia es el factor de riesgo más importante para el desarrollo de asma en la infancia y además es frecuente entre la población general. En los pacientes del presente estudio encontramos atopia en un 53,1%, prevalencia más elevada que la hallada en nuestra población general de la misma edad (37%)26. En otras publicaciones ya se ha recogido la existencia de una prevalencia de atopia mayor entre los pacientes con FQ que en la población general19,27. En nuestro estudio no encontramos que la atopia sea un factor de riesgo significativo para la HRB, al igual que algunos trabajos previos18,19,21. En cambio, otros estudios sí encuentran una relación muy significativa entre atopia e HRB en pacientes con FQ20,22.
Aparte de la coexistencia de atopia y/o asma, la presencia de HRB en los pacientes con FQ podría estar relacionada con el tipo de mutación genética que causa la enfermedad. Esta relación no se ha estudiado en profundidad, pero algunos estudios apuntan la posible asociación de asma en pacientes heterocigóticos para F508del28 y también en sujetos con mutaciones de aminoácido (missense) en el gen de la FQ29. Nosotros clasificamos a nuestros pacientes en 3 grupos según la ausencia de F508del, su presencia en homocigosis o en heterocigosis, sin que encontráramos asociación entre estos grupos y la existencia de HRB.
En el presente estudio todos los pacientes con HRB estaban colonizados-infectados por P. aeruginosa, incluso aquéllos con función pulmonar normal (tabla III). No se sabe si en los pacientes con FQ la inflamación es anterior a la infección o viceversa, aunque sí sabemos que está ya presente en el primer año de vida7. Por razones aún no del todo entendidas, P. aeruginosa infecta crónicamente el pulmón de los pacientes con FQ y ocasiona una inflamación neutrofílica permanente en la vía aérea30. La existencia de este tipo de inflamación, que no requiere la existencia de infección concomitante, se encuentra en niños pequeños con sibilancias31. Por otra parte, el asma "neutrofílica" es un tipo de asma bien definida en el adulto que se relaciona con una mayor gravedad de la enfermedad32. La vía por la cual los neutrófilos contribuyen a los síntomas de asma no está del todo establecida, pero se ha demostrado que estas células son capaces de producir concentraciones significativas de leucotrienos (LT) C4, transfiriendo el LTA4 inestable a células que contienen LTC4 sintetasa (como las células endoteliales) por medio de un proceso llamado "síntesis transcelular de LT cisteinílicos"33. Por otra parte, el proceso de inflamación crónica de la vía aérea produce un tipo de remodelación caracterizada por hiperplasia sin hipertrofia del músculo liso bronquial34. El incremento del número de células del músculo liso puede ser una explicación adicional para la existencia de HRB en la FQ. Además, debería investigarse cómo la colonización-infección crónica por P. aeruginosa puede afectar al correcto funcionamiento de los receptores muscarínicos, especialmente los receptores M2, que son importantes para el control de la HRB35.
El presente estudio tiene 2 limitaciones principales, ambas relacionadas con la imposibilidad de aplicar un modelo de regresión logística a los datos. En primer lugar, el número de pacientes es demasiado reducido para construir un modelo lo suficientemente potente en el que la HRB fuese la variable dependiente, y la atopia, la colonización-infección, la edad y la función pulmonar, las variables independientes. En segundo lugar, todos los niños con HRB estaban colonizados-infectados, lo que no nos ha permitido utilizar este factor como variable independiente. Sin embargo, la colonización-infección crónica se asocia significativamente con la HRB en el subgrupo de pacientes sin atopia y en el subgrupo de pacientes con función pulmonar normal. Esto indicaría que la asociación entre HRB y colonización es independiente de la atopia y probablemente de la función pulmonar, aunque se desconoce la secuencia de ambos eventos.
En resumen, los resultados del presente estudio indican que en los pacientes con FQ la HRB podría estar relacionada con la colonización-infección crónica por P aeruginosa, que sería un factor de riesgo más importante que la atopia.