En 2008, la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) publicó las primeras normativas del mundo sobre el diagnóstico y tratamiento de las bronquiectasias. Tras casi una década, muchos han sido los avances científicos en esta enfermedad, tanto en sus aspectos terapéuticos como en su valoración y diagnóstico. Por ello estas nuevas normativas sobre el tratamiento de las bronquiectasias en el adulto tratan de ofrecer al lector una actualización del conocimiento científico sobre las posibilidades terapéuticas en bronquiectasias, basándose en un estricto procedimiento metodológico que asegura la calidad del contenido de la misma, y en una amplia cantidad de información online que incluye abundante bibliografía. En estas normativas se ha enfocado el tratamiento de las bronquiectasias desde un punto de vista tanto multidisciplinar, que implica las especialidades y escalones asistenciales involucrados, como multidimensional que incluye todos y cada uno de los aspectos que definen a la enfermedad. Así, se establecen recomendaciones basadas en una exhaustiva revisión de la evidencia sobre los tratamientos de la etiología, de la infección bronquial en sus diferentes formas de presentación y con las diferentes terapias existentes, de la inflamación bronquial y de la obstrucción al flujo aéreo. Se revisan los aspectos nutricionales, el manejo de las secreciones, el entrenamiento muscular, el manejo de las complicaciones y comorbilidades, la profilaxis de la infección, los aspectos educacionales, el manejo del paciente en el domicilio, el tratamiento quirúrgico, las agudizaciones y el seguimiento de los pacientes.
In 2008, the Spanish Society of Pulmonology (SEPAR) published the first guidelines in the world on the diagnosis and treatment of bronchiectasis. Almost 10 years later, considerable scientific advances have been made in both the treatment and the evaluation and diagnosis of this disease, and the original guidelines have been updated to include the latest therapies available for bronchiectasis. These new recommendations have been drafted following a strict methodological process designed to ensure quality of content, and are linked to a large amount of online information that includes a wealth of references. The guidelines are focused on the treatment of bronchiectasis from both a multidisciplinary perspective, including specialty areas and the different healthcare levels involved, and a multidimensional perspective, including a comprehensive overview of the specific aspects of the disease. A series of recommendations have been drawn up, based on an in-depth review of the evidence for treatment of the underlying etiology, the bronchial infection in its different forms of presentation using existing therapies, bronchial inflammation, and airflow obstruction. Nutritional aspects, management of secretions, muscle training, management of complications and comorbidities, infection prophylaxis, patient education, home care, surgery, exacerbations, and patient follow-up are addressed.
Las bronquiectasias no debidas a fibrosis quística (FQ), (en lo sucesivo, bronquiectasias [BQ]) son, en frecuencia, la tercera enfermedad inflamatoria crónica de la vía aérea, después del asma y de la enfermedad pulmonar obstructiva crónica (EPOC), y en estrecha relación con ambas. En 2008, la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) fue la primera sociedad científica en establecer unas normativas sobre el diagnóstico y tratamiento de esta enfermedad, incluyendo en aquella ocasión también a la FQ1. Trascurridos más de 8 años, la evidencia científica sobre las BQ ha avanzado en algunos puntos importantes de forma que la aportación de los nuevos estudios ha permitido que se considerara esta nueva normativa que, para ofrecer al lector una información más específica, tan solo se dedicará a las BQ del adulto. Esta entrega se ha dedicado al tratamiento de las BQ. Para su confección se ha contado con el consejo de un experto en metodología. Por un lado, se ha utilizado un sistema Delphi para construir el temario priorizando las preguntas clínicas (anexo 1). Para la elaboración de las preguntas clínicas clave se utilizó la estructura PICO (Pacientes incluidos-Intervención a valorar-Comparación a realizar-Variable final [outcome] a analizar) y que aparece como anexo al final del manuscrito (anexo 3). Finalmente, la calidad de la evidencia y la fuerza de las recomendaciones se han establecido siguiendo las directrices de la propuesta GRADE (anexos 1 y 2).
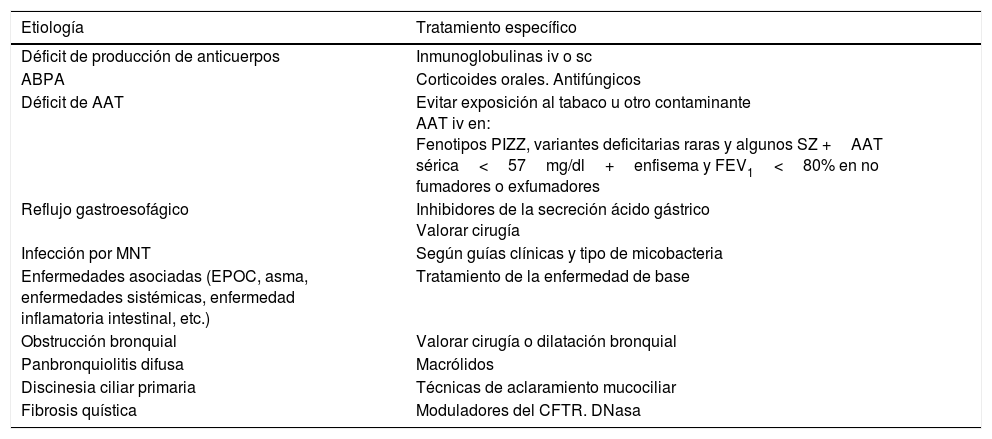
TratamientoDe la etiologíaLa importancia de detectar aquellas etiologías de las BQ que tengan un tratamiento específico es poder iniciarlo lo más precozmente posible para facilitar el control de la clínica y detener la progresión del daño pulmonar (tabla 1). En cada control clínico se debe revisar el tratamiento de la enfermedad de base1.
Causas de bronquiectasias con un tratamiento específico
| Etiología | Tratamiento específico |
|---|---|
| Déficit de producción de anticuerpos | Inmunoglobulinas iv o sc |
| ABPA | Corticoides orales. Antifúngicos |
| Déficit de AAT | Evitar exposición al tabaco u otro contaminante AAT iv en: Fenotipos PIZZ, variantes deficitarias raras y algunos SZ +AAT sérica<57mg/dl+enfisema y FEV1<80% en no fumadores o exfumadores |
| Reflujo gastroesofágico | Inhibidores de la secreción ácido gástrico Valorar cirugía |
| Infección por MNT | Según guías clínicas y tipo de micobacteria |
| Enfermedades asociadas (EPOC, asma, enfermedades sistémicas, enfermedad inflamatoria intestinal, etc.) | Tratamiento de la enfermedad de base |
| Obstrucción bronquial | Valorar cirugía o dilatación bronquial |
| Panbronquiolitis difusa | Macrólidos |
| Discinesia ciliar primaria | Técnicas de aclaramiento mucociliar |
| Fibrosis quística | Moduladores del CFTR. DNasa |
AAT: α-1 antitripsina; ABPA: aspergilosis broncopulmonar alérgica; CFTR: cystic fibrosis transmembrane conductance regulator; EPOC: enfermedad pulmonar obstructiva crónica; iv: intravenosa; MNT: micobacterias no tuberculosas; sc: subcutánea.
Se ha demostrado una asociación entre la infección bronquial crónica por Pseudomonas aeruginosa (P. aeruginosa) y un peor pronóstico de los pacientes con BQ2–5. Basándose fundamentalmente en el beneficio de la erradicación de P. aeruginosa en FQ, se recomienda asimismo intentar su erradicación en pacientes con BQ (Recomendación fuerte. Calidad de la evidencia baja)6,7.
Consideraciones:
- -
Ningún protocolo de erradicación de P. aeruginosa (tabla 2) ha demostrado superioridad sobre otro.
Tabla 2.Tratamiento antimicrobiano en la infección bronquial en pacientes con bronquiectasias
Situación clínica Comentarios Tratamiento de la primoinfección Ningún protocolo de erradicación ha demostrado superioridad sobre otro
Si fracasan 3 estrategias de tratamiento debe aplicarse el protocolo de la infección crónicaPrimer cultivo positivo por P. aeruginosa (primoinfección)
Ciprofloxacino 750mg/12h vo durante 3 semanas
-→En el caso de BQ graves (E-FACED 6-9 puntos) e inmunodeprimidos se añadirá un antibiótico inhalado (colistimetato, tobramicina o aztreonam) desde el inicio durante 3 meses
-→En caso de alergia o intolerancia al ciprofloxacino se recomienda utilizar solo el antibiótico por vía inhalada durante 3 meses, salvo en el caso de BQ graves e inmunodeprimidos que se utilizarán, desde el inicio, además del antibiótico inhalado, uno o 2 antibióticos iv con actividad antipseudomonas, durante 2-3 semanas según antibiograma
-→En el caso de que la primoinfección se detecte en periodo de agudización se recomienda iniciar terapia con antibióticos iv con actividad antipseudomonas (consultar apartado de agudizaciones)
Antibióticos inhalados que deben emplearse en las primoinfecciones: aztreonam lisina (solución para inhalación) o colistimetato de sodio solución para inhalación o tobramicina solución para inhalación (posología: ver tabla de antibióticos inhalados)Realizar cultivo de esputo mensual durante los 3 primeros meses después de finalizar el tratamiento con ciprofloxacino y después cada 2 meses durante un año
Si en cualquier momento durante el primer año vuelve a presentar P. aeruginosa en el cultivo de esputo considerar fracaso de la erradicación. En este caso: a) Añadir un antibiótico inhalado al ciprofloxacino o b) Repetir la misma pauta de ciprofloxacino+antibiótico inhalado, o c) Cambiar por otra combinación (ciprofloxacino+un antibiótico inhalado no utilizado en el primer ciclo)
Si fracasan al menos 2 estrategias que incluyan antibióticos inhalados y orales se recomienda el empleo de antibióticos inhalados más iv simultáneamentePrimer cultivo positivo por SARM (primoinfección)
Ácido fusídico 500mg/12h vo, cotrimoxazol 160/800mg/12h vo, rifampicina 600mg/24h vo, clindamicina 300mg/6h vo, linezolid 600mg/12h vo, tedizolid 200mg/24h vo o vancomicina (formulación iv administrada por vía inhalada, tratamiento continuo, 250mg, 2 veces/día)Se recomienda emplear simultáneamente diferentes combinaciones de estos antibióticos por vo. Puede añadirse vancomicina inhalada a cualquiera de estas pautas
Duración: 2 semanas (tedizolid 6 días)
Si no se logra la erradicación deben pautarse antibióticos iv (tigeciclina, teicoplanina, vancomicina +/-rifampicina) frente al SARM añadidos o no a vancomicina inhalada
No utilizar juntos rifampicina y linezolid por disminución de los niveles de este últimoPrimer cultivo positivo por cualquier MPP (primoinfección)
Antibióticos vo según antibiogramaDuración: 2 semanas
Si no se logra la erradicación, dar otro ciclo con el mismo antibiótico o cambiar por otroTratamiento de la infección crónica Los protocolos de tratamiento de la infección crónica son variados y ninguno ha demostrado superioridad sobre otro
Duración: mantener pauta inhalada mientras el beneficio/riesgo sea favorable (habitualmente años)Infección crónica por P. aeruginosa
Por orden alfabético: aztreonam lisina (solución para inhalación) o bciprofloxacino (polvo seco o solución para inhalación) o acolistimetato (polvo seco o solución para inhalación) o cgentamicina (formulación iv administrada por vía inhalada) o tobramicina (polvo seco o solución para inhalación)En afectación pulmonar moderada-grave o respuesta insuficiente en los ciclos on-off
-→ Emplear los antibióticos inhalados de manera continua, alternándolos/rotándolos sin periodos de descanso entre ellos o con intervalos off más cortos de 28 días
-→Si a pesar del tratamiento inhalado persiste mal control clínico, asociar un antibiótico vo o iv con actividad antipseudomonas según sensibilidad, a demanda o en ciclosInfección crónica por SARM
dVancomicina (formulación iv administrada por vía inhalada), tratamiento continuo, 250mg, 2 veces/día
Infección crónica por Stenotrophomonas maltophilia
Colistimetato, solución para inhalaciónSi la respuesta es insuficiente o no tolerancia añadir cotrimoxazol 160/800 mg/12h vo a la vancomicina o sustituir esta por cotrimoxazol
Si la respuesta es insuficiente o no tolerancia añadir cotrimoxazol 160/800 mg/12h vo al colistimetato o sustituir este por cotrimoxazolInfección crónica por otros MPP
cGentamicina es una formulación iv empleada por vía inhalada (80mg, 2 veces/día, tratamiento continuo)
o
Cualquiera de los antibióticos específicos para inhalación empleados en la infección crónica por P. aeruginosaSi la respuesta es insuficiente: a) Probar eficacia con otras formulaciones iv de antibióticos administrados por vía inhalada o b) Añadir (o sustituir) el antibiótico inhalado por uno vo de acuerdo a las sensibilidades antibióticas del MPP causante de la infección BQ: bronquiectasias; iv: vía intravenosa; MPP: microorganismos potencialmente patógenos; SARM: Staphylococcus aureus resistente a la meticilina; vo: vía oral.
El orden de los antimicrobianos empleados por vía inhalada no supone un orden de prioridad en la recomendación, sino que se han escrito por orden alfabético.
aLa dosis de colistimetato de sodio depende de la eficacia del nebulizador utilizado. Si bien faltan estudios de depósito pulmonar que lo confirmen, se recomienda que con un nebulizador con liberación adaptada de aerosol, como el l-neb se utilicen dosis más bajas (1mU, 2 veces/día).
- -
Para el resto de microorganismos potencialmente patógenos (MPP), la decisión de un tratamiento erradicador ante una situación de primoinfección debe individualizarse en función de la clínica del paciente y del MPP en cuestión, ya que no existe una evidencia firme sobre su contribución a la patogenia de las BQ (tabla 2).
El objetivo principal del tratamiento antibiótico de la infección bronquial crónica es disminuir al máximo la densidad bacteriana para romper el círculo vicioso patogénico de infección-inflamación de la vía aérea disminuyendo ambas en lo posible y, de esta forma, enlentecer el deterioro clínico-funcional. Se recomienda el tratamiento antibiótico prolongado en las siguientes situaciones: a) En todos los pacientes que presenten una infección bronquial crónica por P. aeruginosa (Recomendación fuerte. Calidad de la evidencia moderada); b) En aquellos con una infección bronquial crónica por otros MPP que además presenten al menos 2 agudizaciones o una hospitalización por agudización durante el año previo, un deterioro marcado de la función pulmonar o un deterioro de la calidad de vida evidenciado por un incremento del volumen o la purulencia del esputo, la disnea o la tos (Recomendación fuerte. Calidad de la evidencia baja)8 (tabla 2).
Debido tanto a la elevada efectividad (reducción significativa de la carga bacteriana, disminución de la inflamación local, mejoría de la calidad de vida y disminución del número de agudizaciones), y seguridad (altas concentraciones del antibiótico en el lugar de la infección con mínimos efectos secundarios sistémicos y menor tasa de resistencias) se recomienda la utilización de antibióticos inhalados frente a las administraciones sistémicas (Recomendación fuerte. Calidad de la evidencia moderada)9.
Consideraciones:
- -
Los protocolos de tratamiento de la infección bronquial crónica son muy variados y ninguno ha demostrado superioridad frente a los demás.
- -
Si a pesar del tratamiento inhalado persiste un mal control o evolución clínica inadecuada debe asociarse un antibiótico oral o intravenoso, a demanda o en ciclos (cada 1-2 meses).
- -
Debido a que con la administración por vía inhalada se alcanzan elevadas concentraciones del antibiótico en la vía aérea, la elección del antibiótico se realizará según el tipo de MPP que cause la infección, pero no según las sensibilidades antibióticas de los mismos.
- -
Se debe pautar este tratamiento de forma indefinida mientras que el riesgo/beneficio sea favorable, ya que muchos pacientes pueden empeorar clínicamente al suspenderlo. Debe monitorizarse la efectividad del tratamiento sobre el control de la infección con la obtención y mantenimiento de un esputo lo menos purulento posible y la disminución de las agudizaciones. La realización de cultivos con recuento bacteriano también puede ayudar a valorar la eficacia del tratamiento.
- -
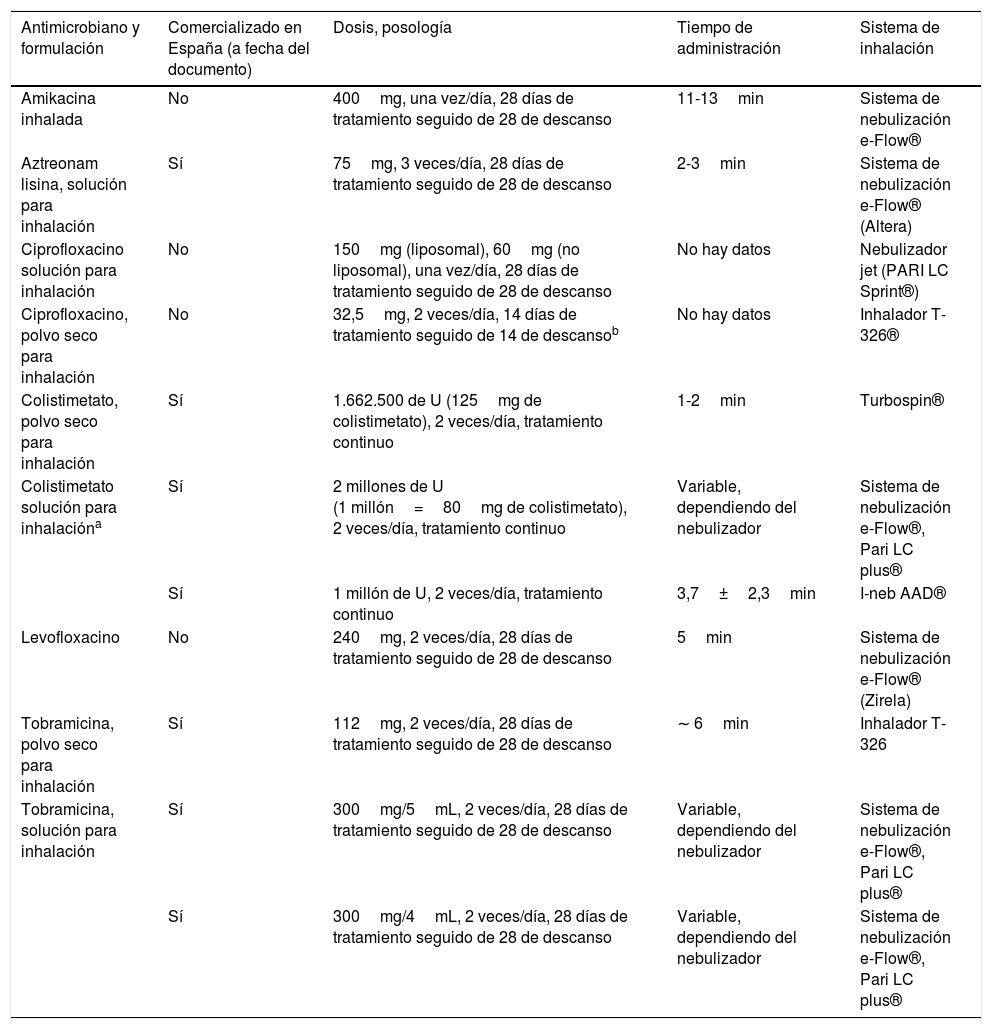
Los antibióticos específicos para inhalación actualmente comercializados en España son: colistimetato de sodio (disponible para nebulización y en polvo seco), tobramicina (solución para nebulizador y en polvo para inhalación), y aztreonam lisina para inhalación. La indicación formal de todos ellos es actualmente la infección bronquial crónica por P. aeruginosa en pacientes con FQ (pero no en BQ), si bien su uso en BQ está muy extendido. En sendos ensayos clínicos realizados con aztreonam lisina10 y colistimetato de sodio11 respectivamente, se constató un efecto antibacteriano beneficioso que no se tradujo en un beneficio clínico, salvo en el subgrupo de pacientes tratados con colistimetato de sodio con buena cumplimentación (más del 80% de las dosis). Aztreonam lisina presentó más efectos adversos que el placebo. En un ensayo clínico, ciprofloxacino en polvo seco, en ciclos de 14 días, demostró su efectividad clínica con un buen perfil de seguridad (RESPIRE-1)12, si bien estos resultados no pudieron ser corroborados por otro estudio de igual diseño (RESPIRE-2)13. De la misma forma, un ensayo clínico (ORBIT-4) demostró que ciprofloxacino en solución para inhalación, en ciclos de 28 días, presentó efectividad clínica y buen perfil de seguridad, pero nuevamente otro estudio de igual diseño no confirmó estos resultados de eficacia clínica (ORBIT-3)14. Es posible que en un futuro próximo se disponga en España de nuevas formulaciones de antibióticos por vía inhalada (amikacina liposomal, levofloxacino en solución y ciprofloxacino solución para inhalación y en polvo seco) (tabla 3).
Tabla 3.Antimicrobianos específicos para inhalación
Antimicrobiano y formulación Comercializado en España (a fecha del documento) Dosis, posología Tiempo de administración Sistema de inhalación Amikacina inhalada No 400mg, una vez/día, 28 días de tratamiento seguido de 28 de descanso 11-13min Sistema de nebulización e-Flow® Aztreonam lisina, solución para inhalación Sí 75mg, 3 veces/día, 28 días de tratamiento seguido de 28 de descanso 2-3min Sistema de nebulización e-Flow® (Altera) Ciprofloxacino solución para inhalación No 150mg (liposomal), 60mg (no liposomal), una vez/día, 28 días de tratamiento seguido de 28 de descanso No hay datos Nebulizador jet (PARI LC Sprint®) Ciprofloxacino, polvo seco para inhalación No 32,5mg, 2 veces/día, 14 días de tratamiento seguido de 14 de descansob No hay datos Inhalador T-326® Colistimetato, polvo seco para inhalación Sí 1.662.500 de U (125mg de colistimetato), 2 veces/día, tratamiento continuo 1-2min Turbospin® Colistimetato solución para inhalacióna Sí 2 millones de U
(1 millón=80mg de colistimetato), 2 veces/día, tratamiento continuoVariable, dependiendo del nebulizador Sistema de nebulización e-Flow®, Pari LC plus® Sí 1 millón de U, 2 veces/día, tratamiento continuo 3,7±2,3min I-neb AAD® Levofloxacino No 240mg, 2 veces/día, 28 días de tratamiento seguido de 28 de descanso 5min Sistema de nebulización e-Flow® (Zirela) Tobramicina, polvo seco para inhalación Sí 112mg, 2 veces/día, 28 días de tratamiento seguido de 28 de descanso ∼ 6min Inhalador T-326 Tobramicina, solución para inhalación Sí 300mg/5mL, 2 veces/día, 28 días de tratamiento seguido de 28 de descanso Variable, dependiendo del nebulizador Sistema de nebulización e-Flow®, Pari LC plus® Sí 300mg/4mL, 2 veces/día, 28 días de tratamiento seguido de 28 de descanso Variable, dependiendo del nebulizador Sistema de nebulización
e-Flow®, Pari LC plus® - -
No deben utilizarse formulaciones intravenosas de antibióticos por vía inhalada si el mismo antibiótico está disponible en formulación para inhalación. Si se decide emplear estas formulaciones debe hacerse con precaución, ya que los pacientes podrían tolerarlas peor y pueden presentar un mayor riesgo de efectos adversos dado que no existen garantías de que la preparación sea idéntica a las aprobadas por las agencias reguladoras correspondientes.
- -
Aquellos pacientes que utilizan antibióticos inhalados en meses alternos y presentan un empeoramiento clínico en los periodos de descanso (periodos de 28 días), podrían beneficiarse de su utilización de manera continua alternándolos o rotándolos con otro antibiótico sin periodos de descanso entre ellos, o con intervalos de descanso más cortos (14 días). Colistimetato de sodio se administra de forma continua (sin necesidad de ciclos on-off) debido a la escasa generación de resistencias que produce este antibiótico frente a P. aeruginosa.
- -
La rotación o alternancia de antibióticos podría ser útil para minimizar el desarrollo de resistencias. No hay evidencia de que la inhalación de 2 antibióticos a la vez sea más eficaz que emplear uno solo, por lo que esta práctica solo se utiliza en pacientes de control muy difícil (microorganismos multirresistentes).
- -
Se considera adecuado el siguiente orden terapéutico: broncodilatadores, solución salina hipertónica (SSH), fisioterapia y antibióticos inhalados. Los nebulizadores de malla e inhaladores de polvo seco son más eficaces que los jet. No se deben utilizar nebulizadores ultrasónicos dado que pueden inactivar el antibiótico. Es muy importante limpiar y desinfectar adecuadamente los nebulizadores después de su uso. El tiempo que se tarda en administrar el antibiótico es menor en los de polvo seco y de malla que en los jet, lo que favorece la cumplimentación del tratamiento. Asimismo en los inhaladores de polvo seco se minimiza el riesgo de infección del dispositivo.
- -
Debido a que pueden producir broncoespasmo, disnea, o tos, la primera dosis debe administrarse de forma supervisada tras broncodilatación.
- -
Es necesario extremar las precauciones en pacientes con hemoptisis de repetición, hiperreactividad bronquial (HRB) importante y afectación grave de la función pulmonar. En los pacientes con afectación renal o auditiva importante es preferible emplear otros antibióticos distintos del colistimetato y de los aminoglucósidos además de realizar una bioquímica sanguínea anual con función renal.
Los macrólidos, además de su acción antibiótica, son capaces de modular la inflamación bronquial e interferir en la formación de biopelículas. Son capaces de reducir el número de agudizaciones, así como la cantidad de esputo, mejorar la calidad de vida y atenuar el deterioro funcional pulmonar. Se recomienda en los pacientes con BQ en fase de estabilidad clínica pero con, al menos, 2 agudizaciones anuales a pesar del tratamiento de base correcto (Recomendación fuerte. Calidad de la evidencia elevada)15–17.
Consideraciones:
- -
Esta situación suele aparecer en pacientes con infección bronquial crónica por diversos MPP, en especial P. aeruginosa, y expectoración abundante o difícil control clínico a pesar del tratamiento antibiótico.
- -
De las diferentes posologías publicadas, por su comodidad, se utiliza habitualmente 500mg de azitromicina, 3 veces por semana en días no consecutivos.
- -
Los efectos adversos más frecuentes son los digestivos, que suelen ser transitorios. Antes de su inicio se deben evaluar alteraciones en el electrocardiograma (prolongación del segmento QT), una analítica (incluyendo función hepática), y cultivo de micobacterias ya que, en el caso de aparición de las mismas, no deben administrarse por riesgo de inducir la aparición de cepas resistentes a las mismas. Su uso puede incrementar las resistencias a MPP comunes sensibles a los macrólidos.
- -
Se debe reevaluar su eficacia clínica cada 6 meses en base al descenso en el número de agudizaciones.
No se recomienda su uso de rutina, tan solo en los pacientes con HRB, asma o broncorrea importante no controlable con otros tratamientos. Se debe prestar cuidado con el tratamiento con corticoides inhalados en pacientes con una infección bronquial crónica por MPP, por el posible aumento en la susceptibilidad a las infecciones que podría producir este fármaco (Recomendación fuerte. Calidad de la evidencia baja)18.
Otros tratamientos antiinflamatoriosPor la ausencia de datos sobre su eficacia clínica, no se recomienda el uso rutinario de otros tratamientos antiinflamatorios como el inhibidor de la elastasa neutrofílica, los antileucotrienos, los inhibidores de la fosfodiesterasa 4 o las estatinas salvo por la coexistencia de EPOC, asma u otras comorbilidades, si estuvieran indicados (Recomendación débil. Calidad de la evidencia baja).
De la obstrucción al flujo aéreoSe recomienda el empleo de betaadrenérgicos de acción corta (salbutamol o terbutalina) antes de la fisioterapia respiratoria para facilitar el drenaje de secreciones (DS) y del empleo de antibióticos inhalados o solución salina hipertónica (SSH) (Recomendación fuerte. Calidad de la evidencia moderada).
El uso de betaadrenérgicos de acción prolongada se recomienda en aquellos pacientes que cursen con obstrucción al flujo aéreo sintomática, siempre y cuando las ventajas superen los efectos adversos, así como para permitir una reducción en la dosis de esteroides inhalados (Recomendación fuerte. Calidad de la evidencia moderada)19.
No existe información sobre el uso de anticolinérgicos por lo que no está indicado su uso generalizado, salvo en casos de asma o EPOC coexistente, o en casos particulares en los que el resto de los tratamientos no hayan producido el efecto deseado.
Aspectos nutricionalesEn los pacientes con BQ existe riesgo de desnutrición (sobre todo de masa magra) porque presentan mayores requerimientos energéticos (por el aumento del trabajo respiratorio y la inflamación crónica) y pueden disminuir la ingesta por anorexia (especialmente, durante las agudizaciones). El índice de masa corporal es un marcador independiente de supervivencia en BQ (<20kg/m2) y la desnutrición de masa magra se asocia a complicaciones y mayor mortalidad. La valoración nutricional debe formar parte de la evaluación integral de los pacientes con BQ, siendo indispensable medir el índice de masa corporal en cada visita y valorar la ingesta y la pérdida de peso en el tiempo. Es especialmente importante en pacientes con enfermedad evolucionada y en las agudizaciones. Sería aconsejable, además, medir la composición corporal (Recomendación fuerte, calidad de la evidencia moderada). En la tabla 4 se resumen las medidas de control y tratamiento nutricional20.
Control y tratamiento nutricional
| Valoración nutricional |
|---|
| Valorar en cada visita |
| -Peso, IMC y pérdida de peso/tiempo |
| -Criterios de desnutrición: |
| IMC inferior a 20kg/m2 (o de 22kg/m2 en mayores de 70 años) y/o pérdida de peso involuntaria>5% en 3 meses o del 10% en 6 meses |
| Valorar anualmente |
| -Patrón dietético o encuesta dietética (escala Predimed de dieta mediterránea) |
| -Analítica de sangre con marcadores de inflamación (PCR) y albúmina |
| -Envío al especialista de Endocrinología y Nutrición de los pacientes con BQ graves o agudizadores (ya que tienen riesgo de desnutrición) para estimar composición corporal |
| -Índice de masa magra por plicometría, DEXA o impedanciometría: |
| Desnutrición de masa magra: |
| Índice de masa magra (kg/talla-metros−2): <17kg/m2 (varones) y 15kg/m2 en mujeres. Los pacientes con sobrepeso u obesidad pueden padecer también desnutrición de masa magra (obesidad sarcopénica) |
| En agudizaciones |
| -Peso, IMC y pérdida peso/tiempo |
| -Valorar ingesta básica (por cuartiles:–nada–¼ - ½ - ¾- todo-) |
| -Analítica de sangre con marcadores de inflamación (PCR), albúmina y prealbúmina (para valorar la eficacia del tratamiento nutricional) |
| Tratamiento nutricional |
| -Valorar añadir suplementos orales en personas con IMC<20kg/m2, o bien, >20kg/m2 pero que estén perdiendo peso de forma aguda (especialmente en agudizaciones e ingresos) |
| -Se recomiendan fórmulas poliméricas e hipercalóricas, sobre todo si se requiere restricción de líquidos |
| -En situaciones de alto estrés metabólico (albúmina<3,5g/dl, PCR elevada o agudizaciones moderadas/graves) se recomienda, además, que sean hiperproteicas |
| -El uso de fórmulas altas en grasas no debe ser la norma en pacientes con BQ |
| -En caso de diabetes concomitante, las fórmulas específicas con moderado o alto contenido en ácidos grasos monoinsaturados han demostrado mejorar el control metabólico |
| -Enviar al especialista de Endocrinología y Nutrición a los pacientes desnutridos graves o en riesgo, con indicación de suplementos (indispensable en valoración pretrasplante) |
| -La efectividad de los tratamientos es mayor si se combina con un programa de ejercicio |
BQ: bronquiectasias; DEXA: densitometría de rayos X de doble energía; IMC: índice de masa corporal; PCR: proteína C reactiva.
Las técnicas de DS son seguras y recomendables en pacientes adultos con BQ clínicamente estables con tos productiva porque mejoran, de forma significativa, la calidad de vida en especial en aquellos pacientes hipersecretores o con agudizaciones frecuentes (Recomendación fuerte. Calidad de la evidencia baja)21.
Consideraciones:
- -
La elección de la técnica debe tener en cuenta la preferencia del paciente, su habilidad, comorbilidad y su interferencia en la vida diaria.
- -
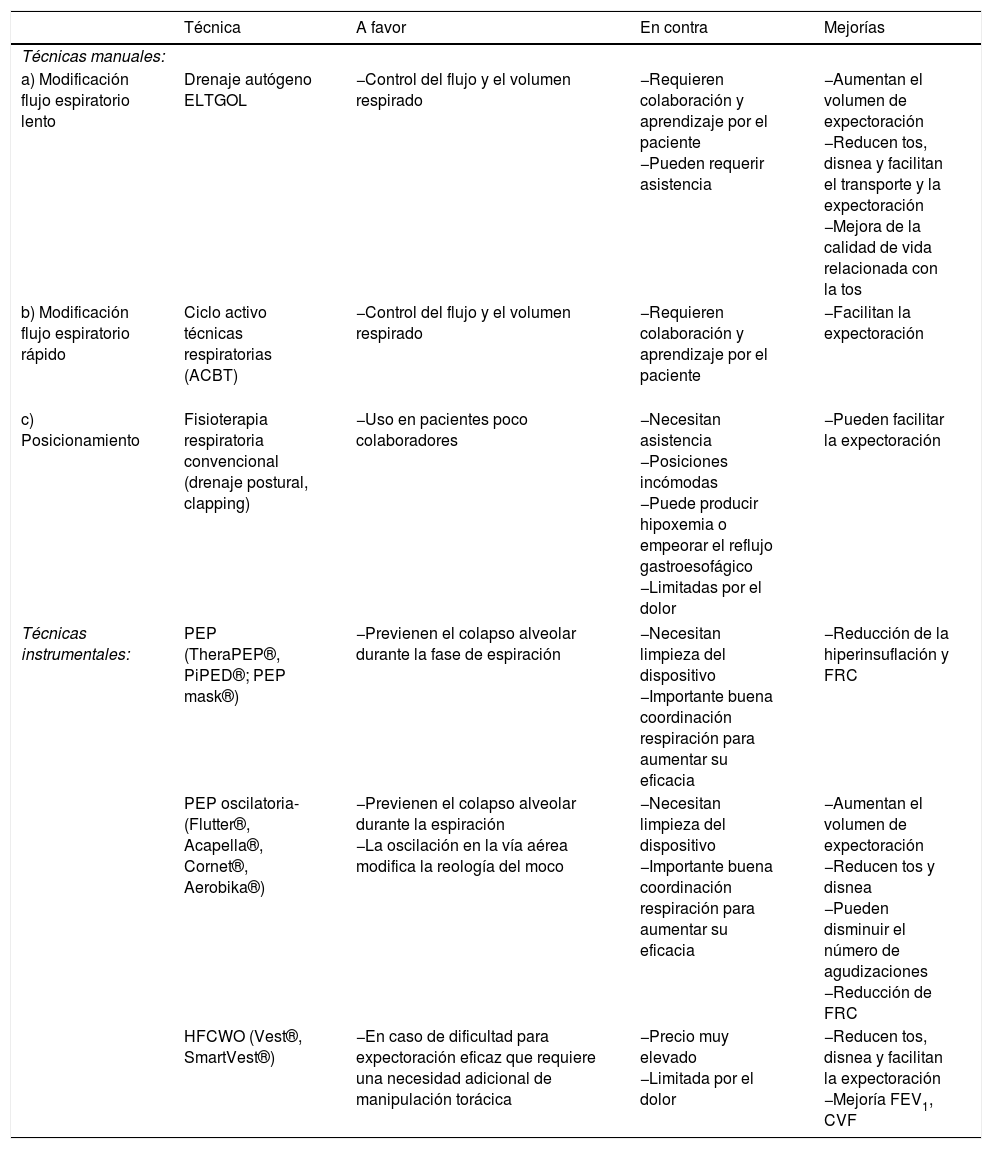
El DS se debe utilizar dentro de un programa de entrenamiento global realizándose un mínimo de una vez al día o según requiera el estado del paciente. Las técnicas de DS se agrupan en manuales (drenaje autógeno, espiración lenta con glotis abierta y ciclo activo técnicas ventilatorias [ACBT]) e instrumentales (presión espiratoria positiva [PEP], oscilación espiratoria positiva [OPEP] y oscilación extratorácica de alta frecuencia [HFCWO]). Todas ellas reducen los síntomas de disnea y tos y facilitan la expectoración. El uso de OPEP incrementa además el volumen de expectoración y podría disminuir el número de agudizaciones. La HFCWO realizada durante 15 días puede mejorar los valores dinámicos de la función pulmonar (volumen espiratorio máximo en el primer segundo [FEV1] y capacidad vital forzada). La espiración lenta con glotis abierta, la PEP y la OPEP pueden producir una reducción de la hiperinsuflación pulmonar disminuyendo la capacidad funcional residual. Por último, se ha observado una importante reducción de la resistencia de las vías aéreas periféricas (tabla 5).
Tabla 5.Técnicas de fisioterapia habituales en bronquiectasias
Técnica A favor En contra Mejorías Técnicas manuales: a) Modificación flujo espiratorio lento Drenaje autógeno
ELTGOL−Control del flujo y el volumen respirado −Requieren colaboración y aprendizaje por el paciente
−Pueden requerir asistencia−Aumentan el volumen de expectoración
−Reducen tos, disnea y facilitan el transporte y la expectoración
−Mejora de la calidad de vida relacionada con la tosb) Modificación flujo espiratorio rápido Ciclo activo técnicas respiratorias (ACBT)
−Control del flujo y el volumen respirado −Requieren colaboración y aprendizaje por el paciente −Facilitan la expectoración c) Posicionamiento Fisioterapia respiratoria convencional (drenaje postural, clapping) −Uso en pacientes poco colaboradores −Necesitan asistencia
−Posiciones incómodas
−Puede producir hipoxemia o empeorar el reflujo gastroesofágico
−Limitadas por el dolor−Pueden facilitar la expectoración Técnicas instrumentales: PEP (TheraPEP®, PiPED®; PEP mask®) −Previenen el colapso alveolar durante la fase de espiración −Necesitan limpieza del dispositivo
−Importante buena coordinación respiración para aumentar su eficacia−Reducción de la hiperinsuflación y FRC PEP oscilatoria-(Flutter®, Acapella®, Cornet®, Aerobika®) −Previenen el colapso alveolar durante la espiración
−La oscilación en la vía aérea modifica la reología del moco−Necesitan limpieza del dispositivo
−Importante buena coordinación respiración para aumentar su eficacia−Aumentan el volumen de expectoración
−Reducen tos y disnea
−Pueden disminuir el número de agudizaciones
−Reducción de FRCHFCWO (Vest®, SmartVest®) −En caso de dificultad para expectoración eficaz que requiere una necesidad adicional de manipulación torácica −Precio muy elevado
−Limitada por el dolor−Reducen tos, disnea y facilitan la expectoración
−Mejoría FEV1, CVFCVF: capacidad vital forzada; ELTGOL: espiración lenta con glotis abierta; FEV1: volumen espiratorio máximo durante el primer segundo; FRC: capacidad residual funcional; HFCWO: compresión torácica de alta frecuencia; OPEP: técnicas de presión espiratoria positiva oscilante; PEP: técnicas de presión espiratoria positiva.
- -
El DS está contraindicado en situaciones de inestabilidad, hemoptisis, broncoespasmo, hipertensión intracraneal, neumotórax y cirugía ocular reciente. En el caso de ser técnicas aplicadas sobre el tórax directamente, estarían contraindicadas en alteraciones óseas como metástasis, osteoporosis o fracturas costales.
El entrenamiento físico, dentro de programas de rehabilitación respiratoria, se recomienda en pacientes estables con disnea mayor de uno según la escala mMRC (Recomendación fuerte. Calidad de la evidencia moderada)22.
Consideraciones:
- -
Los programas con una frecuencia de 3 veces por semana (por ejemplo 2 sesiones hospitalarias y una domiciliaria), supervisados, durante un mínimo de 8 semanas han mostrado ser eficaces.
- -
El ejercicio aeróbico consiste generalmente en trabajar a intensidades moderadas o altas (un 75% velocidad máxima de la prueba de marcha de lanzadera [ISWT], o 60-70% min de frecuencia cardíaca máxima en la prueba de la caminata de los 6 min, o un 85% del consumo máximo de oxígeno [V02máx] durante 30-45min mediante un cicloergómetro, cinta de marcha o elíptica). Se puede incluir ejercicios de potenciación de extremidades inferiores y superiores con carga progresiva (iniciándose el 60% de la carga máxima, así como potenciación de la musculatura inspiratoria 2 veces al día durante 15min, iniciando el trabajo al 30% de la presión inspiratoria máxima y aumentando progresivamente cada semana un 5% hasta alcanzar el 60%). Estas intervenciones mejoran la tolerancia al ejercicio (medida por ISWT o 6MWT) y la calidad de vida. Se mantienen los efectos a las 12 semanas posteriores al final del ejercicio pero se reducen progresivamente al año. El trabajo de la musculatura inspiratoria podría estar relacionado con una mayor duración del efecto. La rehabilitación respiratoria disminuye el número de agudizaciones de forma significativa, no así la duración o los días necesarios de antibióticos en las mismas.
La evidencia existente es insuficiente para recomendar el uso rutinario de mucolíticos en BQ (Recomendación fuerte. Calidad de la evidencia baja)23.
Consideraciones:
- -
Bromhexina a dosis altas (30mg/8h) durante 15 días junto a un antibiótico podría mejorar el DS en pacientes en un periodo de exacerbación. En enfermos estables, se podría utilizar en mayores de 55 años y con expectoración diaria superior a 30ml.
- -
Erdosteína (225mg/12h) durante 15 días junto a técnicas de aclaramiento mucociliar ha demostrado mejorar la purulencia del esputo y la función pulmonar. Este mucolítico no está comercializado actualmente en España.
- -
En pacientes que además de BQ presentan EPOC, se podrían valorar otros mucolíticos asociados al tratamiento habitual, como acetilcisteína (dosis de 400-1.800mg/día), carbocisteína (dosis de 1.500-2.700mg/día) o ambroxol (75mg/día) a más largo plazo (>10 meses), ya que pueden reducir las agudizaciones.
- -
DNasa en aerosol no ha mostrado su utilidad (e incluso podría ser contraproducente) en pacientes con BQ.
Las sustancias hipertónicas se recomiendan en pacientes con BQ con expectoración superior a 10ml al día o con≥2 agudizaciones al año a pesar de un tratamiento de base correcto (Recomendación fuerte. Calidad de la evidencia moderada)24.
Consideraciones:
- -
Utilizar la inhalación de 5ml de SSH a una concentración del 6 o 7%, una o 2 veces al día durante al menos 3 meses para comprobar su efectos. La inhalación de SSH ha demostrado que facilita el drenaje bronquial, disminuye la viscosidad, mejora el FEV1 y la calidad de vida y reduce las exacerbaciones y el consumo de antibióticos.
- -
El uso prolongado de manitol inhalado en polvo seco a una dosis de 400mg/12h (10 cápsulas de 40mg) ha demostrado mejorar la calidad de vida y aumentar el tiempo hasta la primera exacerbación en pacientes con BQ, pero hasta la fecha no está comercializado en España. Antes de utilizar una sustancia hipertónica se debe realizar una prueba de tolerancia a la misma mediante una espirometría forzada antes y después de la inhalación. Debe suspenderse la administración en casos de descensos del FEV1 ≥ 15%.
- -
Asimismo, en los pacientes que no toleren la SSH, la formulación con ácido hialurónico añadido es una alternativa a evaluar, o en su defecto, una concentración de solución salina más isotónica (diluyéndola con SS al 0,9% o probando concentraciones de SSH a menor concentración, como al 3%). Con las sustancias hipertónicas precedidas de un broncodilatador y seguidas de la fisioterapia respiratoria se obtiene un mayor beneficio.
Se recomienda que la oxigenoterapia se prescriba siguiendo las indicaciones habituales de las enfermedades crónicas de la vía aérea. En fase de estabilidad clínica, la ventilación mecánica no invasiva está indicada en la insuficiencia respiratoria crónica, como terapia coadyuvante a otras técnicas de rehabilitación y fisioterapia respiratoria y como puente al trasplante pulmonar. La modalidad de ventilación mecánica no invasiva más adecuada es la ventilación con presión binivel (Recomendación fuerte. Calidad de la evidencia baja).
Tratamiento de las complicacionesLas complicaciones (hemoptisis amenazante, neumotórax, amiloidosis, sepsis, insuficiencia renal, etc.) deberán ser tratadas siguiendo las normativas existentes para cada una de las mismas. Ante la presencia de hemoptisis debe evitarse el empleo de fármacos inhalados y fisioterapia respiratoria hasta pasadas 48h desde su resolución. La aparición de esputos hemoptoicos suele indicar la presencia de una infección que deberá de tratarse con terapia antibiótica.
CirugíaLa cirugía (lobectomías o segmentectomías) es el único tratamiento curativo en caso de BQ localizadas que causen problemas de manejo clínico, siempre que se descarten las enfermedades subyacentes que favorecen su aparición. También está indicada con intención paliativa en casos de hemoptisis grave con embolización inefectiva, o de zonas abscesificadas no curables con tratamiento antibiótico. Factores como la existencia de BQ residuales, la infección por P. aeruginosa o micobacterias no tuberculosas y el estado de inmunosupresión pueden influir en una peor respuesta clínica tras la cirugía (Recomendación fuerte. Calidad de la evidencia moderada)25.
Trasplante pulmonarIndicado en aquellos pacientes con una enfermedad pulmonar crónica en estado avanzado o con evidencia de progresión de la enfermedad, en la que se estime una supervivencia inferior a 2 años una vez empleados todos los recursos terapéuticos disponibles si no existe ninguna contraindicación absoluta. No existen unas indicaciones específicas de derivación a trasplante pulmonar en pacientes con BQ, aunque se asumen las de la FQ o las de la enfermedad de base si tienen indicaciones propias. En la tabla 6 aparecen las principales indicaciones para el trasplante26.
Indicaciones de trasplante pulmonar
| FEV1 inferior al 30% o una pérdida rápida de la función pulmonar en pacientes con afectación grave |
| Insuficiencia respiratoria crónica o hipercapnia |
| Hipertensión pulmonar (presión sistólica de la arteria pulmonar>35mm Hg) |
| Agudizaciones o complicaciones graves frecuentes como neumotórax o hemoptisis recidivantes |
FEV1: volumen espiratorio máximo durante el primer segundo.
Una elevada proporción de pacientes con BQ presenta comorbilidades que deben identificarse y tratarse. De entre ellas, destacan por su impacto en el paciente con BQ la rinosinusitis y/o poliposis nasal, la hernia de hiato, la ansiedad y la depresión. Los tratamientos inmunosupresores y/o biológicos pueden condicionar un mayor número de infecciones respiratorias lo que obliga a una estrecha monitorización de los mismos.
Profilaxis de la infecciónComo en el resto de las enfermedades crónicas de la vía aérea, se recomienda la vacuna antigripal anual y la vacuna antineumocócica conjugada 13-valente. Si el paciente ha sido vacunado previamente con la vacuna antineumocócica polisacárida 23-valente se aconseja que trascurra un año hasta la administración de la vacuna antineumocócica conjugada 13-valente (Recomendacion fuerte. Calidad de la evidencia moderada)27.
Aspectos educacionalesSon importantes la educación y supervisión en el conocimiento de la enfermedad, el reconocimiento de la agudización y su automanejo inicial, la administración de antibióticos inhalados e intravenosos en el domicilio, el mantenimiento y la limpieza de los equipos, la administración de otros tratamientos (oxígeno, ventilación mecánica, etc.), y el cumplimiento del tratamiento (Recomendación fuerte. Calidad de la evidencia moderada).
Tratamiento antibiótico intravenoso domiciliarioLa literatura apoya la eficacia del tratamiento antibiótico intravenoso domiciliario para una amplia variedad de infecciones, siempre que los pacientes sean cuidadosamente seleccionados y adiestrados. Aporta considerables ventajas al reducir los ingresos hospitalarios (evita complicaciones nosocomiales), reducir los costes y permitir no modificar la rutina diaria del paciente, mejorando su calidad de vida. Es necesario hacer una evaluación exhaustiva de su condición médica, del proceso infeccioso y del domicilio y contar con su consentimiento. Las complicaciones suelen ser escasas y relacionadas con el acceso venoso. Es un tratamiento seguro y coste-efectivo (Recomendación fuerte. Calidad de la evidencia moderada). Deben de seguirse las recomendaciones de las guías publicadas para el tratamiento antibiótico intravenoso domiciliario (tabla 7). El equipo de atención domiciliaria debe contar con personal de enfermería en coordinación con el neumólogo y el grupo cooperador formado por farmacéuticos, fisioterapeutas y el personal de contacto en atención primaria. La cobertura médica debe estar completada por la atención en el servicio de urgencias del hospital y del centro de salud28.
Criterios de selección para tratamiento antibiótico intravenoso en el domicilio
| Inclusión |
| Estabilidad clínica del paciente |
| Soporte familiar o de cuidadores |
| Alta motivación para realizar el tratamiento en domicilio |
| Capacidad física y mental del paciente y los cuidadores para la terapia en domicilio |
| Domicilio dentro del área de cobertura de la unidad responsable del tratamiento |
| Domicilio con los medios adecuados: teléfono, agua corriente, frigorífico, etc. |
| Firma de consentimiento informado |
| Exclusión |
| Posibilidad de tratamiento oral efectivo |
| Necesidad de otro tratamiento intrahospitalario |
| Enfermos no cumplidores, con problemas psicosociales o adictos a drogas |
| Criterios de inestabilidad o gravedad |
Se define agudización como un deterioro clínico agudo y mantenido caracterizado por aumento de la tos habitual y de cambios en las características del esputo consistentes en aumento de la purulencia o incremento del volumen o viscosidad, que puede acompañarse de aumento de la disnea, fiebre, astenia, mal estado general, anorexia, dolor torácico pleurítico, hemoptisis, cambios en la exploración respiratoria, cambios en el tratamiento habitual del paciente o caída significativa de la función pulmonar.
La frecuencia y gravedad de las agudizaciones desempeñan un papel fundamental, no solo en la calidad de vida de los pacientes, sino también en la progresión de la enfermedad (deterioro clínico, funcional, aumento de la morbimorbilidad y de los costes asociados), sobre todo en las clases funcionales de mayor gravedad. Los patógenos más frecuentemente aislados durante un periodo de agudización son P. aeruginosa, Haemophilus influenzae, Streptococcus pneumoniae, Staphilococcus aureus, Moraxella catarrhalis y las enterobacterias aunque es posible que los virus tengan también un papel relevante ya que se han descrito hasta en un 25% de las agudizaciones. En caso de neumonía, S. pneumoniae sigue siendo la causa microbiológica más habitual.
Criterios de gravedad e ingresoSe clasifican como agudizaciones leves o moderadas aquellas que pueden controlarse con un tratamiento antibiótico por vía oral, mientras que se consideran como graves aquellas que precisan de tratamiento antibiótico intravenoso u hospitalización29. Además también se consideran como graves aquellas que cursan con, al menos, una de las siguientes circunstancias: insuficiencia respiratoria aguda o crónica agudizada, deterioro significativo de la saturación de oxígeno, fiebre elevada u otros criterios de sepsis, hemoptisis franca o deterioro significativo de la función pulmonar. Aquellas agudizaciones que cursan con inestabilidad hemodinámica, alteración del nivel de consciencia o necesidad de ingreso en una unidad de cuidados intensivos o intermedios se consideran como muy graves.
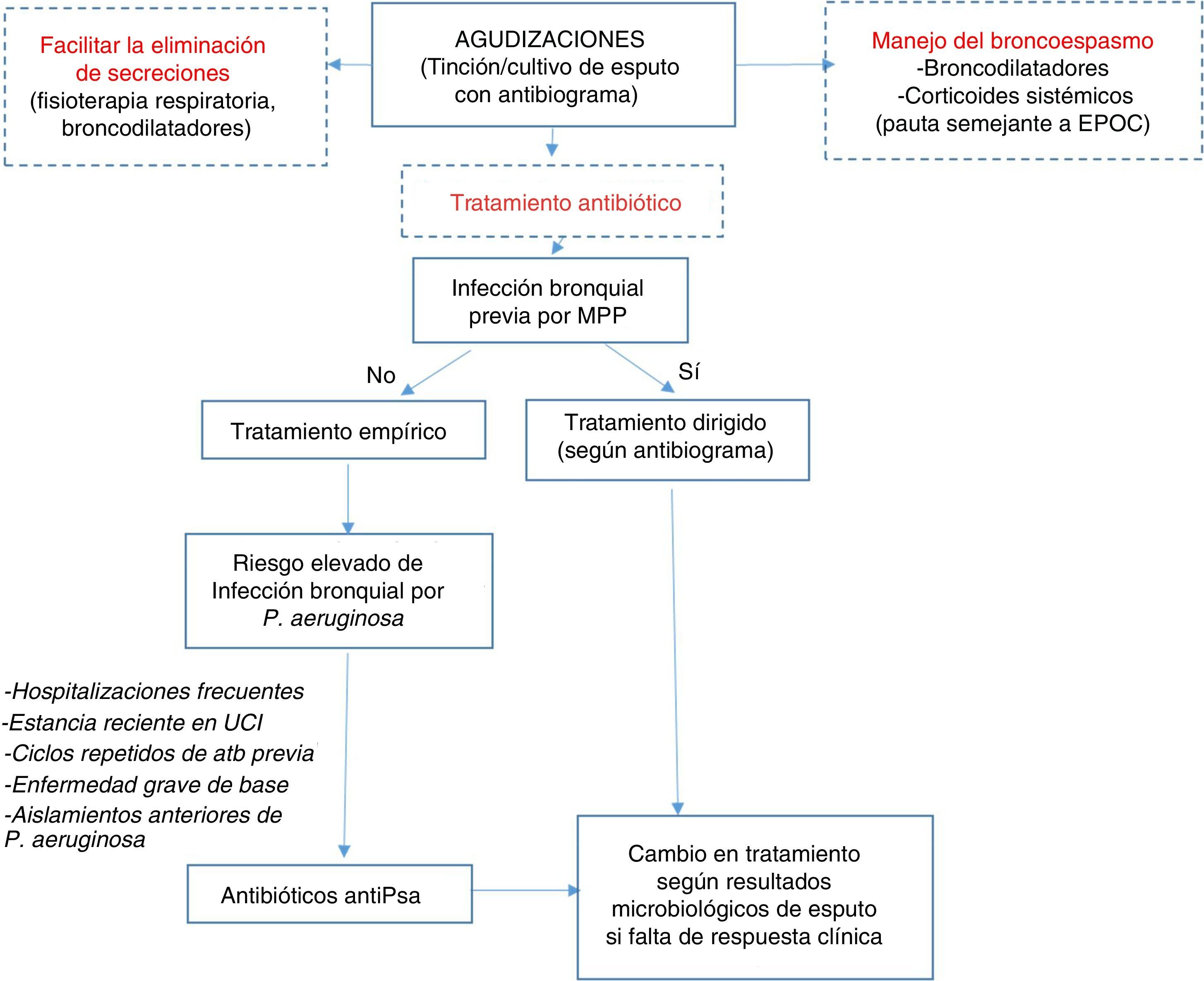
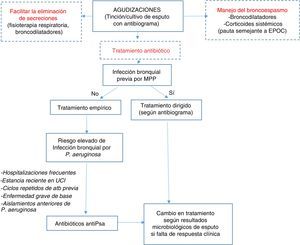
Algoritmo terapéuticoEl tratamiento antibiótico empírico debe iniciarse en base al cultivo previo si existe. En la tabla 8 aparecen las diferentes posibilidades terapéuticas dependiendo del microorganismo y de la gravedad de la agudización. Para mejorar el rendimiento de la muestra de esputo para estudio microbiológico en las agudizaciones, la toma de la muestra debe realizarse previamente al inicio del tratamiento (fig. 1).
Tratamiento antibiótico en las agudizaciones
| Comentario | Tratamiento de elección | Tratamiento alternativo | Duración |
|---|---|---|---|
| Agudización leve: | 10-21 días, salvo para: - Azitromicina, se recomienda 3–5 días - P. aeruginosa, se recomienda 14-21 días | ||
| H. influenzae | Amoxicilina-clavulánico 875mg/8h vo | Amoxicilina 1-2g/8h vo o Ciprofloxacino 750mg/12h vo o Azitromicina 500mg/24h vo o Cefditoren 200-400mg/12h vo | |
| S. aureus | Cloxacilina 500-1.000mg/6h vo | Amoxicilina-clavulánico 875mg/8h vo Cotrimoxazol 160/800mg/12h vo | |
| SARM | Linezolid 600mg/12h vo | Cotrimoxazol 160/800mg/12h vo Clindamicina 300-450mg/6-8h vo Tedizolid 200mg/24h vo | |
| P. aeruginosa | Ciprofloxacino 750mg/12h vo | Levofloxacino 750mg/24h vo o 500mg/12h vo | |
| Agudización grave, sin respuesta a vo o por microorganismos resistentes: | 14-21 días | ||
| H. influenzae | Amoxicilina-clavulánico 1-2g/8h iv | Ceftriaxona 2g/24h iv | |
| S. aureus | Cloxacilina 1-2g/4-6h iv | Amoxicilina-clavulánico 1-2g/8h iv o Vancomicina 15-20mg/kg/8-12h iv | |
| SARM | Linezolid 600mg/12h iv | Vancomicina 15-20mg/kg/8-12h iv o Ceftarolina 600mg/12h iv | |
| P. aeruginosa | Ceftazidima 2g/8h iv + Tobramicina 5-10mg/kg/24h iv | Imipenem 1g/8h iv o Piperacilina/tazobactam 4g/8h iv o Aztreonam 2g/8h iv o Cefepime 2g/8h iv o Meropenem 2g/8h iv o Ciprofloxacino 400mg/12h iv + Amikacina 15-20mg/kg/24h iv o Gentamicina 5-7mg/kg/24h iv Ceftolozano/tazobactam 1-2g/8h iv | |
iv: vía intravenosa; SARM: Staphylococcus aureus resistente a la meticilina; vo: vía oral.
En caso de tratamiento empírico hay que cubrir microorganismos previamente aislados y modificar posteriormente en función del cultivo de esputo.
Las BQ son una enfermedad de manejo multidisciplinar por lo que todos los escalones asistenciales deben de implicarse con funciones propias.
Atención primaria: presunción clínica, diagnóstico diferencial con otras enfermedades de la vía aérea, derivación a especializada para el diagnóstico y estudio etiológico, priorización de la derivación, control del paciente no grave y estable, y control de las agudizaciones leves-moderadas así como de los efectos adversos leves del tratamiento.
Enfermería: control de la adherencia al tratamiento, valoración de la tolerancia, educación en inhaladores y nebulizadores y uso de la terapia intravenosa, fisioterapia respiratoria, así como la higiene de los sistemas de nebulización y realización de espirometrías.
Consultas monográficas/Unidades especializadas (no disponibles en todos los centros): deben de derivarse aquellos pacientes que precisen de un diagnóstico o tratamiento especializado (infección bronquial crónica [en especial por P. aeruginosa], así como aquellos que presenten múltiples agudizaciones, un valor de E-FACED = 6-9 puntos o de BSI >9 puntos, algunas etiologías como inmunodeficiencias primarias o discinesias ciliares así como aquellos con mal control o progresión de la enfermedad.
Unidad de hospitalización domiciliaria o equipos de atención domiciliaria: manejo del paciente con tratamiento intravenoso domiciliario, paciente terminal o en fase avanzada o paciente con dificultad para trasladarse al centro hospitalario.
SeguimientoLa frecuencia e intensidad del seguimiento del paciente con BQ depende de su gravedad inicial, su progresión, del lugar en el que se controle y de la disponibilidad sanitaria. En la tabla 9 se puede observar la cadencia de visitas y pruebas recomendadas a realizar. En general, en aquellos pacientes que son controlados en consultas monográficas o unidades especializadas de BQ se debe realizar, al menos, una visita cada 6-12 meses. En aquellos pacientes más graves o inestables se aconseja una visita cada 1-3 meses con estudio clínico y microbiológico en todas las visitas. En cualquier caso, tras una agudización grave, el control clínico debe de realizarse dentro del primer mes.
Valoración de la gravedad y el seguimiento
| Clínica: controles cada 1-6 meses según morbilidad, gravedad y progresión, y un máximo de un mes después de una agudización |
| Aspectos a considerar y monitorizar en cada visita |
| Etiología: repercusión y tratamiento de la enfermedad de base |
| Síntomas y signos: disnea (escala mMRC), presencia de broncoespasmo, hemoptisis, afectación sistémica y otras. Esputo: volumen (semicuantitativo marcado por el paciente en un recipiente graduado); color (escala de Murray) y viscosidad. Posibles complicaciones |
| Número y gravedad de las agudizaciones: ingresos hospitalarios y tratamiento antibiótico (tolerancia y respuesta al mismo) |
| Saturación de oxihemoglobina |
| Adherencia al tratamiento y educación |
| Cultivo de esputo incluyendo bacterias con diferenciación de morfotipos de colonias, estudio de sensibilidad (antibiograma) y, si es posible, recuento de colonias bacterianas, MNT y hongos |
| Otros aspectos |
| Espirometría anual, o en cada visita en caso de pacientes en riesgo de rápida progresión o graves. Prueba de 6min marcha según resultados espirométricos |
| Radiografía de tórax en el caso de complicaciones, o sospecha de neumonía o neumotórax |
| TCAR de baja dosis cada 2 años en caso de deterioro clínico-funcional rápido, hemoptisis frecuente o factores de riesgo para una mala progresión. Para el resto de los pacientes cada 4-5 años |
| Calidad de vida: valoración anual mediante el cuestionario QoL-B |
| Gravedad: valoración anual mediante la puntuación E-FACED |
| Analítica: anual y tras agudizaciones. Valoración de marcadores de inflamación, parámetros nutricionales o efectos adversos del tratamiento |
| Valoración nutricional: anual y si cambios significativos del IMC (ver apartado correspondiente) |
| Otros: Revisión de la medicación, de las técnicas fisioterápicas y de la técnica de inhalación |
mMRC: escala modificada del Medical Research Council; MNT: micobacterias no tuberculosas; IMC: índice de masa corporal; TCAR: tomografía computarizada de alta resolución; QoL-B: Quality of Life bronchiectasis questionnaire.
Murray et al. Eur Resp J. 2009;34:361–4.
Miguel Ángel Martínez ha participado en reuniones de formación patrocinadas por Gilead, Novartis, Glaxo, Praxis, Teva y Zambon. Asimismo ha sido investigador principal de proyectos financiados por Praxis y Zambón y ha participado en reuniones de análisis de resultado de ensayos clínicos organizadas por Bayer y Grifols.
Luis Máiz ha participado en reuniones de formación patrocinadas por Gilead, Novartis, Zambón y Praxis.
Casilda Olveira ha participado en actividades de formación o comités de expertos patrocinadas por Gilead, Praxis, Novartis, Teva y Zambon.
Rosa Maria Girón Moreno ha participado en reuniones de formación patrocinadas por Gilead, Teva y Zambon.
Marina Blanco Aparicio ha participado en reuniones de formación patrocinadas por Zambón, Praxis Pharmaceuthical y ha sido investigador principal de ensayo clínico sobre antibioterapia inhalada patrocinado por Bayer.
David de la Rosa ha participado en reuniones de formación patrocinadas por Praxis, Zambon y Teva.
Rafael Cantón ha participado en reuniones de formación patrocinadas por Gilead, MSD, Novartis y Zambon. Asimismo ha sido investigador principal de proyectos financiados por AZ y MSD y ha participado en reuniones de análisis de resultado de ensayos clínicos organizadas por Bayer.
Montserrat Vendrell ha participado en reuniones de formación patrocinadas por Praxis, Zambon, Novartis y Chiesi. Ha sido investigador principal de proyectos financiados por Praxis, Zambon y Chiesi. Ha participado en reuniones de Grifols y Raptor pharmaceuticals.
Eva Polverino ha sido investigadora principal de ensayos clínicos promovidos por Bayer, Grifols, Insmed, Chiesi; ha participado en reuniones de análisis de resultado de ensayos clínicos organizadas por Bayer e Insmed; ha participado en reuniones de formación patrocinadas por Zambon.
Javier de Gracia ha participado en reuniones de formación patrocinadas por Gilead, Novartis y Zambon. Asimismo ha sido investigador principal de proyectos financiados por Bayer y Gilead.
Concepción Prados ha participado en reuniones organizadas por Gilead, Praxis, Zambón, Teva y Vertex.
David Rigau. Centro Cochrane Iberoamericano. Barcelona. España. DRigau@santpau.cat
Gabriel Olveira. Endocrinology and Nutrition Service, Nutrition Unit, Regional University Málaga Hospital, CIBERDEM, CIBER of Diabetes and Associated Metabolic Diseases (Instituto de Salud Carlos III), Madrid, Spain. e-mail: gabrielm.olveira.sspa@juntadeandalucia.es
Radiología: M.a Isabel Marco Galve. Servicio de Radiología. Hospital de Alta Resolución de Benalmádena (E.P. Hospital Costa del Sol). Málaga. isabelmarcogalve@yahoo.es
Fisioterapia y Rehabilitación: Marta López Martín. Servicio de Rehabilitación y Medicina Física. Hospital Universitario de la Princesa. Madrid. marta.lopez.martin@salud.madrid.org
Jordi Vilaró Casamitjana. Facultad de Ciencias de la Salud Blanquerna, Grupo de Investigación en Salud, Actividad Física y Deporte, Universidad Ramon Llull, Barcelona, España. Jordi.gestos@gmail.com
En el anexo 4 online se ha añadido un amplio conjunto de referencias bibiliográficas por cada uno de los puntos en los que está dividida la presente normativa.