Las enfermedades del colágeno constituyen un gran grupo de enfermedades inflamatorias sistémicas de etiología autoinmune. La etiopatogenia de las enfermedades del colágeno es multifactorial. Existe una susceptibilidad genética, y muchos trastornos del tejido conectivo muestran una agregación familiar, sobre la que actúan factores ambientales que desencadenan la enfermedad. En las enfermedades del colágeno se pueden afectar casi todos los órganos del cuerpo. El sistema respiratorio es uno de los más frecuentemente afectados, aunque no se conoce con exactitud la prevalencia de enfermedad pulmonar en las diferentes enfermedades del colágeno. Cualquier estructura del aparato respiratorio puede estar afectada. Quizá lo más frecuente sea la enfermedad del parénquima pulmonar en forma de neumonitis, que puede manifestarse como cualquiera de los patrones de neumonitis intersticiales idiopáticas. Pero también pueden afectarse la pleura, los vasos pulmonares, la vía aérea y la musculatura respiratoria. La frecuencia de enfermedad pulmonar asociada a las enfermedades del colágeno está aumentando, por una parte gracias a los mejores métodos de diagnóstico de que disponemos hoy en día, como la tomografía computarizada de alta resolución, y también por la aparición de nuevas formas de neumonitis asociadas a los nuevos tratamientos empleados en la actualidad. El objetivo de este artículo es ofrecer una visión en conjunto de cómo las enfermedades del colágeno pueden afectar el pulmón, de acuerdo con las nuevas evidencias científicas.
Collagen diseases are a large group of systemic inflammatory diseases of autoimmune etiology. The etiopathogenesis of collagen diseases is multifactorial. There is genetic susceptibility, as many connective tissue disorders show family history, and environmental factors may trigger the disease. Collagen diseases can affect almost all the organs of the body. The respiratory system is one of the most frequently affected, although the prevalence of pulmonary disease is not precisely known for the different collagen disorders. Any structure of the respiratory tract can be affected, but perhaps the most frequent is pulmonary parenchymal disease in the form of pneumonitis, which can be produced in any of the idiopathic interstitial pneumonitis patterns. The pleura, pulmonary vessels, airways and respiratory muscles may also be affected. The frequency of lung disease associated with collagen diseases is on the rise. This due in part to the better diagnostic methods that are available to us today (such as high-resolution computed tomography) and also to the appearance of new forms of pneumonitis associated with the new treatments that are currently used. The objective of this article is to offer a global vision of how collagen diseases can affect the lungs according to the latest scientific evidence.
Las enfermedades del colágeno son un grupo heterogéneo de enfermedades inflamatorias sistémicas de origen autoinmune que afectan a una gran diversidad de órganos y sistemas. El aparato respiratorio es uno de los que se afectan con más frecuencia. Cualquiera de las estructuras del sistema respiratorio puede estar afectada: parénquima pulmonar, pleura, vasos pulmonares, músculos respiratorios y estructuras óseas. La frecuencia y la forma en que se afecta el sistema respiratorio dependen de cada tipo de enfermedad del colágeno1-3. Además de la afectación por la propia enfermedad hay que tener en cuenta que los tratamientos empleados pueden también ser causa de enfermedad pulmonar por toxicidad4-6. La afección pulmonar más frecuente, en cualquier caso, es la neumonitis7, que aparece en cualquiera de los patrones anatomopatológicos de neumonitis intersticial idiopática8. Por otra parte, las enfermedades del tejido conectivo, por sí mismas y sobre todo por la inmunodepresión que producen los fármacos usados en su tratamiento, tiene aumentada la prevalencia de infecciones, entre ellas las del sistema respiratorio, fundamentalmente con los nuevos tratamientos biológicos que se usan hoy en día. Además, estos se han relacionado con el desarrollo de neumonitis6,9, en algunos casos de fatales consecuencias. En cualquier caso, la aparición de complicaciones pulmonares aumenta la morbilidad y la mortalidad de los enfermos con conectivopatías.
Artritis reumatoideLa artritis reumatoide (AR) es una enfermedad autoinmune de causa desconocida y de evolución crónica que afecta fundamentalmente a las articulaciones provocando una sinovitis erosiva crónica y simétrica. Su prevalencia en España se estima en el 0,5%10. Puede tener otras manifestaciones extraarticulares, como nódulos subcutáneos, vasculitis, pericarditis, neuropatías, epiescleritis y afectación pleuropulmonar. De las manifestaciones extraarticulares de la AR, la afectación pulmonar y la vasculitis cutánea son las 2 más frecuentes. El 18% de la mortalidad de la AR es por causa pulmonar, y aproximadamente el 5% de los pacientes con AR presentan manifestaciones clínicas de afectación pulmonar. La AR puede afectar al pulmón de diferentes formas: enfermedad pulmonar intersticial (EPI), pleuritis, derrame pleural, nódulos reumatoideos asociados o no a neumoconiosis (síndrome de Caplan), obstrucción de vías aéreas, vasculitis, hipertensión pulmonar (HTP), afectación de la pared torácica y músculos respiratorios1,11. La afectación pulmonar se ha relacionado con el hábito tabáquico y con algunos rasgos clínicos de los enfermos, como el sexo masculino, la enfermedad articular grave y erosiva, la positividad del factor reumatoide (FR) y la presencia de otras manifestaciones clínicas, como los nódulos reumatoides subcutáneos.
Afectación parenquimatosaEnfermedad pulmonar intersticialLa EPI es la manifestación pulmonar más frecuente de la AR. La forma de presentación de EPI en la AR es similar a la vista en las neumonías intersticiales idiopáticas (NII), y los patrones histológicos de enfermedad intersticial que podemos encontrar en la AR son los mismos de las neumonitis intersticiales idiopáticas. Estos incluyen la neumonía intersticial usual (NIU), la neumonía intersticial no específica (NINE), la neumonía organizada criptogenética (NOC), la neumonía intersticial descamativa (NID), la bronquiolitis respiratoria asociada a EPI (BR-EPI), la neumonía intersticial aguda (NIA) y la neumonía intersticial linfoide (NIL) (tabla 1)8,12. La mayoría de las enfermedades pulmonares asociadas a la AR ocurren en los primeros 5 años desde el comienzo de la enfermedad. En el momento del inicio de la AR pueden aparecer complicaciones pulmonares en el 10-20% de los casos, y se ha demostrado la presencia de fibrosis pulmonar en el 14% de los pacientes con AR de menos de 2 años de evolución. La prevalencia de EPI varía en función de los criterios utilizados para establecer el diagnostico. Se ha descrito presencia de EPI clínicamente significativa en aproximadamente el 7% de los pacientes7, mientras que estudios realizados en autopsias demuestran una prevalencia de EPI del 35%13. En estudios en los que se ha utilizado la tomografía computarizada de alta resolución (TCAR) torácica para realizar cribado de EPI en pacientes con AR se vio una prevalencia de casi el 20%14. En otros donde se han realizado pruebas de función respiratoria (PFR) se han observado alteraciones restrictivas hasta en el 40% de los pacientes. En el registro español de AR, la EPI tiene una prevalencia del 3,7% cuando se considera exclusivamente la radiografía de tórax, y aumenta al 80% si se tienen en cuenta los hallazgos histológicos de la biopsia pulmonar15. En un estudio realizado en el año 2008 en pacientes con AR sin síntomas respiratorios, en el cual se realizaba TCAR, se encontró EPI en 21 de los 64 pacientes estudiados (33%)16.
Neumonías intersticiales idiopáticas
| Neumonía intersticial usual (NIU) |
| Neumonía intersticial no específica (NINE) |
| Neumonía organizada (NO) |
| Neumonía intersticial descamativa (NID) |
| Bronquiolitis respiratoria asociada a enfermedad pulmonar intersticial (BR-EPI) |
| Neumonía intersticial aguda (NIA) |
| Neumonía intersticial linfoide (NIL) |
Se ha visto que la EPI, al igual que otras manifestaciones extraarticulares, es más frecuente en hombres que en mujeres. La relación del tabaco con el desarrollo de EPI no está clara en el momento actual:algunos han visto el tabaquismo como un factor de riesgo potencial para el desarrollo de EPI, mientras que otros lo han asociado de forma independiente con el desarrollo de EPI15,16. La presencia de anticuerpos anticitrulinados (anti-CCP) o Ig A y/o IgM factor reumatoide (FR) aumenta el riesgo para el desarrollo de manifestaciones extraarticulares, y títulos altos de FR se han asociado con la presencia de EPI y con disminución de la capacidad de difusión de monóxido de carbono (DLCO)17. La relación entre anti-CCP y enfermedad pulmonar es desconocida. Otros factores que se han asociado con la aparición de EPI en enfermos con AR son la edad avanzada en el momento del diagnóstico, marcadores de actividad y severidad de la enfermedad, aparición de nódulos reumatoideos y una clasificación funcional más grave18. La supervivencia media de los pacientes con EPI y AR es inferior al 40% a los 5 años. Bongartz et al. encuentran en su serie una supervivencia media de 2,6 años tras el diagnóstico de EPI18.
Las manifestaciones clínicas son inespecíficas y el síntoma más frecuente es la disnea de esfuerzo, seguida de tos no productiva. El dolor torácico es raro. La fiebre es un síntoma muy poco frecuente. La exploración física puede ser normal en los momentos iniciales de la afectación pulmonar. Posteriormente aparecen crepitantes secos, tipo «velcro», en la auscultación pulmonar, y en estadios evolucionados se pueden observar acropaquías.
El diagnóstico de EPI en AR se basa en la combinación de sintomatología sugestiva de enfermedad pulmonar, PFR compatibles, hallazgos radiológicos típicos, y en algunos casos pude ser necesario el estudio histológico. La fibrobroncoscopia y el lavado broncoalveolar (BAL) pueden ser útiles para realizar el diagnóstico diferencial con otras enfermedades intersticiales, para descartar infecciones pulmonares o enfermedades inducidas por fármacos.
Las PFR son fundamentales en la evaluación de la afectación pulmonar en la AR. Pueden estar alteradas incluso en pacientes asintomáticos. Lo primero que se altera es la DLCO, siendo este el test más sensible, pudiéndose encontrar disminuida en el 40% de los pacientes aun en presencia de radiografía simple de tórax normal y en el 82% de los pacientes con alteraciones la TCAR, aun estando asintomáticos13. La DLCO se correlaciona bien con el grado de extensión de la enfermedad en la TCAR y además tiene valor pronóstico: una DLCO<54% del previsto llega a predecir la progresión de la enfermedad19. Posteriormente se objetiva un patrón restrictivo con disminución de la capacidad pulmonar total (TLC) y de la capacidad vital forzada (FVC) y aumento del gradiente alveolo-arterial de oxígeno. En algunos casos se puede observar un patrón mixto con alteraciones obstructivas, sobre todo en caso de pacientes fumadores. En fases evolucionadas de la enfermedad se observa desaturación con el ejercicio físico, e incluso hipoxemia en reposo.
En muchos casos la radiografía de tórax es normal. Es una técnica muy poco sensible para el diagnóstico de enfermedad intersticial pulmonar en estadios precoces14. Pueden observarse patrones reticulonodulares, opacidades basales, vidrio deslustrado, patrón en panal y, en estadios más avanzados, signos de HTP.
La TCAR es mucho más sensible para detectar las alteraciones que se producen en el pulmón, incluso en pacientes asintomáticos. Los hallazgos son muy variados, y los más frecuentes son: imágenes reticulares, patrón en vidrio deslustrado, engrosamientos bronquiales, dilataciones bronquiales, consolidaciones, micronódulos y patrón en panal2.
Dependiendo del tipo de afectación pulmonar los hallazgos radiológicos difieren, adoptando distintos patrones. Algunos de estos son característicos de determinados patrones histológicos y permiten tomar decisiones diagnósticas y terapéuticas sin necesidad de realizar una biopsia pulmonar3.
En el patrón TCAR de NIU los hallazgos más frecuentes son reticulación y patrón en panal de predominio en bases y zonas periféricas, que se acompaña de bronquiectasias de tracción y vidrio deslustrado de poca extensión. En el patrón TCAR de NINE predomina el vidrio deslustrado y la reticulación de predominio en zonas periféricas y basales, pudiendo aparecer también bronquiectasias de tracción y muy escaso panal. El patrón de bronquiolitis se caracteriza por nódulos centrolobulillares o peribronquiales y pueden coexistir dilataciones bronquiales con bronquiectasias. En el patrón de NOC se observan consolidaciones del espacio aéreo con vidrio deslustrado y pueden existir nódulos centrolobulillares20.
El BAL no tiene un valor específico en el diagnóstico. Su principal interés recae en excluir otras enfermedades como infecciones oportunistas, reacciones a fármacos y neoplasias3. En la AR la celularidad del BAL está aumentada, y en general se observa un aumento de los neutrófilos y ocasionalmente de los eosinófilos. En estadios iniciales, en fases subclínicas puede existir un predominio de linfocitos, que se asocia a un mejor pronóstico y a una mejor respuesta al tratamiento21,22.
En la AR se pueden hallar cualquiera de los patrones histológicos definidos de NII8,12 (tabla 1). El patrón histológico más frecuentemente visto en la EPI asociada a la AR es la NIU23,24, al contrario que en otras enfermedades del colágeno, en que es más común la NINE, que es la segunda en frecuencia en la AR. En tercer lugar se encuentra la NOC. Además, con mucha menos prevalencia, se pueden hallar otros patrones: bronquiolitis respiratoria (BR-EPI), NID, NIL y daño alveolar difuso (DAD).
Enfermedad pulmonar intersticial por fármacosLos fármacos usados en el tratamiento de la AR pueden tener diversos efectos secundarios. También pueden afectar el pulmón y producir enfermedad intersticial. El metotrexato (MTX) es el fármaco que se ha visto con más frecuencia asociado con enfermedad pulmonar en la AR. La neumonitis por MTX es una reacción idiosincrásica más que dependiente de la dosis. Su aparición no tiene relación con la dosis acumulada, e incluso pude ocurrir semanas después de finalizado el tratamiento. La presencia de enfermedad intersticial previa, la edad elevada y la alteración de la PFR son factores de riesgo para el desarrollo de neumonitis por MTX. Sin embargo, en algunos estudios no se ha visto que tratamientos con dosis bajas de MTX produzcan empeoramiento de EPI25. Su diagnóstico es difícil, ya que la clínica es inespecífica y puede confundirse con un proceso infeccioso. Se han propuesto diferentes criterios para su diagnóstico26,27. Además, como una enfermedad pulmonar previa puede ser un factor de riesgo para su desarrollo, también se han diseñado algoritmos para minimizar el riesgo de su utilización27. En un paciente con EPI que desarrolla aumento de disnea durante el tratamiento con MTX y que se objetive una disminución de la DLCO respecto la previa o aparecen opacidades en vidrio deslustrado el MTX debe suspenderse4,28.
Los anti-TNF-alfa (infliximab, etanercept y adalimumab) han demostrado su efectividad en el tratamiento de la AR. Sus efectos secundarios están en la mayoría de los casos relacionados con su efecto inmunosupresor, que se manifiesta con infecciones, y entre ellas cabe hacer mención especial de la tuberculosis. El TNF-alfa es una citoquina implicada en la respuesta inmune precoz de una gran variedad de enfermedades inflamatorias y es un mediador crítico en la patogénesis de la fibrosis pulmonar29. Se han comunicado casos aislados de mejoría de los síntomas, estabilización de la función pulmonar e imágenes radiológicas con estos fármacos29,30. Pero también se han comunicado casos de inicio de EPI31,32 y de exacerbación clínica importante tras el inicio de cada uno de estos fármacos33-35. Las EPI relacionadas con el tratamiento anti-TNF son más agresivas y tienen mayor mortalidad en comparación con la EPI en pacientes que reciben únicamente MTX, y en la mayoría de los casos se producen al poco tiempo de recibir dicho tratamiento. En las guías de prescripción para tratamiento con anti TNF se recomienda tener precaución al exponer a los pacientes de AR con fibrosis pulmonar y monitorizar estrechamente la función pulmonar36.
La leflunomida se ha empleado como alternativa al MTX en pacientes que presentan enfermedad pulmonar subyacente. Sin embargo, en el año 2001, en el congreso de la Sociedad Británica de Reumatología se comunicaron los primeros efectos adversos de la leflunomida en el pulmón en los pacientes con AR37. En Japón se ha descrito una incidencia del 0,5% de EPI en pacientes tratados con leflunomida38. Hasta ahora se han descrito escasos casos de EPI asociados a tocilizumab: un caso en la serie de Smolen et al.39 y un caso aislado descrito por Kawasshiri et al.40 También se han descrito algunos casos de EPI asociada al tratamiento con rituximab en pacientes con linfoma39 y se han comunicado algunos casos de neumonía organizada, en pacientes diagnosticados de AR, tras el inicio de tratamiento con rituximab41,42.
Las complicaciones pulmonares pueden llegar a ser responsables del 10 al 20% de la mortalidad de los pacientes con AR. La supervivencia de los pacientes con EPI es menor que la esperada en pacientes con AR sin EPI. En general, la evolución y el pronóstico de los pacientes con EPI asociada a enfermedad del colágeno son mejores que los de los pacientes con fibrosis pulmonar idiopática (FPI)43,44. También el pronóstico de la EPI asociada a AR es mejor que el de la FPI45. Sin embargo, la supervivencia de los pacientes con AR que tienen una EPI con patrón NIU es igual que la de la FPI43. En general, la supervivencia media de los pacientes con EPI y AR es inferior al 40% a los 5 años. Se han descrito varios factores clínicos que pueden predecir una menor supervivencia: disnea progresiva medida en escalas estandarizadas; disminución del tamaño pulmonar en la radiografía de tórax; grado de extensión de la enfermedad en la TCAR; disminución de la FVC, y disminución de la capacidad de transferencia gaseosa46.
Tradicionalmente la EPI se ha tratado con corticoides, asociados a no a otros inmunosupresores, sin tener en cuenta la histopatología subyacente. La EPI con patrón NIU tiene una pobre respuesta a los corticoides, mientras que la NO suele tener una evolución muy favorable20, por lo que parece lógico basar el tratamiento según el patrón de neumonía intersticial subyacente.
En general, un tratamiento agresivo está justificado en pacientes en los que exista evidencia de inflamación en la TCAR, linfocitosis en el BAL y que no presentan patrón de NIU, sobre todo sin son pacientes jóvenes con un deterioro progresivo de la función pulmonar. Otros tratamientos que hay que tener en cuenta son la rehabilitación respiratoria y la oxigenoterapia en el caso de que exista insuficiencia respiratoria. Cuando la enfermedad está muy evolucionada hay que considerar el trasplante pulmonar.
Nódulos pulmonares reumatoidesAparecen en menos del 1% de las radiografías de tórax de pacientes con AR. En la TCAR de tórax se pueden detectar hasta en el 22% de los casos, y esta prevalencia aumenta en las autopsias de pacientes con AR47.
Son más frecuentes en pacientes de larga evolución, pero en algunos casos puede ser la primera manifestación de la AR. Generalmente son asintomáticos y raramente producen tos o hemoptisis. Son más frecuentes en pacientes con nódulos subcutáneos, fumadores y FR elevado48. Se trata de opacidades redondeadas y bien definidas y pueden ser únicos o múltiples, unilaterales o bilaterales. Su tamaño también es variable, de milímetros a varios centímetros, y se localizan con más frecuencia en los lóbulos superiores y en situación subpleural. Histológicamente presentan las mismas características que los nódulos reumatoides subcutáneos, con un núcleo central de necrosis fibrinoide envuelto por una capa de histiocitos con disposición típica en empalizada y rodeado periféricamente de tejido de granulación e inflamación crónica. En el 50% de los casos se cavitan. Hay que realizar el diagnóstico diferencial con neoplasia pulmonar primaria si se trata de un nódulo único, o con metástasis si son múltiples nódulos, y con granulomas, micosis, vasculitis pulmonares e histiocitosis X. La evolución clínica es variable, y pueden aumentar en número o tamaño, cavitarse, disminuir o permanecer estables. El pronóstico es bueno, y muy raramente se complican dando lugar a neumotórax, pioneumotórax o fístula broncopleural. El único diagnóstico de certeza es el estudio histológico.
Síndrome de CaplanFue descrito en 1953 por Caplan, en mineros de carbón con neumoconiosis y AR49. Se caracteriza por la aparición, en pacientes con AR, de imágenes nodulares redondeadas en ambos campos pulmonares de localización predominantemente periférica y que pueden cavitarse, junto con las alteraciones típicas de la neumoconiosis. La patogenia de los nódulos en el síndrome de Caplan no es bien conocida, y se cree que el material inorgánico podría ser el desencadenante de fenómenos inmunológicos que favorezcan, en el contexto de la AR, la formación de nódulos50.
Afección pleuralSu prevalencia se ha estimado en el 5%, pero hasta el 20% de los pacientes pueden tener, en algún momento de su evolución, síntomas compatibles51. El derrame pleural puede aparecer en cualquier momento del curso de enfermedad, e incluso preceder al diagnóstico de AR. Puede presentarse como un hallazgo casual al realizar una radiografía de tórax, y en algunos casos se pone de manifiesto por la presencia de dolor de características pleuríticas, fiebre o disnea de esfuerzo. En ocasiones la afectación pleurítica coincide con exacerbación de la sintomatología articular y puede coincidir con la aparición de otra patología pulmonar, como la presencia de nódulos reumatoides o el desarrollo de EPI. Generalmente el derrame es unilateral y afecta con más frecuencia al lado derecho, pero en el 25% de los casos puede ser bilateral. El líquido pleural oscila entre un exudado serofibroso y un líquido turbio. Suele ser un exudado, y en ocasiones puede ser seudoquiloso debido a la acumulación de colesterol, sobre todo en los derrames de larga evolución. Un líquido hemático obliga a descartar otra etiología del derrame. Generalmente presenta glucosa baja o normal, pH y proteínas bajos y LDH elevada52. El FR en el líquido pleural con frecuencia es positivo. En las formas agudas existe un predominio de polimorfonucleares, y en las crónicas, de linfocitos. La presencia de células multinucleadas e histiocitos es más específica de la AR, ya que son células que proceden de nódulos reumatoides subpleurales. En casos donde el estudio del líquido pleural no es suficiente para efectuar el diagnóstico etiológico se debe realizar una biopsia pleural con el fin de descartar tuberculosis o neoplasia. El curso clínico es muy variable: puede desaparecer en un tiempo comprendido entre 4 semanas y 3 meses, pero en ocasiones puede durar años. Generalmente no precisa tratamiento específico. En caso de dolor se utilizan AINE, y si no responde se puede pautar tratamiento con corticoides orales.
Afección vascularLa vasculitis pulmonar en la AR como alteración primaria es poco frecuente, y se suele asociar con patología del parénquima pulmonar. La hemorragia alveolar difusa en la AR puede ser secundaria a una vasculitis de pequeño vaso y no debida a la existencia de vasculitis sistémica. El diagnóstico se basa en la presencia de macrófagos con hierro en el BAL, los cuales sugieren hemorragia pulmonar subclínica.
Afección de la vía aéreaBronquiectasiasSe ha observado una prevalencia bastante importante de bronquiectasia en pacientes con AR, pero muy variable en función de las series consultadas (0-30%)53. La TC es la prueba más sensible para su diagnóstico. La colonización de estas bronquiectasias por diferentes microrganismos es causa de infecciones respiratorias de repetición, lo cual es muy importante a tener en cuenta en estos pacientes que reciben tratamiento inmunosupresor por su enfermedad de base.
Bronquiolitis obliteranteEs una complicación muy poco frecuente pero muy grave. Se caracteriza por la obstrucción de la pequeña vía aérea de forma aguda o subaguda, produciendo tos seca y disnea rápidamente progresiva. Se produce un patrón obstructivo resistente al tratamiento broncodilatador, secundaria a la obstrucción de los bronquiolos por la inflamación y fibrosis de sus paredes. La radiografía de tórax puede ser normal o mostrar signos de atrapamiento aéreo. En la TCAR se observa engrosamiento de las paredes bronquiales, áreas de enfisema centrolobulillar y bronquiectasias. En la biopsia pulmonar existe una bronquiolitis constrictiva con infiltrado linfocitario. Se trata de un cuadro muy grave con muy mala respuesta a los tratamientos y con una tasa elevada de mortalidad.
Esclerosis sistémicaLa esclerosis sistémica es un trastorno generalizado del tejido conjuntivo caracterizado clínicamente por engrosamiento y fibrosis de la piel y afectación de órganos internos. La afectación pulmonar es la segunda manifestación en frecuencia. La prevalencia de la afección pulmonar oscila entre el 25 y el 90% de los pacientes con esclerosis. El 60% de los pacientes presentan síntomas respiratorios a lo largo del curso de su enfermedad, y existen hallazgos de afectación en el 80% de las necropsias de los pacientes con esclerodermia. Las 2 formas de afección pulmonar más frecuentes son la EPI y la HTP, que son las 2 primeras causa de muerte. Con menos frecuencia figuran las bronquiectasias —que pueden aparecer hasta en el 68% de los pacientes si utilizamos como método diagnóstico la TCAR54—, el derrame pleural (<10%), el neumotórax espontáneo, la neumonitis asociada a fármacos y el cáncer de pulmón.
Afección parenquimatosaEnfermedad pulmonar intersticialAparece con más frecuencia en los pacientes con esclerosis sistémica difusa que en los que tienen esclerosis sistémica limitada. La prevalencia de EPI depende de la población seleccionada para los estudios y de la definición de EPI aplicada, llegándose a observar hasta en el 74% de los pacientes. Se asocia fundamentalmente con la presencia de fenómeno de Raynaud severo, úlceras digitales y afectación tendinosa. La EPI puede ser la primera manifestación clínica de esclerosis sistémica55. Se han relacionado la raza afroamericana, el grado de afectación cutánea, el hipotiroidismo, la afección cardiaca, los niveles de CPK y de creatinina con el desarrollo de afección pulmonar precoz56.
La presencia de ciertos anticuerpos está relacionada con un aumento de la probabilidad de desarrollar EPI. Pero su sensibilidad y su valor predictivo son bajos. Un alto porcentaje de pacientes con esclerosis sistémica presentan ANA positivos, los anti-topoisomerasai se encuentra en hasta el 40% de los pacientes con afectación pulmonar. Por otro lado, se ha observado que la presencia de anticuerpos anti- centrómero podría ser un factor protector para el desarrollo de EPI. La presencia de anticuerpos anti-topoisomerasa tipoi se encuentra asociada con niveles más bajos de FVC (p<0,001) basales y con una disminución acelerada de la FVC57. En otro estudio se ha observado una prevalencia de EPI del 79% en pacientes con anticuerpos dirigidos contra U11/U12 ribonucleoproteína (RNP)58. En los últimos años se han realizado estudios importantes con el objetivo de encontrar biomarcadores capaces de predecir el desarrollo de fibrosis pulmonar y que se correlacionen con el curso clínico y la respuesta clínica a distintos agentes terapéuticos59,60. Las proteínas Krebs von den Lungen 6 antígeno (KL-6) y los tensioactivos pulmonares A y D (PS-A y -D) se han relacionado con la aparición de EPI61,62. En una cohorte de pacientes japoneses se han encontrado niveles elevados de PS-A y -D en los pacientes con EPI, y se observó que la isoforma PS-D era más sensible para el diagnóstico e identificación de la fibrosis pulmonar que la A63. También se observó una correlación entre los niveles de PS-D, CV y DLCO60. Otro estudio encontró que pacientes con esclerosis sistémica tenían niveles más altos de ambas proteínas que los individuos sanos, y que los pacientes con alveolitis tenían niveles superiores a los que no la tenían64. Estos resultados se han confirmado posteriormente, y se observó que los niveles de KL-6 y SP-D se correlacionaban de forma positiva con el grado de fibrosis en TC, siendo la correlación de KL-6 superior65. Otro marcador, el ligando (CCL)-18, también se ha visto más elevado en esclerosis sistémica que en LES y personas sanas, y su aumento en esclerosis sistémica se encuentra asociado con fibrosis pulmonar y disminución de DLCO y FVC. Se vio que los niveles son inferiores en los pacientes con EPI inactiva que en aquellos con fibrosis activa66. Una glucoproteína, la YKL-40, puede ser un marcador para evaluar la afectación pulmonar en pacientes con esclerosis sitémica67, aunque no es específica, puesto que también está elevada en otras entidades, como la fibrosis hepática y numerosos tumores malignos.
El comienzo clínico es insidioso y las manifestaciones aparecen en una fase tardía, quizá por la relativa inactividad física de los enfermos con esclerosis sistémica, por lo cual es recomendable realizar un cribado con pruebas no invasivas ante la sospecha clínica de esclerosis sistémica. Al inicio de la enfermedad se deberían realizar radiografías de tórax y PFR, DLCO e incluso prueba de la marcha durante 6min y TCAR. Los síntomas más típicos son la tos seca, la tolerancia al esfuerzo limitada y la disnea progresiva, y generalmente no existe buena correlación clínica entre la disnea y los hallazgos radiológicos. Existe buena correlación entre la clínica, la DLCO y los hallazgos histológicos. La tos es poco frecuente, y en ocasiones puede existir hemoptisis secundaria a la presencia de telangiectasias bronquiales. En la exploración física se observan crepitantes bibasales tipo «velcro» al final de la inspiración, y en algunos casos cianosis, acropaquías y signos de insuficiencia cardiaca derecha.
La radiografía de tórax es poco útil para el diagnóstico precoz. La TCAR es la prueba de imagen más sensible para el diagnóstico precoz. En la EPI establecida se observa un patrón reticular bilateral que generalmente es más pronunciado en las bases, quistes con pared delgada en bases conocido como pulmón en panal. Con la TCAR podemos conocer el tipo de lesiones pulmonares y su grado de extensión, y detecta afectación hasta en el 44% de pacientes con radiografía de tórax normal. Se ha visto que el 85% de los pacientes que presentan una TCAR normal en el diagnóstico no desarrollan EPI a los 5 años del seguimiento68. Por ello se proponen la realización de TC al diagnóstico, y si no existe afectación repetir a los 2 y 5 años69. En la esclerosis sistémica podemos encontrar imágenes con patrón NINE, NIU, DAD y NOC. En el 76% de los casos se trata de NINE, mientras que la NIU solo se encuentra en el 11% de los casos70. En el momento actual está aceptado que la biopsia pulmonar no es necesaria en pacientes con EPI asociada a esclerodermia, excepto en los casos en que existe una discrepancia entre las manifestaciones clínicas y los hallazgos en la TCAR19. Se considera que existe una enfermedad limitada si hay un afectación <20% en la TCAR y extensa si es >20%71.
En todos los pacientes con escelerosis sistémica, aun en ausencia de síntomas, deben realizarse PFR como cribado. Lo más frecuente es la evidencia de un trastorno restrictivo con una reducción de la FVC por debajo del 80% y/o una diminución de la DLCO por debajo del 75. La diminución de la DLCO es el parámetro estático más sensible y el primero que se afecta. Se ha visto que hasta el 50% de pacientes con EPI pueden presentar alteraciones en las PFR al principio de la enfermedad, incluso estando asintomáticos, aunque solo el 16% presentan una disminución de la FVC por debajo del 55%72. Una disminución aislada de la capacidad de difusión confiere un pronóstico desfavorable para algunos autores73. La DLCO<40% se correlaciona con una supervivencia a los 5 años del 5%, mientras que con la DLCO>40% la supervivencia a los 5 años es mayor del 75%. La prueba de la marcha de 6min puede estar alterada en pacientes con esclerosis sistémica, incluso en algunos casos con otras PFR y TCAR normales. Pero esta prueba tiene varias limitaciones en estos pacientes: la medición de la saturación presenta dificultades por la presencia de fenómeno de Raynaud severo y las alteraciones musculoesqueléticas de estos enfermos hacen que los resultados no siempre sean reflejo de la afección pulmonar74.
Existen diferentes opiniones en cuanto a la utilidad y el significado clínico del BAL en pacientes diagnosticados de esclerodermia. El BAL no es específico, pero puede revelar la presencia de alveolitis inflamatoria con neutrófilos por encima del 3% y presencia de más del 2% de eosinófilos. La presencia de alveolitis en el BAL se correlaciona con la gravedad y se ha relacionado con el deterioro progresivo de la función pulmonar75.
La EPI asociada a conectivopatía tiene mejor pronóstico que la idiopática76. La raza negra y asiática, los varones, la afectación cardiaca y el inicio temprano de la enfermedad están asociados con afectación intersticial más severa77. El pronóstico empeora con una FVC y DLCO inferior al 70%, una afectación extensa en la TCAR y un deterioro rápido, definido por disminución del 10% de la FVC y del 15% de DLCO en un año. Se recomienda monitorización cada 6 meses con PFR, o antes, si existe un deterioro clínico en ausencia de una causa que lo justifique.
Por un lado hay que realizar un tratamiento de soporte básico que incluye oxigenoterapia en los casos que exista insuficiencia respiratoria, tratamiento rehabilitador y tratamiento del reflujo gastroesofágico, dado que es uno de los factores que se ha relacionado con la EPI tanto idiopática como asociada a conectivopatía. Por otro lado, el tratamiento farmacológico dirigido directamente a la EPI incluye el tratamiento con corticoesteroides y los inmunosupresores. Se recomienda el uso de corticoides en los casos con afectación pulmonar radiológica tipo NINE, si bien hay que recordar el riesgo aumentado que tienen estos pacientes de presentar crisis renales en relación con la administración de dosis elevadas de glucocorticoides, por lo que se recomienda el uso de dosis inferiores a 15mg/día. En las recomendaciones establecidas por EULAR se recomienda la ciclofosfamida para el tratamiento de la afectación pulmonar78. El tratamiento con ciclofosfamida ha demostrado que puede mejorar las PFR, los hallazgos de TC y la calidad de vida medida utilizando los cuestionarios HAQ y SF3679-82. La mejoría puede ser más importante en los enfermos con más afección pulmonar, con un FVC<70%82. Se ha visto que algunos de los efectos secundarios del tratamiento con ciclofosfamida oral pueden disminuirse con el uso de ciclofosfamida intravenosa82. Se han publicado algunos resultados del uso de micofenolato en pacientes con esclerodermia, en los que se demostraba una mejoría de la FVC a los 12 meses de tratamiento82,83. El rituximab ha demostrado mejoría de la enfermedad intersticial en algún caso aislado, y recientemente se han publicado los resultados a un año de un estudio aleatorizado realizado con 14 pacientes con esclerodermia, y se observó que el grupo que recibió tratamiento presentó una mejoría de FVC y DLCO84. El trasplante pulmonar es una opción en los pacientes con esclerodermia y EPI cuya afectación progresa a pesar de haber recibido tratamiento con ciclofosfamida.
Afección vascularHipertensión pulmonarLa esclerosis sistémica es la conectivopatía que con más frecuencia se asocia con HTP, y es una de las causas más frecuente de morbimortalidad. Es la manifestación más frecuente de enfermedad vascular pulmonar en la esclerosis sistémica, y su prevalencia varía, en función de las series consultadas, desde el 7 al 50%. Puede aparecer aislada o asociada a EPI. Es más frecuente en mujeres, y cuanto más edad tienen los pacientes en el momento de diagnóstico. La tercera parte aproximadamente de los pacientes se encuentran asintomáticos, y el síntoma más frecuente es la disnea de esfuerzo, que suele ser de comienzo tardío y progresiva. Otros síntomas, pero menos frecuentes, son los síncopes durante el ejercicio. La presentación clínica, el procedimiento diagnóstico y los tratamiento empleados no difieren del utilizado en la HTP idiopática85. Su aparición produce una disminución de la tasa de supervivencia del 88 al 40% a los 2 años de su diagnóstico. Por ello se recomienda la realización de ecocardiograma anual en todo paciente diagnosticado de esclerodermia. Se ha observado que los niveles de NT-proBNP y los de BMP activos en estos pacientes tienen una elevada sensibilidad y especificad para su diagnóstico, y que una diminución de la DLCO por debajo del 60% es un factor predictivo de desarrollo de HTP86.
Lupus eritematoso sistémicoEl lupus eritematoso sistémico (LES) es una enfermedad autoinmune que causa una inflamación generalizada con una expresión clínica muy diversa, ya que puede afectar a cualquier órgano. Su incidencia varía entre 3 y 8 por 100.000 habitantes, dependiendo del origen de la población. Es más frecuente en mujeres, con una relación mujer/hombre de 9/1, y su edad media de comienzo es a los 30 años.
Su etiología es desconocida, y existe un componente genético con participación poligénica sobre el que actúan otros factores, tanto endógenos (hormonas) como exógenos (sustancias químicas, fármacos, radiación ultravioleta, infecciones).
Las manifestaciones del aparato respiratorio son frecuentes en el LES, e incluyen afección de la pleura, del parénquima pulmonar, de la vía aérea y de la vasculatura pulmonar (tabla 2).
Manifestaciones pulmonares del lupus eritematoso sistémico
| Afectación pleural | PleuritisDerrame pleural |
| Afectación del parénquima | Neumonitis agudaNeumonitis crónica |
| Afectación vascular | Hipoxemia aguda reversibleTromboembolismo pulmonarHemorragia alveolar |
| Afectación de músculos respiratorios | Síndrome del pulmón encogido |
| Afectación de la vía aérea | CáncerLimitación al flujo aéreo |
La afectación pleural es la manifestación respiratoria más frecuentes del LES. El dolor de tipo pleurítico ocurre en el 40-50% de los pacientes en el curso de su enfermedad87, incluso sin alteraciones en la radiografía de tórax88,89. En el 5-10% de los pacientes puede ser la primera manifestación clínica90. En algunas series de autopsias se ha encontrado afectación pleural en el 93% de los pacientes con LES89.
El derrame pleural suele presentarse con disnea, dolor pleurítico, tos y fiebre. Generalmente es pequeño o moderado, y predominantemente bilateral. Puede ser recurrente. Tiene características de exudado con niveles de glucosa normales o ligeramente bajos, en general más altos que en la AR. La LDH está aumentada y el complemento, disminuido. En el líquido pleural se pueden encontrar ANA, anti-ADN y células LE.
El diagnóstico diferencial hay que hacerlo con derrame pleural de origen infeccioso, insuficiencia cardiaca, embolismo pulmonar y neoplasias. Generalmente el análisis del líquido pleural es diagnóstico y rara vez hay que realizar biopsia pleural, que estará indicada en caso de sospecha clínica de tuberculosis o neoplasia.
El dolor pleurítico generalmente cede con antiinflamatorios no esteroideos. El derrame suele responder a dosis moderadas de corticoides, aunque ocasionalmente puede ser necesario el uso de dosis altas. Si no se consigue una adecuada respuesta con corticoides se pueden añadir antimaláricos u otros inmunosupresores, como la azatioprina y la ciclofosfamida. En raras ocasiones es necesario el drenaje del derrame e incluso la pleurodesis en caso de derrames recidivantes90.
Afección parenquimatosaNeumonitis agudaEs una manifestación poco frecuente del LES, y ocurre en el 1-5% de estos pacientes91. En algunos casos puede ser la forma de presentación del LES92. Se caracteriza clínicamente por fiebre, disnea, tos y ocasionalmente hemoptisis. En la radiografía de tórax encontramos infiltrados bilaterales de predominio en bases. En la TACAR vemos infiltrados en vidrio deslustrado y zonas de engrosamiento reticular con patrón en panal. El examen anatomopatológico de la lesión no es específico y demuestra daño de la pared alveolar con necrosis, edema y hemorragia alveolar, formación de membranas hialinas, y puede aparecer también capilaritis. En los septos alveolares pueden encontrarse depósitos granulares de inmunoglobulina G y complemento89.
La frecuencia de esta complicación en más alta en los pacientes con anticuerpos anti-SSA93. El pronóstico es malo, con una mortalidad cercana al 50%. Tiene peor pronóstico si en el BAL existe un predominio de neutrófilos o eosinófilos y si aparece en el posparto. En los supervivientes puede evolucionar hacia una neumonitis intersticial crónica con gran alteración ventilatoria restrictiva.
Es fundamental hacer el diagnóstico diferencial con las infecciones, por lo que suele ser necesario realizar un BAL buscando potenciales patógenos. Se debe realizar tratamiento antibiótico empírico hasta que se ha descartado la infección. El tratamiento de la neumonitis aguda se basa en corticoides a dosis altas de 1-2mg/kg/día y, en pacientes muy críticos, pulsos de 1mg/día durante 3 días. En caso de falta de respuesta se pueden añadir otros inmunosupresores, como la ciclofosfamida, las inmunoglobulinas intravenosas y la plasmaféresis89.
Neumonitis intersticial crónicaEs una complicación poco frecuente del LES, con una prevalencia de alrededor del 3 al 9%94. Puede existir de forma subclínica en un tercio de los pacientes, en los que pueden observarse alteraciones en la TCAR a pesar de estar asintomáticos95.
La sintomatología es similar a las neumonitis idiopáticas, con disnea de esfuerzo progresiva, tos seca y aparición de crepitantes secos tipo «velcro» en la auscultación, con predominio en las bases. Los hallazgos radiológicos tampoco se diferencian de los producidos por la neumonitis idiopáticas. Puede aparecer infiltrados en vidrio deslustrado, patrón reticular y panalización. Los hallazgos radiológicos se relacionan y son predictivos del patrón anatomopatológico. El vidrio deslustrado se relaciona con patrón NINE, y el panal, con NIU. Los patrones histológicos que se encuentran en la enfermedad pulmonar secundaria a LES son similares a las neumonitis idiopáticas; el más frecuente es el patrón NINE, seguido del NIU, y también se han observado patrones de NIL y de NOC96.
El tratamiento se debe individualizar, ya que en general esta neumonitis es menos agresiva que las idiopáticas. Hay que descartar infecciones mediante BAL o biopsia pulmonar. El tratamiento se basa en corticoides a altas dosis, y a veces es necesario añadir otro inmunosupresor, como ciclofosfamida, azatioprina o micofenolato97.
La NOC se caracteriza histológicamente por la formación de tejido fibroso en los bronquiolos y en los conductos alveolares. Produce tos seca, disnea, dolor torácico, fiebre e insuficiencia respiratoria. En los estudios radiológicos encontramos infiltrados alveolares parcheados, periféricos, que pueden ser bilaterales, con engrosamiento de los bronquios. Se puede diagnosticar con biopsia transbronquial o, en ocasiones, con biopsia pulmonar. Suele evolucionar favorablemente al ser tratada con corticoides, aunque en ocasiones es necesario añadir algún otro inmunosupresor.
Hemorragia alveolar difusaEs una rara, aunque potencialmente fatal, complicación del LES. Su prevalencia oscila entre menos del 2 al 5,4% de los pacientes con LES, y puede ser la primera manifestación del LES98. Los síntomas se suelen desarrollar en horas o en pocos días, con fiebre, tos, disnea y hemoptisis. Generalmente ocurre en pacientes con LES activo. Radiológicamente se observan infiltrados alveolares bilaterales, y puede ser útil la resonancia magnética para demostrar la presencia de sangre90. La DLCO suele estar elevada, lo que la diferencia de la neumonitis aguda. El BAL es útil para descartar infección y permite confirmar el diagnóstico, ya que muestra macroscópicamente un líquido hemorrágico y microscópicamente abundantes macrófagos cargados con hemosiderina.
Es importante efectuar diagnóstico diferencial con infección, embolia pulmonar, vasculitis y descartar coagulopatías. El diagnóstico definitivo es la biopsia pulmonar, en la que se pueden encontrar 2 patrones: capilaritis con depósito de inmunocomplejos o hemorragia90.
El tratamiento se basa en el uso de corticoides a altas dosis junto con ciclofosfamida. También es útil la plasmaféresis. Y podría ser útil, aunque se necesitan más estudios, el rituximab99.
Afección vascularHipertensión pulmonarNo es una complicación frecuente del LES. Su prevalencia oscila entre el 3 y el 4% de los pacientes con LES, según las series100,101. No se relaciona con la duración ni con la gravedad del lupus, y puede ser una forma de presentación del LES. Tiene un peor pronóstico y peor supervivencia que la HTP primaria102.
La prueba diagnóstica es la ecografía-doppler, que permite estimar la presión arterial pulmonar y ayuda a descartar otras causas de HTP. Es necesario confirmar el diagnóstico con un cateterismo cardiaco derecho que mostrará una presión en arteria pulmonar >25mmHg y una presión de enclavamiento capilar <15mmHg con disminución del gasto cardiaco.
El tratamiento es similar a la HTP primaria, aunque los antagonistas de los canales del calcio no han demostrado tanta eficacia. Incluyen anticoagulación, antagonistas del calcio, antagonistas de los receptores de la endotelina (bosentán, ambrisentán), sildenafilo y prostaciclinas103,104. El tratamiento con inmunosupresores, como la ciclofosfamida, puede añadir algún beneficio adicional104.
Hipoxemia aguda reversibleSe refiere a un episodio de insuficiencia respiratoria sin clara evidencia de enfermedad pulmonar en pacientes hospitalizados por LES. Su patogenia no está clara, aunque se postula que se debe a leucoagregación y activación el complemento en los capilares pulmonares. Suele responder favorablemente al tratamiento con corticoides solos o en combinación con aspirina105.
Afección muscularSíndrome del pulmón encogidoConsiste en la aparición de disnea, alteración de los músculos respiratorios y una disminución de los volúmenes pulmonares en la radiografía de tórax, con elevación de los diafragmas y patrón restrictivo en las pruebas funcionales en ausencia de afectación parenquimatosa que lo justifique. La prevalencia es de alrededor del 0,9% de los pacientes con LES99.
Clínicamente los pacientes refieren disnea de esfuerzo, que a veces se mantiene con el reposo y empeora con el decúbito supino. La tos es rara. En la auscultación puede haber disminución del murmullo vesicular en las bases, y a veces crepitantes. Radiológicamente se manifiesta con elevación de los diafragmas y con atelectasias laminares en las bases. En las PFR observaremos un patrón restrictivo.
Tiene un pronóstico bueno y con aceptable respuesta al tratamiento, que consiste en corticoides, a los que se pueden añadir broncodilatadores y teofilina.
Afección de la vía aéreaLa afección de la vía aérea superior ocurre en el 0,3 al 3% de los pacientes con LES, en forma de inflamación de la mucosa laríngea, criocaritenoiditis y parálisis de las cuerdas vocales89,99. Generalmente tiene una buena respuesta al tratamiento con corticoides.
La afección sintomática de la vía aérea inferior también es rara en el LES. Se puede encontrar bronquiectasias y engrosamiento de las paredes bronquiales en el 20% de los lupus, pero suelen ser silentes. También se ha descrito la aparición de bronquiolitis obliterante en algunos casos en los que puede ser beneficioso el tratamiento con ciclofosfamida106.
Síndrome de SjögrenEl síndrome de Sjögren (SS) es una enfermedad inflamatoria autoinmune, lentamente progresiva, caracterizada por una infiltración linfocitaria de glándulas exocrinas que disminuye la función glandular y produce sequedad de las mucosas. Puede ser primario, si no está asociado a otras enfermedades del colágeno, o secundario, si se asocia a otras enfermedades del tejido conectivo. Su prevalencia es del 0,5 al 1,0%, y aumenta al 10-30% en pacientes con otras enfermedades del colágeno107-109. Se han descrito prevalencias de enfermedad pulmonar en enfermos de SS que varían entre el 9 y el 75%, dependiendo de los criterios y de los métodos usados para el diagnóstico110,111. En España se ha descrito una prevalencia del 11% de enfermedad pulmonar en enfermos con SS primario112.
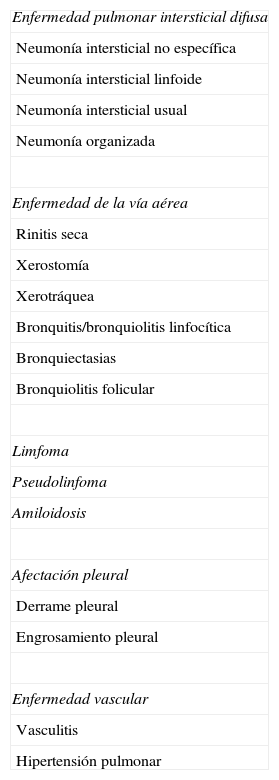
Puede afectar de varias formas al sistema respiratorio (tabla 3). La enfermedad pleuropulmonar es más frecuente en el secundario y la EPI en el primario113. Las afectaciones del parénquima y de la vía aérea pueden coexistir en un mismo paciente114.
Manifestaciones pulmonares del síndrome de Sjögren
| Enfermedad pulmonar intersticial difusa |
| Neumonía intersticial no específica |
| Neumonía intersticial linfoide |
| Neumonía intersticial usual |
| Neumonía organizada |
| Enfermedad de la vía aérea |
| Rinitis seca |
| Xerostomía |
| Xerotráquea |
| Bronquitis/bronquiolitis linfocítica |
| Bronquiectasias |
| Bronquiolitis folicular |
| Limfoma |
| Pseudolinfoma |
| Amiloidosis |
| Afectación pleural |
| Derrame pleural |
| Engrosamiento pleural |
| Enfermedad vascular |
| Vasculitis |
| Hipertensión pulmonar |
La EPI es la forma más común de afección pulmonar en el SS; aunque clínicamente significativa, solo ocurre en una minoría de pacientes. Sin embargo, las PFR pueden estar afectadas hasta en el 20%91.
Dentro de las neumonías intersticiales, la NINE es la forma que se asocia con más frecuencia al SS115,116. Clínicamente se manifiesta con disnea y tos seca. Provoca un patrón ventilatorio restrictivo y disminución de la DLCO. En el TCAR podemos ver patrón en retículas, bronquiectasias de tracción y patrón en vidrio deslustrado.
La neumonía intersticial linfocítica es una enfermedad linfoproliferativa benigna. Aunque clásicamente se ha asociado con el SS, puede aparecer en otras entidades como infección por VIH, síndrome de inmunodeficiencia variable común y otras enfermedades autoinmunes. Su prevalencia en el SS es del 0,9%110. Histológicamente se caracteriza por un infiltrado policlonal de linfocitos maduros, células plasmáticas e histiocitos tanto del intersticio como de los alvéolos. A veces se asocia a bronquiolitis folicular. Aunque algunos pacientes están asintomáticos, puede producir disnea y tos seca, mientras que otros síntomas como fiebre, pérdida de peso y sudoración son raros. En la TCAR podemos encontrar infiltrados en vidrio deslustrado, quistes de pared fina, nódulos de diferentes tamaños, nodulillos centrolobulillares y engrosamiento de septos. Las PFR se caracterizan por un patrón restrictivo con disminución de la capacidad de transferencia de CO. Al diagnóstico definitivo se llega por biopsia pulmonar. El tratamiento se basa en corticoides y otros inmunosupresores. Existe algún caso descrito que evoluciona favorablemente con rituximab116,117.
La NIU no es frecuente en pacientes con SS, y sus manifestaciones clínicas, radiológicas e histológicas no difieren de la NIU idiopática115. Solo se han descrito unos pocos casos de NO en pacientes con SS118,119.
Enfermedad de la vía aéreaLa vía aérea superior está afectada con frecuencia en el SS, siendo común la sensación de sequedad de la mucosa nasal, de la boca (xerostomía) y de la tráquea (xerotráquea), e incluso de grandes bronquios (xerobronquitis)120.
También la vía aérea inferior está frecuentemente afectada en el SS, y se suele manifestar con tos y disnea. Hasta el 46% de los pacientes con SS pueden tener un test de hiperreactividad bronquial positivo121. En las PFR se pueden observar datos de afectación de la pequeña vía aérea y de atrapamiento aéreo110. También en la TCAR se observan signos de atrapamiento aéreo que se correlacionan con el resultado de las PFR. Histológicamente se produce una infiltración de linfocitos y fibrosis peribronquiolar. En algunos casos también pueden aparecer bronquiectasias, sobre todo en los lóbulos inferiores, y más frecuentemente en pacientes mayores y con anti-SMA, lo que suele predisponerlos a padecer más infecciones respiratorias y neumonías122.
Enfermedades linfoproliferativasBronquiolitis folicularEs un tipo de enfermedad linfoproliferativa que en general coexiste con la NIL y la bronquitis linfocítica. Histológicamente se caracteriza por nódulos de infiltrados linfocitarios con una hiperplasia de centros germinales alrededor de los bronquiolos. Responde bien al tratamiento con corticoides107,108.
Granulomatosis linfomatoideEs una enfermedad rara, en la que se produce una proliferación linforreticular y granulomatosa angiodestructiva. Puede afectar al pulmón, a la piel y al sistema nervioso central.
LinfomaLa prevalencia de linfoma pulmonar primario en pacientes con SS se estima entre el 1 y el 2%112. En general son linfomas MALT de célulasB. Su presentación radiológica es muy variada, y puede aparecer como masas, nódulos únicos o múltiples que puedes estar cavitados, infiltrados difusos, y a veces es indistinguible radiológicamente de otro tipo de enfermedades benignas. El diagnóstico debe realizarse con biopsia pulmonar.
Enfermedad pleuralEl derrame pleural es muy poco frecuente en el SS primario, y en general aparece asociado a la AR. En el SS primario, cuando aparece, el derrame suele ser bilateral, con características bioquímicas de exudado, con pH y niveles de glucosa normales, con un predominio de linfocitos en el recuento celular.
Miopatías inflamatorias idiopáticasLas miopatías inflamatorias idiopáticas son un grupo heterogéneo de enfermedades de origen autoinmune que producen debilidad muscular debido a inflamación de los músculos esqueléticos. Las complicaciones pulmonares son la causa más frecuente de morbilidad y mortalidad en estos enfermos123. Aparecen en más del 40% de los pacientes124. Las más frecuentes son la neumonía aspirativa, la hipoventilación y la EPI difusa.
NeumoníasLas complicaciones infecciosas son frecuentes en estos pacientes. Hasta el 50% de los enfermos tienen disfagia, y la neumonía aspirativa puede aparecer en el 17% de estos pacientes. También son frecuente las infecciones oportunistas; Pneumocystis jiroveci y Candida albicans son los gérmenes más frecuentes125,126.
HipoventilaciónEl fallo ventilatorio debido a debilidad de los músculos respiratorios es un proceso raro en los pacientes con polimiosistis, y ocurre en menos del 5%123. Sin embargo, es más frecuente en la dermatomiositis. Se produce a causa de una alteración restrictiva por una disminución de los volúmenes pulmonares con descenso de la CPT, disminución de las presiones de inspiración (PIM) y espiración máximas (PEM). Los valores que pueden predecir esta fallo ventilatorio son una PIM y PEM<30% de su valor teórico y una FVC<55%123.
Enfermedad intersticial difusaEs una complicación frecuente en estos pacientes, con una prevalencia que varía entre el 5 y el 65% en diferentes series, dependiendo del método de diagnóstico127. En un estudio se ha llegado a demostrar una incidencia del 65%, por alteraciones en la TC o en las PFR, en pacientes recién diagnosticados de polimiositis o dermatomiositis128.
La enfermedad intersticial adopta 3 patrones de evolución en estos pacientes91,127: uno con un curso agudo de los síntomas, que puede llevar rápidamente a insuficiencia respiratoria grave, que suele corresponderse histológicamente con un DAD y en la radiología aparecen consolidaciones extensas y patrón en vidrio deslustrado; una forma con una progresión crónica, con un curso más insidioso, que es la más frecuente y en general se correlaciona con un patrón histológico de NINE y que se caracteriza radiológicamente por un patrón reticular con vidrio deslustrado, sin panalización; y una forma trivial, sin síntomas pero con alteración radiológica o funcional.
Existen evidencias de que determinados perfiles de autoanticuerpos se relacionan con subgrupos clínicos particulares de evolución. Así, los anticuerpos anti aminoacil-tRNA-sintetasa (Ac antisintetasa) son un factor predictivo de desarrollo de enfermedad intersticial129. El más frecuente es el antihistidil-tRNA-sintetasa (Ac anti-Jo-1), que se encuentra en el 20% de los pacientes con miositis130. Los portadores de estos anticuerpos desarrollan una enfermedad llamada síndrome antisintetasa, que se caracteriza por presentar EPI, artritis, miosistis, fenómeno de Raynaud y «manos de mecánico»131. Además, estos anticuerpos pueden aparecer en enfermos con EPI sin clínica de miopatía, y se ha postulado que deberían ser investigados en todos los pacientes con enfermedad intersticial132. La mayoría tienen una histología compatible con NINE y en general evoluciona favorablemente con tratamiento, aunque alguno puede tener un curso rápidamente progresivo, sobre todo en aquellos con patrón NINE133.
El tratamiento de estos pacientes se basa en corticoides, aunque generalmente precisan la combinación de otros inmunosupresores134 como ciclosporina y azatioprina. La ciclofosfamida se ha usado en casos de enfermedad refractaria a otros tratamientos134. El tacrolimus y el micofenolato también han resultado beneficiosos en algunos pacientes, aunque se necesitan más estudios para encontrar el tratamiento óptimo en estos pacientes135.
Enfermedad mixta del tejido conectivo/enfermedad indiferenciada del tejido conectivoLa enfermedad mixta del tejido conectivo es un trastorno inflamatorio sistémico en el que los pacientes tienen una combinación de hechos clínicos de SS, LES, esclerosis sistémica y miopatía inflamatoria, y frecuentemente títulos altos de anticuerpos anti-RNP. Puede tener las manifestaciones pulmonares de estas enfermedades. La incidencia de enfermedad pulmonar es desconocida; aunque puede llegar al 67%, generalmente es asintomática91. Puede aparecer EPI frecuentemente con patrón NINE, derrame pleural e incluso HTP.
Algunos pacientes presentan síntomas sugestivos de enfermedad del colágeno pero no cumplen criterios para ninguna enfermedad definida y son clasificados como enfermedad indiferenciada del tejido conectivo. La enfermedad intersticial que se asocia a esta entidad característicamente cumple criterios de NINE. Además, la NINE puede ser la manifestación inicial de una enfermedad indiferenciada del tejido conectivo136,137.
Tratamientos biológicos y enfermedad pulmonar intersticialLos nuevos fármacos biológicos usados en el tratamiento de las enfermedades autoinmunes han supuesto un gran avance en el tratamiento de estos procesos. Sin embargo, se han descrito varios casos de aparición de EPI o de agudización, incluso grave, de una enfermedad preexistente con el uso tanto de agentes anti-TNF (infliximab, etanercept, adalimumab) como anti-CD20 (rituximab) y anti-IL (tocilizumab)6. El abatacep podría ser un fármaco seguro en estos pacientes, aunque todavía son necesarios más estudios que permitan confirmarlo138.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.