Introducción
El niño presenta una serie de particularidades anatómicas y funcionales de las vías respiratorias superiores, junto con peculiaridades madurativas desde el punto de vista de la neurofisiología del sueño, que lo diferencian del adulto; así pues, tanto la clínica como las consecuencias físicas, cognitivas y madurativas del síndrome de apnea-hipopnea del sueño (SAHS) difieren en muchos aspectos de las que se producen en los adultos.
Es más, la edad pediátrica actual incluye etapas madurativas muy diferentes, que abarcan desde el neonato, tanto a término como pretérmino, hasta el adolescente. Su nexo de unión principal es que son individuos en crecimiento susceptibles a las influencias patógenas en los que el desarrollo cognitivo es especialmente vulnerable. Éstas y otras razones justifican un enfoque diferenciado del SAHS pediátrico.
Definiciones
La obstrucción de la Vía aérea superior (VAS) en el niño puede manifestarse como una apnea obstructiva completa o como una obstrucción parcial con hipoventilación. Esta hipoventilación es el resultado de la obstrucción parcial continua que conlleva a una respiración paradójica, hipercapnia y a menudo hipoxemia.
En realidad, lo correcto sería hablar de "problemas respiratorios relacionados con el sueño," ya que de esta manera se describe mejor un abanico clínico que incluye la apnea obstructiva, la hipopnea obstructiva y la resistencia aumentada en vías respiratorias, así como la implicación nocturna del asma y otras alteraciones respiratorias crónicas.
El ronquido es el síntoma que tienen en común los tres problemas respiratorios durante el sueño. Aproximadamente el 10-12% de los niños ronca. Muchos de ellos tienen el llamado ronquido simple no asociado a apnea, alteraciones del intercambio gaseoso o excesivos microdespertares. Su frecuencia declina a partir de los 9 años.
El hecho de roncar durante más de 4 noches a la semana se asocia significativamente con tos nocturna y asma1. El ronquido primario se suele resolver en el 50% de los niños con el tiempo2, mientras que su progreso a SAHS se observa en el 10% de los casos3.
En la actualidad, la inocuidad del ronquido simple está en entredicho, ya que se ha encontrado una asociación con déficit neurocognitivos probablemente relacionados con la fragmentación del sueño:
Los niños con ronquido simple (5-7 años) presentan menor porcentaje de sueño REM en relación con el tiempo de sueño total, un mayor índice de microdespertares y peores valoraciones en el test de Conners y en el Child Behavioural test, así como diferencias en la habilidad lingüística y visoespacial4.
El ronquido habitual único se asocia a un menor rendimiento escolar: de 22 niños con ronquido habitual, el 32% tenía mal rendimiento escolar, lo que sólo se observaba en el 15% entre no roncadores. Después de ajustar, el bajo nivel socioeconómico se asocia a más problemas respiratorios nocturnos. El ronquido se considera patológico si ocupa más del 30% del tiempo de sueño5.
La hipopnea en el niño es definida como una disminución ≥ 50% en la amplitud de la señal de flujo nasal/ oral, a menudo acompañada de hipoxemia o microdespertar. Ha habido intentos de clasificar las hipopneas en obstructiva y no obstructiva. La hipopnea obstructiva se define como una reducción en el flujo aéreo sin disminución del esfuerzo. La hipopnea no obstructiva asocia a reducción del flujo aéreo y una disminución del esfuerzo respiratorio del 50%6.
Los niños con síndrome de resistencia de las vías respiratorias superiores roncan y tienen una obstrucción parcial de la VAS que ocasiona episodios repetidos de un incremento del esfuerzo respiratorio que finaliza en un microdespertar. El patrón del sueño se altera y los síntomas diurnos pueden ser similares a los de la apnea obstructiva, aunque estos niños no presentan apneas ni hipopneas o alteraciones del intercambio gaseoso en la polisomnografía (PSG). Su incidencia en niños es desconocida, aunque parece ser más frecuente que el SAHS7.
La apnea obstructiva en niños se define8 como "una alteración de la respiración durante el sueño caracterizada por una obstrucción parcial prolongada de la VAS y/o una obstrucción completa intermitente (apnea obstructiva) que altera la ventilación normal durante el sueño y los patrones normales de sueño. Se asocia con síntomas que incluyen el ronquido habitual nocturno, las dificultades con el sueño y/o problemas de conducta diurnos. Las complicaciones pueden incluir alteraciones del crecimiento, alteraciones neurológicas y cor pulmonale, especialmente en los casos severos. Se han identificado y definido varios factores de riesgo".
La primera descripción médica de SAHS en niños se atribuye a Osler en 1892. En la bibliografía moderna, Guilleminault publicó la primera serie de niños con SAHS en 1976.
Prevalencia
Se estima que su prevalencia en los niños de 4-5 años el del 0,7-3%9, con un pico de incidencia entre los 2 y los 5 años. Solamente la mitad de los niños que roncan y en los que se sospecha una apnea obstructiva presentan esta enfermedad al realizar una PSG. Por esta razón, algunos autores han apostado por un tratamiento expectante si no se aprecian cambios en la clínica10, aunque esta actitud cada vez está más en entredicho por las consecuencias cognitivas. Muchos niños con SAHS tienen obstrucción continua u obstrucción parcial prolongada, por lo que el criterio diagnóstico adulto (índice de apnea > 5/h) no es válido.
En el estudio TuCASA se ha demostrado que en niños hispánicos entre 6 y 11 años hay un índice de alteraciones respiratorias por encima de las cuales se incrementa estadísticamente la prevalencia de sintomatología clínica: un índice de 5 (sin asociación con desaturación) se relaciona con una mayor prevalencia de ronquido simple, excesiva somnolencia diurna y problemas de aprendizaje. Cuando se asocia con una desaturación del 2%, el índice se reduce a 2, y cuando se asocia con una desaturación del 3%, a 1. Este estudio realza la importancia de las hipopneas en cuanto a la severidad del síndrome respiratorio11. Los niños con SAHS tienen mayor riesgo de enuresis12.
Las VAS de los niños son más resistentes que las de los adultos al colapso durante el sueño. Los niños normales tienen conservada la respuesta de la VAS a la presión subatmosférica y a la hipercapnia durante el sueño, mientras esas respuestas parecen estar disminuidas en los adultos; por tanto, parece que los niños tienen un patrón diferente de activación de las VAS. Es posible que esta respuesta conservada sea compensatoria de la relativa estrechez de la vía respiratoria infantil13. Sin embargo, también hay factores inherentes a su anatomía que facilitan el colapso: vías respiratorias altas más estrechas, posición más alta de la laringe, mayor laxitud de los tejidos y mayor flexibilidad cartilaginosa de las estructuras de soporte49,52.
La edad media de inicio de la apnea es de 34,7 meses mientras que el ronquido simple tiene una edad media de inicio de 22,7 meses14. A diferencia de lo que ocurre en los adultos, los niños con apnea obstructiva respiran mejor en posición supina15. La obstrucción respiratoria nocturna tiene una agregación familiar significativa, con independencia de las similitudes familiares en el peso16.
Patogenia
En la patogenia del SAHS infantil influyen factores anatómicos y factores funcionales, de manera que el SAHS pediátrico es la consecuencia de la combinación de resultados anatómicos y funcionales y no el efecto de un problema anatómico exclusivamente:
1. Factores anatómicos.
a) Nasales:
Estenosis o atresia de coanas.
Desviación del tabique.
Rinitis crónica.
Pólipos nasales.
Cuerpo extraño nasal o hematoma
b) Nasofaringe y orofaringe:
Hipertrofia adenoamigdalar. Supone tres cuartas partes de los casos en la mayoría de series. Aunque no todos los niños con hipertrofia adenoamigdalar tendrán SAHS, parece ser que su incidencia como causa de SAHS infantil ha aumentado en relación con el descenso de las indicaciones de amigdalectomía47-49.
Macroglosia entendida como una desproporción entre el continente (boca) y el contenido (lengua). A este respecto, resulta interesante la utilización de tratamientos ortodóncicos y ortopédicos que pueden variar esta proporción mediante su actuación en el continente. Las disyunciones y máscaras faciales que aumentan el espacio intraoral para alojar la lengua (sagital y transversalmente) pueden llegar a reducir la incidencia de este factor en la patogenia del SAHS. Los aparatos de disyunción maxilar llegan incluso a inducir cambios en la válvula nasal y el área turbinal inferior, mejorando la ventilación nasal de la VAS50,51. Por el contrario, algunos tratamientos de ortodoncia pueden reducir el espacio vital de la lengua, como las extracciones dentarias que disminuyen el tamaño del continente.
Higroma quístico.
Cirugía de paladar hendido que ocasiona una hipoplasia maxilar superior y en ocasiones desemboca en un SAHS.
c) Masa faríngea:
Displasias esqueléticas
Micrognatismo maxilar superior transversal o sagital (anteroposterior).
Micronagtismo mandibular y/o retrognatismo mandibular.
Hipoplasia mandibular, hipoplasia mediofacial, retrognatia o micrognatia y angulación aguda de base de cráneo (Pierre-Robin, Treacher Collins)54.
Hipoplasia hemifacial (síndromes de Down, Crouzon, Apert, Goldenhar, etc.). En el síndrome de Down se han publicado referencias de SAHS en el 30-70% de los casos52. Un estudio interesante es el de Uong et al51, en el que se analiza la VAS de 11 pacientes con síndrome de Down sin SAHS y la compara con la de 14 controles. El volumen de HAVA es menor en los pacientes con síndrome de Down y la grasa de la lengua, el paladar blando y la parafaringe es similar. Sin embargo, la vía respiratoria se ve reducida, pero es debido a que el esqueleto medio y bajo facial es más pequeño que en los controles53.
Traumatismo craneofacial.
2. Factores funcionales.
a) Hipotonía faríngea relacionada con el sueño REM.
b) Procesos infecciosos de las vías respiratorias repetidos: pueden agravar SAHS leves o desencadenar su desarrollo en niños55-57.
c) Los niños con SAHS muestran una menor respuesta neuromotriz de la VAS a la hipercapnia y la presión negativa, y su VAS es más colapsable, en contraste con los niños normales, lo que indica la presencia de diferencias estructurales entre ambos grupos. Tras la intervención se observa una recuperación parcial de estas variables funcionales58.
d) Mucopolisacaridosis (síndromes de Hunter o de Hurler). Desarrollan obstrucción de las vías respiratorias en la edad escolar por la macroglosia, el estrechamiento del tejido faríngeo y la hipertrofia adenoamigdalar.
e) Control neurológico anómalo:
Hipotonía generalizada.
Enfermedad del sistema nervioso central: asfixia perinatal, parálisis cerebral.
Alteración del troncoencéfalo:
* Malformación de Chiari II.
* Estenosis del foramen magno (acondroplasia).
* Anoxia, tumor, infección.
f) Fármacos:
Sedantes: hidrato de cloral, benzodiacepinas, fenotiacinas.
Anestésicos.
Narcóticos.
Antihistamínicos.
Descongestionantes nasales con uso prolongado.
g) Otros:
Disfunción autonómica.
Disfagia.
Secreciones orales excesivas.
Obesidad.
Prematuridad.
Glosoptosis59.
Clínica
La fragmentación del sueño, el incremento del esfuerzo respiratorio y las anomalías intermitentes en los gases sanguíneos son las consecuencias fisiológicas inmediatas más frecuentes asociadas con el aumento de la resistencia de la vía respiratoria que ocurre con el inicio del sueño17. Las diferencias más significativas en cuanto a presentación, alteraciones del sueño y modalidades terapéuticas del SAHS infantil frente al SAHS del adulto se exponen en la tabla I.
Solamente el 42% de las apneas obstructivas termina con una respuesta de microdespertar. Los microdespertares son significativamente más frecuentes en las apneas largas (> 15 s) y obstructivas que en las apneas centrales.
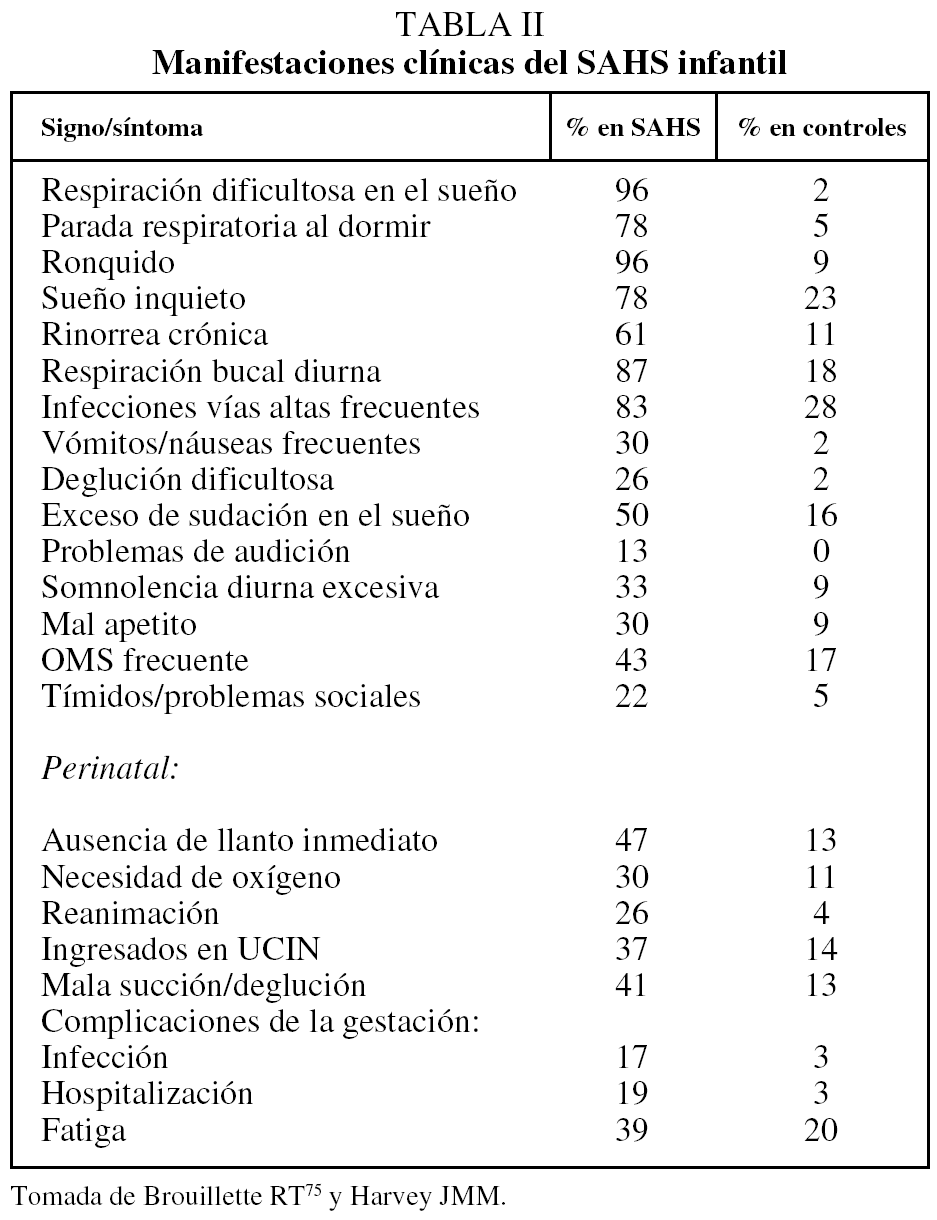
Sus manifestaciones clínicas son muy variadas como consecuencia del diferente grado de desarrollo, la severidad y las diversas etiologías, como queda reflejado en la tabla II.
Quizá la diferencia clínica más importante con los adultos radica en que el niño con problemas respiratorios nocturnos no presenta una somnolencia diurna excesiva de manera obvia en la mayoría de las ocasiones. Sin embargo, es necesario reconocer algunas peculiaridades que diferencian esta situación de la que acontece en la edad adulta.
Aunque la hipersomnia en la infancia se diagnostica en pocas ocasiones, según algunos estudios el 1,7% de niños de 4 a 12 años se duerme durante el día más de 7 veces a la semana y un 4% está cansado más de 7 veces a la semana18, un 11-12% de los niños de escuelas elementales tiene síntomas de somnolencia diurna y un 18-21% describe fatiga durante las horas escolares19,20. Entre un 63 y un 87% de los adolescentes informa que necesitarían más horas de sueño de las que duerme21.
Los niños pueden presentar síntomas de somnolencia diurna por 3 razones:
1. No duermen el tiempo que requieren sus necesidades personales (sueño insuficiente).
2. Su calidad de sueño es pobre (fragmentación del sueño), por ejemplo, por SAHS.
3. Tienen unas necesidades de sueño incrementadas, por ejemplo, en la narcolepsia.
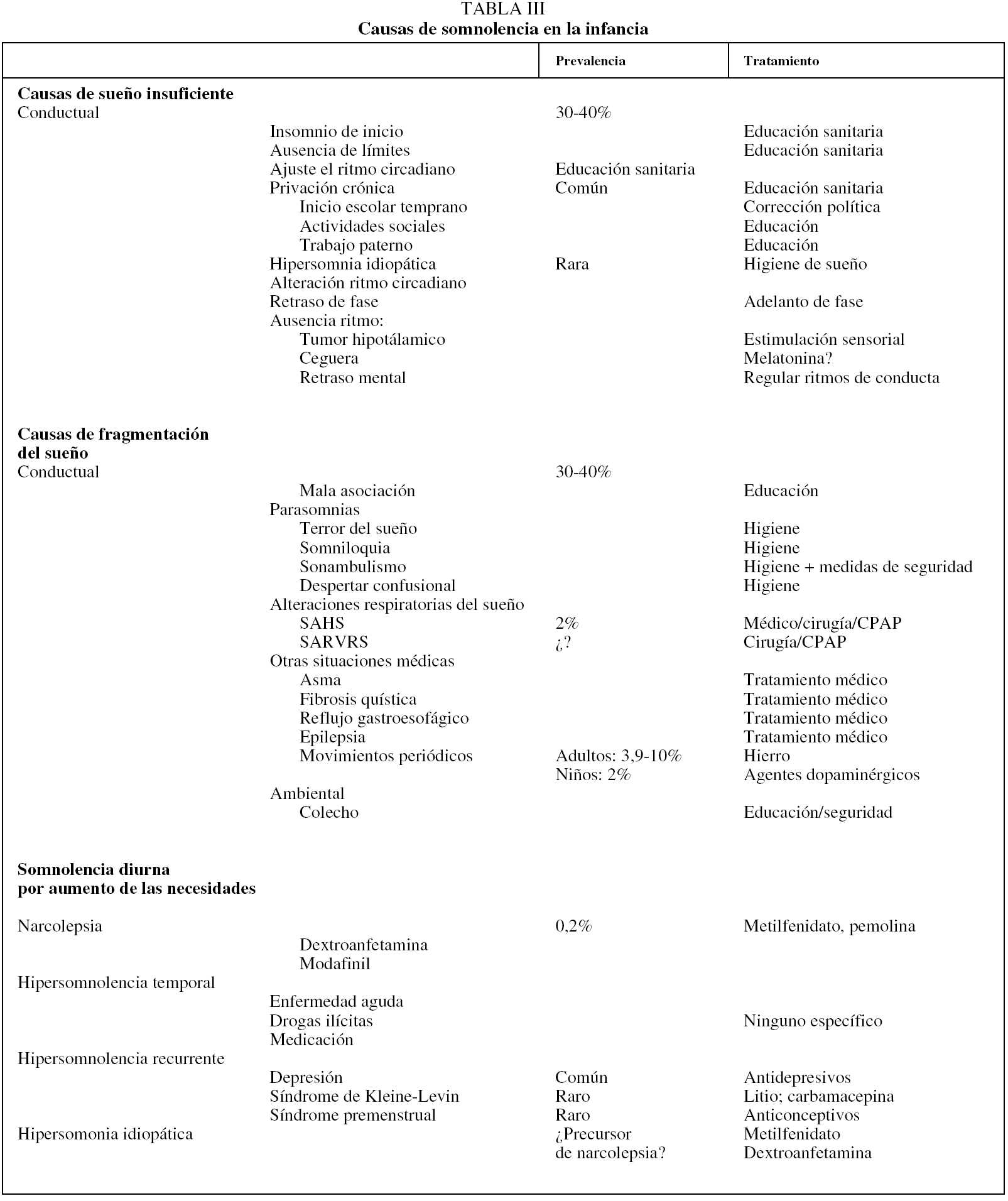
Las causas de somnolencia diurna en la infancia, su prevalencia y sus modalidades terapéuticas se exponen de manera esquemática en la tabla III22.
En niños, una latencia media de sueño < 5 min indica excesiva somnolencia diurna (ESD) severa; una latencia media de 5-10 min indica ESD moderada; una latencia media de 10-14 min indica una ESD moderada o mínima y una latencia media ≥ 15 min es considerada normal.
Comorbilidad
Una gran diversidad de entidades clínicas pediátricas cursan con apneas23:
Digestivas. Reflujo gastroesofágico (RGE), estenosis de píloro, aspiración, infección, malformación congénita (hernia diafragmática, fístula esófago-traqueal, anomalías funcionales). Cohen et al24 encontraron que la apnea precede al RGE en el 93,6% de los episodios y solamente un 6,4% de los episodios de apnea sigue al RGE. Demostraron que la apnea que precede al RGE es de mayor duración que la que no es precedida por RGE.
Neurológicas. Epilepsia, tumor cerebral, hematoma subdural, infección, respuesta vasovagal, malformación congénita.
Respiratorias. Infección, hipoventilación alveolar congénita, alteraciones respiratorias congénitas o adquiridas.
Metabólicas y endocrinas. Hipocalcemia, hipoglucemia, hipotiroidismo, déficit de carnitina, síndromes de Leigh y de Reye, fructosemia y otras intolerancias alimentarias.
Cardiovasculares. Miocardiopatías, arritmias, infección (endocarditis), anomalías de los grandes vasos, otras malformaciones.
Parasomnias. Los niños con parasomnias persistentes a menudo presentan problemas respiratorios durante el sueño y en menos proporción síndrome de piernas inquietas, observándose su mejoría o desaparición tras el tratamiento de los problemas respiratorios nocturnos25
Miscelánea. Asfixia, efectos de fármacos, botulismo, pielonefritis, sepsis, accidentes, errores en la nutrición, maltrato.
En la mayoría de los niños con SAHS se observa un incremento del esfuerzo respiratorio durante el sueño y de la sudación nocturna. La respiración bucal durante el sueño es igual de frecuente en los niños con apnea que en los niños sin ella.
Hay un incremento de la frecuencia de enuresis nocturna, que en muchas ocasiones se resuelve tras la adenoidectomía.
Hoppenbrouwers et al26 encontraron que los eventos motores ocurren después de 46, 54 y 86% de los episodios de apnea respectivamente al mes y a los 3 y 6 meses de edad. Vecchierini observó que la frecuencia electroencefalográfica aumenta después del 60% de las apneas, seguidas o no de eventos motores, sea cual sea el estado de sueño y el tipo de apnea.
SAHS y crecimiento
En cuanto a la relación entre apnea obstructiva y alteraciones del crecimiento, Nieminen et al27 no encontraron diferencias significativas en la concentración sérica periférica de IGF-1, pero tanto los niños con SAHS como los roncadores primarios presentan valores periféricos reducidos de IGFBP-3. Tras la intervención, el peso, la talla, el índice de masa corporal (IMC) y la masa grasa corporal aumentaron en los niños con SAHS, mientras que en los niños con ronquido simple sólo se incrementaron la masa grasa y la talla relativa.
Entre el 4 y el 13% de los niños con SAHS tienen problemas estaturoponderales; las causas descritas de estos problemas asociados a SAHS son28:
1. Anorexia o disfagia por hipertrofia adenoidea.
2. Secreción anómala de HGH.
3. Hipoxemia nocturna.
4. Acidosis respiratoria nocturna.
5. Aumento del trabajo respiratorio nocturno: el gasto de energía durante el sueño pasa de 51 ± 6 Kcal/kg/día antes de la intervención quirúrgica a 46 ± 7 Kcal/kg/día después de la intervención29. La velocidad de crecimiento se acelera después de la adenoidectomía.
6. Alteración de la arquitectura del sueño que interfiere en la liberación de la hormona del crecimiento30,31, que se produce sobre todo en las fases III y IV de ondas lentas.
SAHS y aparato cardiovascular
La presión arterial (PA) en pacientes pediátricos con trastornos respiratorios durante el sueño sin complicaciones severas está positivamente correlacionada con el grado de alteración respiratoria. A los 7-10 s de terminar cada episodio de apnea se produce un incremento de la PA. Los niños con un IAH > 10 tienen PA diastólicas y sistólicas mayores, tanto durante la vigilia como durante la fase REM, que los que tienen un IAH < 10. El grado de elevación de la PA durante el sueño REM está relacionado con el valor del IAH, mientras que durante el sueño no REM y la vigilia no muestra correlación con la severidad de la alteración respiratoria. Así pues, el IAH es uno de los mayores determinantes de la PA sistólica durante el sueño REM, de forma que la PA durante esta fase del sueño podría reflejar sensiblemente la severidad de la alteración respiratoria en los niños y estar envolucrada en la elevación de la PA durante la vigilia32.
La geometría y la estructura del ventrículo izquierdo se encuentran alteradas en los niños con SAHS33. Los niños con SAHS adecuadamente tratados muestran una mejoría evidente de la función de su ventrículo izquierdo34.
SAHS y alteraciones cognitivo-conductuales
La odds ratio (OR) para las alteraciones neuroconductuales en niños roncadores es de 2,93 (intervalo de confianza [IC] del 95%)35.
Se ha sugerido que la comorbilidad entre el síndrome de déficit de atención con hiperactividad (SDAH) y problemas respiratorios durante el sueño es alta. El mecanismo por el cual el problema respiratorio puede contribuir al déficit de atención es desconocido36.
En los niños con problemas respiratorios durante el sueño se multiplica por 3 la frecuencia de alteraciones de la conducta y problemas de atención37.
Se observa un acortamiento de la latencia de sueño en los niños con SAHS, pero es infrecuente la ESD, que tiende a desarrollarse en los casos más intensos o en los pacientes obesos38.
Mientras el tratamiento efectivo produce la normalización inmediata de las alteraciones respiratorias durante el sueño, la reversibilidad de la morbilidad secundaria asociada con el SAHS puede no ocurrir o puede no ser completa39.
El rendimiento escolar resulta afectado en estas alteraciones del intercambio gaseoso nocturno. Los niños con bajo rendimiento académico tienen más probabilidades de haber roncado durante la niñez temprana y de requerir una adenoamigdalectomía por ronquido, en comparación con sus compañeros con rendimiento escolar superior, de manera que la morbilidad neurocognitiva asociada a los trastornos respiratorios durante el sueño puede ser sólo parcialmente reversible, esto es, puede desarrollarse una "deuda de aprendizaje" en estos trastornos ocurridos durante la niñez temprana y perjudicar el rendimiento escolar posterior40.
En los niños que presentan hiperactividad y que no reúnen los criterios diagnósticos del SDAH, la Academia Americana de Pediatría recomienda, tras una exhaustiva evaluación, la realización de una cuidadosa historia de sueño y, si presentan ronquido, la realización de un estudio nocturno de sueño41.
SAHS y enuresis
La causa de la enuresis primaria es desconocida, aunque puede ser multifactorial. Los niños con SAHS tienen aumentada la producción de orina y la excreción salina, de manera que tienden a tener más micciones nocturnas, al tiempo que se produce un estado de hipercatecolaminas29.
Se ha especulado sobre la posible relación entre enuresis, respiración y saturación de oxígeno en sangre, lo que ha sido evaluado en sentido inverso, esto es, estudiando a pacientes en los que la resolución de la enuresis ha aparecido como efecto "espontáneo" secundario a la utilización de terapias que, al aumentar el calibre de las VAS, conducen a una mejora de la ventilación42-45.
Tras el tratamiento se reducen en un 66% las noches enuréticas al mes y en un 77% a los 6 meses. En el grupo de enuresis secundaria, ésta se reduce el 100% a los 6 meses46.
SAHS y muerte súbita del lactante
En el recién nacido pretérmino y el lactante de bajo peso hay un predominio de la fase REM, que destaca por la hipotonía muscular y la menor capacidad para despertar ante un fallo de la respiración automática. Steinscheneider demostró que los niños con un episodio aparentemente letal (EAL) que con posterioridad murieron de síndrome de muerte súbita del lactante (SMSL) presentaban gran cantidad de apneas cortas mientras dormían. En el SMSL, en ocasiones resulta indetectable el colapso de las VAS en los primeros días de la vida. Es sugestivo de obstrucción de la VAS, el hallazgo de una diferente distribución de las petequias en la necroscopia, lo que puede ser explicado por una presión intratorácica negativa antes de la muerte. Las apneas obstructivas del sueño deben ser documentadas en los niños fallecidos de SMSL, aunque la PSG no parece ser predictiva (A. Zurita Molina. Principales hipótesis y teorias patogénicas de la MSI. En: Camarasa Piquer, F, editor. Síndrome de la muerte súbita del lactante (SMSL). Libro Blanco. Madrid: Ergón; 1996).
Herramientas diagnósticas del SAHS pediátrico
La alta prevalencia del SAHS ha inducido a la Academia Americana de Pediatría a recomendar que todos los niños reciban una investigación sobre el ronquido en los controles de salud. Si presentan ronquido y, además, tienen síntomas o hallazgos clínicos sugestivos de SAHS se deben realizar pruebas adicionales.
El hecho de añadir un cuestionario específico sobre la apnea del sueño incrementa las posibilidades diagnósticas (de un 26% por la historia clínica a un 53% cuando se usa un cuestionario específico en niños con síndromes craneofaciales)60.
Los criterios diagnósticos utilizados en el adulto no pueden aplicarse al niño. A continuación se describen las técnicas diagnósticas utilizadas en pediatría.
Historia clínica completa general y del sueño
Los datos más destacables son:
Presencia de ronquido e intensidad de éste.
Evidencia de pausas respiratorias.
Posición habitual durante el sueño: suelen dormir con el cuello hiperextendido, posición prona con las rodillas debajo del tórax, posición semisentado o necesita varias almohadas. Son posiciones inconscientes que realizan durante el sueño buscando una mejor ventilación.
Enuresis secundaria.
Somatometría y cambios en ella.
Presencia de cambios escolares o conductuales: informe escolar.
El índice de Brouillette61 es un test que cada vez tiene menos credibilidad. Se trataba de un índice clínico basado en tres preguntas sobre la frecuencia de dificultad respiratoria nocturna, la observación de paradas respiratorias durante el sueño y la frecuencia del ronquido.
Exploración física completa con especial atención a la anatomía craneofacial y de las vías respiratorias altas: Hipertrofia adenoamigdalar
1. Exploración ORL. Es esencial realizar una exploración básica del área ORL y maxilofacial55,62. En primer lugar inspeccionaremos el aspecto externo.
Se sabe que la hipertrofia adenoidea o amigdalar pueden influir en el desarrollo de la hemicara inferior y mandibular al provocar respiración oral63,64. Aparece la denominada facies adenoidea caracterizada por mirada triste (ojos hundidos), acumulación de secrecciones en torno a las fosas nasales, boca abierta en reposo con queilitis comisural y restos de secrección salivar perioral. Tras la adenoidectomía en una edad precoz y/o el tratamiento ortodóncico-ortopédico durante el crecimiento hay evidencias de que estas anomalías pueden resolverse.
Realizaremos una observación de perfil para valorar las discrepancias maxilomandibulares, el micrognatismo o el prognatismo maxilar sagital y/o transversal, el retrognatismo o el prognatismo mandibular. Con esta simple exploración podremos evidenciar los casos de maloclusión dentoesquelética65.
Posteriormente exploraremos la cavidad oral y la orofaringe en busca de hipertrofias amigdalares; debe señalarse que en ocasiones pueden infravalorarse debido a que están muy introducidas en sus fosas o que lo verdaderamente oclusivo de la vía respiratoria sean sus polos inferiores (esto lo confirmaremos con la endoscopia). La ocupación de la vía respiratoria por amígdalas linguales hipertróficas también puede condicionar una posición lingual avanzada que favorece el desarrollo de la madíbula y limita el del maxilar superior.
Hemos de valorar también la forma del paladar duro, pues una compresión maxilar superior (paladar ojival) suele acompañar a una mala respiración nasal, o las fisuras palatinas, las alteraciones de lengua (macroglosia), el frenillo lingual corto y, finalmente, confirmar las alteraciones de oclusión dentarias.
La exploración nasal es importante para evidenciar alteraciones de permeabilidad debidas a dismorfias septales, poliposis u otras tumoraciones intranasales que provoquen dificultad respiratoria nasal57,64. Esta exploración nasal se completará con la endoscopia flexible, exploración en general bien tolerada por el niño y sin necesidad de anestesia local en niños colaboradores. Nos permite valorar, además de las fosas nasales, la hipertrofia adenoidea, las posibles atresias de las coanas, la intensidad de la obstrucción retropalatal y retrolingual y las eventuales alteraciones laríngeas62,65.
En el ámbito radiológico, la placa simple lateral de partes blandas de cuello puede mostrarnos con relativa fiabilidad el tamaño de las vegetaciones adenoides, aunque difícilmente predice el grado de obstrucción real, y menos durante el sueño63. Más importante es el estudio cefalométrico en los niños con alteraciones craneomandibulares60,61, y las técnicas de fluoroscopia, la resonancia magnética67,68 o la tomografía computarizada (TC) ultrarrápida o cine-TC que reproduce con precisión las vías respiratorias durante la fase de respiración y los períodos de apnea69. Esta técnica permite obtener imágenes cada 0,05-0,1 s y no precisa sedación. Sin embargo, parecen más fiables las imágenes de la tráquea y los bronquios que las de las vías más altas, en las que realmente está el problema.
2. Exploración cardiopulmonar:
Soplo sugestivo de regurgitación tricuspídea.
Observación del trabajo respiratorio, especialmente durante el sueño o reposo.
Presencia de cianosis.
Descripción del patrón y la frecuencia respiratoria.
Muchos estudios retrospectivos han demostrado que el SAHS no puede distinguirse del ronquido simple basándonos única y exclusivamente en la historia clínica y la exploración física. La correlación entre la clínica y los hallazgos PSG varían del 37 al 56% en función de los criterios polisomnográficos más o menos estrictos utilizados70,71.
Goldstein et al72 encontraron para el ronquido, las pausas, el dormir en posición de opistotonos, la excesiva somnolencia diurna, la facies adenoidea y audio durante el sueño una sensibilidad del 76,9%, un especificidad del 82,4%, un valor predictivo positivo del 76,9% y un valor predictivo negativo del 82,4%, si bien su serie era escasa (30 pacientes).
Audio y videograbación en el hogar
En la mayoría de las ocasiones, la exploración e inspección durante la vigilia es completamente normal y es necesario observar al niño durante el sueño. Desde la asistencia primaria, en ocasiones es posible solicitar a los padres la realización de una videograbación en el hogar. Sivan et al desarrollaron una escala (anexo 1) para valorar el vídeo realizado durante media hora por los padres en su domicilio en niños de 2 a 6 años de edad, y lo compararon con los hallazgos PSG en esos mismos niños. La grabación se realiza durante media hora con la cabeza y el tronco del niño visibles y sin ropa que impida observar los movimientos respiratorios. Se indica a los padres que realicen la grabación durante el período en el que ellos hayan observado con anterioridad una mayor incidencia de alteraciones respiratorias, respiración ruidosa o ronquido. Deben ser instruidos para evitar ruidos (incluyendo el ruido de los aparatos de grabación o la conversación en la habitación o en sus cercanías).
La sensibilidad y la especificidad del score del vídeo fue del 89 y del 77%, respectivamente, con los puntos de corte de 5 (todos los niños con una puntuación ¾ 5 tuvieron PSG normales) y 11 (todos los niños con una puntuación ≥ 11 tuvieron PSG patológicas). La alta sensibilidad (vídeo anormal con PSG anormal), junto con sus escasos falsos negativos (vídeo normal con PSG anormal) y la relativamente baja especificidad (vídeo normal con PSG normal) hacen de la grabación de vídeo en el hogar una herramienta útil para el cribado sin un excesivo coste. En los niños con una puntuación de 6 a 10 es necesario realizar una PSG. Cuando la puntuación es > 11, las probabilidades de SAHS son elevadas73 y según la valoración del Subcomité del SAHS de la Academia Americana de Pediatría35, la sensibilidad es del 94%, la especificidad del 68%. La conclusión de dicho Comité con respecto al uso de videograbaciones en el hogar es que son necesarios más estudios sobre su especificidad y sensibilidad para poderlos usar como una alternativa a la PSG.
Es preciso descartar por medios diagnósticos específicos la comorbilidad del RGE, el asma, la epilepsia y los problemas del desarrollo (parasomnias).
Cuestionarios
Chervin et al74 han desarrollado un test de cribado para niños de 2-18 años de edad desde asistencia primaria con una línea de corte del 33%, una sensibilidad de 0,85 y especificidad de 0,87 (anexo 2). Sin embargo, sus resultados, al igual que en otros cuestionarios desarrollados, son poco interpretables, pues no han sido comparados con la PSG.
Pulsioximetría
En la revisión realizada por el grupo de consenso sólo se ha encontrado un estudio en el que se relaciona la pulsioximetría con la PSG, con la realización simultánea de ambas pruebas pero evaluándolas de manera independiente. En este grupo de niños con una incidencia de SAHS del 60,2% en comparacón con la PSG nocturna, el valor predictivo positivo es del 97% y el negativo del 47%.
La pulsioximetría nocturna es útil como método de cribado cuando es positiva, mientras que los niños con resultado negativo requieren una PSG nocturna75.
Polisomnografía diurna
La conclusión que se puede extraer de los estudios que evalúan la PSG diurna de 1 h de duración76,77 es que un estudio de siesta con resultado negativo requerirá un seguimiento mediante PSG nocturna para su confirmación. Su valor predictivo positivo es del 77-100% y su valor predictivo negativo del 17-49% en una población con incidencia de SAHS del 66%. Su resultado positivo es útil a pesar de que puede infravalorar la intensidad del SAHS. El resultado negativo requiere una PSG nocturna. La diferencia en el valor predictivo de la PSG diurna y la PSG nocturna probablemente radique en la menor fase REM durante los estudios diurnos y en la disminución del tiempo total de sueño40.
Polisomnografía nocturna
Uno de los problemas para evaluar los diferentes métodos de diagnóstico del SAHS infantil con el patrón de referencia, la polisomnografía, es que ésta no ha sido bien estandarizada, ni en su técnica ni en su interpretación, a pesar de que últimamente se han realizado aproximaciones78,79. Así, en la bibliografía hay diferentes criterios polisomnográficos para definir el SAHS pediátrico80:
Criterio I. Más de 1 apnea obstructiva (ausencia de flujo durante 2 o más ciclos de un esfuerzo respiratorio continuado) por hora de sueño.
Criterio II. Más de 5 apneas o hipopneas (reducción del flujo, movilidad torácica o movilidad abdominal durante 2 o más ciclos respiratorios seguidos de una desaturación del 4% o más, un microdespertar o un despertar) por hora de sueño.
Criterio III. Más de una apnea, hipopnea o evento respiratorio relacionado con un microdespertar (un incremento gradual de la presión intratorácica negativa al final de la inspiración de al menos 5 cm de H2O durante 5 o más ciclos respiratorios, seguidos de un microdespertar o un despertar) por hora de sueño.
Marcus et al76 concluyeron en su estudio que una apnea con cualquier incidencia mayor de 1 evento por hora es anormal. La PO2 mínima no debe ser inferior al 92%.
La PSG, cuando incluye la determinación de CO2, permite el diagnóstico del síndrome de hipoventilación siempre y cuando se detecte la presencia de una presión de CO2 > 50 mm en más del 8-10% del tiempo (la presión esofágica en vigilia suele ser de 10 a 5 cm de H2O).
Se define un SAHS severo cuando hay un índice de alteración del sueño (RDI: número de eventos respiratorios obstructivos/hora de sueño) > 10,0 y/o un punto más bajo de saturación de oxígeno < 90%. Un SAHS moderado se define ante la presencia de un RDI entre 5,0 y 10,0 y un nadir de saturación > 90%82.
En las bases del conocimiento actual, este grupo de consenso cree que un índice de apnea obstructiva entre 1 y 3 debe ser tomado como la línea de corte de la normalidad. Mientras que un índice de apnea de 1 es estadísticamente significativo, no conocemos qué nivel de significado clínico tiene81.
Una de las ventajas de la PSG es que nos permite cuantificar la gravedad del SAHS. La presencia de un SAHS importante durante la PSG es un factor de riesgo para complicaciones durante el período postoperatorio inmediato.
Ante la presencia una excesiva somnolencia diurna es necesario plantear la realización de un test de latencias múltiples o un test de mantenimiento de la vigilia.
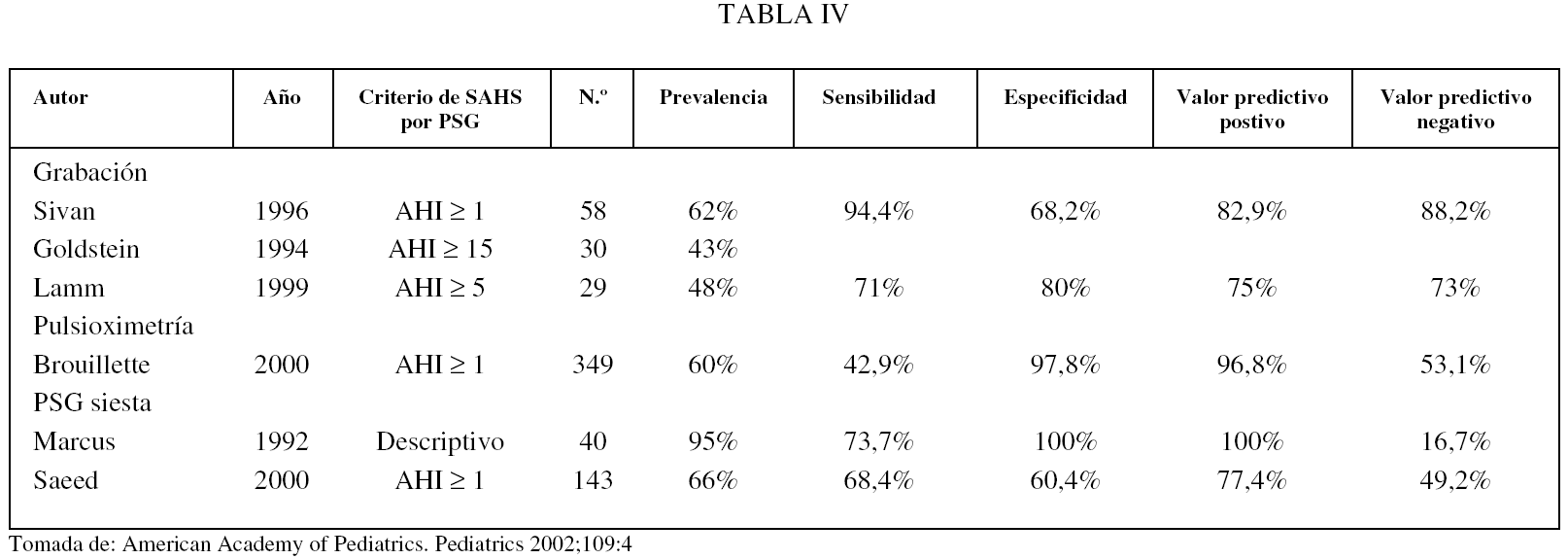
En la tabla IV se valoran la sensibilidad, la especificidad y los valores predictivos positivo y negativo de algunas estas técnicas comparándolas con la PSG nocturna. Del estudio de esta tabla podemos concluir que la evaluación clínica, incluidos los cuestionarios dirigidos, tiene una baja sensibilidad y especificidad, inaceptable para el diagnóstico del SAHS.
Desde el punto de vista práctico en cuanto al diagnóstico del SAHS pediátrico podríamos concluir:
La PSG nocturna sigue siendo el patrón diagnóstico de referencia.
Los recursos disponibles de PSG pediátrica son escasos y se prevé un incremento de su demanda en un futuro. El escaso número de unidades con dedicación pediátrica está condicionado en parte por las peculiaridades de tamaño del paciente, la mayor exigencia de tiempo en su preparación por su escasa colaboración, las dificultades de interpretación de los registros por la ausencia de personal especializado en somnología pediátrica, etc.
La historia clínica y la exploración física no permiten distinguir el ronquido simple del SAHS.
En aquellos niños en los que haya una alta probabilidad pretest de presentar SAHS, la pulsioximetría nocturna tiene un elevado poder predictivo positivo. Dado su bajo poder predictivo negativo, los niños que presenten un test negativo deben ser estudiados mediante PSG nocturna.
Los estudios PSG de siesta son poco sensibles para evaluar la gravedad del SAHS.
En casos no complicados la poligrafía respiratoria junto con la oximetría y las videograbaciones domiciliarias pueden tener una alta correlación con los hallazgos de PSG82.
Las técnicas simples realizadas en el hogar deben ser aplicadas con precaución, pues hay escasos estudios que las validen en este grupo de edad.
Si se sospecha algún cuadro comórbido al SAHS (epilepsia, MPP, etc.) se requiere la realización de una PSG nocturna vigilada.
Así pues, en asistencia primaria, la evaluación clínica de un niño con el objetivo de descartar o confirmar la presencia de SAHS y priorizar su atención debe incluir, en opinión de este grupo de consenso84:
Historia clínica estándar completada con una historia de sueño.
Exploración pediátrica estándar con especial valoración del área ORL.
Child Behavioral Test cumplimentado por los padres o un test de evaluación psicomotriz de validez semejante.
Test clínico de sospecha de SAHS, de Chervin o similar.
Telerradiografía lateral de cráneo y cefalometría específica de la VAS.
De manera optativa, en función de las posibilidades técnicas, se debería incluir la valoración del trabajo respiratorio durante el sueño mediante videograbación casera y la pulsioximetría nocturna.
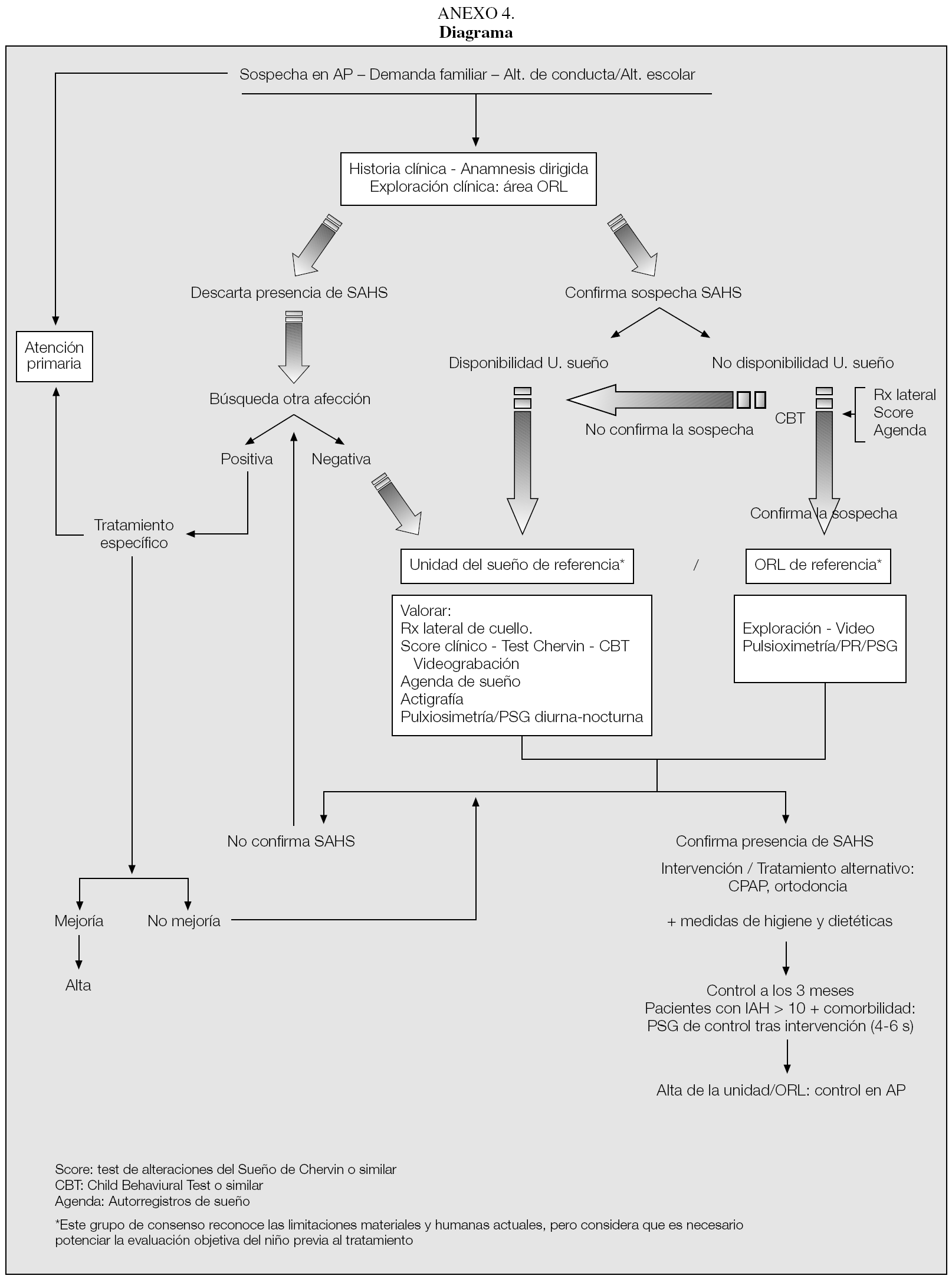
La valoración conjunta de estas técnicas deberá facilitar la indicación o no de derivación del paciente a una unidad de sueño (preferible) o al servicio de ORL de referencia para completar el estudio e indicar el tratamiento de elección (véase diagrama en anexo 4).
Tratamiento del SAHS pediátrico
El tratamiento se puede dividir en cuatro categorías:
Tratamiento quirúrgico
Las técnicas quirúrgicas que se han aplicado son:
Adenoamigdalectomía.
Traqueotomía.
Cirugía plástica maxilar/mandibular.
Tratamiento de atresia o estenosis de coanas.
Revisión del paladar hendido.
Uvulopalatofaringoplastia.
Corrección del tabique desviado.
Pólipos nasales.
La adenoidectomía/adenoamigdalectomía suele ser el tratamiento de elección en la mayoría de las situaciones, con una mejoría que ronda el 75%. La adenoamigdalectomía es el tratamiento más extendido y eficaz en casi tres cuartas partes de los casos de SAHS infantil. Consigue la normalización del cuadro respiratorio nocturno, de la sintomatología diurna y la reversión en muchos casos de las complicaciones cardiovasculares, las alteraciones neurocognitivas y el retraso en el crecimiento. Sin embargo, la adenoidectomía aislada no es, en general, efectiva para tratar el SAHS infantil85.
La última Revisión Cochrane disponible indica que no es posible saber si la adenoidectomía aislada, la amigdalectomía aislada o la combinación de ambas reportan alguna ventaja. Esta revisión afirma que en el presente, debido a la ausencia de suficientes estudios doble ciego, la eficacia del tratamiento de la apnea del sueño con adenoidectomía debe ser investigada y se necesitan más estudios antes de recomendar de manera sistemática la adenoidectomía en estos casos86. La Revisión Cochrane a este respecto concluye que la bibliografía disponible sobre los efectos de la adenoamigdalectomía en la apnea obstructiva pediátrica contiene problemas metodológicos que incluyen la falta de aleatorización y controles, así como variaciones en las definiciones y variables tenidas en cuenta. La evidencia disponible procedente de ensayos no aleatorizados y trabajos no controlados hasta el momento sugiere que la adenoamigdalectomía es a menudo de ayuda en el tratamiento del SAHS en niños. Así pues, los clínicos deben continuar realizándolas en los niños con SAHS significativo y asegurarse de sus beneficios en cada caso concreto. Debido a la necesidad de realizar investigaciones de calidad, la cirugía debe efectuarse como parte de un completo enfoque clínico.
Posteriormente a esta revisión, Goldstein demostró que los niños, por otro lado sanos, con datos clínicos sugestivos de SAHS se benefician de la intervención incluso cuando la PSG es normal87. Uno de los efectos beneficiosos de la adenoamigdalectomía es la mejoría significativa en los parámetros objetivos que miden la conducta (especialmente la intención de la acción y la impulsividad) tras la intervención88. Por ejemplo, Mitchell et al89 en un estudio de 60 niños con SAHS y Avior et al90 con 19 operados con adenoamigdalectomía demuestran una significativa mejora de las alteraciones del sueño, los síntomas físicos y emocionales y la función diurna y el comportamiento89,90. Por otro lado, también se ha demostrado un descenso en la utilización de consumos sanitarios después de esta intervención en este tipo de enfermedad91.
Este grupo de consenso recomienda realizar siempre adenoamigdalectomía si bien, a criterio del cirujano, éste puede decidir una u otra aislada en función de cuál esté hipertrofiada y cuál no según la exploración.
La ausencia de ronquido posquirúrgico se correlaciona bien con el éxito de la intervención; así, se ha comprobado un valor predictivo negativo del ronquido postadenoamigdalectomía del 100%, mientras que el 57% de los niños que continúan roncando tiene alteraciones polisomnográficas (valor predictivo positivo del ronquido del 57%)92.
Es necesario tener en cuenta que se ha estimado que en el 20% de las intervenciones se observa un SAHS residual93.
El riesgo posquirúrgico pediátrico oscila entre el 0 y el 1,3%; sin embargo, en los niños con SAHS se han encontrado tasas del 16-27%94. Se ha comunicado una mayor incidencia de complicaciones respiratorias postoperatorias cuando la indicación de la adenoamigdalectomía ha sido el SAHS. Ruboyianes et al95, por ejemplo, comunican una incidencia de complicaciones de la vía respiratoria en estos pacientes de un 16% en un estudio realizado en 44 niños con SAHS. En algunos centros, por cuestiones de rentabilidad económica, se tiende a realizar esta cirugía de forma ambulatoria. Si esto es así, se recomienda que en los casos de SAHS se evite95,96. Rosen et al94 aconsejan un control postoperatorio de los casos de más riesgo: los menores de 2 años, los casos con anomalías craneofaciales, retraso de crecimiento, hipotonía, cor pulmonales o graves alteraciones en el estudio polisomnográfico previo97. Los factores de riesgo en cuanto a un compromiso respiratorio serio en el postoperatorio inmediato mencionados en la bibliografía son98:
Edad < 3 años.
SAHS severo en la PSG.
Complicación cardíaca del SAHS.
Obesidad mórbida.
Retraso de crecimiento estaturoponderal.
Historia de nacimiento pretérmino.
Enfermedad cardíaca congénita. Hipertensión pulmonar.
Infección respiratoria reciente.
Enfermedad neuromuscular.
Anomalía craneofacial. Fisura palatina.
Alteración cromosómica.
Gillan et al99 sugieren que la pulsioximetría nocturna puede utilizarse para estimar la severidad del SAHS y diseñan una escala con una sensibilidad del 71% para los que van a requerir alguna intervención respiratoria durante el período posquirúrgico inmediato.
Tras la intervención, los niños que continúan roncando deben ser revaluados para descartar la presencia de SAHS residual. Se han observado, además, casos de reproducción de los síntomas tras la pubertad, sobre todo en varones, o de persistencia de síntomas residuales tras la cirugía. Ello se debe a una insuficiente evaluación de la problemática antes de la intervención, ya que puede haber otras alteraciones junto con la hipertrofia adenoamigdalar, como hipertrofia de paladar blando, retropulsión mandibular o hipertrofia basilingual. Se recomienda, por ello, que los niños operados sigan siendo evaluados con posterioridad, tanto clínica como polisomnográficamente.
Se han descrito multitud de técnicas de amigdalectomía. Los procedimientos con el paciente despierto (Sluder) son inaceptables hoy día debido al alto riesgo de complicaciones. La disección con anestesia general e intubación orotraqueal es el procedimiento más habitual. Se han descrito múltiples modificaciones de la técnica de disección (disección fría, bipolar, láser, criocirugía, radiofrecuencia, etc.) que no han disminuido significativamente la morbilidad de la intervención ni la tasa de complicaciones.
Técnica de amigdalectomía por disección fría. El procedimiento universalmente admitido es la técnica de disección. Esta técnica se realiza en un quirófano correctamente equipado y con anestesia general con intubación orotraqueal. Con el paciente en decúbito supino, el cirujano se coloca detrás de la cabeza y, con la ayuda de un abrebocas que deprime la lengua, se procede a la disección extracapsular de las amígdalas ("disección fría")100.
Amigdalectomía por electrodisección. El electrobisturí y el electrocauterio se utilizan en cirugía para muchas intervenciones. Se consigue una hemostasia del campo quirúrgico más fácilmente que con otras técnicas y se acorta el tiempo operatorio. Se puede realizar con bisturí monopolar o bipolar ayudado o no con microscopio. Con bisturí monopolar, el dolor es superior a la disección fría100,101. En un estudio llevado a cabo en Estados Unidos y basado en un cuestionario que respondió un total de 418 centros sobre las técnicas utilizadas para la extirpación amigdalar, el electrocauterio monopolar fue la técnica más utilizada, con un 53,5% de los centros, y la causa más abogada fue la reducción del riesgo de sangrado102.
Radiofrecuencia. Consiste en la generación de calor por medio de radiación electromagnética. La radiofrecuencia se puede utilizar como instrumento de disección para realizar la amigdalectomía total extracapsular (similar a la disección fría y a la electrodisección), como bisturí para realizar amigdalotomía (o amigdalectomía parcial) o como reductor del volumen amigdalar por medio de una sonda de radiofrecuencia en el interior de la amígdala.
Con la radiofrecuencia se consiguen temperaturas tisulares más bajas que con el láser o el electrocauterio, con un menor daño térmico tisular, lo que ocasiona menos dolor postoperatorio que la electrodisección103.
En un estudio reciente en 101 niños con SAHS, aleatorizados para recibir radiofrecuencia y electrocauterio, Chang demuestra un postoperatorio mejor tolerado en el grupo en el que se utilizó la radiofrecuencia104.
Láser de CO2. El láser CO2 puede utilizarse como instrumento para la disección extracapsular (amigdalectomía total) o como bisturí para la amigdalotomía (amigdalectomía parcial):
1. Amigdalectomía total (disección extracapsular): no posee ventajas comprobadas y sí un alto coste. Es una técnica lenta, por lo que está reservada sólo para los pacientes con enfermedades tales como hemofilia u otros trastornos importantes de la coagulación. Debido a las altas temperaturas tisulares se produce más dolor que con técnicas tradicionales y no se reduce la hemorragia postoperatoria en comparación con otras técnicas.
2. Amigdalectomía parcial (amigdalotomía): es una alternativa razonable para la hipertrofia amigdalar obstructiva. Junto con la amigdalotomía con radiofrecuencia, es la técnica con menor morbilidad (mínimo sangrado intraoperatorio y postoperatorio, y escaso dolor postoperatorio) debido a la ausencia de desgarro de la cápsula amigdalina105.
Otra técnica también utilizada es la del bisturí microdesbridador con realización de amigdalotomías parciales que aumentan el paso aéreo. Con estas técnicas parciales parece conseguirse, según diversos autores, un postoperatorio más rápido y menos doloroso. Como señalan Koltai et al106 en un estudio comparativo con esta técnica entre la cirugía parcial o total, no hay diferencias en cuanto a los resultados.
La uvulopalatofaringoplastia (UPFP) es más agresiva. Hasta el momento no hay ningún estudio aleatorizado que avale la conveniencia de utilizarla en etapa pediátrica. La UPFP se ha utilizado en niños con SAHS y paladar y/o úvula hipertróficos. Sin embargo, en los niños no hay series amplias y debe tenerse mucha precaución con las estenosis y las insuficiencias velofaríngeas. En una serie de Kerschner et al107 en 15 niños con SAHS y alteraciones neurológicas, intervenidos con esta técnica asociada a adenoamigdalectomía, se demuestra que el 77% en el seguimiento a largo plazo son exitosos, pero que el 23% necesita intervenciones adicionales con posterioridad107.
Otras técnicas quirúrgicas. Otras cirugías, como la glosopexia, utilizada sobre todo en casos de Pierre-Robin, los avances maxilares y las correcciones de las anomalías congénitas en niños con síndrome de Crouzon o Apert, la cirugía septal o de masas nasales en casos con estos problemas, siempre con una correcta selección de los casos y con la experiencia necesaria, pueden ser útiles. Las estrategias terapéuticas, sobre todo en los casos de malformaciones, deben ser individualizadas a cada caso. En estos casos de cirugía mayor maxilofacial para estas malformaciones, a pesar de corregirlas correctamente, no siempre consiguen solucionar el SAHS, e incluso algunas de estas correcciones, como la de hendidura palatina, pueden desencadenar SAHS107.
Algunas series, como la de Burstein et al108 realizada en 1995, recomienda la cirugía de suspensión lingual del hioides y procedimientos de expansión esquelética para evitar la traqueotomía. Estos autores realizaron esta cirugía en 28 niños con malformaciones craneofaciales y SAHS en su trabajo108. Otros trabajos, como el de Witterborn et al109 en 2004, también se encuentran en esta línea; estos autores publican los casos de 17 niños entre 5 y 120 días con micrognatias severas a los que realizaron de forma exitosa cirugía mandibular, evitando así la traqueotomía109. Otro trabajo es el de Bell et al110, en el que se señala que la cirugía de avance esquelético es útil en los niños con SAHS severo refractario al tratamiento médico. En este trabajo se indica que el tratamiento fue exitoso en 4 de ellos y que este éxito no únicamente depende de la posición esquelética, sino también de la adaptación neuromuscular110.
La traqueotomía sabemos que es absolutamente eficaz para resolver el SAHS, tanto en niños como en adultos, pero sus consecuencias físicas y psíquicas, sobre todo en la población infantil, hace que intentemos evitarla siempre al máximo; debe ser un tratamiento transitorio que une a su efectividad un gran número de limitaciones y efectos secundarios, así como una cierta morbilidad intraoperatoria y postoperatoria. En esta población puede ser útil como método de espera a las cirugías agresivas que deban realizarse con posterioridad cuando el niño alcance una edad mayor y en casos en los que la aplicación de la CPAP por alteraciones anatómicas graves no sea posible. La traqueotomía no es, pues, una técnica de elección en el SAHS pediátrico; sus indicaciones serían:
Niños con problemas craneofaciales (síndrome de Pierre-Robin).
Determinadas displasias óseas.
Intubación prolongada.
Estenosis glótica, subglótica o laringotraqueal.
Tumores.
Parálisis laríngea.
Traqueomalacia.
Enfermedades neurológicas.
CPAP nasal
Durante los últimos años, la CPAP se está convirtiendo en la segunda línea de tratamiento cuando el SAHS persiste sin resolver a pesar de la intervención quirúrgica. Sus indicaciones serían niños con SAHS asociado a otras enfermedades, niños por otra parte sanos con SAHS residual tras la intervención, en el período prequirúrgico para estabilizar a los niños con riesgo de compromiso postintervención o en el ínterin del crecimiento craneofacial y dental hasta la intervención quirúrgica definitiva.
Como complicación se ha descrito hipoplasia facial del tercio medio por un largo uso111. Para Guilleminault, el uso del auto-CPAP en niños y adolescentes es seguro, efectivo y bien tolerado112, aunque la experiencia actual es escasa. Se debe brindar especial atención al tamaño de la máscara (con necesidad de cambio aproximadamente cada 6 meses según el período evolutivo), así como a los puntos de sujeción, evitando la generación de puntos de presión. Para mejorar el cumplimiento terapéutico es necesario adiestrar a los padres y acostumbrar al niño a la máscara sin presión durante el día, enseñándole a dormirse primero con la máscara no conectada, como demostraron McMara et al113. Con esta preparación informan de una buena tolerancia, del 86%; un período de aclimatación a la máscara en casa permite recuperar un 26% de los pacientes que de entrada la rechazan.
Las presiones medias necesarias para mejorar la obstrucción suelen oscilar entre 4 y 6 cm y es necesario realizar controles frecuentes, pues los requerimientos de presión cambiarán con el crecimiento y el desarrollo del niño. Padman et al114 utilizaron BiPAP y encontraron que los pacientes (edad media de 11,7 años y un presión de 5/3 a 14/7) determinan su propio flujo y la frecuencia y, en general, mantienen un patrón respiratorio más natural.
Tratamiento conservador
Se realiza mediante la observación, la pérdida de peso y la terapia posicional. Muchas veces es poco efectivo, especialmente en cuadros intensos, y la pérdida de peso sola no es suficiente para solucionar el problema. Es el tratamiento indicado en niños mayores con un problema mínimo.
Tratamiento médico
No es, generalmente, el tratamiento de elección de primera línea:
Insuflación de la faringe durante el sueño. La insuflación de oxígeno puede disminuir la desaturación, pero no el número de apneas, e incluso puede favorecer el desarrollo de una hipoventilación alveolar significativa115.
Descongestivos nasales durante períodos breves. No se ha demostrado su eficacia.
Esteroides nasales tópicos. En un estudio con niños de 2 a 14 años se encontró que 50 µg de budesonida 2 veces la día durante 4 semanas mejoraba la clínica en pacientes con un SAHS mediano. Este efecto se mantenía hasta 9 meses116. Así pues, los corticoides tópicos parece que tienen algún efecto beneficioso en niños por otra parte sanos con un SAHS leve o moderado, y pueden desempeñar un papel en determinados casos92.
Profilaxis del SAHS
Se han identificado algunas de las técnicas eficaces para el tratamiento del SAHS pediátrico que pueden generar anomalías faciales que favorecen su persistencia (CPAP infantil e hipoplasias del tercio medio facial). Si bien los tratamientos ortopédicos no obtienen resultados inmediatos, sí que hay que considerar el papel profiláctico que puede derivarse de un tratamiento ortodóncico-ortopédico que corrija o mitigue las anomalías maxilomandibulares en edades tempranas, conduciendo a un desarrollo adecuado del patrón esquelético facial. Todo ello conforma un soporte de la VAS menos susceptible al colapso.
Puntos básicos que se deben tener en cuenta frente a la apnea obstructiva según la medicina basada en pruebas117:
1. Los tres síntomas con mayor poder predictivo de la presencia de SAHS son el ronquido profundo, la dificultad para respirar durante el sueño y las pausas respiratorias (o esfuerzo respiratorio) durante el sueño observadas por los padres. El ronquido primario no puede ser distinguido de la apnea del sueño sólo mediante la historia clínica (III-2).
2. El factor anatómico más frecuentemente asociado en los niños es la hipertrofia adenoamigdalar. El riesgo de obstrucción de la VAS no depende del tamaño de la adenoides y las amígdalas per se, sino de su tamaño relativo comparado con el tamaño de la vía respiratoria (III-2).
3. El SAHS altera claramente el desarrollo normal y el funcionamiento del niño.
4. La compleja interacción de varios factores en el SAHS explica el retraso de crecimiento observado.
5. Se debe prestar especial atención a los detalles del sueño (movimientos, sudación, sueño intranquilo, etc.), un aspecto generalmente olvidado en la historia clínica.
6. El examen realizado durante la vigilia a menudo es completamente normal.
7. Una saturación sanguínea normal por la mañana no excluye la presencia de hipoxemia o hipoventilación nocturna.
8. Los niños con SAHS tienen mayor riesgo de complicaciones postoperatorias.
9. La adenoamigdalectomía es el tratamiento de elección en los niños con SAHS (III-2). La CPAP se indica en los niños que no responden a la intervención o en los que ésta no es posible.
10. Hay un elevado riesgo postoperatorio en los niños que tienen un cuadro severo de apnea obstructiva, comorbilidad (p. ej., hipoplasia facial) o son menores de 3 años (III-2).
No todos los niños con síndrome de apnea obstructiva del sueño se curan con la adenoamigdalectomía. Aproximadamente el 20% necesita ser revaluado y, posiblemente, ser tratado de nuevo (III-2)
11. La PSG nocturna es el método ideal para detectar y graduar la severidad del síndrome de apnea nocturna en los niños (III-2).
El tratamiento del SAHS ocasionado por hipertrofia adenoamigdalar reduce el gasto sanitario de estos niños tras la intervención en un tercio. Los gastos sanitarios previos a la intervención en el grupo de niños con SAHS es 2,5 veces el gasto de los niños control. La intervención se asocia con una reducción del 60% de los ingresos hospitalarios, del 47% en el número de consultas, del 39% en visitas a servicios de urgencia y del 27% en el gasto farmacológico, de manera que durante el segundo año tras la intervención los niños intervenidos reducen su gasto sanitario en un 32,5%118.
El diagnóstico y el tratamiento del SAHS pediátrico, así como el ámbito en el que éste debe ser desarrollado según este grupo de consenso, quedan resumidos en el anexo 4.
Un aspecto que debe tomarse en consideración y que sin duda aumentará su presencia en el futuro es la posible prevención del SAHS del adulto en edades tempranas, donde con medios ortodóncicos es viable estimular o inhibir el crecimiento sagital y/o transversal mandibular o maxilar y, por ende, inducir cambios en las VAS, consiguiendo una conformación de la vía respiratoria menos susceptible al colapso119,120.