Introducción
La resistencia a la quimioterapia, independientemente de los mecanismos que la produzcan, puede ser innata o adquirida1. Dos características tumorales parecen determinarla: la cinética de crecimiento2 y, en estrecha relación con ésta, la aparición de mutaciones espontáneas3,4. Muchos tumores, entre ellos los de pulmón, al recibir quimioterapia siguen aparentemente las reglas enunciadas por Skipper y Simpson-Herren4 y Goldie y Coldman3. La mayor parte de los pacientes con cáncer de pulmón de células no pequeñas no responden inicialmente a la quimioterapia5; o sea, presentan resistencia intrínseca o innata.
No hay una definición claramente establecida de qué es un tumor "resistente" desde el punto de vista clínico. Algunos autores6 estiman apropiado emplear criterios de valoración de respuesta a la quimioterapia como los de la Organización Mundial de la Salud, donde se consideran sensibles los tumores con respuesta completa, y resistentes o parcialmente resistentes, los demás. Dado que hasta el momento no se ha identificado ningún mecanismo que por sí solo confiera resistencia a todos los fármacos conocidos7,8, es muy probable que esta resistencia sea de causa multifactorial.
La reducción de la acumulación intracelular de los fármacos es uno de los mecanismos más frecuentes de resistencia a los antineoplásicos. Esto puede producirse por su expulsión a través de la membrana celular9,10, por secuestro en vesículas citoplásmicas6, por variaciones en el transporte entre núcleo y citoplasma o por alteración en el metabolismo intracelular del fármaco11.
En 1973, Dano12 descubrió la expulsión activa de daunomicina en células tumorales resistentes, un descubrimiento que inició la historia de las proteínas causantes de resistencia a múltiples fármacos (MDR-proteínas), cuyo estudio ha sido objeto de interés cotinuado13. Las Mrp se localizan en la membrana plasmática, al igual que la Pgp, mientras que la Lrp se localiza en los vaults citoplásmicos13-15. Los vaults16,17, de descripción relativamente reciente, son ribonucleoproteínas que tienen una compleja composición y estructura casi idéntica en especies filogenéticamente tan alejadas como amebas y humanos, lo que parece indicar que su función es esencial para las células eucariotas.
El objetivo del presente trabajo es determinar mediante estudio inmunohistoquímico la expresión de las proteínas Pgp, Mrp1 y Lrp (MDR-proteínas) en muestras tumorales de pacientes afectados de cáncer de pulmón, así como su posible respuesta a la quimioterapia según la expresión de dichas proteínas.
Material y métodos
El presente estudio se ha realizado en muestras de tejido tumoral de pacientes diagnosticados y/o tratados de cáncer de pulmón en el Hospital Donostia de San Sebastián entre abril de 1995 y junio de 1997 (tabla I).
Obtención y conservación de las muestras
Se obtuvieron muestras quirúrgicas y broncoscópicas. Durante el acto quirúrgico se tomaban 2 muestras de la zona tumoral, que se introducían en criotubos y se almacenaban en una cubeta portátil de nitrógeno líquido hasta su procesamiento. En cuanto a las muestras broncoscópicas, se tomaba sólo una, con la que se procedía del mismo modo que con las piezas quirúrgicas.
Se recogieron 147 muestras tumorales procedentes de 143 pacientes. De ellas, 35 eran broncoscópicas y 112 quirúrgicas. De 4 pacientes se dispuso de muestra quirúrgica y broncoscópica, y se optó por procesar únicamente la quirúrgica. No fueron válidas para el estudio 46 muestras: 27 broncoscópicas por ausencia de tumor y 19 quirúrgicas (15 por ausencia de tumor, 3 por quimioterapia previa y una por tumor de origen no pulmonar). Resultaron válidas para el estudio 101 muestras correspondientes a 99 pacientes. Finalmente el estudio se realizó en 99 muestras de 99 pacientes, 6 de ellas broncoscópicas y 93 quirúrgicas.
Estudio inmunohistoquímico de las muestras tumorales y reactivos utilizados
Las muestras tumorales criocongeladas se sometieron a análisis inmunohistoquímico para la detección de las 3 MDR-proteínas: Pgp, Mrp1 y Lrp. Para ello se utilizó la técnica comercial de estreptavidina-biotina (LSAB, Dako Barcelona, España), junto con anticuerpos monoclonales no comerciales que procedían de un laboratorio de investigación universitario (Universidad Libre de Ámsterdam).
En cuanto a los reactivos empleados, se utilizaron los siguientes anticuerpos monoclonales: MRPr1 y MRPm6, que reconocen la proteína Mrp1; LRP-56, que reconoce la proteína Lrp, y JSB-1, que reconoce la proteína Pgp. Se utilizaron un sistema de visualización LSAB y equipos de diamonobencidina (Dako), con acetona, suero bovino y PBS (solución tampón de fosfato salino).
Variables del estudio
Variable dependiente: expresión de MDR-proteínas. Se cuantificó la proporción de células que reaccionaban con el anticuerpo monoclonal. Se consideró positiva cuando un 10% o más de las células de la preparación expresaban la proteína. El estudio de la expresión de MDR-proteínas y su relación con las diferentes variables clinicopatológicas se realizó de 2 formas:
1. Individual o independiente: analizamos la expresión de cada proteína por separado, sin tener en cuenta si se expresaba sola o asociada a las otras.
2. Simultáneo: analizamos la expresión conjunta de MDR-proteínas en los pacientes desde diferentes puntos de vista: a) expresión positiva frente a expresión negativa, con independencia del número o tipo de proteína expresada; b) número de proteínas expresadas simultáneamente, con independencia del tipo (ninguna, una, 2 o 3), y c) número y tipo de MDR-proteínas expresadas simultáneamente (ninguna, Pgp, Mrp1, Lrp, Pgp + Lrp, Mrp1 + Pgp, Mrp1 + Lrp y las 3 a la vez).
Variables independientes:
Edad.
Sexo.
Tipo histológico. Las muestras se clasificaron, mediante examen en microscopio óptico tras tinción con hematoxilina-eosina, siguiendo los criterios de la Organización Mundial de la Salud en los siguientes tipos histológicos: carcinomas escamosos, adenocarcinomas, carcinomas indiferenciados de células grandes, carcinomas indiferenciados de células pequeñas y otros.
Grado de diferenciación histológico. Se determinó el grado histológico de las muestras por tinción con hematoxilina-eosina y examen al microscopio óptico. La zona más indiferenciada de la muestra fue la que marcó el grado, que se clasificó en uno de los siguientes grupos: bien diferenciado, moderadamente diferenciado y escasamente diferenciado.
Estadio tumoral. Se estableció por el sistema TNM, según la clasificación de la Unión Internacional contra el Cáncer de 1997. Se utilizó el estadio clínico en los casos no tratados quirúrgicamente y el estadio patológico en los restantes.
Variables clinicopatológicas (variables independientes): a) examen anatomopatológico (tipo histológico y grado de diferenciación), y b) revisión de los historiales clínicos, de los que se recogieron datos correspondientes a las siguientes variables: edad, sexo, estadio tumoral, intervalo sin enfermedad, supervivencia y respuesta a la quimioterapia. Para determinar la supervivencia fue necesario establecer contacto telefónico en varios casos, y en otros se consultó el registro de mortalidad del País Vasco.
Resultados
La edad media ± desviación estándar de los 99 pacientes fue de 64 ± 10,2 años. La serie está formada por 85 varones, con una media de edad de 64 ± 9,7 años, y 14 mujeres, con 61 ± 13 años. En cuanto a la histología, 93 pacientes presentaban tumores de células no pequeñas (49 carcinomas escamosos, 37 adenocarcinomas y 7 carcinomas indiferenciados de células grandes), 3 carcinomas indiferenciados de células pequeñas y 3 con otras histologías (un carcinoma con diferenciación neuroendocrina, un carcinoma sin más especificación y un tumor carcinoide). En cuanto al grado de diferenciación histológica, en 20 casos fue bien diferenciado, en 35 moderadamente diferenciado, en 43 escasamente diferenciado y en un paciente no pudo especificarse el grado. Por lo que se refiere a los estadios tumorales, 45 casos se hallaban en estadio I (IA: 14; IB: 31); 23 en estadio II (IIA: 0; IIB: 23); 22 en estadio III (IIIA: 15; IIIB: 7), y 9 en estadio IV.
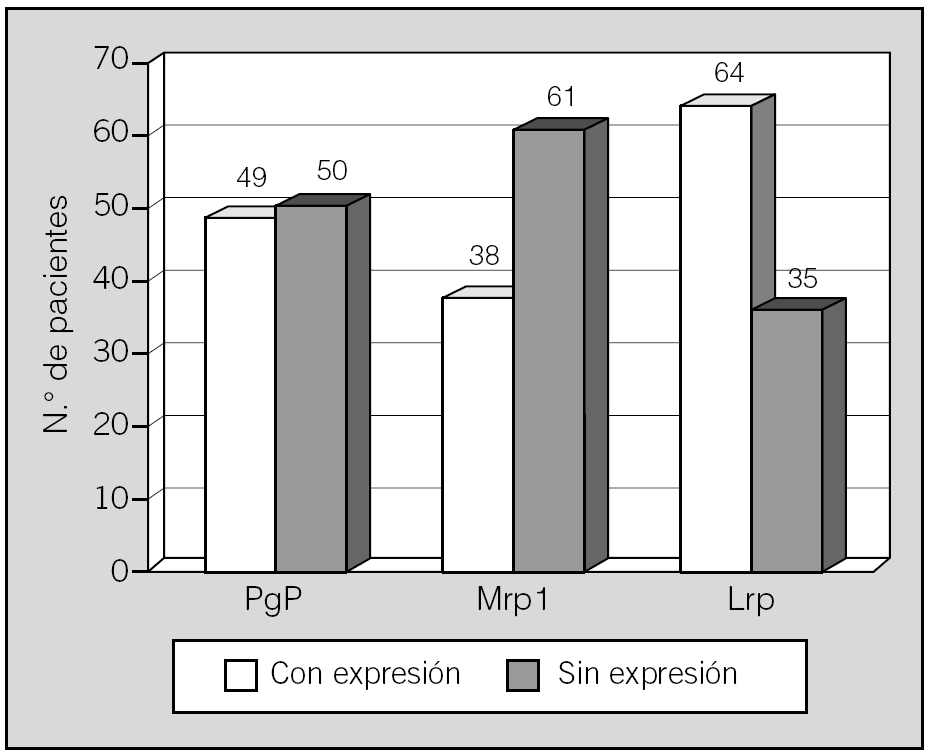
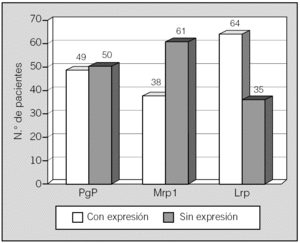
La expresión de las proteínas estudiadas aparece reflejada en la figura 1. La expresión independiente de cada una fue del siguiente modo: la Pgp no se expresaba en 50 pacientes (50,5%) y sí se expresaba en 49 (49,5%); la Mrp1 no estaba expresada en 61 casos (61,6%) y sí lo estaba en 38 (38,4%); la Lrp no se expresaba en 35 pacientes (35,4%) y se encontró expresada en 64 (64,6%).
Fig. 1. Expresión de proteínas relacionadas con resistencia a múltiples fármacos en los 99 pacientes de la serie.
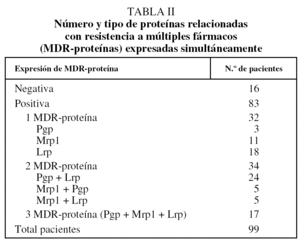
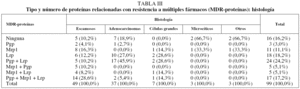
De los 38 pacientes con expresión de Mrp1, 30 presentaron positividad para los 2 anticuerpos monoclonales empleados, mientras que 8 (4 para cada anticuerpo monoclonal) fueron positivos sólo para uno de ellos. De los 99 pacientes, 83 expresaban alguna MDR-proteína y 16 no expresaban ninguna (tabla II). La distribución de acuerdo con el tipo histológico se recoge en la tabla III.
En cuanto al análisis de la tendencia de las MDR-proteínas a expresarse en solitario o asociadas, el resultado fue el siguiente: a) de los 49 casos en que se expresó la Pgp, en 3 (6%) lo hizo sola y en 46 (93%) asociada (con Lrp en 24 casos, con Mrp1 en 5 casos y con Lrp y Mrp1 simultáneamente en 17); b) de los 38 casos en que se expresó Mrp1, en 11 (29%) lo hizo sola y en 27 (71%) asociada (con Pgp en 5 casos, con Lrp en otros 5 y con Pgp y Lrp de forma simultánea en 17), y c) de los 64 casos en que se expresó Lrp, en 18 (28%) lo hizo sola y en 46 (72%) asociada (con Pgp en 24 casos, con Mrp1 en 5 casos y conjuntamente con Pgp y Mrp1 en 17). La tendencia de Pgp y Lrp a expresase asociadas resultó muy significativa (p < 0,01), pero no la asociación de Pgp y Mrp1 (p = 0,18) y Mrp1 y Lrp (p = 0,26).
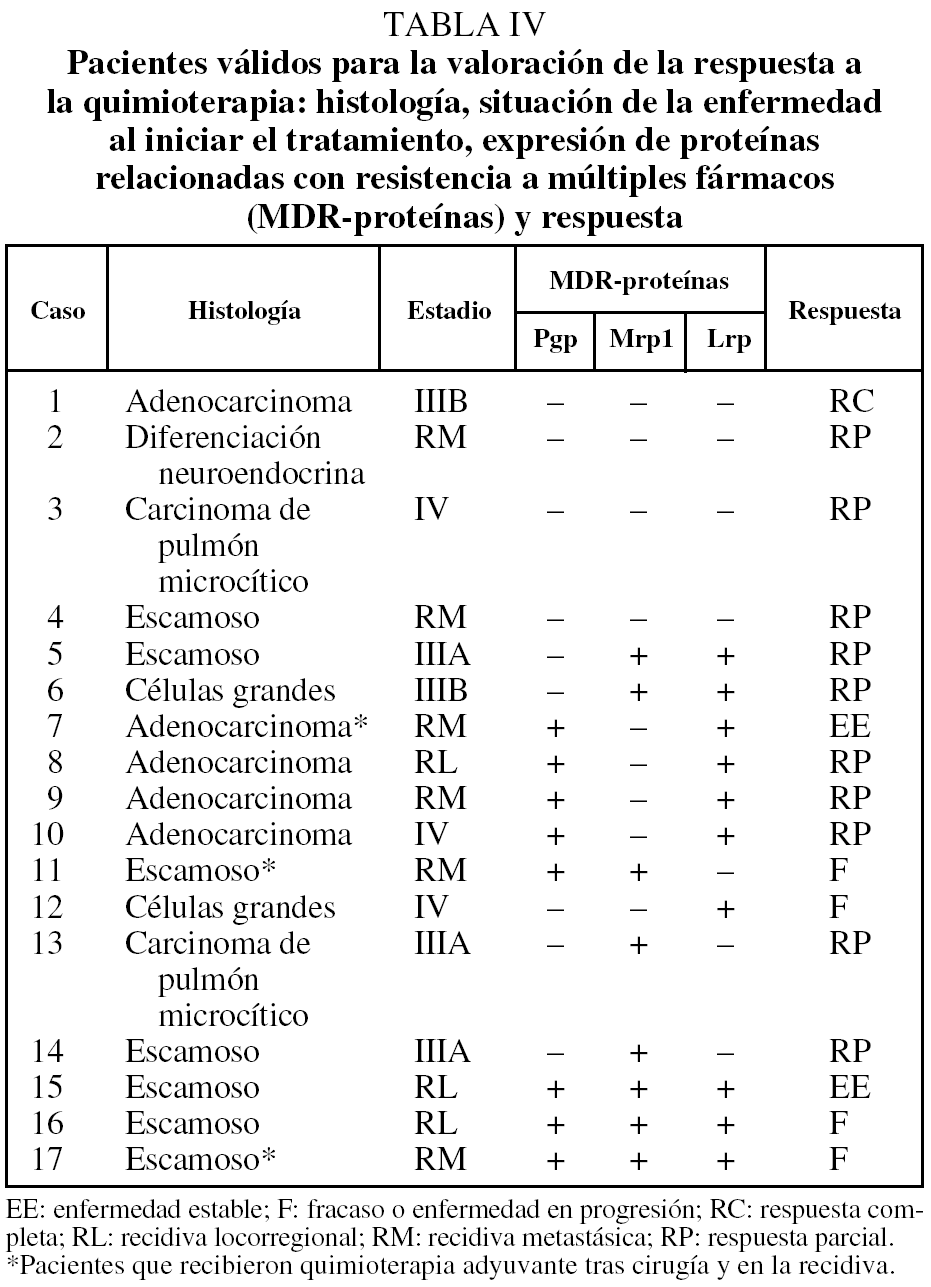
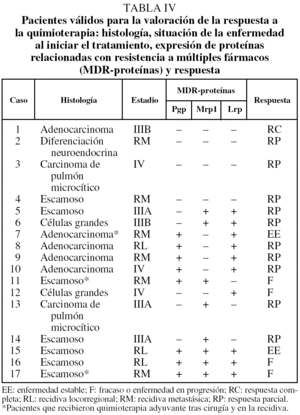
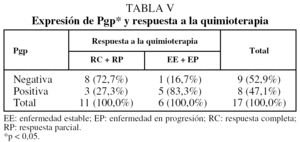
De los 27 pacientes que recibieron quimioterapia, pudo valorarse la respuesta en 17 (tabla IV). En este caso la expresión de Pgp y el número de proteínas expresadas se relacionaron de forma significativa con una peor respuesta al tratamiento (tabla V). Presentaron respuesta 8 de los 9 pacientes con expresión negativa de Pgp, frente a 3 de los 8 con expresión positiva. Los 4 pacientes que no expresaban ninguna MDR-proteína respondieron al tratamiento, mientras que ninguno de los 3 pacientes con expresión simultánea de las 3 proteínas respondió. También se apreció una tendencia hacia una peor respuesta en los pacientes que expresaban Lrp, pero sin alcanzar la significación estadística.
Discusión
El cáncer de pulmón, por su frecuencia y elevada mortalidad, constituye un importante problema sanitario18. La aparición de un fenotipo celular resistente a la quimioterapia ha sido objeto de intenso estudio en los últimos años19. Esto ha conducido a la identificación de varios mecanismos celulares que explican dicha resistencia y ha permitido diseñar estrategias para poder superarla, algunas de las cuales ya están siendo analizadas en la clínica.
La mayoría de los mecanismos asociados a la reducción de la concentración de los quimioterápicos o a su redistribución intracelular se ha relacionado con proteínas transportadoras de membrana, como Pgp y Mrp1, o localizadas en los vaults, como la Lrp. En la actualidad no se dispone de datos concluyentes sobre si la expresión de estas proteínas puede estar implicada en la resistencia a la quimioterapia del cáncer de pulmón, que es un hecho clínico evidente en la práctica clínica diaria. De forma intrínseca o adquirida, esta resistencia afecta a varios agentes antineoplásicos, por lo que presumiblemente se deba a múltiples factores.
Nuestro estudio tenía como primer objetivo determinar la expresión de 3 MDR-proteínas en el cáncer de pulmón y ha confirmado su presencia en un número importante de pacientes. La proteína más expresada fue la Lrp, con positividad en el 64% de los pacientes, seguida de la Pgp (49%) y Mrp1 (38%). Estos resultados son similares a los recogidos en la literatura médica. Los trabajos iniciales sobre MDR-proteínas en el cáncer de pulmón1,4, salvo el publicado por Radosevich et al20 en 1989, detectaron una baja expresión de esta proteína, por lo que durante algunos años se aceptó como un hecho establecido que la Pgp no se expresaba en el cáncer de pulmón y, por lo tanto, no podía influir en la resistencia a la quimioterapia. Estudios posteriores, fundamentalmente mediante inmunohistoquímica, refieren expresiones entre un 35 y un 52% de los casos21. Sobre muestras congeladas, Beer et al22 y Scagliotti et al23 encontraron expresión de Pgp en el 35 y el 41%, respectivamente, de los pacientes con carcinomas de pulmón no microcíticos. Nosotros hemos encontrado un 49% de expresión de Pgp, porcentaje que ascendió al 51% al considerar únicamente los casos de carcinoma no microcítico, cifra algo superior a la publicada por estos autores, lo que confirma la existencia de una expresión relevante de Pgp en estos tumores.
El abanico de resultados publicados para la Mrp1 es más amplio (entre el 38 y el 88% de los casos)24, pero ninguno de los trabajos con un número considerable de pacientes emplea material congelado. Un aspecto importante del presente estudio, que lo diferencia de la mayoría de los publicados, es la determinación de la expresión simultánea de las 3 MDR-proteínas en un mismo paciente. La presumible existencia e interacción de diferentes mecanismos de resistencia in vivo justifican dicha importancia. Estudiada la muestra desde este punto de vista, encontramos que el 83% de los pacientes expresaba proteínas; de ellos, un 32% expresaba sólo una, el 34% expresaba 2 y el 17% expresaba las 3. Es decir, el 51% de los pacientes expresaba más de una proteína.
Son pocas las publicaciones que hacen referencia a la simultaneidad de expresión de estas 3 MDR-proteínas en el cáncer de pulmón. Zhou et al25, en 30 pacientes con carcinoma de pulmón no microcítico, encuentran que alrededor de un 40% expresa a la vez Pgp, Mrp1 y Lrp, un porcentaje superior al 17% obtenido por nosotros.
No es habitual la relación entre los diferentes subtipos histológicos de carcinomas no microcíticos y la expresión de Pgp, Mrp1 o Lrp. En cambio, algunos autores describen una expresión preferente de Pgp y de Mrp1 en carcinomas escamosos, comparados con los adenocarcinomas. Nosotros encontramos diferencias significativas en la expresión de Lrp y Mrp1 entre los diferentes tipos histológicos. Las más llamativas se observaron en la expresión de Mrp1, que es muy baja en adenocarcinomas frente a carcinomas indiferenciados de células grandes y escamosos, con porcentajes del 5,4, el 42,9 y el 63,3%, respectivamente. En cuanto a la menor expresión de Mrp1 en adenocarcinomas, los resultados son similares a los publicados. En cambio, la Lrp se expresa menos en los carcinomas escamosos que en adenocarcinomas y carcinomas indiferenciados de células grandes (el 59,2, el 78,4 y el 85,7%, respectivamente).
Para los tipos histológicos más frecuentes, la proporción de pacientes que expresaron alguna o varias proteínas en nuestro estudio fue similar: un 90% para los carcinomas escamosos, un 81% para los adenocarcinomas y el 100% para los carcinomas indiferenciados de células grandes.
Un aspecto esencial del estudio de las MDR-proteínas en el cáncer es su implicación en la respuesta a la quimioterapia. Mientras que en algunos tipos de tumores hematológicos esta implicación está claramente establecida, en tumores sólidos los datos son muy variados y poco concluyentes, tal como sucede en el cáncer de pulmón26-28.
El carcinoma indiferenciado de células pequeñas, por su mayor sensibilidad a la quimioterapia3, es el más interesante para el estudio de la relación entre la respuesta a ésta y las MDR-proteínas. Los primeros datos que relacionaron la expresión de Pgp con una peor respuesta a la quimioterapia en este tumor29 ya han sido reconocidos. Aunque son más frecuentes los estudios positivos26, algunos autores28,30 no detectan relación alguna entre la expresión de Pgp y Mrp1 y la respuesta a la quimioterapia.
Se han publicado datos indirectos sobre la influencia de las MDR-proteínas en la respuesta a la quimioterapia en el cáncer de pulmón. Algunos autores han encontrado un peor pronóstico en relación con la expresión de MDR-proteínas en pacientes tratados con quimioterapia, sin que haya podido precisarse si esto se debe a la resistencia al tratamiento o a otro efecto no conocido. Es el caso de los resultados comunicados por Segawa et al30 sobre la Pgp en carcinomas indiferenciados de células pequeñas o por Ota et al31 para la Mrp1 en carcinomas escamosos. Un pequeño estudio aleatorizado sobre la adición de verapamilo a la quimioterapia en 72 pacientes con carcinoma de pulmón no microcítico encuentra una respuesta y supervivencia mejores en los pacientes que recibieron el modulador de Pgp32.
En los carcinomas no microcíticos se ha descrito la posible implicación de las MDR-proteínas en la falta de respuesta a la quimioterapia. Ota et al31, en 61 pacientes tratados con esquemas que incluían vindesina y etopósido, encuentran un peor pronóstico en los que expresaban concentraciones altas o moderadas de Mrp1, y más en los carcinomas escamosos y menos en los adenocarcinomas. Resultados similares publicaron Oshika et al29. Lu et al33, en un estudio con 69 pacientes, observan de forma significativa que los pacientes que expresan Lrp responden peor que los que no lo hacen. Volm et al34, en 94 pacientes sin tratamiento previo, estudian la resistencia mediante un test in vitro a la doxorrubicina, que según los autores guarda una buena relación con la respuesta in vivo, y encuentran una relación significativa entre la expresión de Pgp y resistencia, con independencia de que la expresión fuera débil o fuerte. Esto último indicaría que una expresión baja de Pgp es suficiente para originar el fenotipo resistente. También lo relacionan de forma significativa con la expresión de Lrp en 87 casos. Harada et al35, que estudiaron los carcinomas escamosos, también describen una relación entre la expresión de Lrp y la respuesta.
Nuestros resultados, al igual que otros publicados, apuntan a una posible relación entre la expresión de MDR-proteínas y la resistencia a la quimioterapia en el cáncer de pulmón. Con el inconveniente que representa el pequeño número de casos con una respuesta valorable en el presente estudio, podemos deducir que: a) el cáncer de pulmón expresa con frecuencia MDR-proteínas; b) de las 3 MDR-proteínas estudiadas (Pgp, Mrp1 y Lrp), la Lrp es la más frecuentemente expresada; c) los carcinomas escamosos son los que con mayor frecuencia expresan Pgp, Mrp1 y Lrp de forma simultánea; d) la Pgp se expresa fundamentalmente asociada a Lrp y es responsable de un resultado significativo en cuanto a la respuesta a la quimioterapia, y e) la expresión de las 3 MDR-proteínas estudiadas no presenta relación con factores pronósticos como el estadio y no parece influir en la supervivencia o el riesgo de recidiva.
Son necesarios estudios prospectivos bien diseñados, asociados a ser posible con estudios de funcionalidad y con el concurso de inhibidores específicos, para aportar resultados más concluyentes. Sin embargo, el diseño y buen desarrollo de estos estudios presentan algunas dificultades. Las preguntas que se plantean son las siguientes: ¿cuál es el mejor método de detección?, ¿cuál es la concentración o cantidad mínima de proteína necesaria para causar resistencia desde el punto de vista clínico?, ¿disponemos de métodos fiables para medir la funcionalidad de las MDR-proteínas?, ¿hay inhibidores específicos con posibilidades de uso clínico? El cáncer de pulmón, por su frecuencia, elevada mortalidad y significativa expresión de MDR-proteínas, es un buen candidato para este tipo de estudios.
Cada vez resulta más evidente que la resistencia a la quimioterapia es un fenómeno multifactorial, por lo que es muy improbable que un solo mecanismo de resistencia sea la clave para superarla. Es necesario identificar de forma simultánea el mayor número de mecanismos posibles en un mismo paciente. Esto nos permitirá definir perfiles de resistencia a partir de los que diseñar tratamientos más específicos e individualizados. Lo que hoy parece muy lejano puede que no lo esté tanto.
Correspondencia: Dr. M. Echenique Elizondo.
Facultad de Medicina. UD San Sebastián. Universidad del País Vasco.
P.° Dr. Begiristain, 105. 20014 San Sebastián. Guipúzcoa. España.
Correo electrónico: gepecelm@sc.ehu.es
Recibido: 27-6-2006; aceptado para su publicación: 20-3-2007.