Introducción
La creciente importancia del síndrome de apneas e hipopneas durante el sueño (SAHS) deriva de su elevada prevalencia1-3, su repercusión sociosanitaria4,5 y sus evidentes consecuencias en las enfermedades cardiovasculares6-9, todo lo cual convierte el diagnóstico del SAHS en un problema sanitario de gran magnitud. Los datos de la clínica y la exploración física no parecen suficientes para diagnosticar con precisión los trastornos respiratorios del sueño10,11, además de no cuantificar su magnitud. Son necesarios estudios complementarios que la American Sleep Disorders Association (ASDA)12 clasificó en 4 niveles según su complejidad: nivel I, polisomnografía (PSG) estándar; nivel II, PSG portátil completa; nivel III, poligrafía (PGR) respiratoria, y nivel IV, registro continuo de sólo uno o 2 parámetros biológicos (p. ej., pulsioximetría)12.
La PSG sigue siendo la prueba de referencia en el diagnóstico del SAHS13,14, pero tiene el inconveniente de su excesivo coste, precisa atención continuada y una importante dedicación del personal médico14,15. Además, hay opiniones cualificadas que defienden que los parámetros neurofisiológicos de la PSG no son imprescindibles para diagnosticar y tratar el SAHS16. Estos hechos, junto a la limitación de medios diagnósticos, obligan a buscar métodos alternativos, como la PGR, que no precisa vigilancia continua y tiene un coste muy inferior al de la PSG12,17,18.
Se han realizado estudios de validación de algunos de los equipos de PGR que existen en el mercado y diversos trabajos los consideran aceptables como método alternativo a la PSG12,18-28. En un reciente metaanálisis se analizan 25 dispositivos, con un total de 1.631 pacientes. Estos estudios muestran variabilidad en el rendimiento diagnóstico, de modo que la sensibilidad oscila entre el 78 y el 100% y la especificidad entre el 62 y el 99,5%29. Esta variabilidad, junto a la proliferación de equipos de PGR no contrastados, hace necesaria la validación de éstos en los laboratorios de sueño.
El objetivo de este trabajo ha sido validar el rendimiento diagnóstico de un dispositivo de PGR (polígrafo BITMED NGP140) frente a la PSG convencional. Se planteó el estudio en 2 partes complementarias: en primer lugar, la concordancia entre el índice de apnea-hipopnea por hora (IAH) y los índices de eventos respiratorios (IER) obtenidos tanto con el análisis manual como automático de la PGR, y en segundo lugar, la rentabilidad diagnóstica de la PGR con el dispositivo NGP140 frente a la PSG convencional como prueba de referencia.
Pacientes y métodos
Pacientes
Entre junio de 2002 y enero de 2003 se incluyó a 103 pacientes consecutivos remitidos a nuestro servicio por sospecha de alteraciones respiratorias durante el sueño. Se solicitó su consentimiento para participar en el estudio, previa información de la finalidad y de la ausencia de complicaciones o efectos secundarios. Se trataba de pacientes remitidos desde una consulta de neumología extrahospitalaria, y no se excluyó a los que presentaban enfermedad respiratoria o cardiovascular.
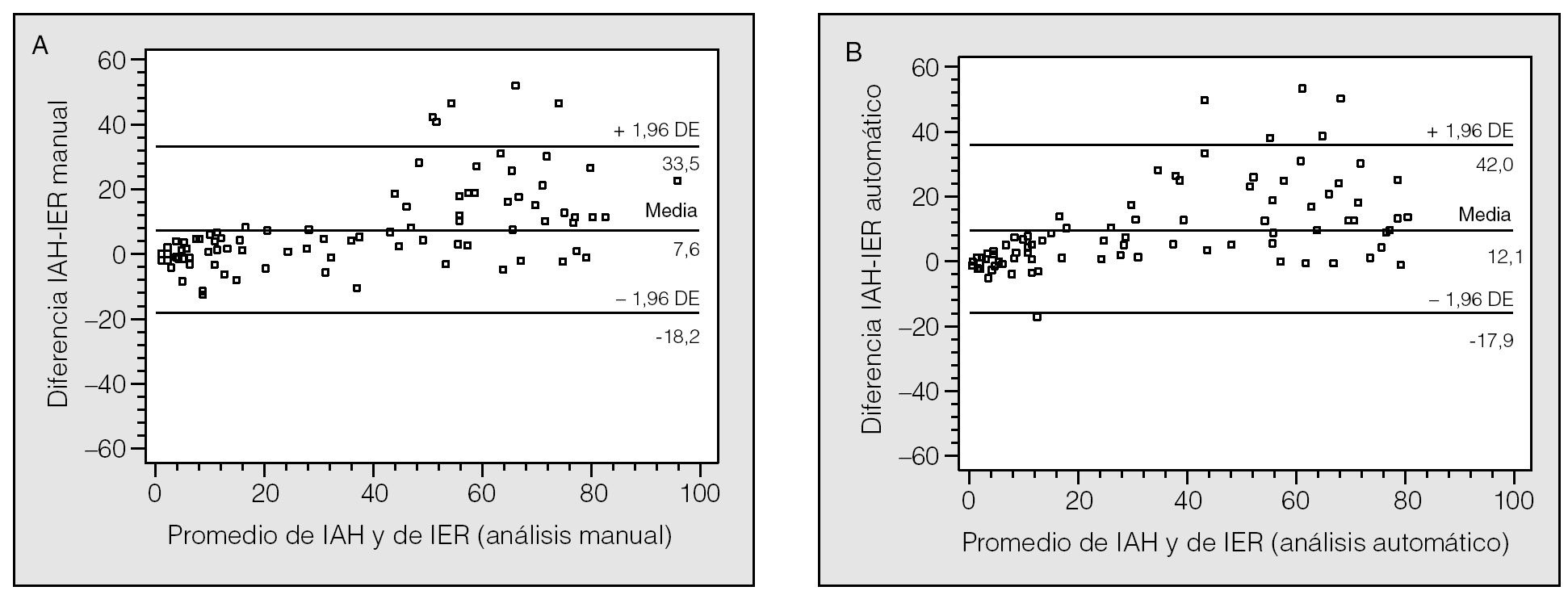
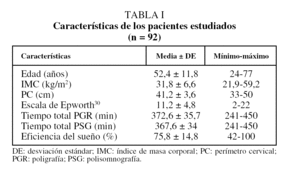
Siguiendo un protocolo previamente establecido en nuestro servicio para el estudio de los pacientes remitidos por sospecha de alteraciones respiratorias durante el sueño, se recogieron de forma prospectiva en todos los pacientes variables antropométricas y clínicas. Se registraron los datos de peso en kilogramos, la talla en metros, el índice de masa corporal (kg/m²), el perímetro cervical en centímetros y la presión arterial (mmHg). Se interrogó por la presencia de síntomas como excesiva somnolencia diurna, ronquidos habituales, pausas de apnea observadas, antecedente de enfermedad pulmonar y tipo, antecedente de hipertensión arterial y otras variables clínicas. Se cuantificó la somnolencia diurna por la escala de Epworth (de 0 a 24 puntos)30.
Equipos y mediciones
La PSG, utilizada como prueba de referencia, se realizó con un equipo Somnostar Alfa (Sensor Medics Co., EE.UU.), que registraba: electroencefalograma con las 4 derivaciones habituales (C3A2, O1A2, C2A1 y O2A1), electrooculograma, electromiograma submentoniano y tibial, electrocardiograma, esfuerzo respiratorio por movimiento torácico y abdominal con sensores de estiramiento por tecnología piezoeléctrica, flujo aéreo por termistor con sensor de flujo respiratorio con tecnología Termopar tipo E (sensibilidad: 2-30 uV/mm), cambios en la saturación arterial de oxígeno por pulsioximetría (pulsioxímetro Sensor Medics Co., EE.UU.; saturación arterial de oxígeno: ± 2%; pulso: ± 1 lat/min, con muestreo cada 6 s), sensor de piezocristal para ronquido y detector de posición corporal por sensor de giro con bola bañada en oro.
La PGR se llevó a cabo con un polígrafo BITMED NGP140 (Meditel Ingeniería Médica, Zaragoza, España), con software XGPLaB de la misma empresa. Se trata de un dispositivo de PGR cardiorrespiratoria de nivel III con registro continuo, con 10 canales y con posibilidad de 2 modos de funcionamiento: ambulatorio y en tiempo real. En modo ambulatorio las señales se almacenan en la memoria interna con una capacidad de registro de 27 h. Sus dimensiones son: 188 x 99 x 35 mm, con un peso de 600 g. Puede alimentarse a red mediante una fuente de alimentación, o bien con 4 pilas estándar de 1,5 V. El programa informático XGPLab realiza de forma automática un análisis de los eventos con criterios que pueden programarse.
Los canales de PGR utilizados en este estudio eran los siguientes: 2 para pulsioximetría (uno para saturación y otro para pulso), 2 canales para esfuerzo respiratorio con sensores de estiramiento por tecnología piezoeléctrica, un canal para posición corporal con sensor de giro con bola bañada en oro, un canal para ronquido con sensor de piezocristal, un canal para flujo respiratorio por termistor con tecnología termopar tipo E y un canal para movimiento de piernas por piezocristal. Los sensores de las variables cardiorrespiratorias, excepto la saturación, frecuencia cardíaca y el movimiento de piernas eran similares para la PGR y la PSG. En el polígrafo NGP140 la frecuencia del pulso y la saturación se obtuvo por pulsioximetría (pulsioxímetro de Nonin Medical Inc.; saturación arterial de oxígeno: ± 2%; pulso: ± 2 lat/min, con muestreo cada 5 s).
Los sensores de flujo por termistor de ambos dispositivos detectaban señales orales y nasales, y se superpusieron sobre el labio superior del paciente.
Se realizó a los pacientes PSG convencional vigilada y, simultáneamente, una PGR sin visualización simultánea (online) del registro poligráfico. Un técnico experimentado se encargó del montaje de los dispositivos. Los estudios se iniciaron simultáneamente y finalizaron también al mismo tiempo.
Tanto para la PSG como para la PGR se utilizaron los siguientes criterios: apnea, cese del flujo oronasal durante 10 s o más, e hipopnea, reducción del flujo del 50% o mayor durante al menos 10 s, asociada a un microdespertar (sólo en PSG) y/o una caída de la saturación de al menos el 3%. En el caso de la PSG las fases del sueño se clasificaron según el sistema descrito por Rechtschaffen y Kales31. Se siguió la definición de microdespertar o arousal de la ASDA32.
Los estudios de PSG y PGR fueron analizados indistintamente por 2 neumólogos con experiencia. Ambos registros se analizaron de forma separada y ciega, sin conocer el observador el resultado del otro método. Se realizó primero un análisis automático y después manual de cada registro de PGR siguiendo los mismos criterios en la clasificación de los eventos. El IAH se obtuvo dividiendo el número de eventos respiratorios de la PSG por el tiempo de sueño, y el IER de la PGR, dividiendo los eventos por el tiempo total de registro. Los acontecimientos respiratorios se clasificaron como obstructivos (acompañados de esfuerzo toracoabdominal), centrales (ausencia de movimientos toracoabdominales) o mixtos (si coexistían ambos componentes).
Para comparar el número de eventos respiratorios entre la PSG y la PGR, con independencia del tiempo total de sueño, se introdujo una nueva variable: el IAH de la PSG corregido (número de eventos/tiempo total de registro).
La comparación del rendimiento diagnóstico se realizó entre el IAH de la PSG y el IER de la PGR. Para el primero se escogieron los puntos de corte que se utilizan habitualmente en la bibliografía, esto es: ≥ 10, ≥ 15, ≥ 20, ≥ 30.
Se excluyeron los estudios en los que, a juicio de los expertos, había fallos significativos en las señales registradas por la PSG o la PGR.
Dado que una de las diferencias fundamentales entre los índices obtenidos con la PSG y la PGR reside en el tiempo de sueño, a diferencia de otros trabajos se decidió no excluir los estudios con tiempo total de sueño inferior a un valor arbitrario (p. ej., 180 o 240 min), y sí aquellos con un tiempo de sueño inferior al percentil 5 de la distribución de nuestra serie.
Análisis estadístico
El análisis estadístico se realizó mediante el paquete estadístico SPSS (versión 9.0, SPSS Inc., 1998, Chicago, EE.UU.). Se analizaron las variables para comprobar su ajuste a la normalidad por el método de Kolmogorov-Smirnov y las medidas de tendencia central se expresaron como medias ± desviación estándar o como medianas con percentiles, según correspondiera.
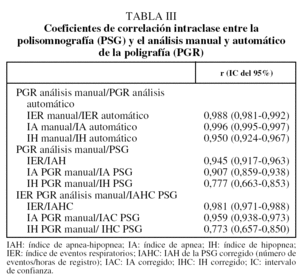
Para cumplir el primer objetivo, esto es, comprobar el grado de coincidencia entre los 2 métodos de medida, se utilizaron 2 procedimientos. Por un lado, se aplicó el método de Bland y Altman33, en el que las diferencias entre los resultados de cada dispositivo se representan frente al promedio de los 2 métodos, expresando los resultados como medias ± desviación estándar e intervalos de confianza (IC) del 95% y los límites de concordancia en ± 1,96 veces la desviación estándar de las diferencias33. Por otro lado, se calcularon las correlaciones intraclase entre el análisis manual y automático de los índices obtenidos con la PGR y con la PSG. Este método permite cuantificar la fiabilidad entre 2 mediciones calculando la proporción que supone la variancia entre individuos sobre el total de la variancia (variancia entre individuos más variancia de la diferencia en las mediciones)34.
La rentabilidad diagnóstica de la PGR frente a la PSG se analizó mediante las curvas de eficacia diagnóstica35, para lo cual se calculó el área bajo la curva con su IC del 95% a fin de evaluar el rendimiento diagnóstico global y se seleccionó para cada punto de corte de la PSG (IAH ≥ 10, ≥ 15, ≥ 20, ≥ 30) el mejor punto de corte de la PGR. La rentabilidad diagnóstica de cada punto de corte se expresó en términos de análisis bayesiano: sensibilidad, especificidad, valores predictivos y exactitud diagnóstica o eficiencia. El nivel de significación estadística se estableció en 0,05.
Resultados
De un total de 103 pacientes incluidos en el período de estudio se excluyó a 11 individuos (11%), en 7 casos por tiempo de sueño inferior a 148 min (percentil 5% de la distribución de tiempo de sueño obtenido con la PSG), en otros 3 casos por fallos técnicos en el almacenamiento y/o volcado de la memoria del polígrafo y en un caso por fallo en la señal de flujo del polígrafo. No se detectaron otros fallos significativos en las señales de los parámetros analizados. Tras obtener el consentimiento informado, ningún paciente rehusó participar en el estudio.
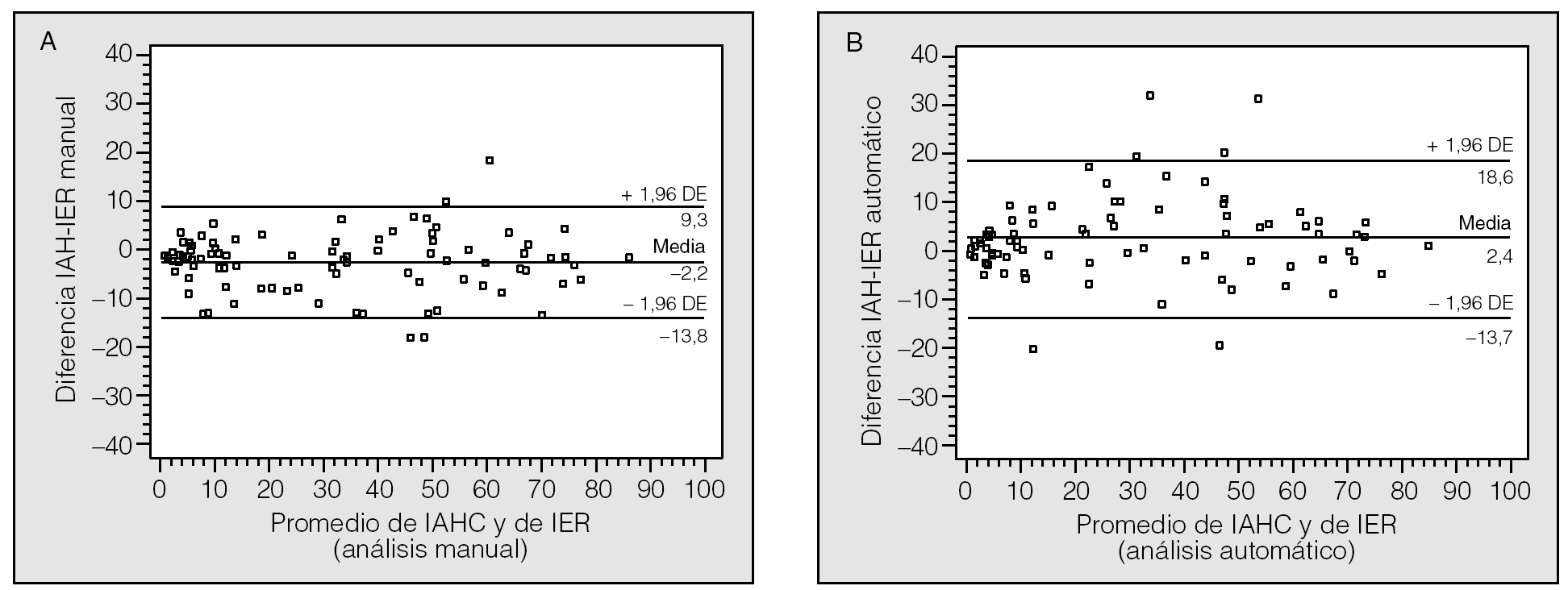
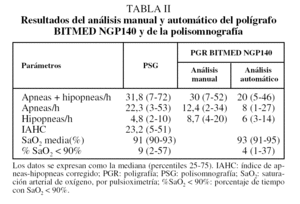
Había 72 varones (78%) y 20 mujeres (22%), con una media de edad de 52,4 ± 12 años. Los resultados de otras variables clínicas se recogen en la tabla I. Un 85% de los pacientes refería apneas observadas, un 70% se quejaba de excesiva somnolencia diurna, los pacientes con hipertensión arterial representaban el 40% y había 8 pacientes con enfermedad pulmonar obstructiva crónica (9%). En la tabla I también se indican los tiempos medios de registro de la PGR y de la PSG, así como la eficiencia del sueño. En la tabla II se recogen los resultados de los índices obtenidos con el análisis manual y automático, tanto de la PGR como de la PSG, expresados como mediana y cuartiles por no seguir una distribución normal. Se decidió no detallar la cifra de apneas centrales dado su escaso número y agrupar las obstructivas y mixtas por su similar significado clínico.
Si escogíamos en la PSG convencional un punto de corte de IAH ≥ 10 para definir el diagnóstico de SAHS, 65 pacientes (71%) cumplían ese criterio; con IAH ≥ 15 había 56 pacientes (61%); con IAH ≥ 20 eran 53 los pacientes (58%) y para un IAH ≥ 30 había 48 pacientes (52%).
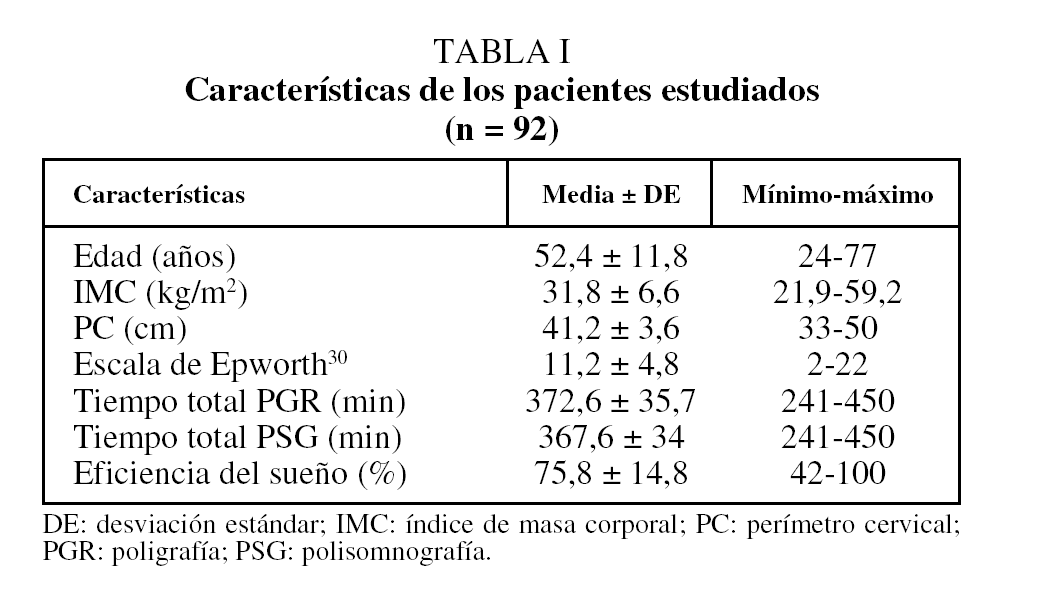
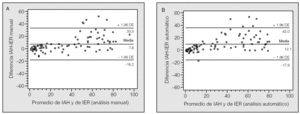
Fig. 1. Diferencias individuales entre el índice de apneas-hipopneas (IAH) de la polisomnografía y el índice de eventos respiratorios (IER) obtenido con el polígrafo BITMED NGP140 en el análisis manual (A) y en el análisis automático (B). DE: desviación estándar.
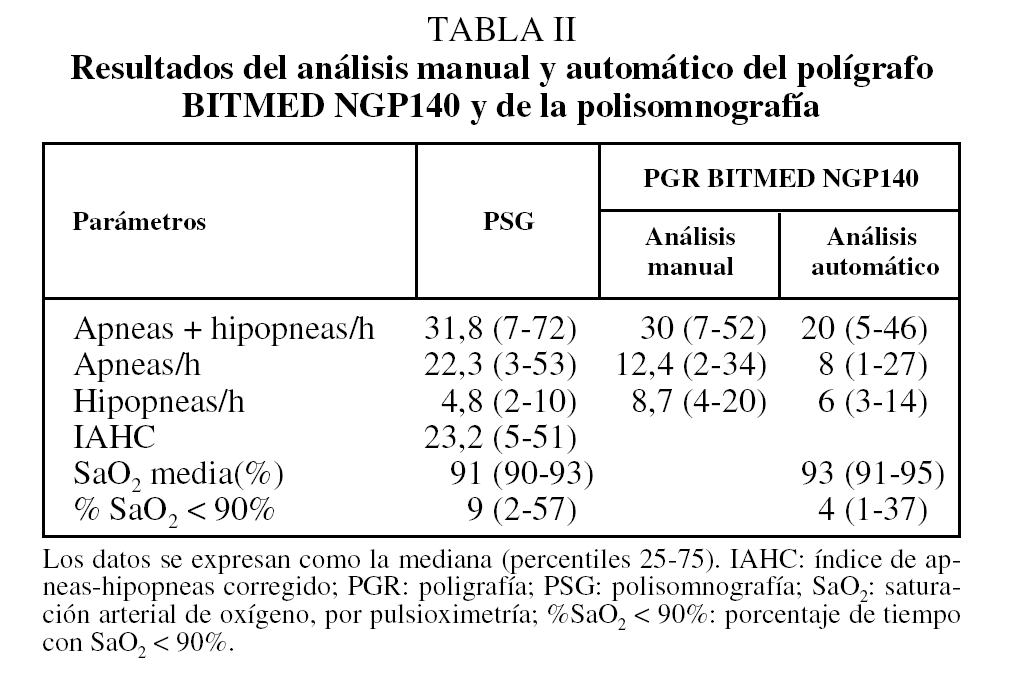
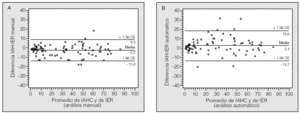
Fig. 2. Diferencias individuales entre el índice de apneas-hipopneas corregido (IAHC) de la polisomnografía y el índice de eventos respiratorios (IER) obtenido con el polígrafo BITMED NGP140 en el análisis manual (A) y en el análisis automático (B). DE: desviación estándar.
Las diferencias individuales entre el IAH y el IER obtenido con el nuevo dispositivo y entre el IAH corregido de la PSG (IAH/tiempo total de registro) y el IER están representadas gráficamente con el método de Bland y Altman, tanto para el análisis manual como para el análisis automático. La comparación de la PSG con el análisis manual de la PGR mostró una media de 7,6 ± 13,2 (IC del 95%, 4,9-10,4; límites de concordancia: -18,2 a 33,5), mientras que para el análisis automático la media fue de 12 ± 15,3 (IC del 95%, 8,8-15,3; límites de concordancia: -17,9 a 42) (figs. 1A y B). Para el IAH corregido (figs. 2A y B), la concordancia entre la PSG y el análisis manual de la PGR tuvo un valor medio de -2,2 ± 5,9 (IC del 95%, -3,5 a -1; límites de concordancia: -13,8 a 9,3) y de 2,4 ± 8,3 (IC del 95%, 0,7-4,2; límites de co ncordancia: -13,7 a 18,6) para el análisis automático de los registros. Las correlaciones intraclase entre el análisis manual y automático de la PGR y entre la PSG y la PGR se expresan en la tabla III.
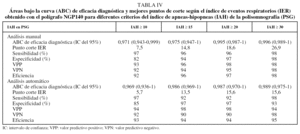
En nuestros resultados, las áreas bajo la curva de eficacia diagnóstica en todos los puntos de corte del IAH (desde IAH ≥ 10 hasta IAH ≥ 30) ofrecían un buen rendimiento diagnóstico global, con valores por encima de 0,97 tanto para el análisis manual como para el automático (tabla IV). Las curvas de eficacia diagnóstica mostraban mejor resultado con puntos de corte por encima de un IAH ≥ 30 tanto con el análisis manual como con el automático. Utilizando unos puntos de corte de la PSG habituales en la bibliografía calculamos el mejor punto de corte del IER obtenido con el polígrafo NGP140, tanto con el análisis manual como con el automático de los registros (tabla IV). Para un IAH de 30, la clasificación con el análisis manual de la PGR NGP140 (punto de corte: 26,9) fue correcta en el 98% de los pacientes, con sólo un falso negativo (IER de 24, con una eficiencia de sueño del 73%) y un falso positivo (IER de 34 para un IAH de 28).
El análisis automático del BITMED NGP140, con sus correspondientes puntos de corte, mostró también una buena exactitud diagnóstica, con valores entre el 93 y el 95%.
Discusión
Un reciente estudio sobre la situación actual del diagnóstico y del tratamiento del SAHS en España36 destacó el insuficiente nivel de recursos diagnósticos en nuestro país, con un 36% de los tratamientos de presión positiva continua de la vía aérea prescritos con sólo un registro oximétrico nocturno (nivel IV de la ASDA). En ese mismo estudio se comunicaba que un 31% de los pacientes se diagnosticaba con PGR respiratorias (nivel III de la ASDA). Estos estudios de nivel III son cada día más numerosos, con nuevos equipos de PGR cada vez más sencillos y de menor tamaño. Sin embargo, muchos de esos equipos no están validados o los estudios de validación se han realizado con pocos pacientes. En el presente trabajo el número de pacientes en los que se ha llevado a cabo la comparación de un nuevo polígrafo con la PSG es superior al de la mayoría de los estudios publicados18,19,23,25,27,28.
Otra dificultad de algunas de las validaciones previas es la falta de simultaneidad de los estudios, lo que introduce innumerables factores de variabilidad, como el diferente tiempo de sueño o número y tipo de los eventos en noches diferentes18,37. En este estudio la variabilidad intraindividual, que disminuye la validez interna, está anulada por la simultaneidad de los registros.
Un detalle no contemplado en validaciones previas, como es el uso de los mismos sensores en la mayor parte de los parámetros registrados, puede contribuir a minimizar las diferencias entre los registros de PSG y PGR. Esta compatibilidad de sensores de PSG y PGR es además un aspecto interesante en un laboratorio de sueño y ofrece múltiples ventajas no sólo desde el punto de vista de la exactitud en la comparación, objeto de este estudio, sino también en la disponibilidad y experiencia en su uso cotidiano.
Una limitación de nuestro estudio es que no tiene una base poblacional, sino que incluye a pacientes seleccionados por haber sido remitidos a una consulta especializada de alteraciones respiratorias durante el sueño. De ahí algunas de las peculiaridades del estudio, como el porcentaje de mujeres (22%) o la edad media de los pacientes, que son características habituales en los pacientes remitidos para estudio de alteraciones respiratorias durante el sueño18,19,22,25,29.
No se ha excluido a los pacientes con enfermedad respiratoria o cardiovascular previa, en quienes podría haber mayor dificultad para interpretar los registros de PGR. En algunos estudios de validación se excluye a la este tipo de pacientes27 y algunos autores contraindican la PGR en estas enfermedades38. Nosotros, por el contrario, creemos que hay que incluir a estos pacientes en la validación, dada la alta prevalencia de las citadas enfermedades en la población con SAHS.
En estudios previos se ha comunicado desde un 2% a más de un 10% de fallos en los registros no vigilados17-19. En nuestro estudio hubo un 4% de fallos en el registro de la PGR, proporción, en nuestro juicio, aceptable en una prueba diagnóstica compleja y de larga duración.
Aunque del escaso número de estudios que no consideramos válidos por fallos técnicos de la PGR podría colegirse la utilidad de este equipo en registros a domicilio, no es ésta una conclusión directa de este trabajo, porque en nuestro caso el registro se realizó en el ámbito hospitalario y con la presencia de personal sanitario.
La validación de un equipo de PGR se realiza frente al método que se considera de referencia, la PSG. Para poder comparar los 2 métodos diagnósticos el primer paso ha de ser determinar si son capaces de detectar los mismos eventos. El BITMED NGP140 tiene en este estudio una excelente correlación intraclase y una buena concordancia con la PSG, con el método de Bland y Altman, sobre todo si se compara el IER con el IAH corregido para equiparar los denominadores de ambos índices. El análisis de concordancia entre el IER y el IAH que se realiza en otros estudios26-28, aun siendo útil, no es a nuestro juicio metodológicamente correcto, ya que no se comparan las mismas variables. La comparación es más correcta cuando se corrige el IAH, como se ha hecho en nuestro estudio. Aunque esta corrección no se va a efectuar en la práctica, sí puede tener sentido en el contexto de un estudio de validación y ayuda a valorar con más precisión si la correlación es buena o si los límites de concordancia que se obtienen con el método de Bland y Altman son o no demasiado amplios y, por tanto, clínicamente importantes.
La concordancia entre la PSG convencional y la PGR no es tan buena en las hipopneas, donde la correlación es inferior a 0,8. Este resultado nos parece lógico ya que la valoración de una hipopnea es más compleja que la de una apnea y concurren más criterios en su definición (reducción de flujo, desaturación, microdespertares, etc.).
Otra de las conclusiones fundamentales de este estudio es el alto rendimiento diagnóstico de la PGR con el polígrafo NPG140. A diferencia de otros estudios28, la exactitud diagnóstica que conseguimos fue mejor con puntos de corte más altos del IER. Con el dispositivo NGP140 un valor manual de IER superior a 26,9 clasificaría correctamente al 98% de los pacientes que presentan un IAH ≥ 30 con la PSG convencional. La exactitud diagnóstica es un poco inferior para un punto de corte de IAH ≥ 10, pero en éste la clasificación diagnóstica en SAHS o no SAHS es más académica que práctica, y para tomar una decisión terapéutica probablemente interesa más acertar con IAH cercanos a 30, que en la mayoría de las recomendaciones de las sociedades especializadas representa el umbral para la indicación de tratamiento con presión positiva continua de la vía aérea39,40.
Otra conclusión relevante de este trabajo es el alto rendimiento diagnóstico del nuevo dispositivo BITMED NGP140 con el análisis automático de los registros. Este análisis automático, si bien no sustituye por completo la valoración de un técnico cualificado, sí facilita y agiliza de forma importante la revisión manual de los registros.
En resumen, aunque la PSG convencional se siga considerando la prueba de referencia en el diagnóstico del SAHS, los dispositivos de PGR cardiorrespiratoria ofrecen cada vez mayor exactitud diagnóstica, y prueba de ello son los resultados de este estudio de comparación del polígrafo NGP140 con la PSG convencional. Esta comparación, que tiene la virtud de ser simultánea en la misma noche y compartir en gran parte los mismos sensores, ofrece una concordancia elevada en la medición de los eventos respiratorios y obtiene un alto rendimiento diagnóstico en especial en los pacientes con más de 30 eventos por hora. Aunque el rendimiento es mejor con el análisis manual de los registros, el análisis automático de los eventos respiratorios es también de una exactitud diagnóstica aceptable, lo que facilita el análisis manual posterior.
En todos los laboratorios de sueño deberían realizarse estudios de niveles I, II y III, utilizando cada uno de ellos en el contexto adecuado. La PGR es un método adecuado para el diagnóstico del SAHS, pero debería cuidarse la adecuada validación de los equipos de PGR que cada laboratorio utiliza.
Estudio financiado por el Área de Evaluación de Tecnologías Sanitarias de la Conselleria de Sanitat de la Generalitat Valenciana (proyecto n.o 006/2001).