Strongyloides es un nematodo que puede persistir en el organismo durante largos períodos y tener como única manifestación eosinofilia asintomática. La enfermedad pulmonar obstructiva crónica (EPOC) puede ser una afección asociada a esta infección. La presencia de una alteración en la inmunidad celular o el uso de esteroides, frecuentes en el tratamiento de la exacerbación de la EPOC, podría provocar una hiperinfección de la larva, arrastrando en su paso al torrente sanguíneo bacterias entéricas. Así pues, la presencia no esperada de bacterias entéricas en la exacerbación de un caso de EPOC no grave con eosinofilia crónica sin filiar debería orientarnos a la búsqueda activa de larvas rabditiformes en las heces.
The nematode of the genus Strongyloides can persist in the body for long periods with asymptomatic eosinophilia as its only manifestation. If patients with chronic obstructive pulmonary disease (COPD) are also infected by this organism, altered cellular immunity or therapy with corticosteroids, which are commonly used to treat COPD exacerbations, could lead to hyperinfection and dissemination of the larvae from the gastrointestinal tract to the bloodstream. Thus, the unexpected presence of enteric bacteria in the context of a nonsevere COPD exacerbation with unexplained chronic eosinophilia should lead us to search for rhabditiform larvae in stool.
Strongyloides stercoralis es un nematodo intestinal que afecta a millones de personas en todo el mundo. Es endémico en el sudeste asiático, Latinoamérica, África subsahariana y algunas zonas del sudeste de EE.UU.1-3. Este parásito tiene un complejo ciclo vital y, aunque la autoinfección está limitada por la respuesta inmunitaria en el huésped inmunocompetente, un bajo grado de autoinfección puede permitir al organismo persistir durante décadas1,2,4, dando lugar a la infección crónica, y causar manifestaciones clínicas tiempo después de la infección inicial1,2,4. Las manifestaciones de la infección pueden ir desde una eosinofilia asintomática en el huésped inmunocompetente hasta una enfermedad diseminada con shock séptico en inmunocomprometidos5,6. Exponemos el caso de un paciente de 85 años de edad, con eosinofilia crónica, que consultó en nuestro hospital por una exacerbación de la EPOC, consecuencia de un síndrome de hiperinfección por S. stercoralis.
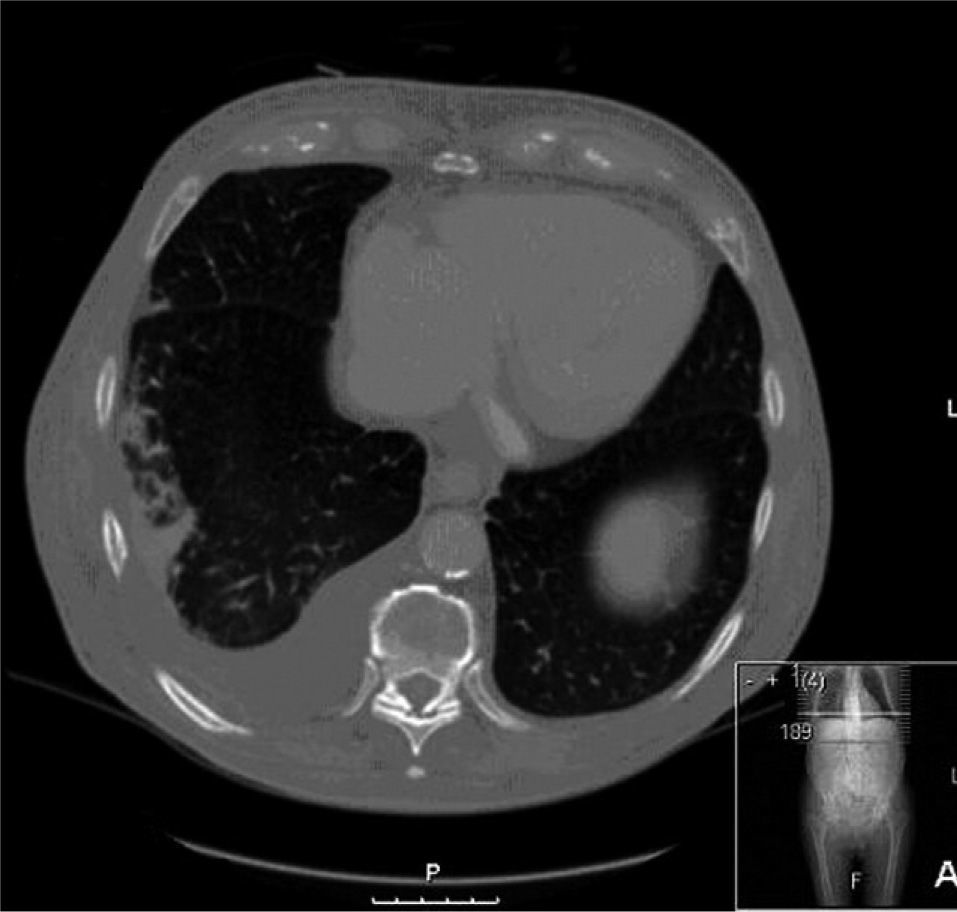
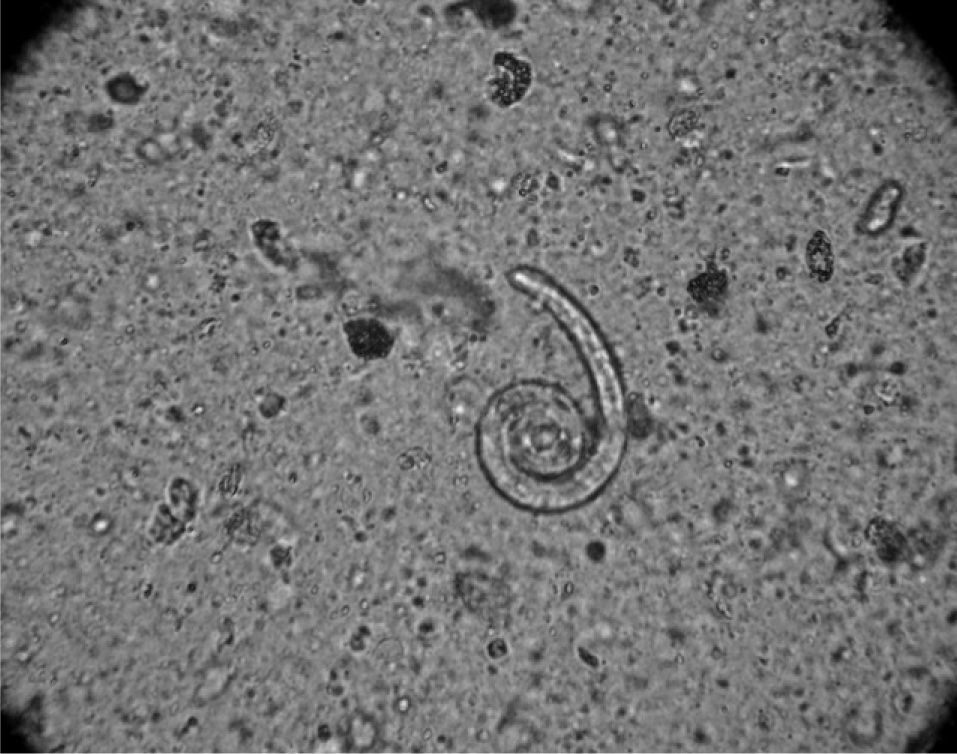
Observación clínicaUn varón de 85 años de edad, de nacionalidad española, consultó en nuestro hospital por disnea. Entre sus antecedentes personales destacaban eosinofilia crónica desde hacía 8 años, úlcera gástrica diagnosticada 2 años antes y EPOC en clase II de la clasificación GOLD, con volumen espiratorio forzado en el primer segundo (FEV1) de 1.300ml (50%) e índice de Tiffeneau (FEV1/VC) del 61,3%. No tenía ingresos recientes y consultó en urgencias por un cuadro de tos, expectoración blanquecina y aumento de la disnea habitual, sin infiltrados pulmonares, tan sólo eosinofilia periférica del 40,8% (2.900 células/μl). Se le diagnosticó de exacerbación de la EPOC por infección respiratoria, se le prescribió tratamiento con moxifloxacino durante 7 días, así como broncodilatadores y esteroides orales, y se le dio de alta. Al cabo de 9 días seguía con disnea y expectoración, y volvió a consultar en urgencias. Se mantuvieron los broncodilatadores y esteroides orales, y se le prescribió tratamiento con claritromicina. Veinte días después ingresó por empeoramiento de su estado. En el momento del ingreso presentaba eosinofilia periférica de 3.100 células/μl. Se recogieron 2 muestras de heces para estudio parasitológico y muestras de esputo para cultivo. Los resultados de la parasitología fueron negativos y en esputo se aislaron Pseudomonas aeruginosa y Serratia marcescens. Se inició tratamiento antibiótico con amikacina y meropenem. Dos semanas después el paciente no mejoraba. En una tomografía computarizada de tórax se observaron un derrame pleural derecho y atelectasia basal derecha (fig. 1). Se practicó una broncoscopia y se objetivó secreción purulenta en el bronquio lobular inferior derecho, de donde se tomó un aspirado bronquial. La tinción de Gram del aspirado bronquial demostró un número importante de larvas de S. stercoralis (fig. 2), y el cultivo del aspirado no presentó crecimiento bacteriano. Se trató al paciente con albendazol, con mejoría clínica, analítica y radiográfica, y se le dio el alta hospitalaria.
La infección crónica por S. stercoralis puede ser desde clínicamente inaparente hasta presentar síntomas gastrointestinales, cutáneos o pulmonares, e incluso dar lugar a un síndrome de hiperinfección o infección diseminada1-3,5,7. En la infección crónica los síntomas pulmonares que aparecen con frecuencia son la tos, la disnea y el esputo blanquecino8, junto a eosinofilia de 350-450 células/μl1-3,8. En el caso que nos ocupa, el paciente presentaba eosinofilia desde 1998, así como leves síntomas gastrointestinales, y en 2005 se le había diagnosticado por endoscopia de úlcera en el canal pilórico. Aunque se le realizaron varios estudios parasitológicos, todos fueron negativos. Sin embargo, esto es lo habitual en una estrongiloidiasis no complicada, ya que la carga de larvas es pequeña y la sensibilidad que tiene el examen de heces es baja; tan sólo aumenta si se examina un número elevado de muestras, en concreto, hasta 73,6,7,9, y en nuestro caso no se tomó ese número de muestras. El ciclo de autoinfección que se mantiene en la infección crónica puede conducir a un síndrome de hiperinfección por un incremento de la carga de parásitos y a una diseminación masiva a otros órganos como el pulmón, hígado, sistema nervioso central y glándulas endocrinas, en los que induce una inflamación con disfunción, y llega a producir un shock séptico5-7. Hay una serie de factores de riesgo para el desarrollo del síndrome de hiperinfección, tales como disminución de la inmunidad celular (en especial los pacientes en tratamiento con corticoides), enfermedades malignas, desnutrición y EPOC, entre otros5-7. Nuestro paciente presentaba EPOC y, además, en el momento del ingreso estaba en tratamiento con esteroides orales desde hacía un mes por la exacerbación de la EPOC. El resultado del síndrome de hiperinfección se debe, en primer lugar, a las consecuencias directas de la invasión del órgano por la larva filariforme y, en segundo lugar, a la bacteriemia, meningitis y neumonía por gérmenes gramnegativos procedentes del intestino (Escherichia coli, Proteus mirabilis, Klebsiella pneumoniae, P. aeruginosa, etc.), que son transportados por la larva, lo que produce un agravamiento del paciente que con frecuencia es causa de muerte8,10-12. Muchos pacientes que desarrollan un síndrome de hiperinfección están en tratamiento con corticoides por su EPOC, e igualmente la estrongiloidiasis pulmonar puede semejar una exacerbación de la EPOC3,12,13. Los glucocorticoides son los fármacos inmunodepresores que con mayor frecuencia se asocian a la transformación de una infección crónica por S. stercoralis en hiperinfección5. Lo llamativo de nuestro caso es el asilamiento de P. aeruginosa en el esputo del paciente, que no presentaba factores de riesgo, tales como una hospitalización reciente, administración de antibióticos en los 3 últimos meses, colonización o aislamiento previo de P. aeruginosa, o una alteración funcional grave (FEV1 < 30%)14,15. Sin embargo, el primer diagnóstico microbiológico fue de P. aeruginosa y S. marcescens. Este aislamiento, que no concuerda con lo descrito en la literatura médica, y la presencia de eosinofilia crónica deberían habernos llevado a buscar larvas de Strongyloides por si el paciente presentaba una infección crónica por este parásito con leves síntomas digestivos, que con la reactivación de la EPOC y la administración de corticoides hubiera conducido a un síndrome de hiperinfección por S. stercoralis. La aparición de P. aeruginosa y S. marcescens en las secreciones respiratorias podría haber sido una consecuencia de su transporte por las larvas en el momento de atravesar el intestino, ya que el paciente, según lo expuesto anteriormente, no presentaba ningún factor que predispusiera al desarrollo de infección por dichos gérmenes. El paciente no mejoraba, a pesar de recibir el tratamiento antibiótico correcto según el antibiograma, y la aparición de una atelectasia segmentaria junto al derrame llevó más tarde a la realización de una broncoscopia, en la que no se observaron alteraciones endobronquiales que justificaran las imágenes radiológicas. Sin embargo, fue en el examen habitual de la tinción de Gram del aspirado donde aparecieron larvas de S. stercoralis, ya que en una hiperinfección es habitual la presencia de abundantes larvas, que pueden encontrarse en el pulmón5,7. Según algunos autores6,12,16, la tinción de Gram es una buena herramienta para la detección y el diagnóstico de la estrongiloidiasis pulmonar16. En pacientes procedentes de zonas endémicas que presentan eosinofilia y exacerbación de la EPOC hay que pensar en una estrogiloidiasis13. Sin embargo, nuestro paciente era de nacionalidad española, no procedía de una zona endémica ni desarrollaba ningún trabajo u actividad que pudiera suponer un factor de riesgo para su contagio. Por este motivo nunca se pensó en la posibilidad de una estrongiloidiasis pulmonar, cuyo hallazgo fue, por tanto, casual. En el cultivo del aspirado ya no crecieron los gérmenes gramnegativos aislados en un primer momento. Cuando se administró al paciente tratamiento específico con albendazol, presentó una franca mejoría del cuadro clínico y una disminución progresiva de la eosinofilia.
En conclusión, la presencia no esperada de bacterias entéricas en secreciones respiratorias de pacientes con infección respiratoria de las vías inferiores y eosinofilia crónica sin filiar debería llevarnos a la búsqueda activa de larvas rabditiformes en las heces.