En los últimos años la inmunoterapia se está consolidando como un tratamiento eficaz para determinados pacientes con carcinoma no microcítico de pulmón localmente avanzado y metastásico1–3, si bien es cierto que su uso puede asociar efectos secundarios poco habituales y que en ocasiones pueden suponer un reto diagnóstico-terapéutico. Presentamos el caso de una paciente con adenocarcinoma pulmonar metastásico que, tras seguir tratamiento con nivolumab, desarrolló un cuadro de pseudoprogresión tumoral que fue inicialmente malinterpretado y por el que fue enviada a Cuidados Paliativos.
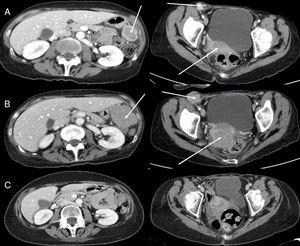
Se trata de una mujer de 55 años que consulta por cefalea, náuseas y vómitos. Se realizan TC y RM craneal que objetivan una lesión cerebral de 2,5×2,5cm temporal derecha con importante edema y desviación de la línea media. En TC de cuerpo completo se encuentra un nódulo pulmonar apical derecho de 23mm compatible con neoplasia primaria. Se realiza PET-TC que muestra una lesión en el LSD con intensa captación, indicativa de malignidad, sin evidencia de tejido tumoral viable con afinidad por la 18F-FDG en otras localizaciones. La paciente es intervenida de la lesión cerebral con anatomía patológica compatible con metástasis de adenocarcinoma de posible origen pulmonar (CK7 positivo y TTF1, CK20, receptores hormonales, marcadores melánicos y marcadores neuroendocrinos negativos). Posteriormente recibió radioterapia holocraneal y a continuación fue intervenida de su lesión pulmonar, realizándose lobectomía superior derecha y linfadenectomía mediastínica por VATS (video-assisted thoracic surgery), con anatomía patológica compatible con adenocarcinoma broncogénico (la estadificación final definitiva fue pT2aN0M1b por afectación de pleura visceral). El estudio molecular no demostró mutaciones ni translocaciones moleculares (EGFR, KRAS, BRAF, ALK y ROS1 negativos). La paciente recibió 2 ciclos de cisplatino+pemetrexed y en el primer control de TC (realizado 8 semanas después) se objetivó la aparición de una adenopatía inguinal derecha y masas pélvicas en teórica localización del anejo derecho, así como en la gotiera parietocólica izquierda, de aspecto tumoral, por lo que inició tratamiento de segunda línea con nivolumab (3mg/kg cada 15 días). En control de imagen realizado a las 8 semanas se objetivó progresión de las lesiones abdominopélvicas y cerebrales con deterioro del estado general (ECOG 3), siendo la paciente remitida a Cuidados Paliativos. Un año más tarde acudió a la consulta con mejoría del estado general (ECOG 1) y en TC de reevaluación se comprobó la desaparición de las lesiones abdominopélvicas descritas y de las lesiones cerebrales en la RM craneal (fig. 1). Actualmente la paciente se encuentra en respuesta radiológica completa tras 41 meses de seguimiento.
A) Imágenes axiales de TC de abdomen (izquierda) y pelvis (derecha) en las que se objetiva una adenopatía inguinal derecha, una masa en la región anexial derecha y otra en la gotiera parietocólica izquierda (flechas). B) Imágenes axiales de TC de abdomen (izquierda) y pelvis (derecha) realizadas 8 semanas más tarde, en las que se observa un llamativo aumento de las lesiones tumorales (flechas). C) Imágenes axiales de TC de abdomen (izquierda) y pelvis (derecha) realizadas 12 meses más tarde, en las que se demuestra la desaparición de las lesiones tumorales.
En los últimos años, las opciones terapéuticas para el carcinoma no microcítico de pulmón avanzado han aumentado de forma significativa. Este nuevo armamentario terapéutico supone una ventaja para algunos pacientes, pero ha traído consigo unas formas diferentes de toxicidad. En este sentido, los fármacos inmunomoduladores pueden dar lugar a complicaciones relacionadas con el sistema inmunológico, complicaciones relacionadas con otras comorbilidades o tratamientos del paciente e, incluso, respuestas paradójicas4. La pseudoprogresión es una forma de respuesta clínica consistente en un empeoramiento radiológico de la enfermedad durante el tratamiento, por un periodo de tiempo indeterminado, y con una posterior regresión5. Inicialmente descrita durante el tratamiento de lesiones cerebrales, se ha observado hasta en un 15% de los pacientes de melanoma que reciben inmunoterapia, pero es poco frecuente en el cáncer de pulmón6, siendo su prevalencia en estos pacientes inferior al 2%5, y parece deberse a la infiltración del tumor por parte de los linfocitos T, con el consiguiente edema y/o necrosis. Solo la evolución radiológica puede confirmar la ausencia de una verdadera progresión de forma no invasiva7, por lo que en ocasiones es muy difícil decidir si continuar con el tratamiento o suspenderlo. Este hecho ha llevado a dejar de usar los criterios WHO o RECIST como respuesta al tratamiento y proponer unos nuevos criterios de respuesta inmunomediada, como los immune-related response criteria (irRC), los immune-related response evaluation criteria in solid tumors (irRECIST1.1), y los immune RECIST (iRECIST)8–10. La principal aportación de estos nuevos criterios de respuesta (que definen la pseudoprogresión o progresión no confirmada) es que los pacientes pueden presentar una respuesta favorable al tratamiento a pesar de un aumento transitorio de la carga tumoral o, incluso, tras la aparición de nuevas lesiones. Para confirmar de forma definitiva si una posible pseudoprogresión corresponde a una verdadera progresión de la enfermedad se requiere un incremento en el volumen de esta que sea confirmado por 2 estudios de imagen separados al menos 4-8 semanas11.
En resumen, parece que la inmunoterapia está cambiando la forma de tratar el carcinoma broncogénico12,13, pero con su uso vienen nuevos efectos secundarios y nuevos retos en la valoración de la respuesta radiológica, lo que exigirá una nueva formación para los profesionales involucrados en el tratamiento y el seguimiento de estos pacientes. A pesar de que la pseudoprogresión parece ser un cuadro infrecuente en pacientes de carcinoma no microcítico de pulmón tratados con inmunoterapia, se debería valorar siempre que fuera posible la realización de técnicas invasivas, ya que la presencia de un denso infiltrado de células inflamatorias en material de biopsia puede ayudar a diferenciar la pseudoprogresión de la progresión14, y tener en cuenta que no debería asociarse a un deterioro clínico significativo del paciente, lo que habitualmente traduce verdadera progresión5.