La medición del óxido nítrico en el aire exhalado diferencia fenotipos de pacientes con EPOC del solapamiento de asma y EPOC (ACO). Hasta el momento no se ha estudiado si existen diferencias entre los componentes alveolar y bronquial del FENO en este grupo de pacientes.
MétodosEstudio observacional transversal realizado en consultas externas de Neumología, incluyendo a pacientes con diagnóstico de EPOC a los que se les realizó una determinación del óxido nítrico en aire exhalado – FENO– diferenciando en esta medida el componente alveolar –CANO– y el de vía aérea central –JawNO–, y realizando las mediciones a distintos flujos. Se compararon los valores de CANO y JawNO entre los pacientes con eosinofilia (definidos como aquellos pacientes con ≥ 300 eosinófilos/ μL en sangre periférica, o bien ≥ 2% eosinófilos o ≥ 3% eosinófilos) y se realizó un análisis de regresión lineal para estudiar las variables clínicas y biológicas que se asociaban a estas mediciones.
ResultadosParticiparon en el estudio 73 pacientes con EPOC. Los criterios de eosinofilia utilizados se asociaban a incrementos de los valores de CANO y de JawNO (en este último caso solo los criterios ≥ 300 eosinófilos y ≥ 3% eosinófilos). CANO se asoció al recuento de eosinófilos y PCR, y JawNO se asoció a tabaquismo y recuento de eosinófilos.
ConclusionesLos pacientes diagnosticados de EPOC y que tienen características de ACO muestran mayor inflamación a nivel bronquial y de vía aérea pequeña. CANO y JawNO se relacionan con variables clínicas y biológicas.
Exhaled nitric oxide (FENO) measurements differentiate COPD phenotypes from asthma-COPD overlap (ACO). To date, no study has been conducted to determine whether alveolar and bronchial components differ in this group of patients.
MethodsThis was an observational cross-sectional study recruiting ambulatory COPD patients. FENO was measured, differentiating alveolar (CANO) from bronchial (JawNO) components using a multiple-flow technique. CANO and JawNO values were compared between eosinophilic COPD patients (defined as ≥ 300 eosinophils/μL in peripheral blood test, or ≥ 2% eosinophils or ≥ 3% eosinophils), and a linear regression analysis was performed to determine clinical and biological variables related to these measurements.
Results73 COPD patients were included in the study. Eosinophil counts were associated with increased values of CANO and JawNO (for the latter only the association with ≥ 300 or ≥ 3% eosinophils was significant). CANO was also associated with CRP, and JawNO with smoking.
ConclusionsPatients with COPD and ACO characteristics show increased inflammation in the large and small airways. CANO and JawNO are associated with clinical and biological variables.
La enfermedad pulmonar obstructiva crónica (EPOC) se define como la presencia de limitación crónica y poco reversible al flujo aéreo, que es habitualmente progresiva, asociada a una reacción inflamatoria anómala, debida principalmente al humo del tabaco1,2. Esta respuesta inflamatoria característica de la EPOC está mediada por macrófagos, neutrófilos y linfocitos T citotóxicos (CD8+), y se acompaña de cambios estructurales que pueden producir estrechamiento de la luz en las vías aéreas, cambios en las arterias, enfisema en el parénquima pulmonar, o combinaciones de estas alteraciones3. Estos cambios estructurales comienzan en las fases más tempranas de la enfermedad4, especialmente en las vías aéreas de pequeño calibre. En determinados pacientes, esta respuesta inflamatoria está protagonizada principalmente por linfocitos Th2 y eosinófilos, configurando un patrón clínico de presentación que comparte características con el asma bronquial, que, aunque no está claramente descrito en sus características, es denominado actualmente ACO (Asthma-COPD overlap o síndrome de solapamiento de asma y EPOC)5–7. Una de las características que diferencian biológicamente este fenotipo en los pacientes con EPOC es el recuento de eosinófilos en sangre periférica8, aunque los puntos de corte óptimos no están claramente establecidos.
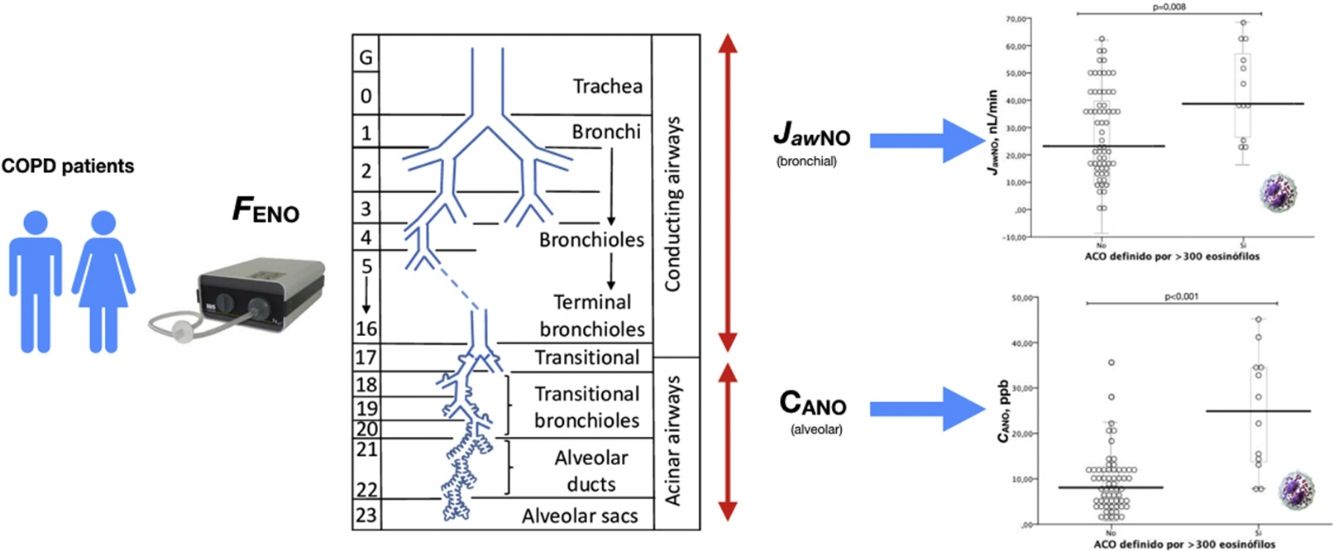
La medición del óxido nítrico en aire exhalado como marcador de inflamación en la vía aérea ha observado un gran desarrollo en las últimas décadas, permitiendo en la actualidad, mediante la aplicación de diferentes ecuaciones, separar el componente alveolar o de la vía aérea distal (CANO) del componente bronquial central9–11 (JawNO). El análisis de ambos componentes ha sido más extensamente estudiado en pacientes con asma bronquial, en donde se aprecia un aumento del componente alveolar –CANO– en los pacientes con asma más grave, lo que traduce mayor inflamación a este nivel12,13. Además, la medición del CANO puede ayudar a identificar a pacientes susceptibles de mejorar con el empleo de corticoides inhalados (CI)14 así como a pacientes con mayor riesgo de comorbilidad15.
En pacientes con EPOC, la medición del óxido nítrico en aire exhalado (FENO) ha demostrado ser capaz de discriminar diferentes tipos de pacientes16,17 y estar asociada a la presencia de eosinófilos en esputo18,19, un hallazgo característico del ACO. Por otra parte, los niveles de FENO son un buen predictor de respuesta al empleo de CI20,21. Los estudios realizados hasta la fecha, en los que se ha diferenciado la determinación de la fracción alveolar y bronquial del FENO en pacientes con EPOC, han demostrado la existencia de inflamación distal en algunos pacientes22, a semejanza de lo que ocurre en pacientes con asma grave.
En un estudio transversal realizado en nuestro país, los niveles de FENO se encontraban elevados en los pacientes definidos como ACO, con un punto de corte óptimo de 20 partes por billón (ppb) para el diagnóstico de ACO16.
Sin embargo, no se han estudiado suficientemente las diferencias entre ambos componentes, alveolar y bronquial, así como las variables clínicas y biológicas que se relacionan con que la inflamación asiente preferentemente en uno u otro territorio.
El objetivo de este trabajo por tanto es estudiar si existen diferencias en cuanto a la cantidad de FENO entre los compartimentos alveolar y bronquial en pacientes con criterios biológicos de ACO, así como si estas diferencias se asocian a otras variables clínicas o biológicas, que puedan indicar si la inflamación asienta preferentemente en uno u otro territorio (CANO y JawNO).
Material y MétodosDiseño del estudioEstudio observacional, transversal, enfocado a valorar las diferencias en la producción de CANO y JawNO y su relación con variables clínicas en pacientes con EPOC atendidos de forma consecutiva en una consulta externa de Neumología para la realización de una exploración funcional completa (medición de volúmenes pulmonares y difusión). El periodo de realización del estudio fue de noviembre de 2014 a mayo de 2015.
Población de estudioLa población de estudio estaba formada por pacientes adultos, mayores de 40 años, fumadores o exfumadores con un consumo acumulado de al menos 10 años-paquete, con diagnóstico de EPOC de acuerdo a las normativas y recomendaciones nacionales e internacionales1,2. Como criterios de exclusión se encontraban la presencia de otra enfermedad respiratoria diferente a la EPOC que pueda alterar significativamente la exploración (incluyendo el antecedente de asma bronquial), el antecedente de exacerbación de la EPOC en las 4 semanas previas a la realización de la prueba, la incapacidad para realizar las mediciones de estudio o para contestar a los cuestionarios y la participación en un ensayo clínico u otro estudio de investigación.
Variables de estudioVariables clínicas: para cada paciente, se recogieron datos acerca de su enfermedad respiratoria, como tiempo de evolución, hábitos tóxicos, comorbilidades asociadas, disnea basal medida mediante la escala modificada de disnea del Medical Research Council (mMRC), cuestionario de síntomas COPD Assessment Test (CAT®), y el historial de exacerbaciones en el año anterior (clasificándolas como moderadas en el caso de tratamiento ambulatorio con corticoides sistémicos y/o antibióticos y como graves en el caso de ingreso hospitalario o estancia en un servicio de urgencias >24h).
Analítica sanguínea: previo a la realización de las pruebas de función respiratoria, a los pacientes se les realizó una extracción de sangre periférica para la determinación del recuento de eosinófilos y porcentaje de eosinófilos así como para la medición de la proteína C reactiva (PCR).
Medición del componente alveolar (CANO) y bronquial (JawNO) del óxido nítrico en aire exhalado: previa a la determinación de la función pulmonar, los pacientes realizaron tres maniobras de determinación del FENO a 50mL/s (FENO50) y posteriormente se realizaron al menos dos determinaciones adicionales para cada flujo de 100mL/s, 200mL/s y 350mL/s, con el fin de poder obtener los datos de CANO y JawNO, de acuerdo con las recomendaciones internacionales23,24, mediante un medidor de quimioluminiscencia de NO (HypAir FENO ®, Medisoft, Bélgica).
Variables de función pulmonar: los pacientes realizaron una espirometría basal y después de inhalar 400μg de salbutamol de acuerdo con las recomendaciones nacionales e internacionales25,26. Además se realizó una medición de los volúmenes pulmonares y de la capacidad de difusión del monóxido de carbono de acuerdo con las normativas vigentes27,28. Todas las mediciones se realizaron en la misma estación de función pulmonar (MasterLab, Jaeger GmbH, Alemania).
Aspectos éticosEl estudio se realizó de acuerdo con los principios de la Declaración de Helsinki. Los pacientes invitados a participar firmaron un consentimiento informado para su inclusión en el mismo. El estudio fue aprobado por el CEIC de referencia. Todos los registros de la base de datos de pacientes que se generaron eran confidenciales y tratados de acuerdo con la Ley Orgánica15/1999, de 13 de diciembre, de Protección de Datos de Carácter Personal.
Análisis estadísticoSe realizó una estadística descriptiva de las variables del estudio, usando frecuencias absolutas y relativas en el caso de las variables cualitativas. Las variables cuantitativas según sigan o no una distribución normal (aplicando los test de normalidad adecuados al tamaño muestral) son resumidas mediante media, desviación estandar (Md ± SD) y rango (mínimo y máximo) o P50 [P25 - P75] (mediana, rango intercuartílico) respectivamente.
La comparación de las variables cuantitativas según los grupos de estudio, se efectuó mediante t de Student para muestras independientes o H de Kruskal Wallis (con el test apropiado dependiendo de los resultados anteriores obtenidos). Se realizaron pruebas post hoc en el caso de la Anova y la U-Mann-Whitney con la corrección de Bonferroni, en el otro caso. Para conocer la relación entre CANO, JawNO y las variables clínicas se realizó un análisis de regresión lineal múltiple con CANO y JawNO como variables dependientes, respectivamente, mediante el método de introducción hacia delante. El nivel de significación estadística, se estableció en p = 0,05. El análisis estadístico se realizó con el paquete Statistical Package for Social Sciences (SPSS Inc., Chicago, IL, EE. UU.) versión 24.0.
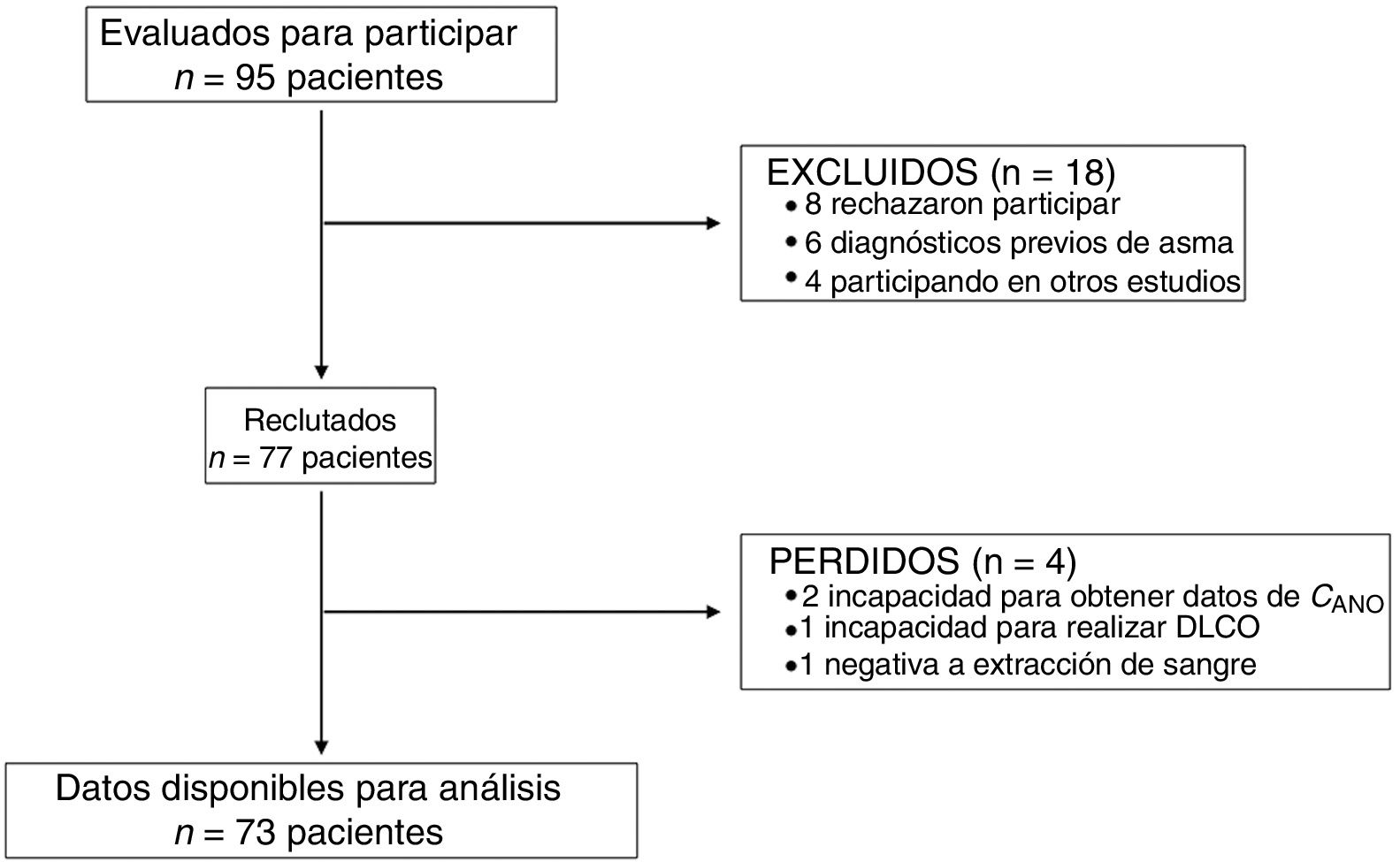
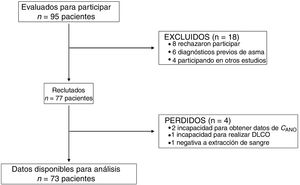
ResultadosCaracterísticas de la población de estudioNoventa y cinco pacientes fueron invitados a participar, siendo finalmente 73 los pacientes en los que se pudieron completar todos los procedimientos. La figura 1 muestra el diagrama STROBE de los participantes en el estudio.
Las características basales de los pacientes se exponen en la tabla 1. En resumen, se trata de una muestra de pacientes con EPOC predominantemente graves, con un FEV1 medio inferior al 50%, fumadores activos cerca de un cuarto de la población de estudio y con una elevada carga de síntomas y de exacerbaciones en el año previo.
Características de la población de estudio
| Variable | Valor (n = 73) |
|---|---|
| Edad, años | 68,0 ± 10,6 |
| Sexo (H/M) n (%) | 63/10 (86,3%/13,7%) |
| Tabaquismo activo, n (%) | 21 (28,8%) |
| Función pulmonar | |
| FEV1% teórico | 47,5 ± 15,8 |
| FVC% teórico | 77,2 ± 17,2 |
| FEV1/FVC | 47,7 ± 10,5 |
| TLC, % teórico | 128,4 ± 19,1 |
| RV, % teórico | 228,6 ± 58,1 |
| IC/TLC | 16,07 ± 5,8 |
| DLCO, % teórico | 42,1 ± 16,3 |
| Gravedad (BODE) | |
| Mediana (RIQ) | 4 (2-5) |
| BODE >2, n (%) | 53 (72,6%) |
| Grado GOLD 2017 | |
| GOLD A, n (%) | 4 (5,5%) |
| GOLD B, n (%) | 25 (34,2%) |
| GOLD C, n (%) | 4 (5,5%) |
| GOLD D, n (%) | 40 (54,8%) |
| Reversibilidad media, % | 9,01 ± 7,84 |
| Exacerbaciones, año anterior | |
| Exacerbaciones moderadas/año | 1,82 ± 1,37 |
| Exacerbaciones graves /año | 0,17 ± 0,38 |
| Tratamiento habitual | |
| LAMA, n (%) | 68 (93,1%) |
| LABA, n (%) | 72 (98,6%) |
| CI, n (%) | 55 (75,3%) |
| Comorbilidades | |
| Cardiopatía isquémica, n (%) | 13 (17,8%) |
| Síndrome depresivo, n (%) | 7 (9,6%) |
| Insuficiencia cardiaca, n (%) | 8 (11,0%) |
| DM tipo 2, n (%) | 6 (8,2%) |
| Indice COTE, mediana (RIQ) | 1 (0-6) |
| Puntuación CAT | 22 (15-27) |
| Analítica sanguínea | |
| Eosinófilos totales, 10-3/μL | 0,215 ± 0,095 |
| Eosinófilos, % | 2,51 ± 1,17 |
| PCR, mg/l | 0,70 ± 0,94 |
| Fibrinógeno, mg/ dL | 435,9 ± 133,6 |
BODE: índice de masa corporal, obstrucción, disnea y tolerancia al ejercicio; CAT: test de evaluación de la EPOC; CI: corticoides inhalados; DLCO: capacidad de difusión del monóxido de carbono (expresado como porcentaje sobre el teórico); DM: diabetes mellitus; FEV1% teórico: flujo espiratorio máximo en el primer segundo (expresado como porcentaje sobre el teórico); FVC: capacidad vital forzada (expresado como porcentaje sobre el teórico); IC: capacidad inspiratoria; LABA: agonistas β-adrenérgicos de acción prolongada; LAMA: antagonistas muscarínicos de acción prolongada; PCR: proteína C reactiva; RIQ: rango intercuartílico; RV: volumen residual (expresado como porcentaje sobre el teórico); TLC: capacidad pulmonar total (expresado como porcentaje sobre el teórico).
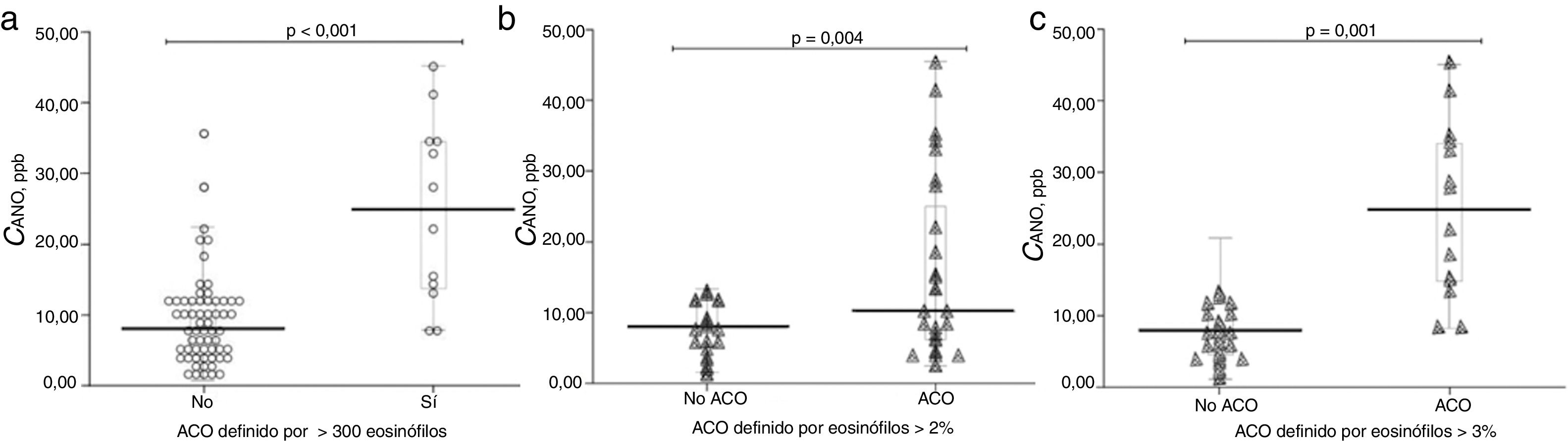
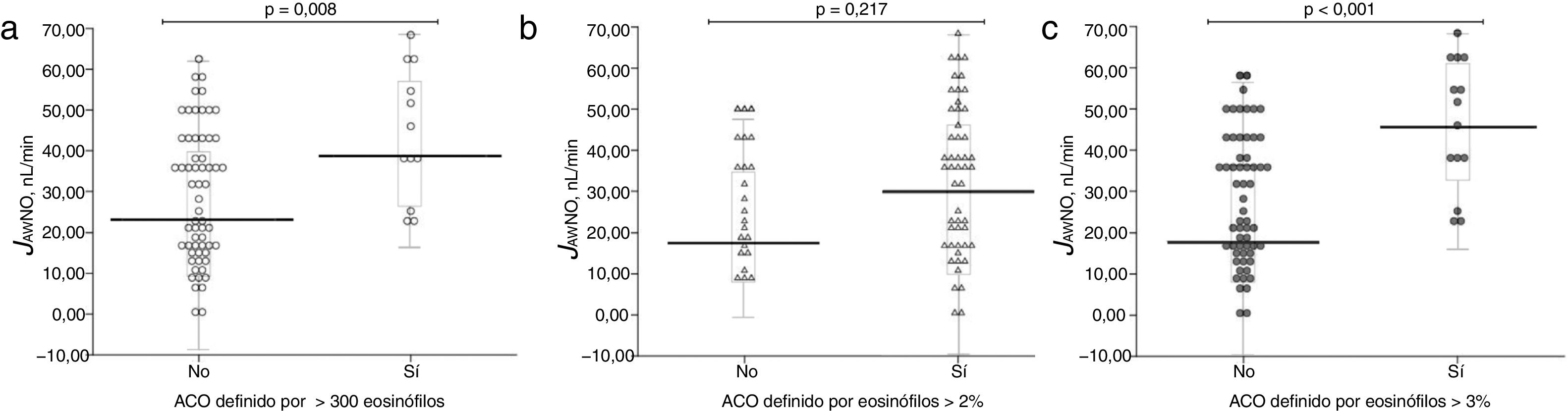
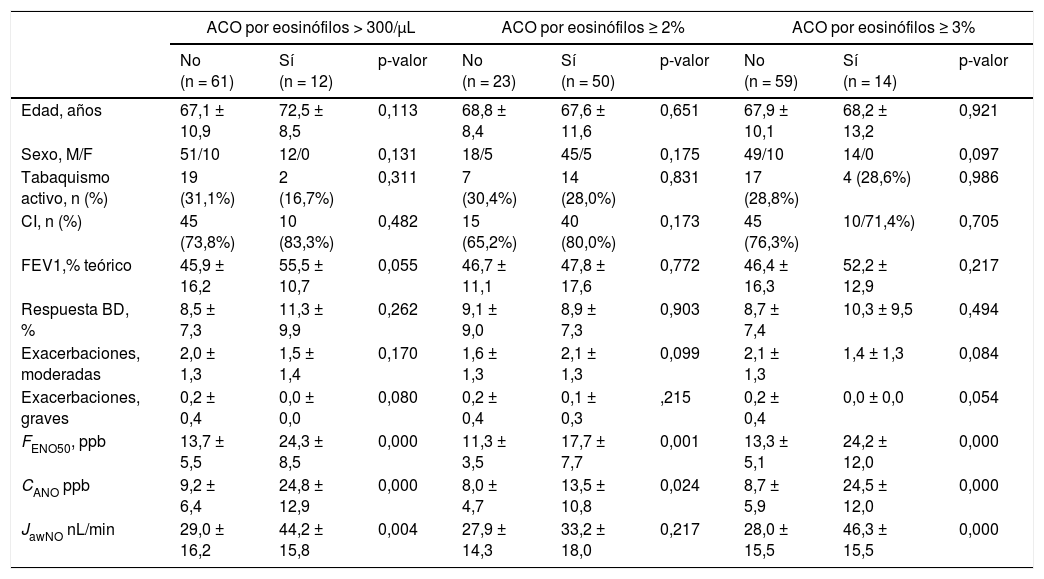
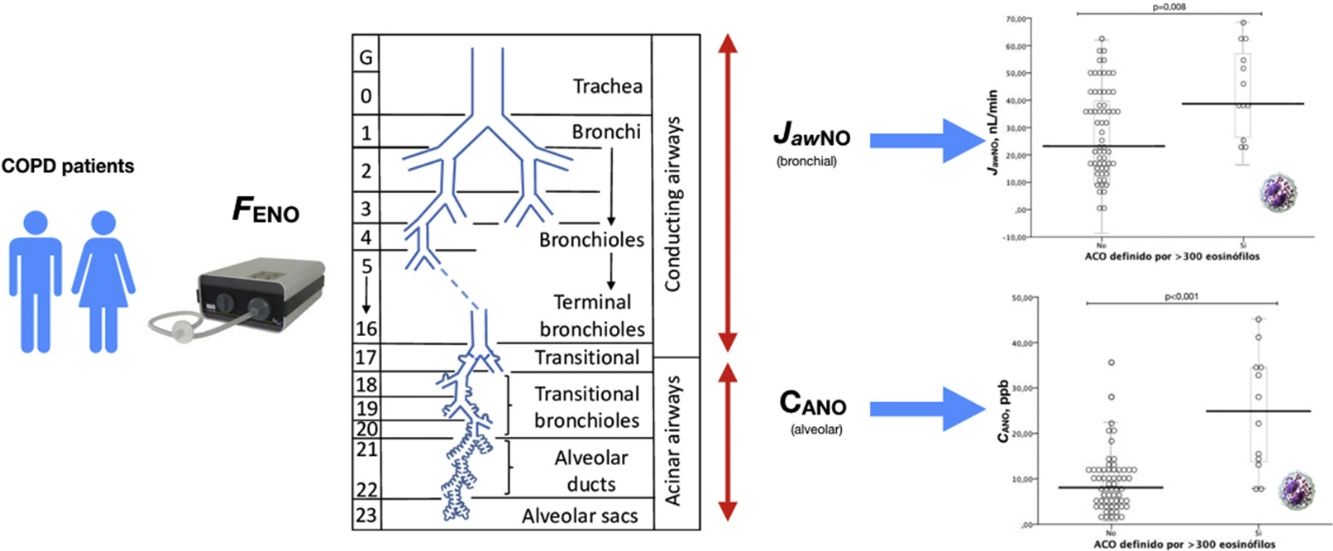
La tabla 2 muestra las características de los pacientes dependiendo del criterio de recuento de eosinófilos para definir ACO (≥ 2% eosinófilos, ≥ 3% eosinófilos o ≥ 300 células/ μL). No se apreciaron diferencias en los parámetros clínicos entre los grupos dependiendo del criterio para definir ACO, salvo en las mediciones de óxido nítrico (tanto FENO50 como CANO y JawNO). Las figuras 2 y 3 muestran los niveles de CANO y JawNO respectivamente utilizando diferentes puntos de corte del recuento de eosinófilos para la definición del ACO (2%, 3% y > 300 eosinófilos, respectivamente). En todos los casos, los niveles de CANO eran superiores para los pacientes definidos como ACO según el recuento de eosinófilos (siendo las diferencias mayores cuando se utilizaban los criterios de >3% o > 300 eosinófilos). Los niveles de JawNO fueron superiores solo en aquellos pacientes con ACO definido por >3% o >300 eosinófilos. Utilizando criterios más restrictivos (>300 eosinófilos y >3%) no mejoraba la detección de diferencias entre los pacientes catalogados como ACO y el resto.
Características de los pacientes incluidos en el estudio dependiendo del criterio para definir ACO utilizado
| ACO por eosinófilos > 300/μL | ACO por eosinófilos ≥ 2% | ACO por eosinófilos ≥ 3% | |||||||
|---|---|---|---|---|---|---|---|---|---|
| No (n = 61) | Sí (n = 12) | p-valor | No (n = 23) | Sí (n = 50) | p-valor | No (n = 59) | Sí (n = 14) | p-valor | |
| Edad, años | 67,1 ± 10,9 | 72,5 ± 8,5 | 0,113 | 68,8 ± 8,4 | 67,6 ± 11,6 | 0,651 | 67,9 ± 10,1 | 68,2 ± 13,2 | 0,921 |
| Sexo, M/F | 51/10 | 12/0 | 0,131 | 18/5 | 45/5 | 0,175 | 49/10 | 14/0 | 0,097 |
| Tabaquismo activo, n (%) | 19 (31,1%) | 2 (16,7%) | 0,311 | 7 (30,4%) | 14 (28,0%) | 0,831 | 17 (28,8%) | 4 (28,6%) | 0,986 |
| CI, n (%) | 45 (73,8%) | 10 (83,3%) | 0,482 | 15 (65,2%) | 40 (80,0%) | 0,173 | 45 (76,3%) | 10/71,4%) | 0,705 |
| FEV1,% teórico | 45,9 ± 16,2 | 55,5 ± 10,7 | 0,055 | 46,7 ± 11,1 | 47,8 ± 17,6 | 0,772 | 46,4 ± 16,3 | 52,2 ± 12,9 | 0,217 |
| Respuesta BD, % | 8,5 ± 7,3 | 11,3 ± 9,9 | 0,262 | 9,1 ± 9,0 | 8,9 ± 7,3 | 0,903 | 8,7 ± 7,4 | 10,3 ± 9,5 | 0,494 |
| Exacerbaciones, moderadas | 2,0 ± 1,3 | 1,5 ± 1,4 | 0,170 | 1,6 ± 1,3 | 2,1 ± 1,3 | 0,099 | 2,1 ± 1,3 | 1,4 ± 1,3 | 0,084 |
| Exacerbaciones, graves | 0,2 ± 0,4 | 0,0 ± 0,0 | 0,080 | 0,2 ± 0,4 | 0,1 ± 0,3 | ,215 | 0,2 ± 0,4 | 0,0 ± 0,0 | 0,054 |
| FENO50, ppb | 13,7 ± 5,5 | 24,3 ± 8,5 | 0,000 | 11,3 ± 3,5 | 17,7 ± 7,7 | 0,001 | 13,3 ± 5,1 | 24,2 ± 12,0 | 0,000 |
| CANO ppb | 9,2 ± 6,4 | 24,8 ± 12,9 | 0,000 | 8,0 ± 4,7 | 13,5 ± 10,8 | 0,024 | 8,7 ± 5,9 | 24,5 ± 12,0 | 0,000 |
| JawNO nL/min | 29,0 ± 16,2 | 44,2 ± 15,8 | 0,004 | 27,9 ± 14,3 | 33,2 ± 18,0 | 0,217 | 28,0 ± 15,5 | 46,3 ± 15,5 | 0,000 |
BD: respuesta broncodilatadora; CANO: óxido nítrico alveolar; FENO50: óxido nítrico en aire exhalado a 50ml/s; JawNO: óxido nítrico bronquial.
Valores de CANO dependiendo del criterio para definir ACO. a) ACO definido por ≥ 300 eosinófilos/ μL. b) ACO definido por ≥ eosinófilos. c) ACO definido por ≥ 3% eosinófilos. Las líneas horizontales muestran el valor medio, las figuras los valores individuales observados, la caja el rango IQ y los bigotes el error estándar de la media.
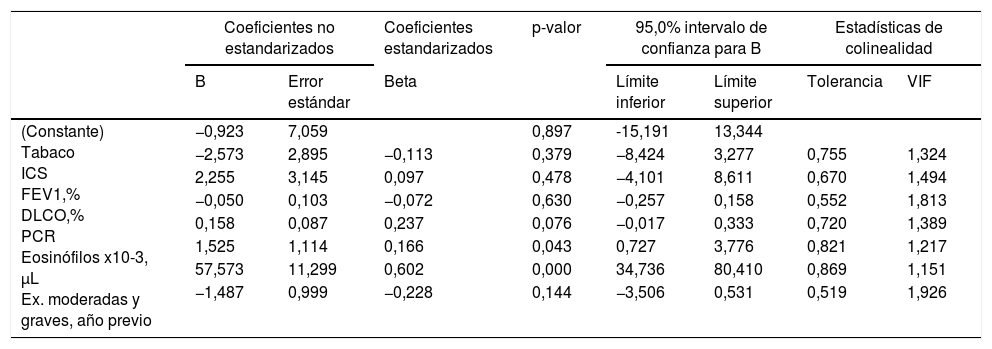
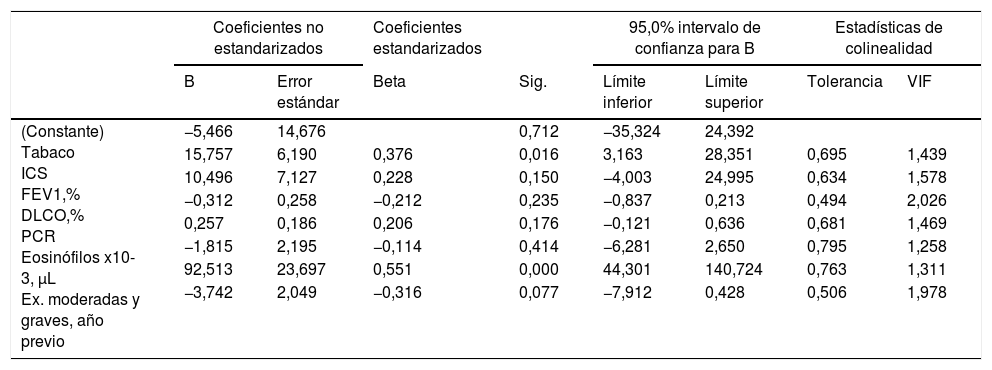
Los análisis de regresión lineal múltiple con el objetivo de valorar las asociaciones de CANO y JawNO con diferentes variables clínicas, biológicas y de función pulmonar están detallados en las tablas 3 y 4, respectivamente. Las variables que se relacionaban con la inflamación del territorio alveolar –CANO– y que predecían su valor fueron los niveles de PCR y el recuento total de eosinófilos en sangre periférica, con una R2 de 0,412. Las variables que mayor relación mostraban con la inflamación territorio bronquial –JawNO–, y que predecían su valor fueron el consumo de tabaco, número de exacerbaciones moderadas en el año previo, y el recuento de eosinófilos en sangre periférica, con una R2 del modelo de 0,477. En el Anexo (material adicional) se presentan gráficamente los valores de CANO y JawNO comparados contra los valores predichos mediante estos modelos (expresado como regresiones del valor predicho estandarizado).
Análisis de regresión lineal múltiple con el CANO como variable dependiente
| Coeficientes no estandarizados | Coeficientes estandarizados | p-valor | 95,0% intervalo de confianza para B | Estadísticas de colinealidad | ||||
|---|---|---|---|---|---|---|---|---|
| B | Error estándar | Beta | Límite inferior | Límite superior | Tolerancia | VIF | ||
| (Constante) Tabaco ICS FEV1,% DLCO,% PCR Eosinófilos x10-3, μL Ex. moderadas y graves, año previo | −0,923 | 7,059 | 0,897 | -15,191 | 13,344 | |||
| −2,573 | 2,895 | −0,113 | 0,379 | −8,424 | 3,277 | 0,755 | 1,324 | |
| 2,255 | 3,145 | 0,097 | 0,478 | −4,101 | 8,611 | 0,670 | 1,494 | |
| −0,050 | 0,103 | −0,072 | 0,630 | −0,257 | 0,158 | 0,552 | 1,813 | |
| 0,158 | 0,087 | 0,237 | 0,076 | −0,017 | 0,333 | 0,720 | 1,389 | |
| 1,525 | 1,114 | 0,166 | 0,043 | 0,727 | 3,776 | 0,821 | 1,217 | |
| 57,573 | 11,299 | 0,602 | 0,000 | 34,736 | 80,410 | 0,869 | 1,151 | |
| −1,487 | 0,999 | −0,228 | 0,144 | −3,506 | 0,531 | 0,519 | 1,926 | |
Ex.: exacerbaciones; VIF: factor de inflación de la varianza.
Análisis de regresión lineal múltiple con el JawNO como variable dependiente
| Coeficientes no estandarizados | Coeficientes estandarizados | 95,0% intervalo de confianza para B | Estadísticas de colinealidad | |||||
|---|---|---|---|---|---|---|---|---|
| B | Error estándar | Beta | Sig. | Límite inferior | Límite superior | Tolerancia | VIF | |
| (Constante) Tabaco ICS FEV1,% DLCO,% PCR Eosinófilos x10-3, μL Ex. moderadas y graves, año previo | −5,466 | 14,676 | 0,712 | −35,324 | 24,392 | |||
| 15,757 | 6,190 | 0,376 | 0,016 | 3,163 | 28,351 | 0,695 | 1,439 | |
| 10,496 | 7,127 | 0,228 | 0,150 | −4,003 | 24,995 | 0,634 | 1,578 | |
| −0,312 | 0,258 | −0,212 | 0,235 | −0,837 | 0,213 | 0,494 | 2,026 | |
| 0,257 | 0,186 | 0,206 | 0,176 | −0,121 | 0,636 | 0,681 | 1,469 | |
| −1,815 | 2,195 | −0,114 | 0,414 | −6,281 | 2,650 | 0,795 | 1,258 | |
| 92,513 | 23,697 | 0,551 | 0,000 | 44,301 | 140,724 | 0,763 | 1,311 | |
| −3,742 | 2,049 | −0,316 | 0,077 | −7,912 | 0,428 | 0,506 | 1,978 | |
Ex.: exacerbaciones; VIF: factor de inflación de la varianza.
Los resultados de este trabajo muestran que los pacientes con EPOC que cumplen uno de los criterios propuesto de ACO (recuento de eosinófilos en sangre periférica elevado) presentan diferencias en la producción de óxido nítrico en el territorio alveolar (CANO) así como a nivel bronquial (JawNO) dependiendo del dintel para considerar el recuento de eosinófilos, siendo similares los valores si el criterio que se aplica es el recuento de eosinófilos ≥ 300 células/ μL o el porcentaje ≥ 3%.
Los hallazgos comentados están en línea con la experiencia publicada previamente por nuestro grupo, demostrando que el FENO50 puede ser un marcador accesible para la detección del ACO16, añadiendo información relevante con valor clínico, que matiza la aportada por la cifra de eosinófilos en sangre periférica.
La medición del FENO y la determinación diferenciada de sus componentes alveolar y bronquial ha sido desarrollada principalmente en el campo del asma bronquial, en donde se ha comprobado previamente que puede ser de utilidad a la hora de valorar el control de la enfermedad, así como para la predicción del riesgo futuro o para el ajuste de tratamiento inhalado29–31.
En los pacientes con EPOC, las experiencias publicadas hasta la fecha sobre las mediciones de CANO y de JawNO han sido más escasas y con resultados poco convincentes32–34, si bien hasta este momento no se hicieron análisis en función de los criterios para definir ACO, como la presencia de eosinófilos en sangre periférica, o la respuesta broncodilatadora. Los valores obtenidos en nuestro estudio son superponibles a la población estudiada por otros autores32,33 en el grupo de pacientes sin características biológicas de ACO. De igual modo, en nuestro estudio existe una relación entre tabaquismo y valores bajos de JawNO al igual que en otro estudio, sugiriendo que el tabaco influye en la producción del óxido nítrico bronquial y no del alveolar. Es necesario destacar que en el grupo de pacientes con EPOC que hemos estudiado, no existen diferencias en cuanto a la inflamación del territorio alveolar y bronquial (CANO y de JawNO) en el grupo de pacientes que no presentan datos de ACO.
Nuestro estudio presenta debilidades como son su naturaleza transversal, el ser realizado en un único centro y el bajo número de pacientes incluidos, todo ello relacionado con la dificultad técnica de realizar la determinación. No obstante, el número de pacientes está cercano al de otros estudios32. Igualmente, y en aras de eliminar posibles factores de confusión, en nuestro estudio se han excluido los pacientes previamente diagnosticados de asma bronquial, por lo que los resultados obtenidos no son aplicables a la totalidad de los pacientes ACO. De igual forma, cabe recordar que no todos los pacientes son clasificados como ACO por el rasgo del recuento de eosinófilos. Otra debilidad de nuestro trabajo es la presencia de tabaquismo activo y tratamiento con CI, que podrían alterar los niveles de CANO y JawNO.
Desde un punto vista de la utilidad clínica, la utilización de las variables incluidas en los modelos de regresión lineal de este estudio puede ayudar al clínico a identificar los pacientes o grupos de pacientes que pueden presentar una mayor inflamación Th2 a nivel bronquial o alveolar35, y por tanto orientar el tratamiento mediante la elección del sistema de inhalación o molécula cuyo depósito predominantemente a nivel bronquial o a nivel alveolar permita tratar más específicamente a cada paciente, disminuyendo la posibilidad de efectos secundarios36.
En resumen, presentamos la evidencia que muestra que la producción de FeNO en pacientes con EPOC es diferente dependiendo de la cifra de eosinófilos en sangre periférica, especialmente en lo referente a la producción del óxido nítrico de las vías aéreas periféricas, así como las variables clínicas que se asocian a dicha producción para su identificación sencilla por el clínico.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.