Los avances obtenidos en los últimos años en las áreas de inmunología y biología molecular nos han permitido conocer más en profundidad los fenómenos que acontecen en la aparición y la evolución del asma. La diversa relación entre los factores ambientales y hereditarios con los elementos biológicos individuales son el principal condicionante de la distinta expresión fenotipificada de la enfermedad. Determinar el momento evolutivo en que tiene lugar la influencia de estos factores es fundamental en el conocimiento de la historia natural del asma, y su modificación permite, desde un acercamiento terapéutico, intervenir en sus manifestaciones clínicas y funcionales. En este sentido, entendemos como intervención temprana en el asma el conjunto de medidas terapéuticas (modificaciones ambientales, educacionales, farmacológicas, etc.) que tienen como objetivo modificar la evolución y el pronóstico de la enfermedad. Aunque el objetivo de este capítulo se centra únicamente en analizar los efectos de la introducción temprana de los esteroides inhalados, es necesario recordar previamente algunos aspectos de la historia natural de la enfermedad.
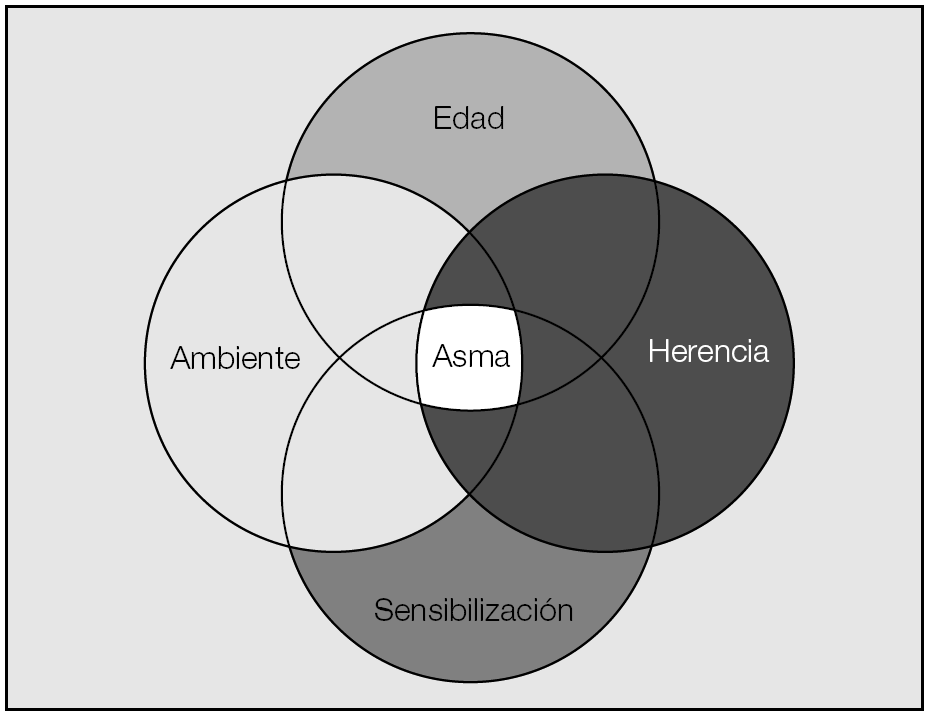
Hoy día, el asma bronquial debe ser considerada como una enfermedad heterogénea y variable en sus fenotipos (fig. 1), con múltiples etapas evolutivas que expresan, cada una, mecanismos patogénicos muy distintos. El estudio de los procesos que tienen lugar durante los primeros años de vida1 ha servido para definir 3 patrones diferentes de evolución clínica en función de la edad de aparición de los síntomas (sibilancias precoces durante el primer año, antes de los 3 años y entre los 3 y 6 años). Asimismo, nos han permitido conocer la distinta influencia que ejercen los factores ambientales (sensibilización ambiental, infecciones, alimentación materna, tabaquismo, obesidad...) y genéticos (patrones hereditarios, polimorfismos en células y mediadores inflamatorios) en la aparición del asma. La asociación entre ambos factores, en un momento en que el crecimiento coordinado de las vías respiratorias y el parénquima pulmonar presentan una dependencia más estrecha, condiciona el desarrollo adecuado de la función pulmonar. La maduración de la función inmunitaria de los individuos tiene lugar durante los primeros meses de vida. En el asma bronquial, como consecuencia de la exposición alergénica, se produce un cambio en la proporción de respuestas linfocitarias Th1 y Th2, que favorece el predominio de la respuesta inmunitaria Th2, responsable de la inflamación eosinofílica y atópica que acompaña a la enfermedad. Este desequilibrio sólo tiene lugar en los individuos más susceptibles con mayor capacidad de sensibilización frente a la influencia alergénica. En este sentido se han descrito diferencias individuales en la capacidad de generar interleucinas o en los propios receptores involucrados en la respuesta inmunitaria (TLR4) que estarían determinados genéticamente2. La mayor presencia de endotoxinas ambientales, las infecciones en los primeros años de vida, e incluso la exposición alergénica muy temprana actúan como mecanismos defensivos en la inducción asmática.
Fig. 1. Interacción de factores en el fenotipo asmático.
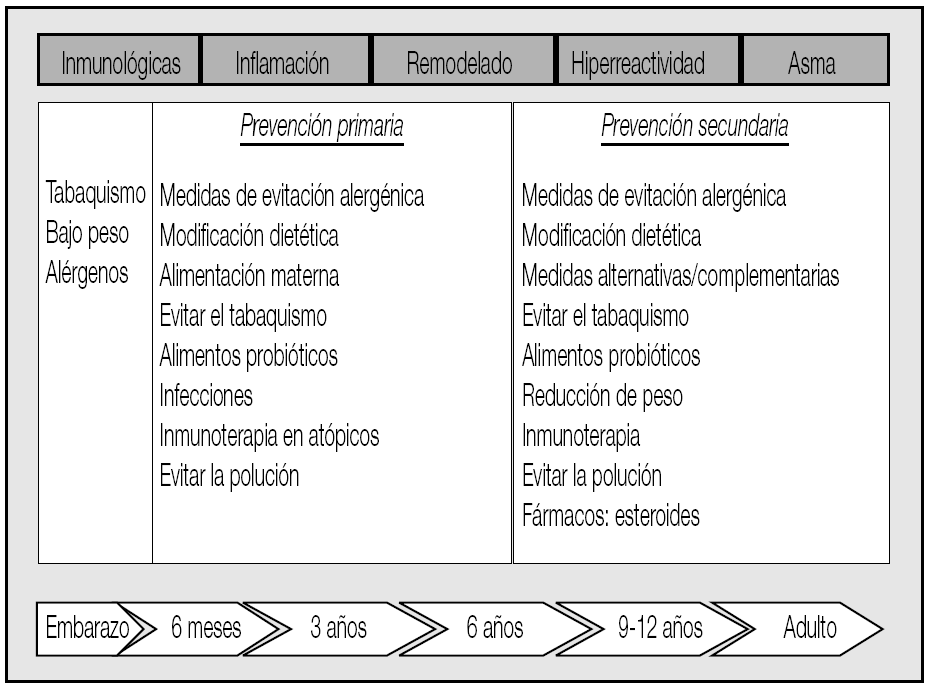
Las estrategias de intervención dependen pues del momento evolutivo considerado. La actuación sobre estos factores cuando se aplican a la población general recibe el nombre de prevención primaria, mientras que se define la prevención secundaria cuando estas mismas medidas se adoptan en poblaciones de alto riesgo, que ya presentan condiciones favorecedoras, como en los individuos atópicos o con factores hereditarios (fig. 2). El tratamiento farmacológico estaría indicado precisamente en este grupo de riesgo, cuando aparecen las primeras manifestaciones clínicas (prevención terciaria) o incluso si se demostrara alguna alteración biológica o funcional que confirmara el diagnóstico de asma (fig. 3). El objetivo de introducir el tratamiento temprano cuando aparecen los primeros síntomas es claro y así se ha establecido en todas las guías de tratamiento publicadas; sin embargo, su capacidad para modificar la historia natural de la enfermedad aún no se ha demostrado totalmente.
Fig. 2. Medidas de prevención en el desarrollo del asma.
Fig. 3. Indicaciones del tratamiento temprano en el asma.
Al estudiar la eficacia del tratamiento temprano con esteroides podemos distinguir, por un lado, los pacientes con una inflamación de las vías respiratorias relacionada con el asma, los cuales, ya sea por la propia gravedad de las lesiones o la percepción individual, aún no presentan síntomas asmáticos y, por otro, los pacientes con asma sintomático leve. El objetivo del tratamiento es diferente en ambos casos. En el primero, se pretende modificar los efectos de la inflamación en el remodelado de las vías respiratorias y la evolución en el deterioro de la función pulmonar, así como evitar en su progresión la aparición de síntomas. Este modelo es característico en la transición del asma infantil a la del adulto. En este grupo se observa que en un porcentaje muy elevado, cercano al 70%, los pacientes están asintomáticos al llegar a la adolescencia. Esta aparente remisión clínica hace que en muchos casos se considere que el asma ha desaparecido; sin embargo, los estudios histológicos han demostrado no sólo la persistencia de la inflamación bronquial3-5, sino también su influencia en el deterioro en la función pulmonar y la hiperreactividad bronquial (HRB)6. La inflamación persistente de las vías respiratorias en individuos asintomáticos no se limita a los adolescentes; se ha descrito de forma frecuente en los pacientes con rinitis alérgica7, atópicos8 y con remisión clínica9. En todos ellos se observa una transición entre los individuos sanos, los que presentan remisión clínica y los pacientes con asma en la intensidad de la infiltración eosinofílica, descamación epitelial y fibrosis subepitelial.
Cuando se analiza el efecto de los esteroides en los pacientes con inflamación asintomática o se investiga su influencia sobre el remodelado, las conclusiones no son claras. Los trabajos publicados hasta el momento muestran resultados discordantes. Convery et al10 demostraron que en un grupo de 10 pacientes con HRB asintomática el tratamiento con fluticasona a dosis elevadas durante 6 semanas produjo una mejoría significativa de la HRB; su efecto, sin embargo, era transitorio y desaparecía a los pocos días de suspender su administración. En un estudio posterior11 se analizaron los efectos del tratamiento con budesonida durante 9 meses en adolescentes con HRB asintomática, y no se observó ningún cambio al final del estudio.
Con respecto al remodelado, mientras que algunos autores, como Hoshino et al12, han descrito una disminución en el depósito de colágeno III y metaloproteinasa 9 en pacientes tratados con beclometasona, otros trabajos, como el estudio de Jeffery et al13, no encuentran diferencias en el grosor de la membrana basal tras el tratamiento con budesonida. En modelos de animales sensibilizados, la administración de fluticasona inhibe pero no revierte totalmente los cambios estructurales inducidos por la sensibilización crónica14. Más recientemente, Sont et al han descrito que el tratamiento con esteroides, dirigido a normalizar la HRB, sí que produce una mejoría en los hallazgos histológicos de remodelado de la vía respiratoria15. No obstante, este estudio se llevó a cabo en pacientes con un asma más evolucionado, y no sería comparable con los anteriores. Así pues, no hay una evidencia firme de que la introducción temprana del tratamiento esteroideo en pacientes con inflamación o HRB asintomática pueda modificar la historia natural de la enfermedad.
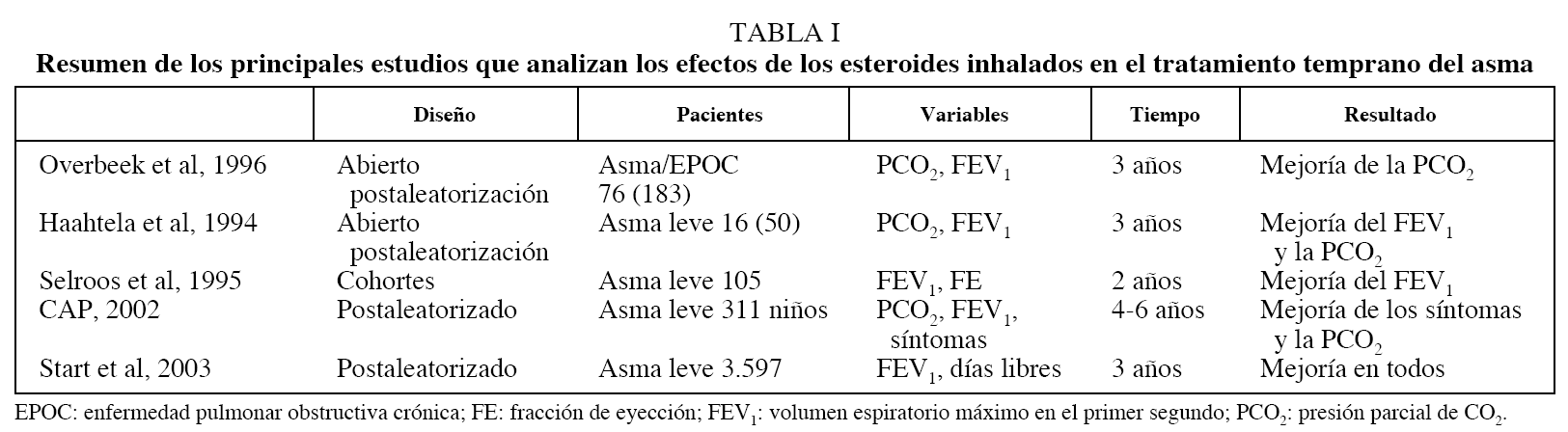
La segunda indicación, y quizás la más frecuente, se establece en pacientes con asma leve, paucisintomáticos o con pérdida ligera de la función respiratoria, cuya clasificación, según las guías de tratamiento, habría que situar entre el asma leve intermitente y el asma leve persistente. En este grupo la evidencia disponible hasta el momento actual se centra en 5 estudios, que analizan en conjunto a cerca de 4.000 individuos (tabla I). De estos 5 trabajos, sólo 3 son aleatorizados. El primero de ellos, publicado por Haahtela et al16, comprende una primera fase en la que se compara durante 2 años la administración de terbutalina frente a esteroides inhalados. En una segunda fase abierta, el grupo de pacientes tratados con terbutalina iniciaron tratamiento con budesonida durante un año, mientras que el grupo inicialmente tratado con esteroides se asignó de forma aleatoria a recibir placebo o una disminución de esteroides. Al comparar los resultados de los pacientes tratados temprana o tardíamente con esteroides, se observan unos valores finales del volumen espiratorio máximo en el primer segundo (FEV1) y la presión parcial de CO2 (PCO2) más elevados en el primer grupo. En contra de este beneficio, se observa que el efecto es transitorio, pues se reduce en la segunda fase al retirar o disminuir el tratamiento. En el trabajo realizado por Overbeek et al17, en el que se agrupan los pacientes con una obstrucción reversible de las vías respiratorias (asma o enfermedad pulmonar obstructiva crónica), los pacientes tratados con beclometasona presentaban una mejoría en la HRB y los síntomas, pero no se demostró ningún cambio en la progresión del FEV1.
Selroos et al18 publicaron en 1994 un estudio abierto en 105 pacientes que habían recibido tratamiento durante 2 años con budesonida, y describieron una respuesta más favorable en la función respiratoria entre los que tenían una evolución previa de sólo 6 meses.
Recientemente, se han conocido algunos resultados del estudio STAR, en el que se compara, de forma aleatorizada y controlada con placebo, la administración temprana y mantenida durante 2 años de budesonida en un número elevado de pacientes (> 3.000). En sus resultados se observa una disminución en el número de exacerbaciones y una mejoría en los parámetros clínicos y de función pulmonar con respecto a los pacientes tratados con placebo. Al igual que ocurre con los estudios previos, también persiste, aunque en menor proporción que en los controles, un descenso en la curva evolutiva del FEV1 a pesar del tratamiento.
Aunque los primeros estudios aleatorizados, analizados en conjunto, han demostrado evidencias sobre la utilidad del tratamiento temprano, también se han vertido algunas críticas acerca de su calidad, tal como ha señalado el panel de expertos de la NAEPP19, lo que restaría fuerza a sus conclusiones. En primer lugar, ninguno de los trabajos antes enumerados es totalmente ciego, pues se analiza siempre la segunda fase en la que los pacientes conocen la naturaleza del fármaco. En todos ellos, el índice de abandonos es superior a lo esperado y el análisis de los datos no se realizó según la intención de tratar ni se calculó el poder del ensayo en función de las pérdidas. En los estudios de un solo grupo, los pacientes fueron introducidos de forma variable, en distintos momentos de la evolución de su enfermedad, lo que dificultaba el establecimiento de comparaciones.
El predominio de los fenómenos inflamatorios en los pacientes con asma de reciente comienzo frente a la mayor intensidad del remodelado en el asma evolucionado ha sido una de las hipótesis esgrimidas para justificar la necesidad del tratamiento temprano. En un estudio de Boulet20 se comparan los hallazgos de la biopsia bronquial, antes y después del tratamiento con esteroides inhalados, en 2 grupos de pacientes con asma clínico leve que nunca habían consumido esteroides. En el primer grupo los síntomas habían aparecido en los últimos 2 años, mientras que el segundo grupo estaba formado por pacientes con asma de al menos 13 años de evolución. Aunque los pacientes con asma de larga evolución presentaban un grado mayor de HRB inespecífica, las diferencias al final del tratamiento, expresadas como dosis dobladas, eran similares en ambos grupos. En ninguno de los casos se encontraron diferencias en el patrón de inflamación ni en el grosor de la membrana basal. El tratamiento no produjo cambios del depósito de colágeno en ninguno de los 2 grupos.
En un reciente metaanálisis de 11 estudios publicados, que comparaban el efecto de los esteroides frente a placebo sobre la HRB21 en pacientes con asma no tratado, se concluye que su administración disminuye la respuesta en 2-8 semanas. Sin embargo, no se pudo deducir una relación dosis-respuesta.
Por tanto, aún resulta prematuro establecer cuál es el momento de introducir el tratamiento temprano de los esteroides; si asumimos que el control del asma tiene como objetivo la mejoría en los parámetros clínicos o de HRB, la evidencia nos dice que deben administrarse al aparecer los síntomas; por el contrario, si el objetivo es tratar la inflamación o el remodelado con el fin de modificar el curso natural de la enfermedad, aún debemos esperar los resultados de futuros estudios para tener mejores pruebas de su utilidad.