Introducción
El asma es una enfermedad que alterna períodos de estabilidad clínica con agudizaciones que parecen relacionarse con la presencia de inflamación subyacente1. Aunque se ha estudiado muy poco in vivo, de los modelos experimentales con provocación bronquial alergénica se deduce que la respuesta es bifásica2. En la fase inmediata predominarían fenómenos de broncoconstricción y alteración de la permeabilidad vascular, producidos por la liberación de mediadores preformados. A esta fase, le seguiría una reacción tardía donde predominaría la presencia de un infiltrado celular, inducido por algunos mediadores previamente liberados, y se constituiría la fase más crónica de la inflamación. Así, la alteración de la permeabilidad vascular durante las crisis de asma produciría un transvase de contenido del suero sanguíneo al espacio intersticial (edema) y a la luz bronquial3. Aunque se supone que este fenómeno participaría en la aparición de los síntomas4, se desconoce si estas alteraciones producen algún efecto sobre el intercambio gaseoso o la obstrucción bronquial durante la crisis.
Probablemente, una de las razones de este desconocimiento sea la falta de un método seguro y fiable que permita obtener muestras de secreciones respiratorias en fase aguda donde medir los marcadores de la permeabilidad vascular pulmonar. En la actualidad, esto no debería representar un problema. Por una parte, en pacientes con asma estable se han descrito diversos marcadores de permeabilidad vascular pulmonar3. El ejemplo más conocido, por su sencillez y amplia disponibilidad clínica, quizá sea la concentración de proteínas plasmáticas en las secreciones respiratorias. Por otra parte, se han desarrollado técnicas no invasivas para la obtención de secreciones respiratorias en la fase aguda, entre las que el esputo inducido con suero salino hipertónico es un método válido para determinar las concentraciones de proteínas séricas extravasadas, como marcador del grado de permeabilidad vascular pulmonar5. Aunque el suero salino nebulizado podría diluir la muestra de una forma difícilmente controlable6, su ventaja sobre métodos como el lavado broncoalveolar es que podría aplicarse de forma segura en pacientes agudos y graves7-10.
Ante la escasez de datos que confirmen la alteración de la permeabilidad vascular en la fase aguda del asma, en el presente estudio se propuso comparar el grado de extravasación de proteínas en la luz bronquial, a través del índice relativo de la concentración de albúmina (IRAlb) y el de macroglobulina α2 (IRMα2), en 3 grupos de sujetos: controles, asmáticos estables (AE) y asmáticos agudizados (AA). Además, se estudió en los AA la relación entre el grado de extravasación, la citología del esputo, el grado de obstrucción --volumen espiratorio forzado en el primer segundo (FEV1)-- y la saturación de oxígeno para valorar su grado de participación en la gravedad de la crisis.
Pacientes y métodos
Pacientes
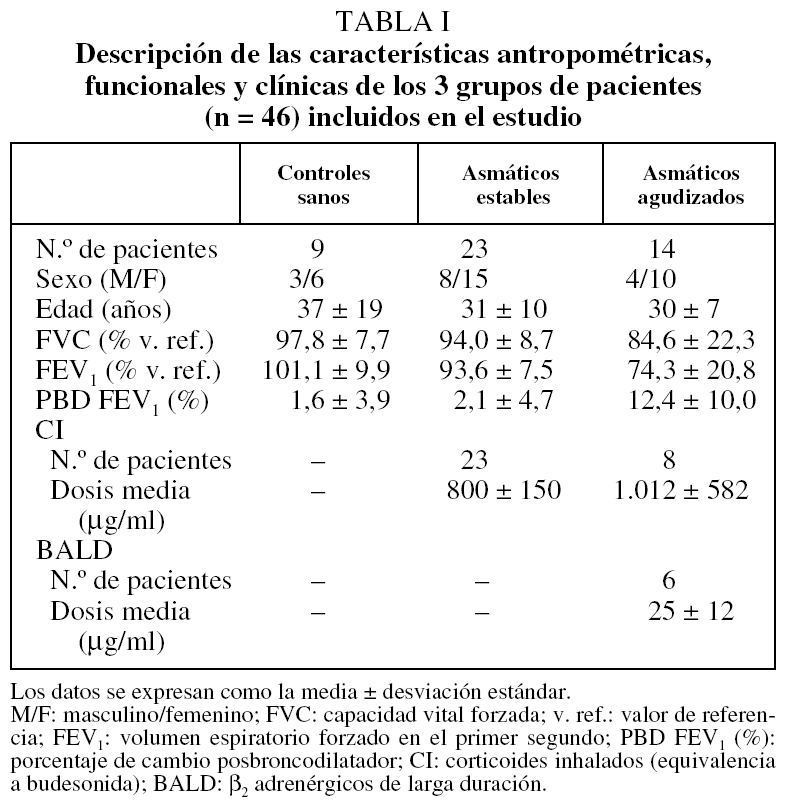
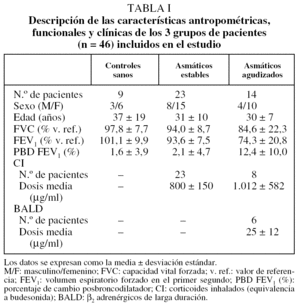
Se estudió a 49 voluntarios no fumadores: 9 del grupo control, 25 del AE y 15 del AA con crisis de leve a moderada. Los pacientes del grupo AA fueron reclutados consecutivamente entre los pacientes que acudían al Hospital de Día de Urgencias Respiratorias y presentaban síntomas de asma con intensificación durante al menos 48 h, acompañados de un descenso del FEV1 o del flujo espiratorio máximo de al menos un 20% de su mejor valor previo registrado. Los del AE estaban asintomáticos y tenían el asma controlada, según reflejaba un cuestionario específico11; permanecieron clínicamente estables durante el período de estudio y no habían experimentado modificaciones en su tratamiento en los últimos 2 meses. Los del grupo control no padecían enfermedad alguna conocida, tenían un espirometría normal y una prueba de provocación con metacolina negativa. Todos ellos acudieron a la Clínica d'Asma i Al·lèrgia (Departament de Pneumologia) del Hospital de la Santa Creu i de Sant Pau de Barcelona para realizar el estudio y participaron después de leer y firmar el consentimiento informado.
En los enfermos, se consideró asma la presencia actual o pasada de síntomas de asma y tener registrada en la historia clínica una prueba de provocación con metacolina con una concentración de ésta igual o inferior a 8 mg/ml4 para provocar un descenso del FEV1 basal del 20% (PC20FEV1), mientras que para el grupo control se aceptó una PC20FEV1 a la metacolina igual o superior 32 mg/ml4 en ausencia de manifestaciones clínicas.
Método
A las personas que aceptaban participar se les realizaron la historia clínica (donde se detallaban síntomas, tabaquismo, historia de asma y alergias, tratamiento) y una exploración física. A los grupos control y AE se les realizó una inducción del esputo según el método que se decribirá más adelante y se les extrajeron 10 ml de sangre venosa periférica. Además, al grupo control se le efectuó una prueba de broncoprovocación con metacolina en un día diferente. Al grupo AA se le trató con una solución de suero fisiológico (3 ml) y 5 mg de salbutamol (1 ml) nebulizada durante 20 min con oxígeno y, a los 10 min, se obtuvo el esputo inducido según una modificación del método estándar descrita previamente7, y también se les extrajeron 10 ml de sangre venosa periférica. A continuación se les administró el resto de la medicación indicada para el tratamiento de su asma aguda según la guía de tratamiento de la Sociedad Española de Neumología y Cirugía Torácica12.
Las muestras de esputo obtenidas se procesaron para obtener un sedimento celular del que se determinó el recuento celular total y diferencial de las células inflamatorias. Las muestras de sangre obtenidas se dejaron reposar unos 10 min y se centrifugaron para la obtención del suero. Este material y el sobrenadante del esputo se remitieron al Laboratorio de Bioquímica para la determinación de albúmina y macroglobulina α2.
Espirometría y prueba de provocación con metacolina. La espirometría se realizó con un espirómetro Datospir 500 (Sibelmed S.A., Barcelona, España) siguiendo las recomendaciones de la European Respiratory Society13. Las broncoprovocaciones con metacolina se realizaron según una adaptación del método continuo descrito por dicha sociedad14.
Inducción y procesado del esputo. La inducción del esputo con suero salino hipertónico para el recuento celular se realizó, en los grupos control y AE, según el procedimiento estándar en nuestro laboratorio15, que consiste en administrar un agonista adrenérgico β2 inhalado de corta duración (2 inhalaciones de 100 μg de salbutamol en cartucho presurizado con cámara espaciadora acoplada) y, tras 10 min de broncodilatación, los sujetos inhalan suero hipertónico (al 3 y al 4%) durante 7 min cada uno. Se controló el estado del paciente al inicio y después de cada una de las inhalaciones mediante espirometrías. Antes de 2 h, el esputo se procesó seleccionando los tapones de moco de la saliva tratados con ditiotreitol (Sputalysin, Calbiochem Corp., San Diego, CA, EE.UU.) y solución salina fosfatada (phosphate buffered saline). La suspensión celular se filtró y, mediante un hemocitómetro y la tinción de azul de tripano, se calcularon el número total de células por gramo de esputo, la viabilidad y el total de células escamosas procedentes de contaminación de las vías respiratorias superiores. Tras centrifugar el preparado celular, se obtuvieron el sedimento celular y el sobrenadante. El sedimento celular se utilizó para el recuento diferencial de células (macrófagos, eosinófilos, neutrófilos, basófilos, linfocitos y células epiteliales bronquiales) realizando la tinción May-Grünwald-Giemsa. Como valores de referencia del recuento celular se tomaron los descritos previamente por Belda et al16. A los pacientes con AA se les aplicaron las modificaciones antes descritas7.
Determinación de proteínas en esputo y suero. La albúmina en esputo (mg/l) se midió por inmunoturbidimetría (Albumina Tina-quant®, ref. 11875400, Roche/Hitachi, Roche Diagnostics GmbH, Mannheim, Alemania), y en suero (g/l) por colorimetría (ALB plus, ref. 1929640, Roche Diagnostics GmbH, Mannheim, Alemania). La macroglobulina α2 en esputo (mg/l) y en suero (g/l) se midió por nefelometría (Alpha-2-macroglobulin antiserum, ref. SAM/15, Dade Behring, Marburg, Alemania). Los resultados se ajustaron por la dilución aplicada (8 veces) y se expresaron como coeficientes relativos, calculados como concentración de proteína en esputo dividido por la concentración de proteína en suero.
Aunque la técnica de nefelometría inmunoquímica utilizada para la determinación de la macroglobulina α2 ya se practicaba en el Laboratorio de Bioquímica de nuestro centro, no había experiencia con muestras de esputo. Por este motivo, se realizó una valoración de la estabilidad de la medida a diferentes tiempos de procesado desde la obtención de la muestras --fresco (menos de 4 h) y 7, 15, 21, 28, 75 y 180 días-- y conservando la muestra a diferentes temperaturas (4, 20 y 80 °C). Se observó que, en general, el resultado de la segunda cuantificación era inferior al de la primera, tanto si la muestra se almacenaba a 4 °C como a 20 o 80 °C. Por ejemplo, en muestras mantenidas a 4 °C durante 15 días, la concentración disminuía entre el 21 y el 83% para concentraciones iniciales de entre 7,06 y 77,7 mg/l. Hay que destacar que en todos los casos el esputo se centrifugó de nuevo a 10.900 rpm durante 4 min antes del estudio analítico, lo que podría explicar una cierta pérdida de proteínas. Finalmente, la concentración de proteína en la muestra remitida para estudio después de su almacenamiento parece depender de su concentración inicial (el coeficiente de variación interserial analítico del método de medida de la macroglobulina α2 es de un 9,0% para una concentración de 12 mg/l). Por tanto, a pesar de la heterogeneidad de los resultados obtenidos, y dado el escaso volumen de muestra del que se dispone en algunos casos, se optó por trabajar siempre con muestras de esputo fresco, procesarlas tras la centrifugación lo antes posible desde su recepción en el laboratorio y mantenerlas a 4 °C hasta el momento de su procesamiento.
Por su parte, la medición de albúmina se realizó según el método habitual en nuestro laboratorio para concentraciones mínimas. De hecho, es el mismo que se utiliza habitualmente para la medición de la microalbuminuria en muestras de orina. Dicha técnica se ha descrito previamente en esputo y resulta estable.
Análisis estadístico
Se utilizó el paquete para ordenador personal compatible SPSS versión 10.0 (1999). La muestra se describió con los valores medios para cada variable y su desviación estándar. Las comparaciones de las medias entre los 3 grupos se evaluaron con el análisis no paramétrico para muestras independientes de Kruskal-Wallis, y para los contrastes entre parejas se utilizó la U de Mann-Whitney. Para las correlaciones entre variables se utilizó el coeficiente de correlación lineal de Spearman.
Resultados
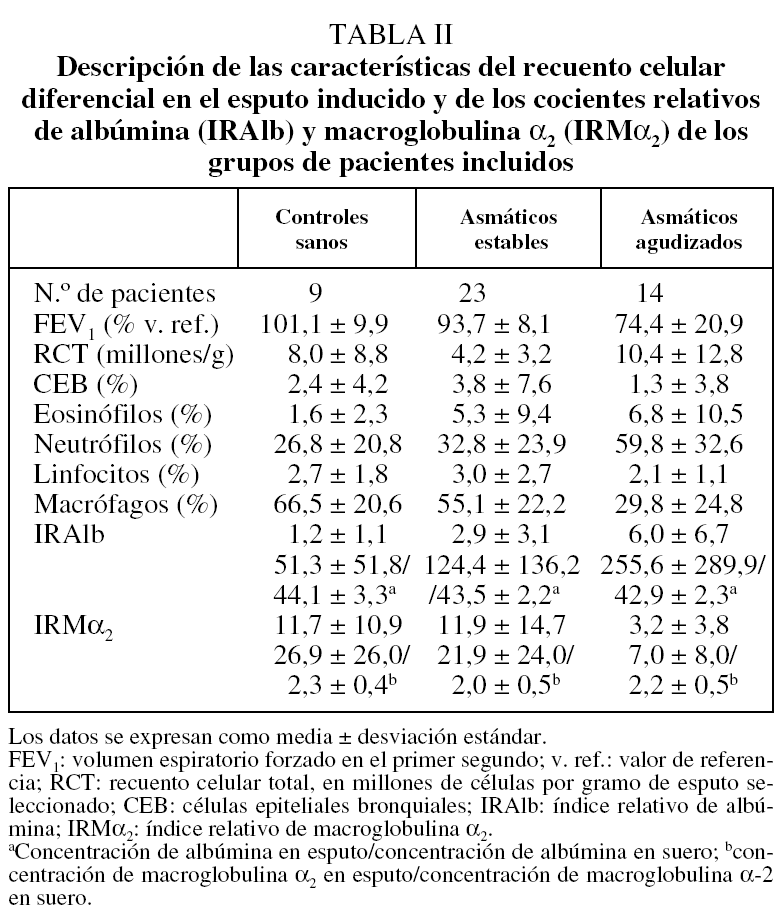
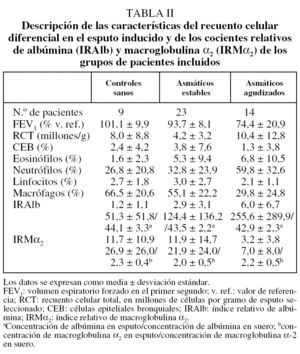
De los 49 individuos inicialmente incluidos en el estudio, se excluyó a 3 pacientes: 2 asmáticos, 1 estable y otro agudizado, porque la muestra conseguida presentaba tan escasa viabilidad que no era citológicamente válida (inferior al 40%), y un tercer AA porque no se pudo obtener una muestra procesable. En los 46 restantes (9 del grupo control, 23 del AE y 14 del AA) se determinaron los IRAlb e IRMα2. Las características antropométricas, funcionales, la citología del esputo y las determinaciones de albúmina y macroglobulina α2 en sangre y en esputo de los 3 grupos aparecen descritas en las tablas I y II.
Los valores medios ± desviación estándar del IRAlb fueron de 1,2 ± 1,1 en el grupo control, de 2,9 ± 3,1 en el AE y de 6,0 ± 6,7 en el AA, y los del IRMα2 fueron de 11,7 ± 10,9, 11,9 ± 14,7 y 3,2 ± 3,8, respectivamente. Se encontró una diferencia estadísticamente significativa en el IRAlb entre los grupos AA, AE y control (p = 0,034), en particular entre el grupo AA y los otros 2, aunque no entre estos últimos. Este IRAlb, que refleja el grado de alteración de la permeabilidad vascular, fue mínimo en los controles, progresivamente mayor en los AE y alcanzó su valor máximo en los AA. Por su parte, las diferencias entre los grupos control y AE en los valores de IRMα2 no alcanzaron significación estadística (p = 0,06) en el análisis no paramétrico (U de Mann-Whitney), pero sí entre los grupos control y AA. El sentido de este índice fue inesperado por cuanto los AA presentaron los valores mínimos de IRMα2.
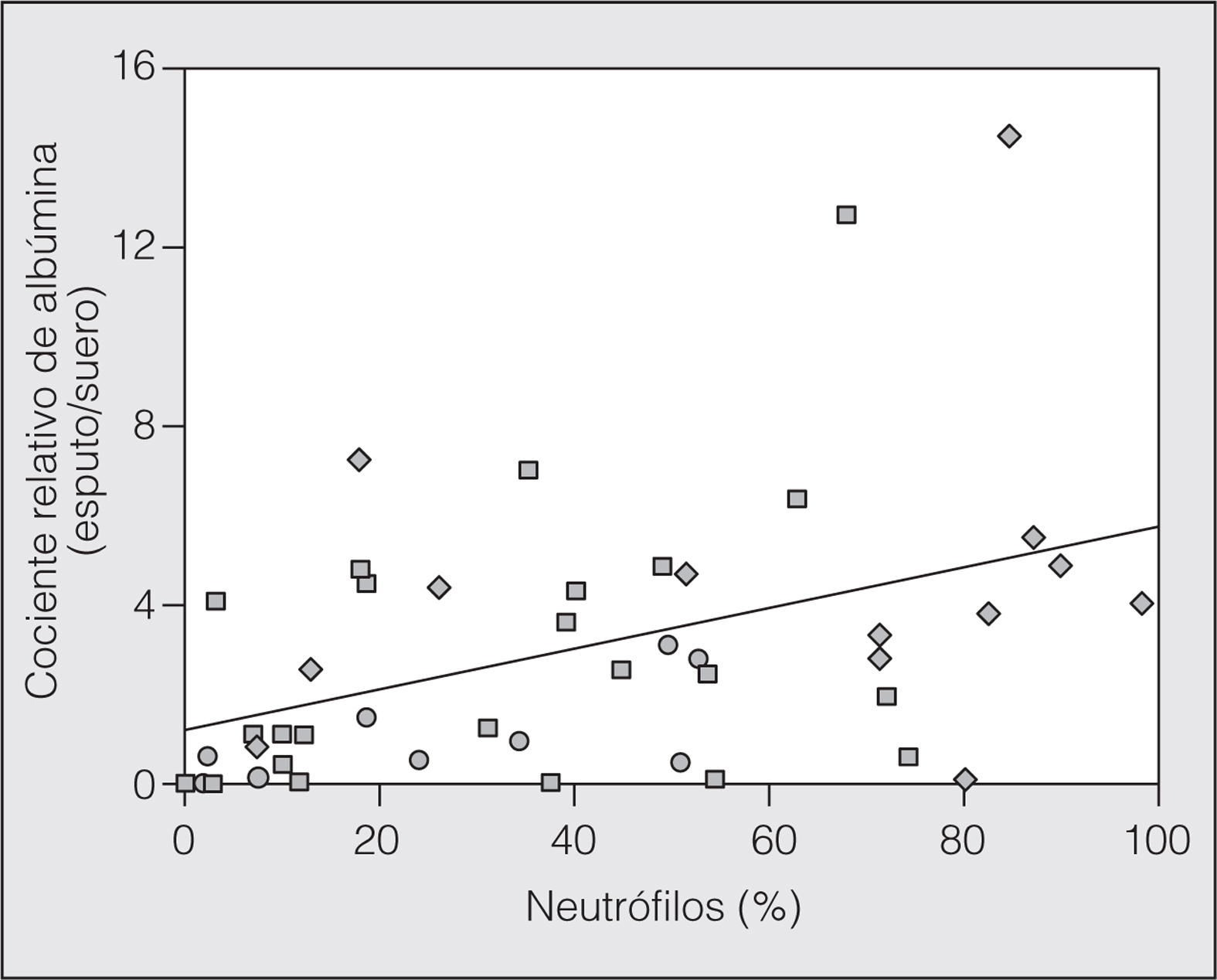
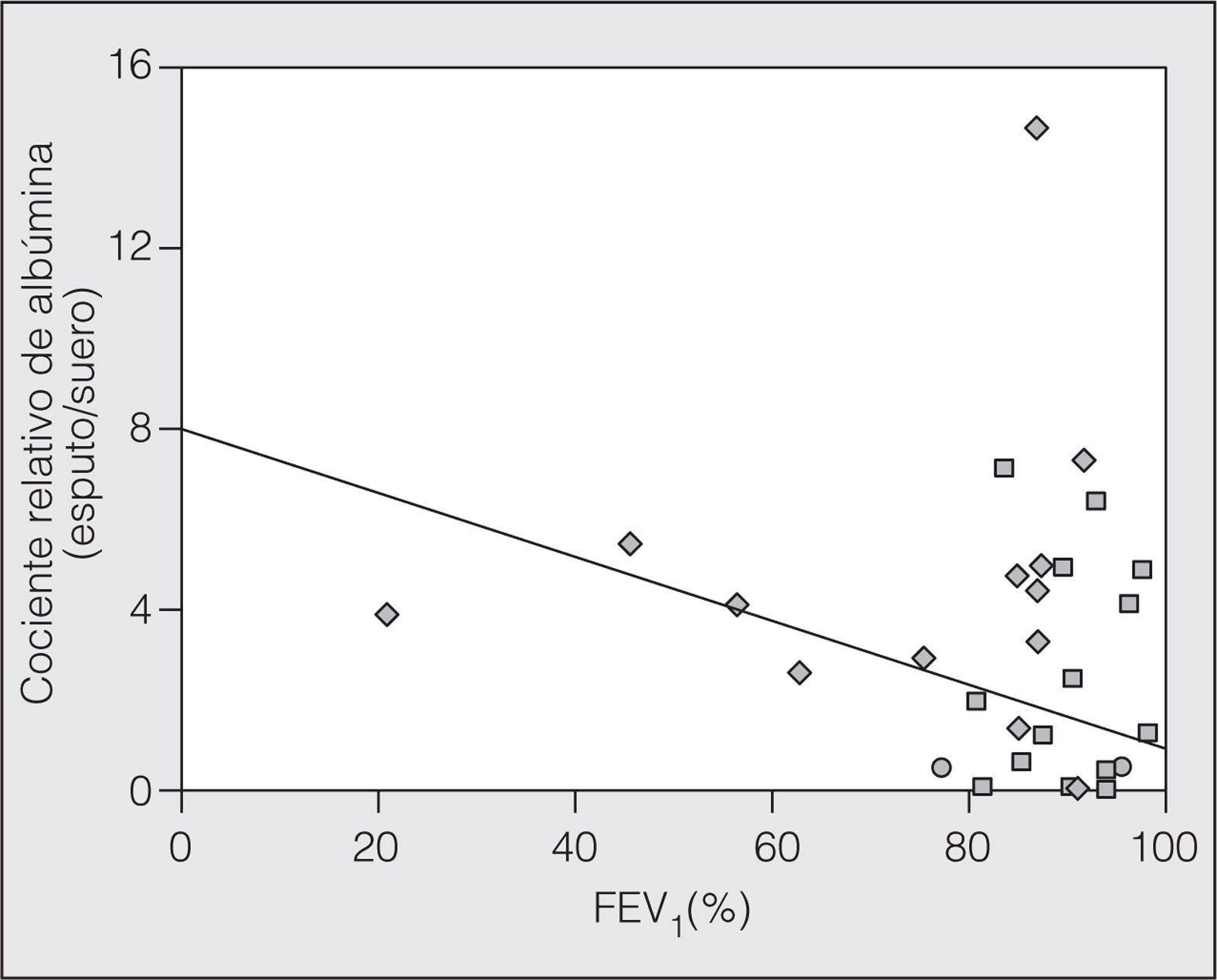
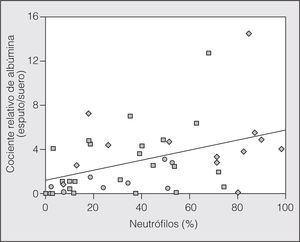
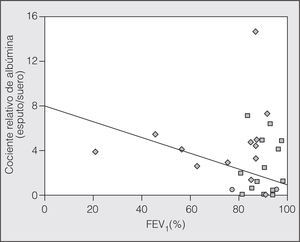
No se encontró una relación significativa entre el número de eosinófilos (porcentaje) y el IRAlb, y tampoco con el IRMα2. Por su parte, sí hubo una relación significativa entre el número de neutrófilos (porcentaje) y el IRAlb (r = 0,39; p = 0,008), que no se detectó con el IRMα2 (r = -0,035; p = 0,82) (fig. 1). La relación inversa encontrada entre el FEV1 --en valores absolutos (l) aunque también, pero de menor intensidad, con el porcentaje del valor de referencia-- y el IRAlb (r = -0,43; p = 0,009) no se detectó con el IRMα2 (r = -0,206; p = 0,24). Esta relación parece máxima en el grupo de AA (fig. 2). No hubo relación entre la saturación de oxígeno determinada por pulsioximetría y el IRAlb (r = -0,33; p = 0,19) o el IRMα2 (r = -0,12; p = 0,84).
Fig. 1. Relación entre el número de neutrófilos en el esputo (%) y la albúmina (cociente relativo de albúmina en μg/ml) en los 3 grupos. Los círculos representan a los sujetos sanos, los cuadrados a los asmáticos en fase estable y los rombos a los asmáticos en fase aguda. La línea representa la recta de regresión.
Fig. 2. Relación entre el volumen espiratorio forzado en el primer segundo (FEV1, en porcentaje del valor de referencia) y la albúmina (cociente relativo de albúmina en μg/ml) en el grupo de asmáticos agudizados.
Discusión
Los resultados confirman que es posible medir el exudado de proteínas plasmáticas, marcador de la permeabilidad vascular, en la fase aguda de exacerbaciones espontáneas de pacientes con asma. Este exudado proteico supone, en la fase aguda, un incremento considerable respecto a la fase estable, cuando el paciente permanece asintomático. A su vez, y como era de esperar, el paciente estable parece presentar un mayor grado de exudado proteico bronquial que los controles sanos, aunque no alcanzó significación estadística en este estudio. Es interesante destacar que la alteración de la permeabilidad detectada no parece relacionarse con la saturación de oxihemoglobina (por pulsioximetría), pero sí con el grado de obstrucción. Esto implicaría que la extravasación de proteínas plasmáticas a la vía respiratoria no repercute sobre el intercambio gaseoso, aunque sí incrementaría la resistencia respiratoria.
Los datos obtenidos en el presente estudio en fase aguda son similares a los descritos por otros autores7-10. El grupo de Hamilton (Canadá)7,8 ha descrito en AA y en controles unos niveles de extravasación de proteínas similares a los de este estudio, aunque bastante diferentes de los descritos por otros grupos utilizando esputo. La discrepancia podría explicarse por el tipo de pacientes seleccionados, por la técnica empleada para el procesamiento del esputo, o por la técnica utilizada para determinar la albúmina, que ya se ha señalado que puede inducir a determinaciones erróneas.
En este estudio, la albúmina ha resultado ser el mejor marcador de alteración de la permeabilidad. Utilizada en un principio como indicador de la dilución del método de recogida de la muestra (principalmente, en el lavado broncoalveolar), pronto se comprobó que su utilidad como tal era muy inferior a la de otros marcadores como la urea. Además, se pudo comprobar que sus valores variaban ampliamente con la edad, el hábito tabáquico y el grado de inflamación subyacente, lo que limitaba aún más su utilidad17. Sin embargo, fue la relación con la inflamación la que ha permitido comprobar su utilidad como marcador de la permeabilidad vascular inducida por la propia inflamación18 y, por lo tanto, su capacidad de responder al tratamiento antiinflamatorio19. Paralelamente, avances recientes en técnicas bioquímicas e inmunológicas como el radioinmunoanálisis o la nefelometría, permiten medir con gran precisión y extraordinaria especificidad sustancias que se encuentran en cantidades ínfimas en diferentes fluidos corporales. La albúmina es fácil de medir con estas técnicas y supone el paradigma de proteína de bajo peso molecular (49 kilodaltons) cuyo transporte intracelular se supone pasivo. Por otra parte, otras proteínas como la macroglobulina α2 serían un ejemplo de proteína plasmática de gran peso molecular (714 kilodaltons) cuyo transporte intracelular se supone activo, precisando para su extravasación de soluciones de continuidad en los vasos sanguíneos. De esta forma, se ha descrito el denominado cociente relativo de excrección (concentración en líquido extravascular/concentración en suero de una proteína pequeña como la albúmina dividido por la concentración en líquido extravascular/concentración en suero de una proteína grande como la macroglobulina α2) como un marcador de permeabilidad vascular aceptablemente validado en muestras nasales y bronquiales20. Sin embargo, en el presente estudio este cociente no resultó de utilidad aplicado a la macroglobulina α2, dado que sus concentraciones resultaron menores en AA que en AE. Aunque la razón final resulta desconocida, es interesante el hecho de que en los pacientes agudos el esputo se inducía tras una nebulización con salbutamol --1 ml de salbutamol (5 mg) con 3 ml de suero salino isotónico--, lo que resulta una dosis bastante elevada de este broncodilatador. Esto parece importante porque se ha descrito que el salbutamol tendría la capacidad de reintroducir la macroglobulina α2 en las células epiteliales, reduciendo el edema, y por lo tanto quedarían plenamente explicadas las bajas concentraciones obtenidas21.
El aumento de la permeabilidad vascular en la fase aguda de la inflamación parece ser un proceso iniciado en las fases tempranas de la misma para facilitar la llegada de nuevas células inflamatorias al área inflamada. En la fase crónica, el mecanismo no se conoce con exactitud, pero igualmente se supone que las células inflamatorias localizadas en el tejido, ante ciertos estímulos, liberarían sustancias preformadas, como la histamina y los leucotrienos, que tendrían efectos inmediatos sobre las células endoteliales, que variarían su fenotipo de expresión de proteínas de superficie, lo que alteraría la permeabilidad vascular y permitiría la extravasación de proteínas. Esto facilitaría la migración de células desde el interior vascular a los tejidos3. En el presente trabajo se ha encontrado una relación significativa entre el recuento absoluto de neutrófilos y la concentración de albúmina y de macroglobulina α2, no puesta de manifiesto con otras células como los eosinófilos. Se desconoce el mecanismo íntimo de esta relación, pero se plantean 2 posibilidades. Por una parte, el estímulo que induce la extravasación celular induciría de forma paralela la migración de neutrófilos (esto sería cierto, por ejemplo, para los sulfatidil-leucotrienos). Otra posibilidad sería que el exudado proteico fuera inducido por un mediador liberado por los propios neutrófilos, de forma que al haber más neutrófilos se liberaría mayor cantidad de dicha sustancia y se produciría un exudado mayor. Esta hipótesis se sustenta en este estudio por el hecho de que no sólo los neutrófilos se relacionaron con la extravasación de albúmina, sino que también hubo una relación entre neutrófilos y obstrucción, y entre obstrucción y extravasación de albúmina, lo que cierra un triángulo que hace altamente probable que los mediadores comunes capaces de ser producidos por los neutrófilos y de inducir extravasación y broncoconstricción sean los leucotrienos22. Esto podría comprobarse en estudios posteriores demostrando la inhibición del proceso inducida por antagonistas específicos de los leucotrienos.
El papel de la alteración de la permeabilidad sobre la gravedad de las crisis de asma es casi desconocido. Su participación se ha deducido de los modelos de provocación alergénica, donde aparece en la fase inmediata. Sin embargo, poco sabemos sobre su contribución real en la gravedad de la crisis. Algunos autores como Gómez et al23 han descrito en AA una alteración del cociente ventilación/perfusión que, asociada a la broncoconstricción, deterioraría el intercambio gaseoso, y plantean que estas alteraciones vasculares estarían mediadas por derivados del ácido araquidónico. Por otra parte, este grupo también comprobó que estas alteraciones vasculares son dependientes del proceso inflamatorio, ya que parecen corregirse con el tratamiento antiinflamatorio habitual24.
Aunque no era un objetivo específico del estudio, se evaluó la estabilidad de la determinación de macroglobulina α2 y se observó que resulta altamente inestable. Por este motivo, su medición debe realizarse en fresco y lo antes posible (puede retrasarse hasta un máximo de 24 h en nevera convencional, a 4 °C). Aunque la albúmina resulta mucho más estable, al medirse conjuntamente deben seguirse similares condiciones de procesamiento.
Este estudio presenta determinadas limitaciones que conviene considerar. Por una parte, la concentración de macroglobulina α2 en un número significativo de casos ha resultado inferior a los valores de detección de la técnica utilizada (2,6 mg/ml). De forma similar, algunas mediciones de albúmina (muy pocas) han estado por debajo de las concentraciones de detección de la técnica (2 μg/ml). En el informe, estos valores aparecen como menores al umbral de detección, aunque no se conocen con precisión. Hemos asignado un valor de 2 mg/ml para todos aquellos casos informados como concentraciones de macroglobulina α2 menores de 2,6 mg/ml, y de 2 μg/ml para las concentraciones de albúmina inferiores a 2,2 μg/ml, lo que puede introducir un pequeño error cuyas repercusiones se consideraron mínimas. En futuros estudios, este problema puede solucionarse fácilmente introduciendo una dilución inferior en el procesamiento del esputo (p. ej., 4 veces). Por otra parte, aunque los AE presentaron mayor grado de exudado proteico bronquial que los controles, este dato no alcanzó significación estadística, ya que el tamaño de la muestra se calculó para encontrar diferencias entre AE y AA, no entre controles y AE. Finalmente, existe la posibilidad de que la inducción del esputo con suero salino hipertónico afecte los resultados obtenidos en la determinación de proteínas en muestras de esputo inducido6,25. Este efecto produciría un error sistemático en nuestro estudio que afectaría por igual a todos los grupos, por lo que creemos no invalidaría los resultados obtenidos.
De los resultados de este estudio podemos concluir que en el asma aguda es posible medir, de forma no invasiva por medio del esputo inducido, la alteración de la permeabilidad vascular pulmonar a través de la extravasación de proteínas plasmáticas como la albúmina, aunque no se confirma la validez de la macroglobulina α2 para este cometido. Igualmente hemos comprobado que en la fase aguda del asma hay una extravasación proteica significativamente mayor que en la fase estable. Además, el estudio apunta a que dicha extravasación podría ser clínicamente relevante al relacionarse con la obstrucción, lo que indicaría algunos mecanismos que precisan confirmación en estudios posteriores.