Introducción
En el pulmón normal, el equilibrio entre antioxidantes y oxidantes es suficiente para mantener en estado altamente reducido los fluidos que tapizan las vías aéreas y llenan los espacios extracelulares. El incremento de la concentración de sustancias oxidantes o la disminución o el consumo excesivo de antioxidantes origina la pérdida de este equilibrio. Cuando esto ocurre se habla de estrés oxidativo. En respuesta a la agresión bacteriana, y especialmente a la producción de lipopolisacáridos, los macrófagos y el endotelio se activan expresando en la superficie moléculas de adhesión, que permiten la transmigración de neutrófilos desde el espacio vascular al interior del alvéolo o la vía aérea en general1. Los neutrófilos activados producen una gran cantidad de oxidantes, los cuales suelen clasificarse según su origen en: sustancias reactivas derivadas del oxígeno (ROS) y sustancias reactivas derivadas del óxido nítrico (RNS)2. La producción de óxido nítrico (NO) por la sintetasa del NO genera ión nítrico (NO·) y sus derivados nitrito (NO2) y nitrato (NO3). El NO, al reaccionar con el oxígeno, genera el poderoso oxidante peroxinitrito (OONO·). El estrés oxidativo conduce a la peroxidación lipídica de la membrana celular y a la formación de una nueva serie de prostanoides, derivados por oxidación del ácido araquidónico y de las prostaglandinas, llamados isoprostanos3.
Las peroxidasas del granulocito, tales como la mieloperoxidasa (MPO) del neutrófilo, desempeñan un importante papel en el desencadenamiento del estrés oxidativo. En los neutrófilos, el peróxido de hidrógeno generado a partir de O2- (y relativamente menos reactivo) es metabolizado por la MPO, en presencia de iones cloro, a ácido hipocloroso, el cual es un poderoso oxidante. Éste es un importante mecanismo antibacteriano, pero a su vez produce efectos citotóxicos4,5.
La condensación del vapor exhalado (CER), que es una técnica de muestreo de los fluidos que tapizan el espacio aéreo mediante la congelación del vapor exhalado por el sujeto, permite el análisis de las sustancias disueltas en él por el proceso de arrastre que se produce en la interfase aérea6. La dilución en el vapor de agua exhalado de las micropartículas arrastradas no permite la determinación cuantitativa de la composición bioquímica de la interfase, aunque sí su caracterización cualitativa, especialmente mediante las relaciones internas entre los parámetros bioquímicos, las cuales son relativamente inmunes a los procesos de dilución, aunque difíciles de interpretar7. La determinación de parámetros de estrés oxidativo en el exhalado se ha aplicado, con mayor o menor fortuna, al diagnóstico de la inflamación en procesos respiratorios crónicos enfermedad pulmonar obstructiva crónica (EPOC)8,9, asma10,11, fibrosis intersticial12 y fibrosis quística13, entre otros-, aunque escasamente en situaciones de agresión broncopulmonar aguda grave, como es el caso de la neumonía multifocal o la sobreinfección aguda de la EPOC14.
El presente trabajo se ha basado en la hipótesis de que un proceso inflamatorio de la magnitud de la infección pulmonar debería de manifestarse con alteraciones del estado redox de la interfase y caracterizarse por un incremento de sustancias oxidantes en el CER. Su objetivo ha sido determinar si el análisis del CER permite constatar la hipótesis anterior en pacientes con neumonía grave y sobreinfección de la EPOC. Un grupo de sujetos sin enfermedad respiratoria ha actuado como control.
Pacientes y métodos
Sujetos
Se ha estudiado a un total de 48 pacientes, divididos en 4 grupos:
1. Grupo control, compuesto por 14 pacientes ingresados para cirugía programada, sin antecedentes de enfermedad respiratoria, con radiografía de tórax normal y no fumadores o ex fumadores de más de 2 años.
2. Grupo de pacientes afectados de neumonía multilobular, constituido por 13 sujetos ingresados por neumonía de diversas etiologías (7 neumonías neumocócicas, una neumonía por Legionella y 5 casos sin identificación precisa del germen). Todos ellos presentaban hipoxemia al ingresar y 2 tenían antecedentes de EPOC.
3. Grupo de pacientes con diagnóstico de sobreinfección de EPOC, compuesto por 14 pacientes. En 3 casos los pacientes presentaban simultáneamente bronquiectasias y el germen infectante resultó ser Pseudomonas aeruginosa; en el resto no se obtuvo diagnóstico microbiológico concluyente. Los criterios utilizados para establecer el diagnóstico de sobreinfección bronquial fueron los propuestos por Anthonisen et al15.
4. Un grupo de 7 pacientes con neumonía grave en ventilación mecánica fue estudiado en la unidad de cuidados intensivos. Excepto en un caso con infección por el virus de la inmunodeficiencia humana y neumonía por Pneumocystis carinii, en el resto el germen infectante fue el neumococo.
Según los criterios autorizados por el Comité de Ética del Hospital de Bellvitge, se informó del protocolo del estudio y de sus objetivos a todos los pacientes (o familiares en su caso), que dieron su libre consentimiento para participar en él. Excepto el grupo control, todos los pacientes recibían aporte suplementario de oxígeno, con una fracción inspiratoria de oxígeno (FiO2) que oscilaba entre 0,8 en los casos más graves (sepsis por neumococo, neumonía por P. carinii, etc.) y 0,24 o 3 l/min con gafas nasales en los casos más leves. La oxigenoterapia se mantuvo en todos los pacientes durante la colección de exhalado (en el caso de gafas nasales se pasó a la administración de un 24% de oxígeno con sistema Venturi).
Obtención y procesamiento de la muestra de condensado exhalado
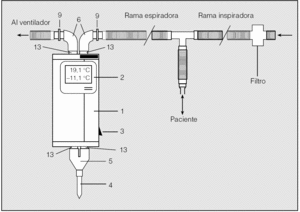
El CER se obtuvo dentro de las primeras 72 h del ingreso en los pacientes de los grupos EPOC y neumonía; inmediatamente tras el ingreso en el grupo control, y dentro de las primeras 72 h de su diagnóstico en la unidad de cuidados intensivos en los pacientes con neumonía y ventilación mecánica. Se obtuvo a la cabecera del paciente mediante congelación del vapor exhalado, para lo que se utilizó el condensador ANACON (Biostec, Valencia, España), generador de frío a través de una bomba termoeléctrica. Los pacientes que respiraban espontáneamente se conectaron al condensador mediante un circuito unidireccional que intercalaba un tubo corrugado de 45 cm. En los pacientes con ventilación mecánica el condensador se intercaló en el circuito espiratorio a 60 cm de distancia del tubo en T y el filtro humidificador se retiró (en la figura 1 se muestra el esquema del montaje del condensador en el circuito de ventilación). La muestra se obtuvo a temperaturas inferiores a -10 °C, con un período de obtención mínimo de 15 min. Los pacientes se enjuagaron la boca antes de cada medición y se les permitió interrumpirla para tragar saliva o cuando lo pedían. Se mantuvieron la administración de oxígeno y los parámetros de ventilación mecánica en su caso. La muestra se descongeló y dividió en alícuotas de 0,2 ml para su estudio bioquímico posterior. Las alícuotas se conservaron a -80 °C hasta el momento de su análisis.
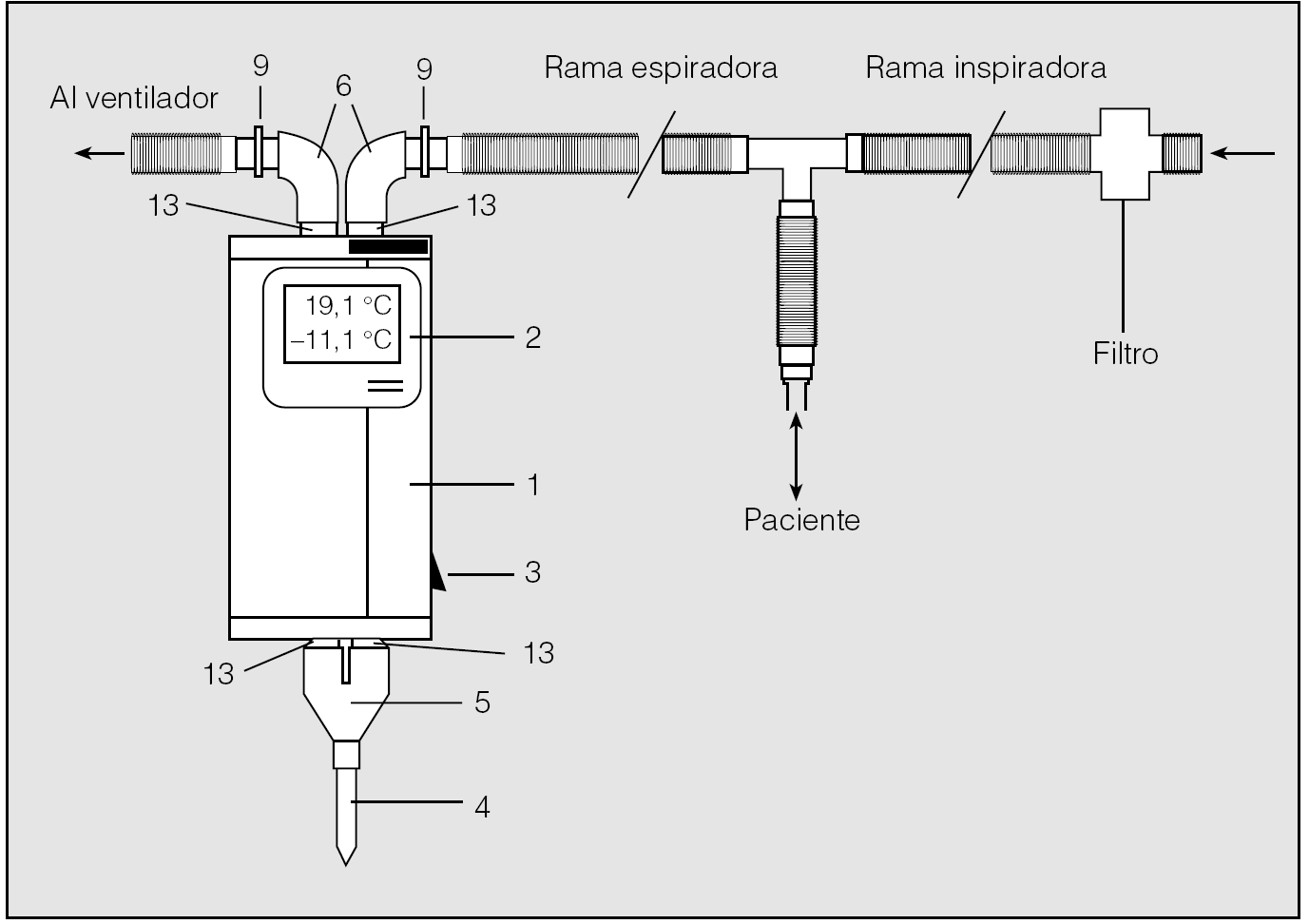
Fig. 1. Condensador ANACON instalado en el circuito de ventilación mecánica. El condensador se intercala en la rama espiratoria del circuito de ventilación mediante 2 adaptadores (9) y 2 codos elastoméricos (6). El aire exhalado es conducido hacia los tubos de condensación (13) que atraviesan el cuerpo del condensador (1). Una pieza en Y (5) cierra el circuito con el tubo colector de condensado exhalado (4). Un termómetro (2) permite monitorizar la temperatura de condensación. 3: interruptor de condensación.
Análisis de los parámetros bioquímicos
La cantidad total de NO2 y NO3 se determinó mediante la reacción de Gries (II) utilizando el equipo colorimétrico de Cayman (Michigan, EE.UU.). El NO2 se determinó añadiendo reactivo de Gries (1% sulfanilamida; 0,1% naftilendiamina; 2,5% H3PO4) directamente a 80 µl de muestra no preprocesada. Tras 10 min de incubación a temperatura ambiente y en ausencia de luz se leyó la absorbancia a 550 nm. La sensibilidad absoluta de la técnica en estas condiciones fue de 0,1 µM. Se construyeron 2 curvas estándar de 6 puntos entre 0,1 y 10 µM que se ajustaron potencialmente para obtener la concentración de NO2 por interpolación. A los valores por debajo de 0,1 µM (no detectables) se les asignó 0 (o 0,05 µM para cálculos logarítmicos).
El NO3 se midió como NO2 tras conversión enzimática mediante la adición de NO3 reductasa, en presencia del cofactor NADPH (fosfato de nicotinamida adenina dinucleótido reducido), a 80 µl de muestra no precondicionada. Tras 1 h de incubación a temperatura ambiente se añadió el reactivo de Gries y se procedió como en el caso de la determinación de NO2. Al resultado total de la lectura de la concentración de NO2 más NO3 se sustrajo la concentración de NO2 obtenida anteriormente.
La concentración de 8-isoprostano se midió mediante técnica de enzimoinmunoanálisis con el equipo específico de Cayman (Michigan, EE.UU.) para 8-isoprostaglandina F2α. No se realizó precondicionamiento o purificación de las muestras antes de la determinación. Se utilizaron 50 µl por determinación y se añadieron 50 µl de trazador de 8-isoprostano colin-esterasa y 50 µl de antisuero anti-8-isoprostano. Tras incubación durante 18 h a temperatura ambiente y a cubierto de la luz se añadieron 200 µl de reactivo de Ellman a los pocillos lavados con buffer, y después de 90 min de reacción se leyó la absorbancia a 420 nm. Se construyeron 2 curvas estándar entre 2 y 32 pg/ml. La sensibilidad de la técnica en estas condiciones fue suficiente para discriminar 2 pg/ml. Entre 2 y 1 pg/ml la concentración se obtuvo por extrapolación retrógrada. En 2 pacientes del grupo de neumonía no se efectuó la determinación de 8-isoprostano.
La concentración de MPO en el CER se determinó mediante técnica de enzimoinmunoanálisis con el equipo de IBL (Hamburgo, Alemania). La sensibilidad de la técnica es de 1 U/ml. Se construyeron 2 curvas de control de 6 puntos entre 1 y 100 U/ml. Entre 1 y 0,1 U/ml la concentración se obtuvo por extrapolación retrógrada. A los valores inferiores a 0,1 U/m se les asignó el valor de 0 (o de 0,1 U/ml para los análisis logarítmicos). En 5 pacientes (3 del grupo de neumonía y 2 de neumonía ventilada) no se efectuó la determinación de MPO.
En todos los casos se realizó un análisis duplicado de las muestras y se computó el valor promedio.
Análisis estadístico
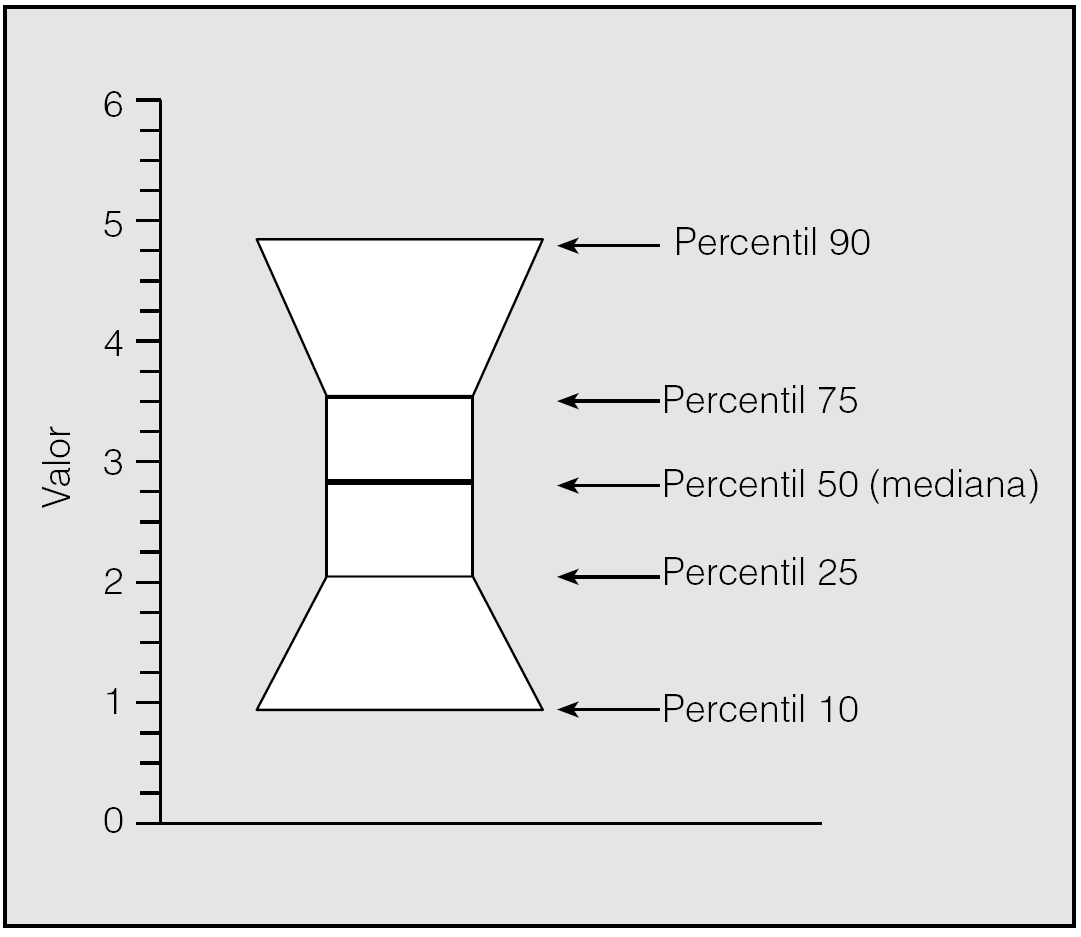
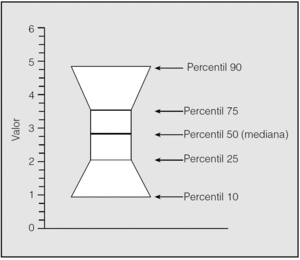
Debido a la falta de normalidad en la distribución de la mayoría de las variables se utilizaron preferentemente pruebas no paramétricas, tales como el test de comparación de grupos independientes de Kruskal-Wallis, en lugar del análisis paramétrico de ANOVA. La descripción de los grupos en las figuras se ha efectuado mediante la representación de la mediana y los percentiles del 10, el 25, el 75 y el 90%, en un gráfico cuya interpretación es como se muestra en la figura 2. En ausencia de normalidad de las muestras no se realizó análisis de covariancia, por lo que la influencia de la concentración de oxígeno se evaluó a través de la correlación de rangos de Spearman en los pacientes. La correlación de Pearson se utilizó en algunas ocasiones, a pesar de su carácter paramétrico, aunque la asociación se confirmó en todos los casos por correlación de Spearman.
Fig. 2. Interpretación del gráfico de cajas.
Resultados
En la tabla I se muestran algunas características relevantes de la población estudiada: distribución por sexos, edad, gasometría arterial el día del estudio y temperatura corporal del paciente en el momento de la recogida del CER. La relación presión arterial de oxígeno/FiO2 permite comprobar que el trastorno de la oxigenación era importante en los 3 grupos de pacientes.
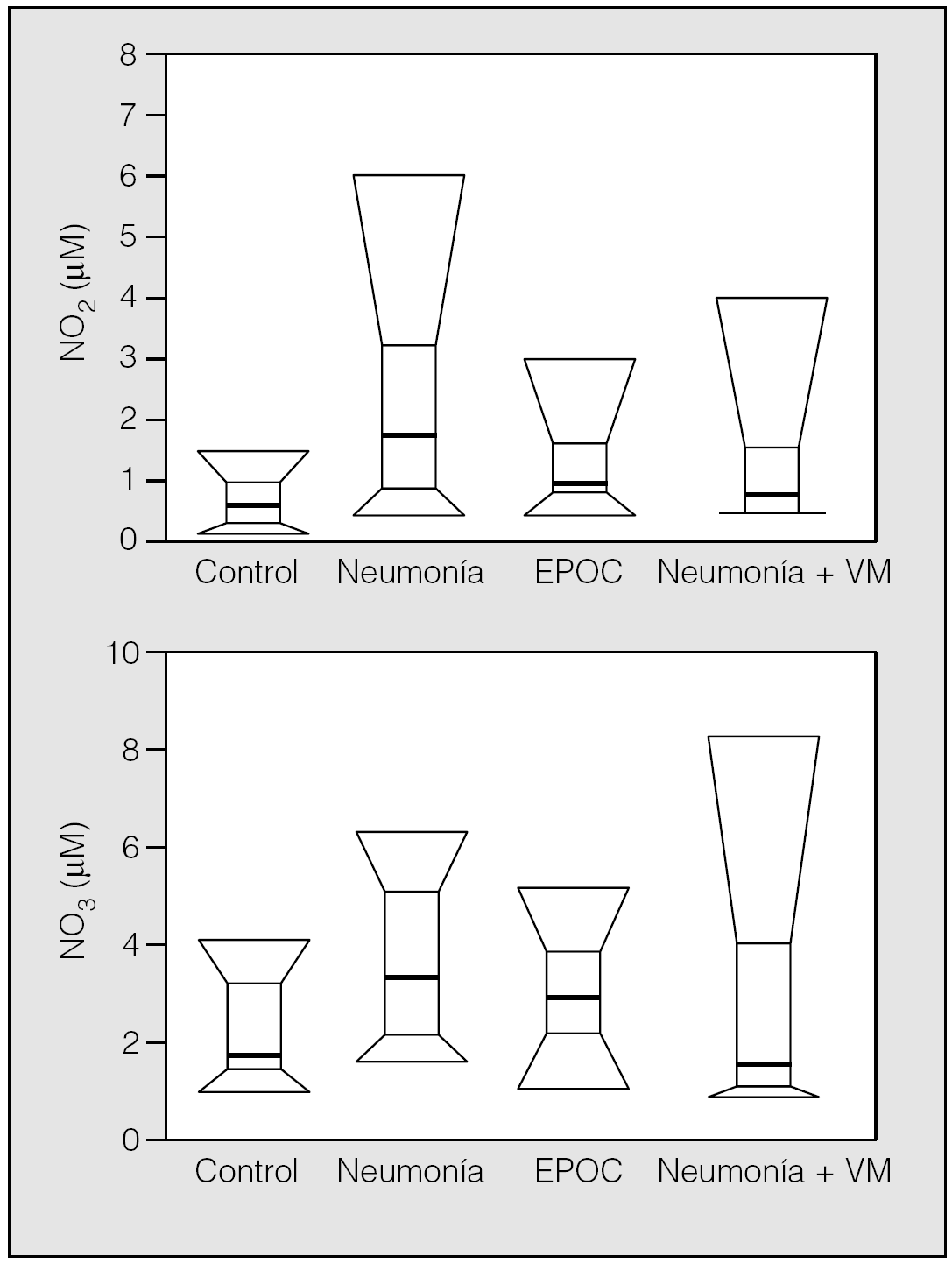
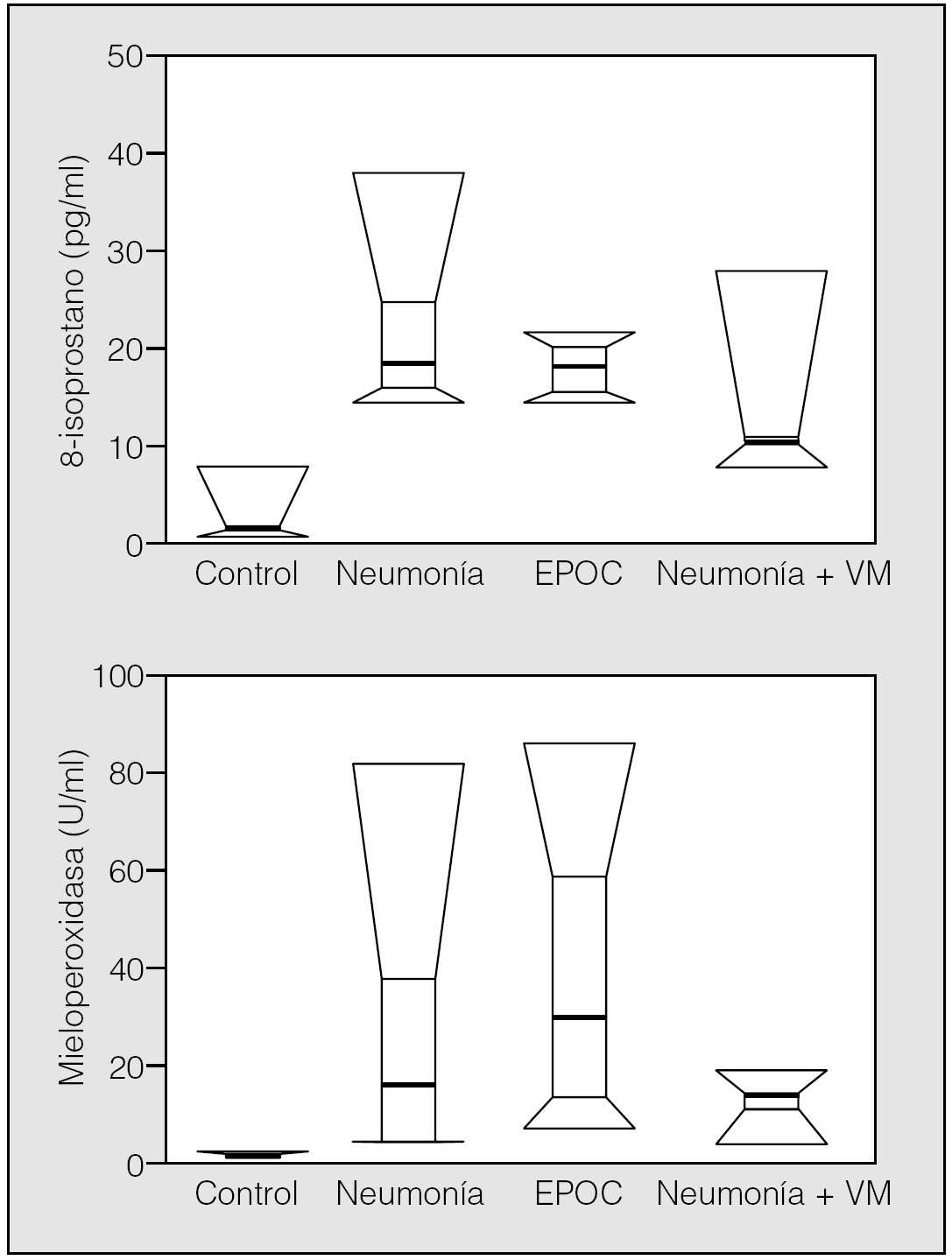
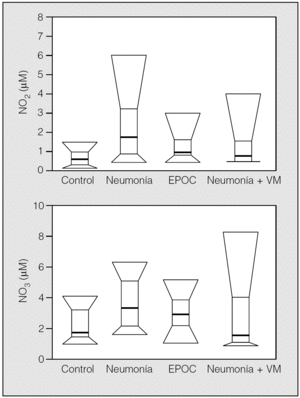
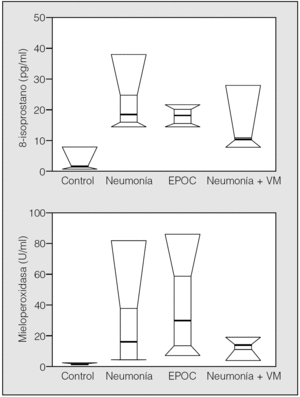
En la figura 3 se muestra la distribución de NO2 y NO3 en los 4 grupos de sujetos. La comparación estadística de la diferencia entre grupos fue significativa para el NO2 (χ² = 12,2; p = 0,007), pero no para el NO3 (χ² = 6,63; p = 0,084). La diferencia entre grupos para el NO2 fue debida a los valores más bajos observados en sujetos normales, ya que cuando se investigó la diferencia entre los 3 grupos de pacientes no se apreció diferencia significativa (χ² = 3,27; p = 0,19). En la figura 4 se muestra la distribución de la concentración de MPO y 8-isoprostano en el CER, en los 4 grupos estudiados. La comparación entre grupos mostró diferencias significativas tanto para la concentración de 8-isoprostano (χ² = 30,5; p < 0,0001) como para la concentración de MPO (χ² = 30,0; p < 0,0001), debido al importante aumento de las concentraciones observadas en el CER de los pacientes, respecto de los valores bajos (a menudo indetectables) obtenidos en los sujetos del grupo control. La comparación de los grupos de pacientes entre sí no ofreció, sin embargo, significación estadística (χ⊃ = 5,05; p = 0,079, y χsup2; = 4,94; p = 0,084 para 8-isoprostano y MPO, respectivamente). No se apreció relación significativa entre la FiO2 y ninguno de los parámetros bioquímicos estudiados en el exhalado.
Fig. 3. Distribución de las concentraciones de nitrito (NO2) y nitrato (NO3) en los grupos de sujetos estudiados. EPOC: enfermedad pulmonar obstructiva crónica; VM: ventilación mecánica.
Fig. 4. Distribución de las concentraciones de 8-isoprostano y mieloperoxidasa en el condensado exhalado de los 4 grupos de sujetos estudiados. EPOC: enfermedad pulmonar obstructiva crónica; VM: ventilación mecánica.
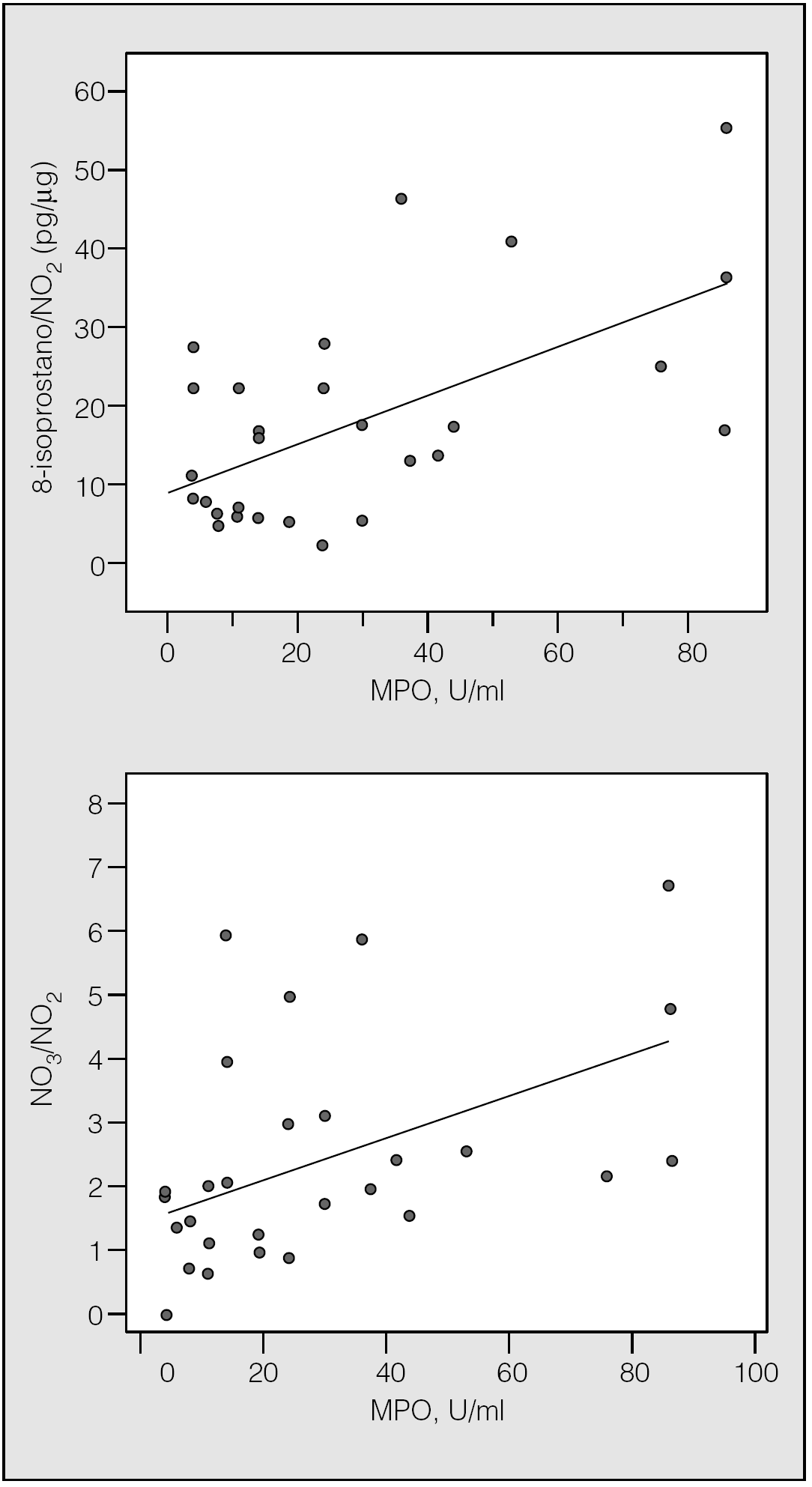
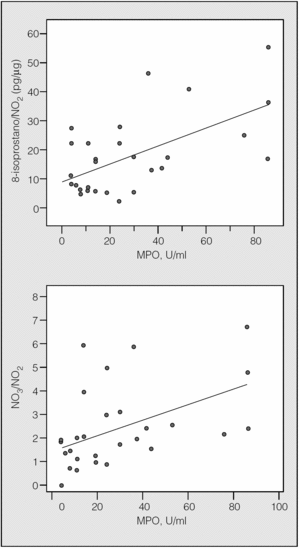
La MPO mostró una relación lineal con la concentración de 8-isoprostano relativa a la de NO2 (R de Spearman = 0,417; p = 0,027, y R de Pearson = 0,583; p = 0,001) o de la relación NO3/NO2 (R de Spearman = 0,589; p = 0,001, y R de Pearson = 0,4792; p = 0,009) en los pacientes con infección pulmonar (fig. 5).
Fig. 5. Correlaciones lineales entre la mieloperoxidasa (MPO) y las concentraciones de 8-isoprostano y nitrato (NO3), normalizadas para la concentración de nitrito (NO2) en pacientes con infección pulmonar grave.
Discusión
El diagnóstico no invasivo de la inflamación de la vía aérea es un objetivo complej o, que se ha abordado utilizando diversas técnicas, con un grado de eficacia y seguridad diagnóstica muy variable16. El muestreo del CER no es ajeno a cierta polémica debido a la gran variabilidad de los resultados y a la escasez de estudios sistemáticos sobre los factores metodológicos que inciden en ella17. No obstante, la facilidad de su utilización, la ausencia de iatrogenia asociada y la buena tolerancia de la técnica estimulan el análisis de las condiciones clínicas de su aplicación.
En este contexto se ha abordado el presente estudio, sin otro objetivo que el de comprobar si, en caso de infección pulmonar grave, el CER es capaz de reflejar el estrés oxidativo inherente a la inflamación pulmonar. La selección de los pacientes se realizó atendiendo al criterio básico de infección pulmonar diagnosticada clínica y radiológicamente, e insuficiencia respiratoria asociada como signo de gravedad. No se atendió a otros criterios de selección, debido al carácter inespecífico del fenómeno estudiado (estrés oxidativo).
La variabilidad inherente a la determinación de parámetros bioquímicos en el CER obedece a factores ligados al método (contaminación buconasal, patrón ventilatorio, etc.), a las condiciones clínicas de recogida (oxigenoterapia, ventilación mecánica, entre otras) o a aspectos inherentes a la composición del CER (dilución, baja concentración de la sustancia a analizar, etc.)18. Aunque no se ha podido sistematizar algunos aspectos metodológicos, limitados por las condiciones clínicas de los pacientes, sí se puede comentar la eventual influencia de algunos de ellos.
La contaminación buconasal es una fuente importante de RNS y, finalmente, de ROS, incluso con pinzas nasales19,20. Aunque las diferencias entre los grupos de pacientes no son significativas, la distribución de NO3 en los ventilados parece aproximarse más a la del grupo control que a la del grupo de pacientes con neumonía no ventilados, lo cual podría quizá explicarse por la contaminación procedente de vías superiores altamente productoras de RNS. Aparte de esta consideración, el patrón observado en pacientes con intubación traqueal era similar al de los pacientes con respiración bucal, lo cual permite aceptar a priori que las variaciones apreciadas tuvieron su origen en las vías aéreas inferiores.
El patrón ventilatorio influye en la cantidad de CER recogido21, pero también puede afectar a su calidad, pues se ha comprobado una relación entre el flujo espiratorio y la concentración de peróxido de hidrógeno en el CER22 y entre la concentración de NO2 y el volumen corriente23. Al no haberse medido el volumen corriente o el flujo espirado en los sujetos respirando espontáneamente, no se pudo ajustar por esta magnitud. Los pacientes con ventilación mecánica, en quienes sí se dispone de estas mediciones, son pocos para obtener una evaluación del efecto, con lo que no se puede descartar que, al menos en parte, la variabilidad observada pudiese estar en relación con diferencias en el flujo espiratorio y con el arrastre de partículas desde la interfase.
La FiO2 es otro importante parámetro de confusión, ya que se ha comprobado que incrementa la concentración de parámetros de estrés oxidativo en el CER de sujetos normales y de pacientes con EPOC expuestos24. La falta de relación entre la FiO2 y la concentración de ROS y RNS en el exhalado no es garantía de que no exista efecto de confusión. La FiO2 en el momento del muestreo no es el parámetro adecuado para medir el efecto de la administración de oxígeno sobre el estado redox de la vía aérea, ya que su efecto es probablemente acumulativo24. A pesar de ello, aunque la FiO2 induzca la expresión de ROS en el exhalado, su participación es, en la práctica, inseparable de la propia enfermedad estudiada en el ámbito clínico y queda incluida en el objetivo central del estudio.
La elevada variabilidad de los resultados obtenidos en los pacientes puede también corresponder a diferentes momentos evolutivos del proceso en cada una de las enfermedades estudiadas. Aunque se ha estudiado la composición del CER en las primeras 72 h tras el ingreso, en realidad el período transcurrido desde el inicio de los síntomas es muy variable, con pródromos que oscilan entre 12 h y una semana en las neumonías, e incluso superiores en pacientes con EPOC. El inicio del proceso agudo, relativamente menos impreciso en las neumonías, es difícil de determinar en la mayor parte de las exacerbaciones de la EPOC. Un análisis en que se tomó el punto de inicio de los síntomas como referencia no ofreció una tendencia evolutiva apreciable para ninguno de los parámetros en los pacientes con neumonía. El bajo número de éstos y la imprecisión del parámetro "días desde el inicio de los síntomas" no permiten aventurar una interpretación. Tampoco existen estudios previos que permitan orientar sobre este aspecto.
Las concentraciones de NO2 y NO3 en nuestra población control fue similar a la observada en sujetos normales de estudios previos25,26. Lo mismo sucedió con la concentración de 8-isoprostano en los controles27. No se ha hallado estudios previos en que se determinase la MPO en el exhalado de sujetos normales; sin embargo, las bajas concentraciones de MPO en el esputo inducido de los sujetos sanos (0,1-1 µg/ml)28 hace sospechar que su concentración en el CER sea prácticamente indetectable en ausencia de enfermedad inflamatoria pulmonar.
El NO es un radical libre que posee un importante papel en la fisiopatología de la inflamación pulmonar. Su producción sistémica está aumentada en presencia de infección bacteriana29, lo que induce a pensar que el NO representaría un marcador inflamatorio local en la infección pulmonar. En un entorno acuoso, tal como el microambiente de la superficie de la vía aérea, la generación de NO puede estimarse a partir de la concentración de sus metabolitos, NO2, y su derivado oxidado NO3. La diferencia entre grupos respecto a la concentración de NO2 y la suma de NO2 y NO3 señalaría la producción de RNS. No hay, sin embargo, una explicación satisfactoria para la ausencia de diferencias entre grupos respecto de la concentración de NO3.
Las alteraciones observadas en el exhalado de los pacientes con infección pulmonar grave parecen afectar más a la expresión de ROS (8-isoprostano, MPO) que de RNS. En modelos animales, la administración de lipopolisacáridos por inhalación determina un rápido (horas) influjo de leucocitos desde la sangre, principalmente neutrófilos1. La gran cantidad de neutrófilos presentes en los espacios aéreos de los pacientes con infección pulmonar hace pensar en esta fuente principal de oxidantes, sin descartar otras fuentes incluso exógenas, como la administración de elevadas concentraciones de oxígeno, como ya se ha destacado.
El desplazamiento del equilibrio redox hacia un estado oxidativo favorece la peroxidación de los lípidos de membrana. El resultado es la producción de isoprostanos. El 8-isoprostano (8-isoprostaglandina F2α) es, al contrario que la generalidad de estas sustancias, un compuesto estable, por lo que puede determinarse con cierta seguridad en los líquidos biológicos. Los isoprostanos se han utilizado como marcadores del estrés oxidativo en el pulmón30 y su medición se acepta como un índice de la peroxidación lipídica in vivo31. Su aparición en el CER se ha asociado a la agresión celular de las ROS, y se han hallado transitoriamente elevados en el CER de pacientes con exacerbación de la EPOC8 y en la lesión pulmonar aguda32. Al contrario de lo que sucede con los isoprostanos, la concentración de MPO en el CER no se ha estudiado hasta la fecha, por lo que no se dispone de referencias en la bibliografía. El incremento de la MPO observado en el CER de todos los pacientes con infección pulmonar indicaría la importancia de la reacción neutrófila y de la actividad oxidativa simultáneamente.
La correlación entre parámetros del exhalado puede estar desvirtuada por el efecto dilución. Relacionar NO3 y 8-isoprostano con la concentración de NO2 permite eliminar el efecto dilución, común a ambos parámetros, e interpretar el índice en función de la relación ROS/RNS. La utilización de relaciones en lugar de concentraciones absolutas tiene, por otro lado, la desventaja de que las variaciones pueden deberse tanto al numerador como al denominador, y su interpretación debe ser cautelosa7, razón por la cual dichas relaciones no se utilizan habitualmente en el análisis del exhalado. La MPO es un producto casi exclusivamente relacionado con la producción de ROS, mientras que el 8-isoprostano está producido por la peroxidación lipídica originada, tanto por ROS (oxígeno, peróxido de hidrógeno, OH, etc.) como por derivados reactivos del NO (principalmente peroxinitrito). Por su parte, el NO3 deriva por oxidación del NO2 (indicador de la producción local de NO). Los cocientes 8-isoprostano/NO2 y NO3/NO2 pueden así interpretarse como dependientes esencialmente del exceso de estrés oxidativo. En consecuencia, la relación entre la MPO y la relación 8-isoprostano/NO2 o NO3/NO2 refleja el hecho de que la actividad oxidativa en la interfase aérea de los pacientes con infección pulmonar se halla altamente relacionada a la actividad neutrófila, tal como se ha postulado previamente2.
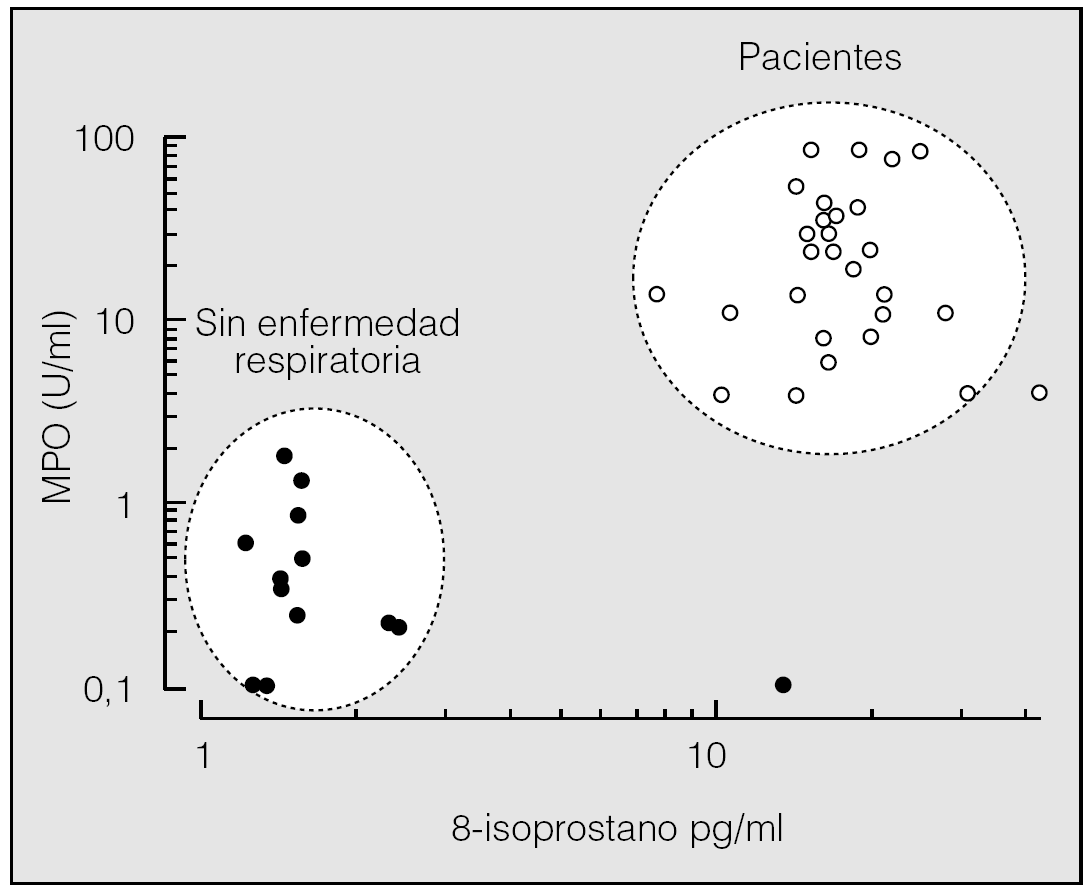
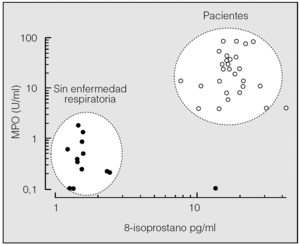
La concentración de 8-isoprostano y MPO en los sujetos sin enfermedad respiratoria es mucho menor que en los pacientes y, a menudo, prácticamente indetectable. La representación logarítmica (fig. 6) permite apreciar claramente 2 agrupaciones en el conjunto de los datos: la primera engloba a los sujetos sin enfermedad respiratoria y la segunda a los pacientes, con puntos de corte entre 8 y 10 pg/ml para el 8-isoprostano y de 2 a 5 U/ml para la MPO. Salvando las imprecisiones ligadas al método (variabilidad, carácter cualitativo de las mediciones, etc.), se puede afirmar que un incremento simultáneo de 8-isoprostano y MPO indica la existencia de un entorno oxidativo en la interfase aérea. En un estudio previo, Carpenter et al32 hallan una elevación de 8-isoprostano en pacientes con síndrome de distrés respiratorio del adutlo, lesión pulmonar aguda o sepsis, con un punto de corte respecto de los sujetos control de 25 pg/ml. Este valor es superior al hallado por nosotros, diferencia que podría radicar en la técnica utilizada. En este sentido cabe destacar que los valores hallados por Carpeferencia son también superiores a los hallados por Van Hoydonck et al27 en el CER de sujetos normales. Debido a la gran variabilidad inherente a la técnica, parece necesario utilizar más de un parámetro para poder definir el estado oxidativo de la interfase aérea.
Fig. 6. Gráfico que representa la concentración de 8-isoprostano y la de mieloperoxidasa (MPO) en el condensado exhalado de sujetos sin enfermedad respiratoria (puntos) y pacientes (círculos). Se aprecian claramente 2 agrupaciones bien diferenciadas (línea discontinua).
En conclusión, el análisis de CER permite detectar el estrés oxidativo de la interfase aérea de pacientes con infección pulmonar grave mediante la determinación de la concentración de 8-isoprostano y MPO.
Agradecimientos
Los autores agradecen a D.a N
Trabajo subvencionado por una beca SEPAR-2002 y por la Red Respira (ISCiii RTIC 03/111, proyecto CER)
Correspondencia: Dr. P.V. Romero.
Laboratorio de Función Pulmonar. Servicio de Neumología.
Hospital Universitario de Bellvitge. IDIBELL.
Feixa Llarga, s/n. 08907 L'Hospitalet de Llobregat. Barcelona. España.
Correo electrónico: pvromero@csub.scs.es
Recibido: 14-3-2005; aceptado para su publicación: 24-5-2005.