Introducción
La enfermedad pulmonar obstructiva crónica (EPOC) es una entidad clínica caracterizada por una obstrucción bronquial, en su mayoría irreversible, secundaria a un proceso inflamatorio subyacente, contracción anómala de la fibra muscular lisa bronquial y presencia de un exceso de moco notablemente viscoso, difícil de movilizar mediante la tos o el movimiento ciliar del epitelio bronquial1. Durante la exacerbación de la EPOC se produce un empeoramiento de la obstrucción bronquial, con la consiguiente alteración del proceso de hematosis y la posibilidad de que se origine una insuficiencia respiratoria.
Clásicamente el tratamiento de la EPOC agudizada ha incluido el uso de broncodilatadores, esteroides sistémicos, oxígeno y, en caso de acidosis respiratoria grave, ventilación asistida (tanto en su versión clásica, mecánica con intubación orotraqueal, como en la recientemente introducida forma no invasiva)2. Una de las piedras angulares del tratamiento de la EPOC agudizada la constituyen los broncodilatadores, especialmente por vía inhalada y a dosis elevadas. De éstos, los más usados son los betasimpaticomiméticos (salbutamol y terbutalina) y los anticolinérgicos (bromuro de ipratropio). Si bien los broncodilatadores tienen un efecto mucho más limitado (en cuanto a potencia broncodilatadora) que en el asma --incrementos menores del volumen espiratorio forzado en el primer segundo (FEV1)--, su administración se acompaña de una mejoría tanto de la disnea como de las alteraciones gasométricas que estos pacientes presentan, en especial durante las agudizaciones3,4. Dicha mejoría se debe no sólo a su efecto relajante directo sobre la fibra muscular lisa bronquial, sino también a la capacidad de reducir la hiperinsuflación pulmonar mediante la disminución de la capacidad residual funcional y, por tanto, de la compresión dinámica de la vía aérea5,6.
El sulfato de magnesio (SM), sobre todo si se administra por vía intravenosa, ha mostrado comportarse como un broncodilatador discreto, especialmente en el asma bronquial agudizada7. Por otro lado, la administración precoz de SM intravenoso en un servicio de urgencias reduce el número de ingresos de los enfermos con asma bronquial agudizada en relación con aquellos que reciben un tratamiento convencional8. Asimismo, se ha observado que este efecto broncodilatador se produce especialmente en los enfermos con asma bronquial agudizada refractaria al tratamiento convencional con betamiméticos9-11. En cuanto al uso del SM parenteral en la EPOC agudizada, los trabajos han sido escasos y no concluyentes12.
En el presente trabajo nos hemos propuesto llevar a cabo un estudio con los siguientes objetivos: a) estudiar si el SM intravenoso tiene efecto broncodilatador en la EPOC agudizada, y b) observar si su administración potencia el efecto broncodilatador de los simpaticomiméticos.
Pacientes y métodos
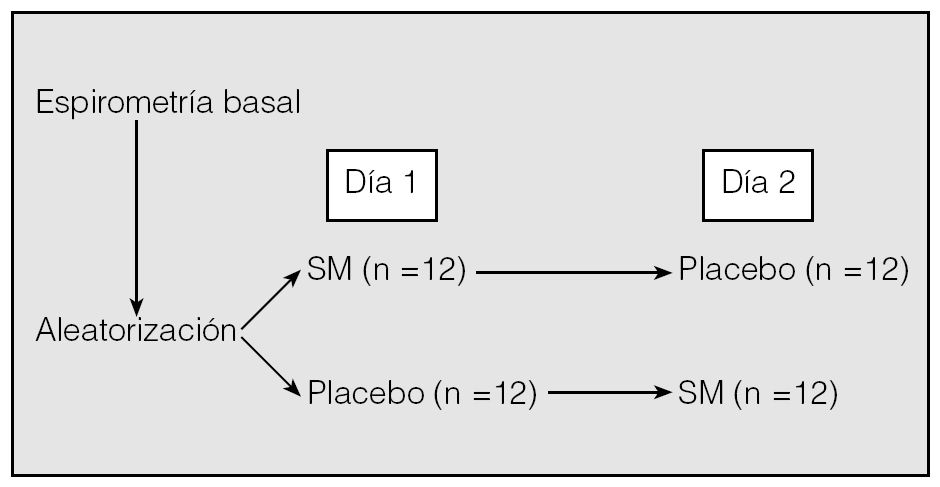
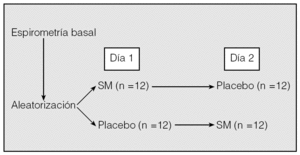
Se ha llevado a cabo un estudio controlado con placebo, aleatorizado cruzado y a doble ciego, en el que se incluyó a 24 pacientes de sexo masculino, con una edad media (± desviación estándar) de 63 ± 3 años, diagnosticados de EPOC agudizada que requirieron ingreso de forma consecutiva en el Servicio de Neumología del Hospital Universitario de Canarias entre octubre de 2003 y septiembre de 2004, y que tenían un buen nivel de colaboración. En todos los casos se obtuvo previamente el consentimiento informado. El estudio fue aprobado por el comité ético local. El tiempo medio entre el ingreso y la realización del estudio fue de 24 h. Cada paciente recibió un tratamiento estándar consistente en metilprednisolona intravenosa, fluidoterapia parenteral, antibióticos (amoxicilina-ácido clavulánico; en caso de alergia a betalactámicos, una quinolona), broncodilatadores inhalados mediante cámara espaciadora (salbutamol y bromuro de ipratropio) y oxígeno (para conseguir una saturación transcutánea superior al 90%). Se excluyó a los pacientes diagnosticados de neumonía, insuficiencia cardíaca, arritmias o insuficiencia renal, o que no se mostraban colaboradores. Se realizó a todos los pacientes una espirometría simple en situación basal, en sedestación, según la normativa de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR)13, con un neumotacógrafo tipo Datospir (Sibelmed, Barcelona), que se calibró diariamente con una jeringa de 3 l. Posteriormente, el día 1, a 12 pacientes se les administraron mediante aleatorización (diseño cruzado) (fig. 1) 1,5 g de SM disuelto en 100 ml de suero salino al 0,9%, y a los otros 12 pacientes, 100 ml de suero salino al 0,9% (placebo) por vía intravenosa en 20 min, sin distintivo alguno que diferenciara ambas soluciones; el día 2, a los 12 pacientes que habían recibido placebo se les administró SM, y a los 12 que habían recibido el día anterior SM, placebo. La administración de SM y placebo se realizó 6 h después de la última dosis de los broncodilatadores inhalados. Una vez finalizada la infusión de cada una de las soluciones, se realizaron espirometrías seriadas a los 15, 30 y 45 min. Por último, se procedió a la administración de 400 µg de salbutamol inhalado mediante una cámara espaciadora (Volumatic, Glaxo Wellcome) y a los 15 min se realizó un último estudio espirométrico. Durante todo el experimento se controlaron la presión arterial, el pulso y la frecuencia respiratoria con el fin de detectar cualquier efecto secundario.
Fig. 1. Protocolo de estudio. SM: sulfato de magnesio intravenoso.
Análisis estadístico
Los resultados de las variables cuantitativas se expresan con medias (desviación estándar). Las variaciones del FEV1 se expresan tanto en puntuaciones directas absolutas (ml) como en porcentajes. Estos porcentajes definen la variabilidad (FEV1 final-FEV1 basal/ FEV1 basal x 100). Las comparaciones de medias se realizaron con la prueba no paramétrica de rangos con signo de Wilcoxon. Se consideró significativo todo valor de p < 0,05 en cualquier contraste. Para el análisis estadístico se usó el paquete estadístico informático SPSS 12.0 para Windows (Chicago, Ill, EE.UU.).
Resultados
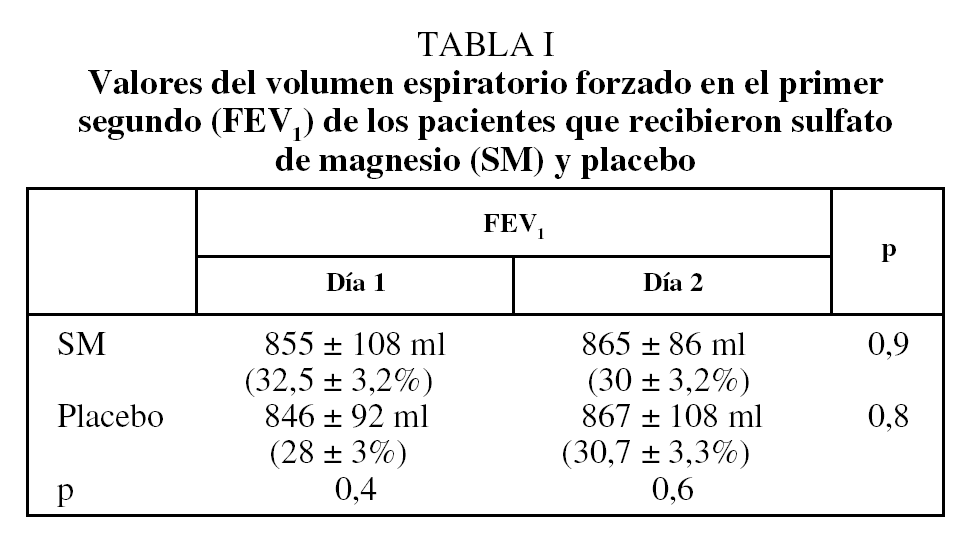
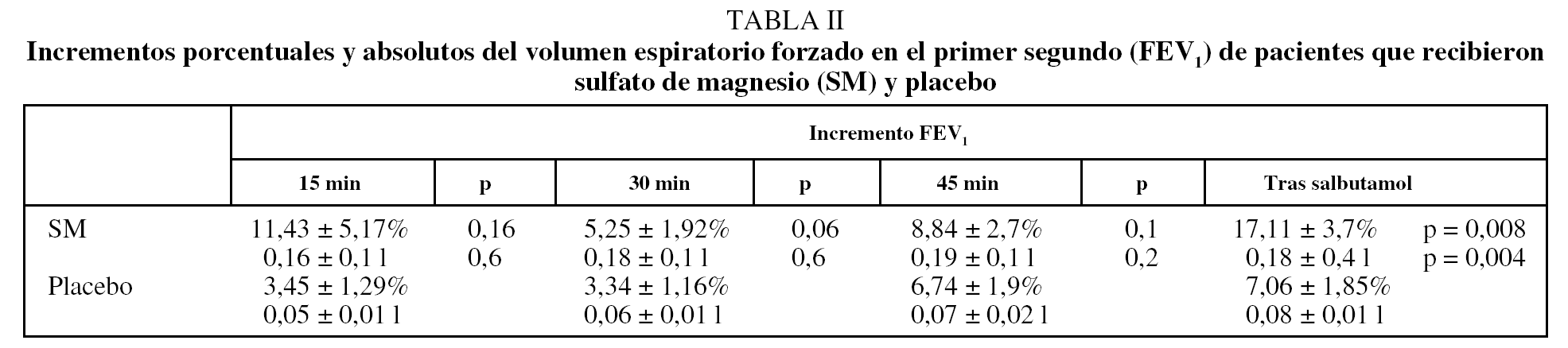
Se incluyó en el estudio a 24 pacientes de sexo masculino, con una edad media de 64 años (rango: 57-78 años), 76 ± 7 kg de peso (rango: 67-98 kg) y 162 ± 13 cm de talla (rango: 157-176 cm). Los valores medios del FEV1 basal en los días 1 y 2, tanto en quienes recibieron SM intravenoso como placebo, eran similares (tabla I). Los incrementos absolutos y porcentuales del FEV1 en ambos grupos a los 15, 30 y 45 min y después de la administración de salbutamol se recogen en la tabla II.
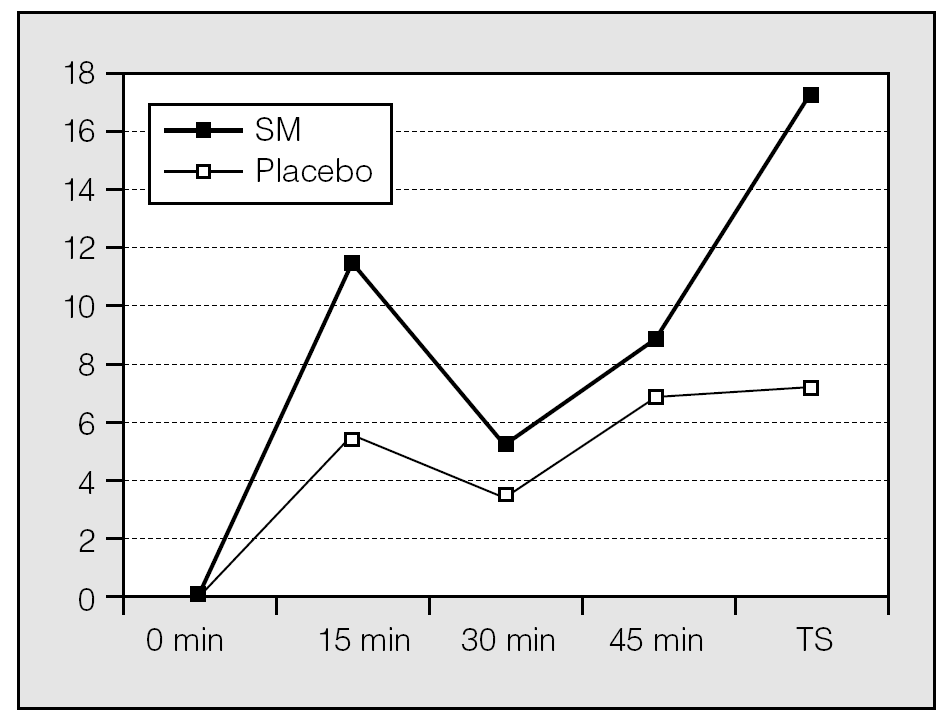
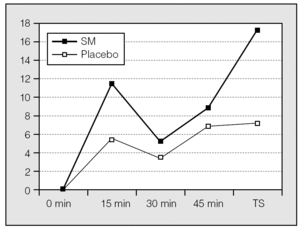
Cuando se compararon los incrementos porcentuales del FEV1 obtenidos en los sujetos que recibieron SM y placebo a los 15, 30 y 45 min, los del grupo que recibió SM intravenoso fueron superiores, si bien no alcanzaron la significación estadística. Sin embargo, en la comparación de los incrementos porcentuales del FEV1 entre los 45 min y después de la administración de salbutamol se obtuvo un aumento significativo del FEV1 en el grupo que recibió SM intravenoso (incrementos absolutos del FEV1 SM/placebo: 0,185 ± 0,42 frente a 0,81 ± 0,17 l; p < 0,004. Incrementos porcentuales del FEV1 SM/placebo: 17,11 ± 3,74% frente al 7,06 ± 1,85%; p < 0,008) (fig. 2). No se observaron diferencias significativas en la frecuencia cardíaca ni en la presión arterial entre los grupos que recibieron SM o placebo.
Fig. 2. Incrementos porcentuales del volumen espiratorio forzado en el primer segundo en pacientes que recibieron sulfato de magnesio (SM) y placebo. TS: tras salbutamol.
Discusión
En nuestro estudio se observó que la administración de 1,5 g de SM intravenoso carece de efecto broncodilatador en los pacientes con EPOC agudizada. Estos resultados son diferentes de los obtenidos por autores como Skorodin et al12, quienes encontraron un efecto broncodilatador en pacientes con exacerbación aguda de la EPOC; dicho efecto era superior al conseguido únicamente por un betasimpaticomimético inhalado. Estos autores valoraron el efecto broncodilatador únicamente mediante las mediciones seriadas de flujo máximo espiratorio, no mediante espirometría convencional, como en nuestro estudio. La discordancia entre los resultados obtenidos por dicho grupo y los nuestros podría deberse quizá a la técnica usada para medir el grado de obstrucción bronquial (flujo máximo frente a un espirómetro). Por otro lado, es conocido que el flujo máximo espiratorio tiene menor sensibilidad que el FEV1 para cuantificar el grado de obstrucción al flujo aéreo y que puede infraestimar el grado de obstrucción bronquial14-16.
Por otro lado, en nuestro estudio observamos un incremento significativo del efecto broncodilatador del salbutamol únicamente cuando se administró después de la infusión de SM intravenoso. Es decir, el SM parece "potenciar" el efecto broncodilatador de un betasimpaticomimético inhalado en pacientes con EPOC agudizada. Nuestros resultados a este respecto coinciden con los de otros autores como Nannini et al17, quienes demostraron que la administración de SM isotónico inhalado (como vía de nebulización) y salbutamol tenía un mayor efecto broncodilatador que el salbutamol más suero salino en el asma bronquial agudizada. Por otro lado, Skorodin et al18 observaron que en sujetos sanos el SM intravenoso potenciaba los efectos metabólicos y cardiovasculares de la terbutalina. Se supone que el magnesio incrementaría la respuesta broncodilatadora de los betasimpaticomiméticos al aumentar la afinidad receptorial del agonista, o bien al facilitar la exteriorización del receptor en la superficie externa de las membranas celulares del órgano diana19. La EPOC se define como una enfermedad cuyo fenómeno obstructivo es irreversible y con escasa respuesta broncodilatadora20-22. Creemos que el efecto "potenciador" de la broncodilatación inducida por el salbutamol que hemos observado con el SM intravenoso en pacientes con EPOC agudizada es digno de reseñar, dado el limitado efecto broncodilatador que tienen en la EPOC los betamiméticos en sí y porque, al contrario de lo que ocurre con el asma, no hay fármacos que aumenten dicho efecto. Es conocido que los corticoides, tanto sistémicos como inhalados, tienen en el asma bronquial la capacidad de aumentar el efecto broncodilatador de los betamiméticos23. Por todo ello, lo encontrado en nuestro estudio a ese respecto podría constituir quizá un avance terapéutico futuro para mejorar dicha situación. La administración de SM intravenoso en pacientes con EPOC agudizada podría reducir el número de ingresos o estancias hospitalarias, e incluso la necesidad de ventilación asistida.
En conclusión, la administración de SM intravenoso a pacientes con EPOC agudizada carece de efecto broncodilatador. Sin embargo, sí potencia dicho efecto de los betamiméticos inhalados.
Correspondencia: Dr. J. Abreu González.
Servicio de Neumología. Hospital Universitario de Canarias.
Ofra, s/n. 38320 La Laguna. Santa Cruz de Tenerife. España.
Correo electrónico: juan_abre@hotmail.com
Recibido: 3-5-2005; aceptado para su publicación: 3-1-2006