Introducción
La fibrosis pulmonar idiopática (FPI) es una enfermedad pulmonar intersticial difusa de etiología desconocida y pronóstico infausto, con una supervivencia media de 3 años desde el diagnóstico. El sustrato anatomopatológico es la neumonía intersticial usual1. Según la hipótesis fisiopatológica recientemente aceptada, las células epiteliales alveolares se activarían en respuesta a agresiones repetidas, lo cual favorecería la apoptosis epitelial, la proliferación de fibroblastos y la formación de miofibroblastos, lo que finalmente conduciría a un excesivo depósito de colágeno y a la distorsión de la arquitectura pulmonar2-4. Todo este proceso está mediado por diversos factores de crecimiento tisular y citocinas Th22-6. Uno de los mediadores profibróticos de mayor relevancia en la patogenia de la FPI es el factor transformador del crecimiento β1 (TGF-β1). El TGF-β1 es una proteína homodimérica de 25 kD secretada por numerosas células, incluidos macrófagos, células epiteliales alveolares y fibroblastos7-9. Se ha demostrado ampliamente su participación en la fibrosis pulmonar experimental, tanto en la alteración de la diferenciación epitelial como en la proliferación fibroblástica7,10,11. El TGF-β1 es quimiotáctico para los fibroblastos, induce la síntesis de proteínas de la matriz extracelular e inhibe la degradación del colágeno7,8.
Dado que la expresión proteica del gen del TGF-β1 se encuentra elevada en el tejido pulmonar de los pacientes con FPI, nuestra hipótesis es que este incremento daría lugar a un aumento de la concentración circulante de TGF-β1. El objetivo del estudio ha sido investigar la utilidad pronóstica de la determinación de la concentración plasmática de TGF-β1 en la FPI.
Pacientes y métodos
Pacientes
En el estudio se ha incluido a 29 pacientes con FPI (10 mujeres y 19 varones), cuya edad media (± desviación estándar) era de 67 ± 7,1 años. El diagnóstico de FPI se estableció de acuerdo con las recomendaciones del consenso de la American Thoracic Society (ATS)/European Respiratory Society (ERS)12 y de la Normativa de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR)13. En 21 pacientes el diagnóstico se realizó mediante criterios clínicos y en 8 mediante biopsia pulmonar quirúrgica. Ocho pacientes eran fumadores y 9, ex fumadores.
Grupo control
Estaba constituido por 27 voluntarios sanos (42 ± 10,6 años de edad; 14 varones y 13 mujeres) sin antecedentes de enfermedad respiratoria ni de otras enfermedades que pudieran asociarse a fibrosis (enfermedades hepáticas, renales, sistémicas autoinmunitarias, diabetes, mielofibrosis, trombocitopenia esencial). Diez eran fumadores y 17, no fumadores.
Métodos
El estudio fue aprobado por el Comité Ético del hospital donde se llevó cabo. Para la determinación en plasma del TGF-β1 se obtuvieron 10 ml de sangre venosa, que se centrifugaron a 500 g durante 30 min. El sobrenadante se congeló en alícuotas a -70 °C hasta su utilización. La determinación de la concentración plasmática de TGF-β1 se realizó mediante una técnica cuantitativa de inmunoabsorción ligada a enzimas en sándwich (ELISA) utilizando un kit comercial (R&D Systems, Mineápolis, EE.UU.), siguiendo las recomendaciones del fabricante.
Análisis estadístico
Los resultados se analizaron con el programa informático SPSS, versión 10.0 (Chicago, Illinois, EE.UU.). Los datos se expresan como media ± desviación estándar. La comparación de medias entre los valores de TGF-β1 del grupo control y del grupo de estudio se realizó mediante la prueba de la t de Student, asumiendo variancias iguales en ambos grupos, contrastada con la prueba Levene. El coeficiente de correlación de Pearson se utilizó para establecer relaciones entre variables. Se consideraron estadísticamente significativos los valores de p < 0,05.
Resultados
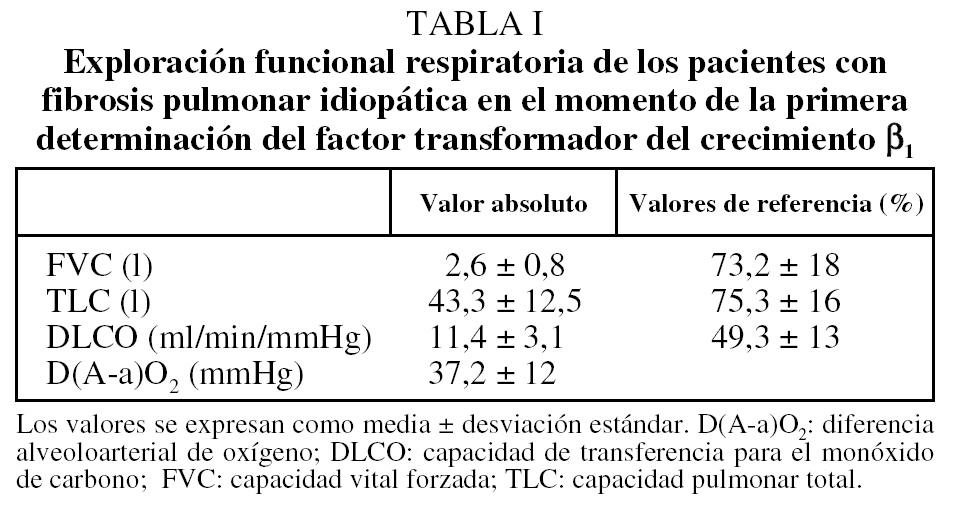
En la tabla I se recogen los hallazgos de la exploración funcional respiratoria de los pacientes con FPI. Cuando se realizó la determinación de TGF-β1, la duración de los síntomas de la enfermedad era de 11,6 ± 7,1 meses (rango: 3-30 meses). Ocho pacientes recibían tratamiento (glucocorticoides asociados o no a azatioprina o sólo azatioprina).
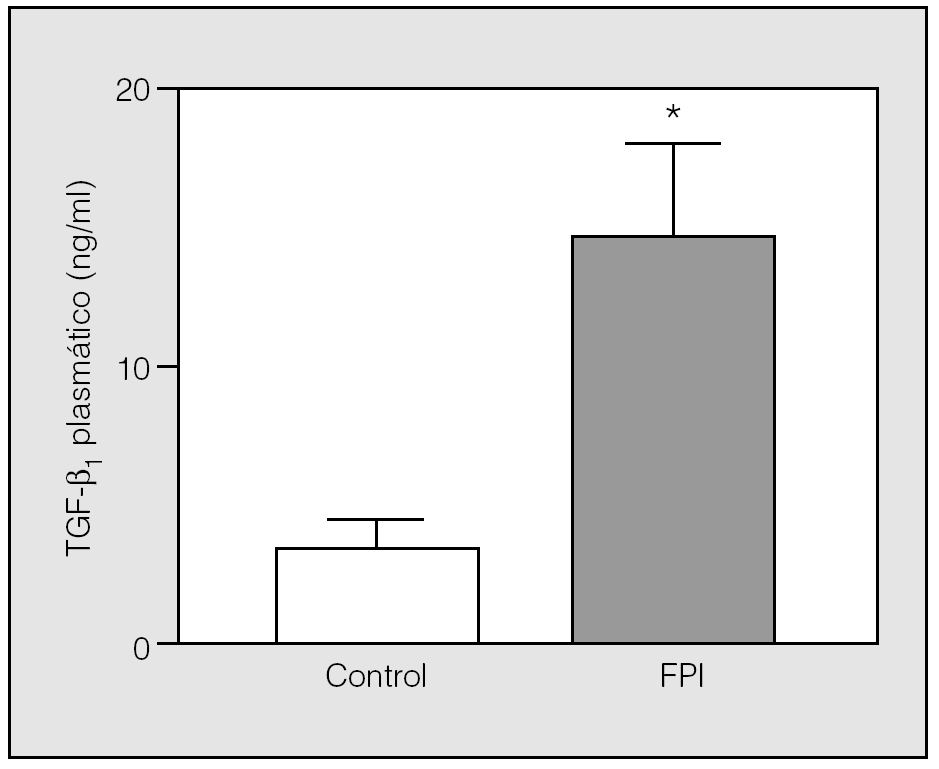
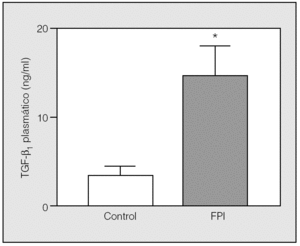
La concentración plasmática de TGF-β1 fue significativamente superior en los pacientes con FPI respecto a los controles (11,1 ± 7,5 frente a 4 ± 2,4 ng/ml; p < 0,01) (fig. 1). Se observó una débil relación inversa entre la concentración plasmática de TGF-β1 y los valores de la capacidad pulmonar total (r = -0,47; p < 0,01) y de capacidad vital forzada (r = 0,48; p < 0,01), pero no con el resto de parámetros funcionales respiratorios. No se observó diferencia significativa en la concentración de TGF-β1 entre los pacientes fumadores y no fumadores, ni entre los tratados y no tratados. Tampoco se encontró ninguna relación entre la edad y la concentración plasmática de TGF-β1 ni en el grupo control ni entre los pacientes con FPI.
Fig. 1. Concentración plasmática del factor transformador del crecimiento β1 (TGF-β1) en el grupo control y en pacientes con fibrosis pulmonar idiopática (FPI). La concentración de TGF-β1 es significativamente superior en los pacientes con FPI respecto a los controles (11,1 ± 7,5 frente a 4 ± 2,4 ng/ml; p < 0,01). Para calcular las diferencias entre medias se ha utilizado la prueba de la t de Student para datos emparejados. *p < 0,01
Se evaluó a 13 pacientes 8 ± 1,2 meses (rango: 5-9 meses) después de la determinación de la concentración de TGF-β1. A todos ellos se les practicaron una exploración funcional respiratoria y una segunda determinación de TGF-β1. En conjunto, los pacientes presentaron un deterioro funcional respiratorio. Con el objeto de determinar con más precisión los cambios de la exploración funcional respiratoria durante el seguimiento, éstos se valoraron con relación al tiempo de seguimiento. Se dividieron los cambios funcionales observados por el tiempo de seguimiento (tabla II). La concentración de TGF-β1 fue de 18,2 ± 15 ng/ml en la segunda determinación. En el conjunto de estos 13 pacientes la primera determinación de TGF-β1 era de 10,9 ± 7,9 ng/ ml, sin diferencias significativas respecto a la segunda determinación. No se observó ninguna relación entre la concentración de TGF-β1 y la exploración funcional respiratoria, ni entre los cambios en la concentración de TGF-β1 y los cambios funcionales respiratorios durante el seguimiento.
Discusión
El presente estudio demuestra que la concentración plasmática de TGF-β1 está elevada en los pacientes con FPI. No obstante, los resultados obtenidos indican que no sería un parámetro útil para valorar la actividad de la enfermedad y su evolución, ya que no se observó ninguna relación entre la variación de la concentración de TGF-β1 y el cambio evolutivo de los parámetros funcionales respiratorios.
Los parámetros que se utilizan actualmente para valorar la evolución y la respuesta al tratamiento en la FPI son las alteraciones en la tomografía axial computarizada de alta resolución y en la exploración funcional respiratoria12,13. En los últimos años se han realizado diversos estudios con el fin de determinar la utilidad de marcadores séricos para optimizar el diagnóstico y el control de la progresión de la FPI14-22, marcadores que podrían tener también un papel en la valoración de la respuesta terapéutica23. El objetivo del presente estudio fue investigar si la determinación en plasma del TGF-β1 es útil para valorar el pronóstico de la FPI. El TGF-β1 es uno de los mediadores profibróticos que tienen más protagonismo en la patogenia de las enfermedades pulmonares fibrosantes7,8,10,11. Salez et al24 demostraron que su concentración está elevada en el lavado broncoalveolar de los pacientes con FPI. Asimismo, se ha observado que los polimorfismos del gen del TGF-β1 se asocian con el desarrollo de fibrosis pulmonar en el pulmón trasplantado por enfermedades pulmonares, como la fibrosis quística, la FPI, las bronquiectasias y el enfisema, y con la progresión de la FPI25-28. Por otra parte, Anscher et al29 observaron una relación significativa entre la concentración plasmática de TGF-β1 y el desarrollo de neumonitis intersticial idiopática en pacientes con trasplante autólogo de médula ósea. Sin embargo, sólo se ha realizado un estudio en el que se ha analizado la concentración plasmática de TGF-β1 como factor pronóstico en la FPI14. En este estudio se determinaron las concentraciones plasmáticas de TGF-β1 en 38 pacientes con FPI y 6 controles sanos. Los resultados demostraron, al igual que en el presente estudio, que la concentración plasmática de TGF-β1 era significativamente superior en los pacientes con FPI. No obstante, disminuyó de forma significativa en 6 pacientes que fueron tratados durante 3 meses con glucocorticoides y colchicina. En cambio, en el presente estudio el tratamiento con glucocorticoides e inmunodepresores no tuvo ningún efecto en la concentración plasmática de TGF-β1. En el estudio de Yong et al14 no se analizó la relación entre la concentración plasmática de TGF-β1 y las alteraciones en la exploración funcional respiratoria14. En el presente estudio se observó una relación débil de la capacidad vital forzada y de la capacidad pulmonar total con la determinación inicial de TGF-β1 en plasma. Sin embargo, cuando se compararon los cambios funcionales respiratorios con la variación en la concentración de TGF-β1 durante el seguimiento de los pacientes, no se demostró ninguna relación. Las discrepancias entre los resultados de los 2 estudios y la variabilidad en la relación entre los cambios funcionales respiratorios y los valores de TGF-β1 probablemente responden, en parte, al escaso número de pacientes evaluados después de la primera determinación del TGF-β1. Otro factor que podría influir en esta variabilidad es la existencia de otros mediadores implicados en la FPI2-5,14 que interactúan con el TGF-β1. Este hecho hace poco probable que la concentración sérica de un solo mediador fibrogénico sea útil para valorar el pronóstico y la evolución de la enfermedad.
Otros marcadores séricos que se han analizado en pacientes con FPI son las proteínas A y D del surfactante, el marcador de alteraciones de las células alveolares epiteliales KL-6, la lactatodeshidrogenasa, la interleucina-8, la molécula de adhesión E-selectina, el factor soluble del marcador de apoptosis Fas y la proteína 1 quimioatractante de los monocitos15-22. Estos estudios han demostrado que las concentraciones de los mencionados marcadores están elevadas en los pacientes con FPI. A pesar de haberse observado que las proteínas A y D del surfactante guardan relación con la supervivencia de los pacientes y que la proteína KL-6 posee un valor discriminativo para distinguir las enfermedades intersticiales difusas de otras enfermedades pulmonares, no hay evidencia de que su determinación seriada sea eficaz para evaluar el pronóstico y la evolución de la FPI15-17,20-22.
Una de las posibles limitaciones del presente estudio es la diferencia de edad entre el grupo control y los pacientes con FPI. Si bien es cierto que no se conoce si la edad influye en la concentración plasmática de TGF-β1, no se ha observado ninguna relación entre la edad de los sujetos incluidos en el estudio y los valores de TGF-β1.
En conclusión, el presente estudio indica que la determinación de la concentración plasmática de TGF-β1 podría utilizarse como un dato analítico más en el diagnóstico de la FPI, pero no como un "biomarcador", ya que no es un parámetro útil para valorar el pronóstico de la enfermedad ni la respuesta al tratamiento. No obstante, serían necesarios más estudios, con un mayor número de pacientes y más tiempo de seguimiento, para ratificar los resultados obtenidos.
Estudio subvencionado por SEPAR-Fundación Respira 2000, FIS 00/0371 y Red Respira V-2003-REDC 11 D-O.
Correspondencia: Dra. M. Molina-Molina.
Servicio de Neumología. Hospital Clínic.
Villarroel, 170. 08036 Barcelona. España.
Correo electrónico: mariamolinamolina@hotmail.com
Recibido: 24-8-2005; aceptado para su publicación: 22-11-2005.