El objetivo de este artículo es destacar la problemática que afecta al cribado del cáncer de pulmón con tomografía computarizada (TC) mediante un análisis exhaustivo de la literatura científica. La publicación del National Lung Screening Trial en 2011 ha indicado que el cribado con TC de fumadores y exfumadores en 3 rondas anuales reduce la mortalidad por cáncer de pulmón en un 20% cuando se compara con el cribado con radiografía de tórax. La primera limitación de esta modalidad de cribado es la falta de descenso en la estadificación en rondas sucesivas de cribado cuando se compara con la ronda inicial. El cribado de cáncer de pulmón con TC también tiene un bajo valor predictivo positivo, similar al porcentaje de cirugías innecesarias realizadas en los falsos positivos. Otro problema es que, actualmente, el sobrediagnóstico del cáncer de pulmón es desconocido. Podemos suponer que si existe sobrediagnóstico cuando la técnica de cribado es la radiografía de tórax, este será mayor cuando se utilice TC. La TC, incluso a dosis bajas, expone a los pacientes a niveles elevados de radiación. La detección de nódulos positivos implica una mayor exposición a radiación, y el número de casos de cáncer inducidos por radiación en los pacientes cribados con TC es desconocido. Por último, los estudios publicados sobre el cribado de cáncer de pulmón con TC son tremendamente heterogéneos. Incluyen diferentes grupos de edad, diferentes categorías de fumadores y exfumadores y diferentes grosores en los cortes de la TC, lo que convierte los resultados en difícilmente comparables. Con estos datos no recomendamos el cribado de cáncer de pulmón con TC de baja dosis para fumadores o exfumadores fuera del contexto de la recomendación individual.
The aim of this article is to highlight some concerns regarding lung cancer screening with CT through a thorough analysis of scientific literature. The publication of the National Lung Screening Trial in 2011 has revealed that CT screening of smokers and ex-smokers in three annual rounds reduces lung cancer mortality a 20% when compared with thorax x-ray screening. The first limitation of this screening modality is its lack of downstaging in successive screening rounds compared with the initial round. Also, lung cancer screening with CT has a low positive predictive value, similar to the percentage of unnecessary surgeries performed in false positives. Another problem is that, at present, the burden of lung cancer overdiagnosis is not known. It is to be expected that if overdiagnosis occurs when thorax x-ray screening is used it will be greater when using CT. CT, even at low doses, exposes patients to high levels of radiation. Dealing with positive nodules entails an even higher radiation dose and the number of cancer cases induced by radiation in patients screened with CT is not known. Lastly, published studies on lung cancer CT screening are vastly heterogeneous. They include different age groups, different types of smokers and ex-smokers and different tomogram thickness, making the results hardly comparable. In this context we do not recommend lung cancer screening with CT for smokers or ex-smokers outside of the context of individual counseling.
El cáncer de pulmón es un importante problema sanitario. En los países desarrollados es el cáncer de mayor mortalidad en varones, mientras que en mujeres es el cuarto más frecuente y el segundo en términos de mortalidad. En 2008, el cáncer de pulmón fue el responsable del 13% de todos los casos de cáncer y del 18% de todas las muertes por cáncer1.
El cáncer de pulmón es también una enfermedad letal. Según el estudio EUROCAREIV, la supervivencia a los 5 años en Europa es del 12%2. Este dato apenas ha variado en los últimos 30años, y aproximadamente el 85% de los sujetos con cáncer de pulmón morirán por esta enfermedad3. Este mal pronóstico se debe fundamentalmente al hecho de que, en el momento del diagnóstico, solo el 15% de los tumores están localizados4 y permiten su resección quirúrgica. Disponer de una prueba de cribado que detectase la enfermedad en una fase temprana prevendría la diseminación de la enfermedad, facilitando el tratamiento precoz y prolongando la vida del paciente.
El cáncer de pulmón tiene múltiples factores de riesgo, aunque del 85 al 90% de todos los casos se atribuyen al consumo de tabaco5. Si se eliminase el consumo de tabaco, el cáncer de pulmón estaría lejos de los primeros puestos en cuanto a la incidencia de cáncer. De esta manera, cualquier diagnóstico precoz debe ser dirigido a fumadores. Muchos aspectos del consumo de tabaco influyen en el riesgo de cáncer de pulmón: duración del hábito, intensidad, profundidad de la inhalación o tipo de tabaco consumido6. Se sabe que la duración del hábito tiene mayor influencia que la intensidad7; así pues, una persona que haya fumado un paquete diario durante 20años tendrá menos riesgo de cáncer de pulmón que una persona que haya fumado medio paquete durante 40años, habiendo fumado ambos 20paquetes-año.
Se ha buscado exhaustivamente una prueba diagnóstica que pueda detectar el cáncer de pulmón de manera precoz. Se han realizado numerosos estudios, de diferente calidad, para establecer la idoneidad de los diferentes tests diagnósticos. La tomografía computarizada de baja dosis (LDCT por sus siglas en inglés), la radiografía de tórax y el análisis de esputo han sido los más utilizados. Aunque estos estudios indican la mayor idoneidad de la tomografía computarizada (TC) para la detección temprana8,9, ninguno de ellos ha sido capaz de demostrar una mayor supervivencia de los pacientes cribados con LDCT frente a un grupo control. Los resultados del National Lung Screening Trial (NLST) han sido los primeros en mostrar una mayor supervivencia de los pacientes cribados con LDCT frente a la radiografía de tórax10. Los resultados del Prostate, Lung, Colorectal and Ovarian Cancer Screening Trial11, publicados en noviembre de 2011, muestran que el cribado anual con radiografía de tórax (4 rondas anuales) no reduce la mortalidad por cáncer de pulmón, descartando la radiografía de tórax como prueba de cribado del cáncer de pulmón. Sin embargo, una publicación reciente ha mostrado diversas limitaciones de la LDCT para el cribado de cáncer de pulmón12. El presente artículo destaca aún más limitaciones que la publicación mencionada, con el objetivo de generar debate entre los profesionales a través de un análisis basado en la evidencia científica antes de que esta tecnología se introduzca en la práctica clínica.
El National Lung Screening TrialEl NLST es un ensayo clínico aleatorizado financiado por el Instituto Nacional de Cáncer de Estados Unidos10. Ha incluido 53.454 grandes fumadores y exfumadores (de al menos 30 paquetes-año) asintomáticos de entre 55 y 74 años. Su objetivo era comparar 2 modalidades de cribado —LDCT y radiografía de tórax— para observar posibles diferencias en la mortalidad. Los participantes fueron aleatorizados a recibir LDCT o radiografía de tórax, y aproximadamente la mitad de los sujetos en cada grupo eran exfumadores. Fueron cribados al inicio del estudio y al final del primer y segundo años de seguimiento, con un total de 3 pruebas de cribado consecutivas. Los participantes fueron seguidos otros 5 años, con una adherencia al programa en torno al 93% en ambos grupos. La población incluida estaba altamente motivada, era urbana y fue cribada en hospitales con amplia experiencia en el análisis de pruebas de imagen y en el manejo de nódulos pulmonares sospechosos. La mediana de seguimiento fue de 6 años y medio.
A continuación se muestran los resultados más relevantes del estudio. Los porcentajes de cribados positivos en el grupo de LDCT fueron, para cada ronda, del 27,3, del 27,9 y del 16,8%, frente al 9,2, al 6,2 y al 5,0% en el grupo de radiografía de tórax. Durante el cribado, el 39,1 y el 16% de los participantes en el grupo de LDCT y radiografía de tórax tuvieron, respectivamente, como mínimo un resultado positivo. En las 3 rondas, el 96,4% en el grupo de LDCT y el 94,5% en el grupo de radiografía fueron falsos positivos. Se diagnosticaron un total de 1.060 casos de cáncer en el brazo de LDCT: 649 después de un cribado positivo, 44 después de un cribado negativo y 367 casos entre los participantes que se habían perdido un cribado o después de que finalizase el cribado. Hubo un total de 18.146 cribados positivos con TC y el cáncer se confirmó en 649 casos, siendo el valor predictivo positivo del 3,6%. La estadificación de los tumores detectados en cada ronda de cribado con TC se incluye en el material suplementario del artículo original, resumido aquí en la tabla 1. En el grupo cribado con TC, las muertes por cáncer de pulmón fueron un 20% inferiores a las del grupo cribado por radiografía de tórax. Esta diferencia fue del 6,7% cuando se consideraron el total de las muertes. En cuanto a los efectos adversos, 16 participantes en el grupo de TC murieron después de un procedimiento diagnóstico invasivo (6 de ellos no tenían cáncer de pulmón).
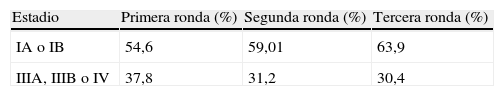
Estadios de cáncer de pulmón detectados con TC por ronda de cribado
| Estadio | Primera ronda (%) | Segunda ronda (%) | Tercera ronda (%) |
| IA o IB | 54,6 | 59,01 | 63,9 |
| IIIA, IIIB o IV | 37,8 | 31,2 | 30,4 |
Fuente: NLST10.
Uno de los objetivos de un programa de cribado es detectar la enfermedad en una fase temprana, para así hacer posible la recuperación y un tratamiento menos agresivo. Cuando se inicia un programa de cribado se espera que la primera ronda detecte casos prevalentes entre los cuales no haya estadios dominantes. Las rondas sucesivas detectarán casos en los que predominen estadios tempranos respecto a la primera ronda13. El tiempo transcurrido entre 2 pruebas de cribado debe ser lo suficientemente corto como para que los cánceres que aparezcan después del cribado no tengan tiempo de progresar a estadios avanzados. Los estudios publicados sobre cribado de cáncer de pulmón con TC no presentan estas características. La tabla 2 muestra la estadificación de los cánceres de pulmón detectados en los cribados iniciales y sucesivos en varios estudios10,14-23. Algunos de ellos no diferencian entre la estadificación de las rondas iniciales y sucesivas, lo que impide el análisis de un posible descenso en la estadificación24.
Estadios de cáncer de pulmón detectados con TC según el cribado de prevalencia o de incidencia
| Estudio | Estadio en el cribado de prevalencia | Estadio en los cribados de incidencia | |
| Segunda ronda | Tercera ronda | ||
| NLST10 | IA: 45,9%IB: 9,2%IIA: 3,4%IIB: 4,1%IIIA: 11,6%IIIB: 10,2%IV: 16,0% | 47,5%11,5%6,0%3,8%7,7%10,4%13,1% | 50,4%13,5%3,5%2,2%6,5%8,7%15,2% |
| Fujikawa et al.14a | IA: 100% | Cánceres no detectados | |
| Bach et al.15,16 | Los cánceres avanzados detectados (estadios III y IV) sobrepasan los predichos por el modelo. No se especifica cuáles de ellos son detectados en un cribado inicial y cuáles en rondas sucesivas (3,9 años de seguimiento mediano) | n/d | |
| Henschke et al.17,18 | I: 85%II: 3,7%III: 11,3%IV: 0% | IA: 85,7%II: 0%IIIA: 14,3%IV: 0% | |
| Swensen et al.19b | I: 71,0%II: 12,9%III: 6,4%IV: 3,2%Cáncer de células pequeñas limitado: 6,5% | I: 50,0%II: 11,8%III: 17,7%IV: 0%Cáncer de células pequeñas limitado: 17,7%Desconocido: 2,9% | |
| Wilson et al.20 | I: 58,4%II: 3,8%III: 28,3%IV: 7,5%Cáncer de células pequeñas: 1,9% | I: 37,5%II: 4,2%III: 25,0%IV: 4,2%Cáncer de células pequeñas: 33,3% | |
| Pastorino et al.21 | I: 54,5%II: 9,1%III: 27,2%IV: 9,1% | I: 100%II: 0%III: 0%IV: 0% | |
| Estudio ITALUNG22 | I: 52,4%II: 9,5%III: 9,5%IV: 19%Cáncer de células pequeñas limitado: 9,5% | n/d | |
| Lung Screening Study23 | I: 53,3%II: 10,0%III: 20,0%IV: 10,0%Desconocido: 6,7% | I: 25,0%II: 0%III: 62,5%IV: 12,5%Desconocido: 0% | |
Como se muestra en la tabla 2, la mayoría de estudios no indican un descenso en la estadificación en las rondas posteriores a la ronda inicial. La frecuencia de cánceres avanzados es estable o aumenta después de la primera ronda. El NLST detecta un ligero aumento en los estadios IA y IB en la segunda y tercera ronda, y un ligero descenso en los estadios III y IV en la tercera ronda si se compara con la ronda inicial (37,8 al 30,4%)10. El estudio de Pastorino et al. observa un aumento significativo en el porcentaje de casos de cáncer en una fase inicial detectados en las rondas de incidencia21. El estudio de Wilson et al. indica, por el contrario, un descenso significativo en los casos detectados en estadio I en la segunda ronda comparados con la ronda inicial, junto con un ligero aumento en los casos con estadios III y IV detectados en la segunda ronda20. Los estudios restantes indican un aumento en el porcentaje de casos de cáncer detectados en estadios avanzados en las rondas de incidencia respecto a los cánceres detectados en el cribado inicial (cribado de prevalencia)17-19,23.
Estos resultados indican que no se da el descenso esperado en la estadificación en los pacientes que acuden a rondas de cribado consecutivas. Esta observación es compatible con la hipótesis de Bach de un modelo bipartito para el cáncer de pulmón, que afirma que algunos cánceres pulmonares crecen rápidamente y son muy agresivos, mientras que otros crecen a un ritmo más lento. Para los últimos, un programa de cribado podría modificar su curso clínico16. Estos hallazgos también implican que uno de los requisitos para un programa de cribado no se cumpliría, ya que no se modificaría el curso clínico de la enfermedad. Si no hay descenso en la estadificación y hay un aumento en el porcentaje de cánceres detectados en estadios avanzados en las rondas de incidencia, el cribado de cáncer de pulmón se demostraría inútil.
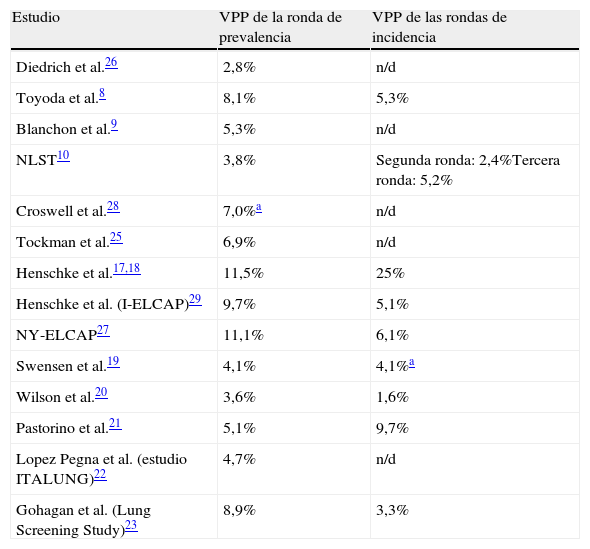
El valor predictivo positivo del cribado de cáncer de pulmón con tomografía computarizada es bajo y es similar al porcentaje de cirugías realizadas en pacientes sin cáncer de pulmónLas lesiones pequeñas no calcificadas detectadas con LDCT se clasificarán como positivas, y la LDCT tiene mucha mayor resolución cuando se compara con otras técnicas de cribado. La tabla 3 refleja un valor predictivo positivo de la TC que oscila entre el 2,8 y el 11,5% en el cribado inicial8-10,17-23,25-29. Solo 3 estudios revelan un valor predictivo positivo superior al 9%17,27,29, con un rango del 1,6 al 25% en las rondas de cribado de incidencia. En la mayoría de los estudios el valor predictivo positivo se sitúa en torno al 5% en las rondas de incidencia. El NLST obtuvo un valor predictivo positivo del 3,8% al inicio y del 5,2% en la última ronda. Muchos de los estudios publicados, como el DANTE, no diferencian los resultados positivos de la primera ronda de los resultados del resto de rondas, por lo que el valor predictivo positivo para cada ronda de cribado no se puede calcular24.
Valor predictivo positivo (VPP) de la TC para cribado de cáncer de pulmón en las rondas de prevalencia e incidencia
| Estudio | VPP de la ronda de prevalencia | VPP de las rondas de incidencia |
| Diedrich et al.26 | 2,8% | n/d |
| Toyoda et al.8 | 8,1% | 5,3% |
| Blanchon et al.9 | 5,3% | n/d |
| NLST10 | 3,8% | Segunda ronda: 2,4%Tercera ronda: 5,2% |
| Croswell et al.28 | 7,0%a | n/d |
| Tockman et al.25 | 6,9% | n/d |
| Henschke et al.17,18 | 11,5% | 25% |
| Henschke et al. (I-ELCAP)29 | 9,7% | 5,1% |
| NY-ELCAP27 | 11,1% | 6,1% |
| Swensen et al.19 | 4,1% | 4,1%a |
| Wilson et al.20 | 3,6% | 1,6% |
| Pastorino et al.21 | 5,1% | 9,7% |
| Lopez Pegna et al. (estudio ITALUNG)22 | 4,7% | n/d |
| Gohagan et al. (Lung Screening Study)23 | 8,9% | 3,3% |
Otro resultado que se espera en un programa de cribado es que el valor predictivo positivo debería aumentar en las rondas de incidencia respecto al cribado inicial. Muchas de las lesiones positivas encontradas en la primera ronda permanecerán en la segunda ronda sin mostrar crecimiento y, por tanto, no deberían ser clasificadas como hallazgos positivos en los cribados sucesivos. En solo 2 estudios17,21 aumenta el valor predictivo positivo en las rondas de incidencia frente a la ronda de prevalencia (tabla 3). Uno de estos estudios es el International Early Lung Cancer Action Project (I-ELCAP), en el que el valor predictivo positivo aumenta del 11,5% en la primera ronda al 25% en las rondas de incidencia. Este estudio tiene el valor predictivo positivo más elevado en ambas rondas29.
Cuando hay un hallazgo positivo, la lesión debe ser examinada para determinar si es maligna y ser tratada. Más del 90% de los hallazgos positivos no corresponden a un cáncer pulmonar. Del total de nódulos detectados, en torno al 98% son benignos30. Así, en el NLST, en torno al 90% de los cribados positivos necesitaron una evaluación diagnóstica10. La mayoría de las lesiones detectadas en el cribado son menores de 1cm de diámetro31. Dado que el riesgo de que una lesión sea cancerosa depende directamente de su diámetro, el manejo de los nódulos subcentimétricos es controvertido, y diferentes estudios proponen distintos protocolos. Para los nódulos pequeños se puede realizar una TC a los 3 o 6 meses, y si hay un aumento en el tamaño se debe realizar un examen invasivo para comprobar la existencia de células malignas. La guía del American College of Chest Physicians (ACCP) contiene criterios específicos sobre el manejo de los nódulos pulmonares en fumadores31. Recomienda TC periódicas, dependiendo del tamaño del nódulo, y para los inferiores a 4mm recomienda una TC anual. Cuando se detectan hallazgos positivos, la probabilidad pretest de una lesión positiva es crucial. El diámetro de la lesión, la historia tabáquica del paciente, ser fumador o exfumador y la edad del sujeto influyen en esta probabilidad. Ninguno de los estudios analizados ha aplicado estos criterios al tratar con los hallazgos positivos, tratando a todas las lesiones de la misma manera dentro de cada estudio, independientemente de las características individuales de los participantes.
El análisis invasivo de un nódulo positivo tiene efectos secundarios que van desde problemas mínimos hasta la muerte. En un cierto porcentaje de casos positivos será necesario realizar un procedimiento quirúrgico como una mediastinoscopia (cuando se encuentran adenopatías en la TC), una toracoscopia o una toracotomía. En el NLST se realizó cirugía en el 4,2% de los casos positivos en la primera ronda, en el 2,9% de los positivos en la segunda ronda y en el 5,6% en la tercera ronda10. De todos los procedimientos quirúrgicos (mediastinoscopia o mediastinotomía, toracoscopia y toracotomía), la toracotomía se utilizó casi en la mitad de los casos en todas las rondas de cribado. Para los pacientes positivos, el porcentaje de procedimientos quirúrgicos supera en un 0,4-0,5% al porcentaje de individuos con cáncer de pulmón confirmado, lo que indica que aproximadamente ese porcentaje de pacientes positivos reciben una intervención quirúrgica innecesaria. En el NLST, 164 pacientes recibieron una intervención quirúrgica innecesaria, por lo que el 0,9% de todos los pacientes positivos fueron sometidos a una cirugía en la que no se detectó cáncer de pulmón (164/total de resultados positivos en las 3 rondas=18.146). Estos porcentajes son significativos si se tienen en cuenta su morbilidad y su mortalidad, incluso aunque en el NLST solo el 0,06% de los pacientes positivos tuvieron complicaciones relevantes después de una cirugía invasiva10. La tasa de mortalidad asociada a las resecciones quirúrgicas del cáncer de pulmón se sitúa entre el 1 y el 4%, en función también del número de cirugías realizadas en cada hospital32. Cuando el tumor está en las fases iniciales, la mortalidad posquirúrgica desciende al 1-2%33.
La tabla 4 muestra las intervenciones quirúrgicas sobre lesiones benignas en los estudios que indican este resultado9,10,19-21,24,28. El porcentaje de cirugías innecesarias oscila entre el 0,9 (NLST)10 y el 13% (DANTE)24, mientras que se sitúa en el 2% en la mayoría de los estudios. Este dato no se indica en el estudio I-ELCAP29.
Intervenciones quirúrgicas en individuos con cribado positivo que al final tienen un resultado benigno
| Estudio | Intervenciones quirúrgicas en lesiones positivas que no corresponden a un cáncer pulmonar |
| Blanchon et al.9 | 2% (3 toracotomías en un total de 152 nódulos no calcificados) |
| Croswell et al.28 | 2% |
| Infante et al.24 | 13% (6 toracotomías de un total de 46 demostraron una lesión benigna) |
| Wilson et al.20 | 1,6% (toracotomía o toracoscopia vídeo-asistida) |
| Swensen et al.19 | 2% (aproximadamente) |
| Pastorino et al.21 | 2,3% recibieron cirugía innecesaria en el primer cribado frente al 0,9% en la segunda ronda |
| NLST10 | 0,9% de cirugías innecesarias (164 en 18.146 sujetos positivos) |
Los resultados mostrados anteriormente indican que los falsos positivos pueden tener un efecto directo en los sujetos cribados. Además, un resultado positivo tiene una severa carga psicológica para los pacientes. La mayoría de los pacientes son conscientes de que el cáncer de pulmón es una enfermedad potencialmente letal, y un resultado positivo afectará a toda la familia. Durante el período que transcurre entre un resultado positivo y el momento en que la enfermedad se descarta, el paciente y su familia experimentarán una gran ansiedad34. Incluso asumiendo que los pacientes están correctamente informados sobre el elevado número de falsos positivos atribuibles a la prueba de cribado, un período de preocupación es inevitable. Además de la propia carga psicológica, los costes directos e indirectos de los falsos positivos pueden ser elevados, incluyendo viajes a y desde el hospital y una posible pérdida de productividad debido a absentismo laboral o poco rendimiento en el trabajo.
El sobrediagnóstico en el cribado del cáncer de pulmón es probablemente elevadoEl sobrediagnóstico puede definirse como sigue: 1)el cáncer no evoluciona o incluso disminuye, o 2)el cáncer progresa tan lentamente que el paciente muere por otras causas sin haber desarrollado síntomas. Esto último depende de 3 factores: a)tamaño en el momento de la detección; b)velocidad de crecimiento, y c)riesgos competitivos de mortalidad. Como en el momento de la detección no se sabe qué cánceres son sobrediagnosticados y cuáles no, en todos ellos es necesaria una aproximación diagnóstica. Una de las principales causas del sobrediagnóstico es el cribado35,36, y en el caso del cribado del cáncer de pulmón, el sobrediagnóstico no es una posibilidad, sino un hecho. Al menos así se ha puesto en evidencia en el Mayo Lung Project, el cual ha observado que el brazo cribado con radiografía de tórax aún tenía un exceso de casos de cáncer detectados después de 16años de seguimiento adicional37. Si el sobrediagnóstico es habitual utilizando radiografía de tórax, es esperable que cuando se utilice TC sea aún mayor, dada su mayor resolución. De hecho, la TC detecta de 2 a 3 veces más nódulos positivos frente a la radiografía de tórax. El cribado poblacional con la TC puede detectar un número sustancial de tumores indolentes y lesiones benignas, así como nódulos potencialmente letales38. El sobrediagnóstico, por definición, se clasifica como un caso innecesario y, de esta manera, todos los procedimientos realizados sobre un nódulo positivo sobrediagnosticado son también innecesarios. Los estudios disponibles que analizan el cribado de cáncer de pulmón con TC mencionan la posibilidad del sobrediagnóstico, aunque este no es analizado formalmente en ninguno de dichos estudios. Es prácticamente imposible clasificar un nódulo positivo maligno como sobrediagnosticado después de haberlo detectado. El paso lógico es analizar los nódulos y comprobar la presencia de células cancerosas. El NLST observa sobrediagnóstico en el brazo cribado con TC. Este brazo detecta sistemáticamente más casos de cáncer que el brazo cribado con rayos x en todas las rondas de cribado (al igual que en otros estudios). Sin embargo, para confirmar esto sería necesario un seguimiento largo de ambos grupos10,35. Es más, el hecho de que el número de positivos solo descienda entre la segunda y la tercera rondas y permanezca igual entre la ronda inicial y la segunda ronda sugiere la posibilidad de sobrediagnóstico. En el NLST no será posible cuantificar la presencia de sobrediagnóstico comparado con los cuidados habituales, ya que el grupo de comparación ha recibido radiografía de tórax.
El manejo del sobrediagnóstico es extremadamente difícil en los programas de cribado de cáncer, y la perspectiva es aún más difícil en el cribado de cáncer de pulmón con TC. La adopción de una aproximación conservadora a las lesiones sospechosas detectadas en el cribado implica la vigilancia con técnicas de imagen31, exponiendo a los pacientes a elevadas dosis de radiación. Sin embargo, esta parecería la manera menos dañina de distinguir 2 lesiones de 0,8cm de diámetro, una agresiva y potencialmente letal y la otra indolente, de progresión muy lenta o incluso recesiva. Esta hipótesis es apoyada por resultados que indican que los sujetos en estadio I detectados en el cribado de cáncer que no reciben tratamiento mueren finalmente por esta enfermedad39.
Utilizar tomografía computarizada de baja dosis como prueba de cribado del cáncer de pulmón aumenta el riesgo de cáncer inducido por radiaciónLa mayoría de los estudios recientes sobre cribado de cáncer de pulmón han utilizado la TC de baja dosis como prueba de cribado. Esta modalidad de cribado tiene grandes ventajas, como la de detectar nódulos subcentimétricos, pero también inconvenientes, ya que expone a los sujetos a dosis de radiación mucho más elevadas que con una radiografía de tórax. Una TC de baja dosis equivale aproximadamente a la radiación natural que recibe un sujeto en 3 años o a 400 radiografías de tórax. Otras pruebas de cribado son mucho menos dañinas, como la mamografía, que es equivalente a la radiación natural que recibe una persona a lo largo de 3 meses40. Estudios de simulación han indicado que en torno al 1,5-2% de todos los cánceres diagnosticados en Estados Unidos son provocados por radiación recibida por TC41. En Estados Unidos, la exposición a radiación médica ha sobrepasado la exposición a radiación natural debido al aumento del uso de las pruebas diagnósticas de imagen42,43. Además, el cáncer de pulmón es uno de los tipos de cáncer más frecuentemente inducidos por radiación44, como han demostrado estudios de modelización recientes. Se ha estimado una muerte por cáncer inducido por radiación por cada 2.000 tomografías (asumiendo una dosis efectiva de 10milisieverts por tomografía y un 5% de riesgo por sievert)45. Los individuos cribados con un resultado normal deben ser cribados anualmente. Esta situación significaría el riesgo más bajo para un individuo cribado debido a la radiación recibida. Cuando se detecta una lesión sospechosa, debería haber un seguimiento para comprobar el crecimiento cada 3-6 meses, exponiendo a los sujetos a dosis acumuladas de radiación elevadas (utilizar una TC diagnóstica implica más radiación). Es más, se ha sugerido que hay una interacción submultiplicativa entre la radiación y el tabaco46, y los individuos cribados para el cáncer de pulmón serán fumadores o exfumadores. Se ha observado que el riesgo de cáncer debido a la radiación desciende con la edad, pero esto no es así para el cáncer de pulmón. Las dosis de radiación empleadas con LDCT se sitúan en el rango de radiación para la que hay evidencia directa de un aumento en el riesgo de cáncer en los supervivientes de la bomba atómica. Para el cáncer de pulmón, la dosis de radiación con esta modalidad de tomografía es de 2,5 a 9mGy. El exceso de riesgo de cáncer de pulmón para una dosis de 5,2mGy en fumadores mayores de 50años que han recibido un cribado anual hasta los 75años es del 0,85% para las mujeres y del 0,23% para los hombres. El cribado anual podría, por lo tanto, aumentar las muertes por cáncer de pulmón sobre un 1,8% en Estados Unidos. Retrasar la edad del primer cribado de 50 a 60años reduciría considerablemente el riesgo de cáncer inducido por radiación, y cambiar la frecuencia de cribado de anual a bianual reduciría a la mitad las dosis de radiación10. Sin embargo, el estudio que ha observado los resultados anteriores no tuvo en cuenta otras pruebas potenciales para diagnosticar cáncer de pulmón, como la tomografía de emisión de positrones (PET), y los riesgos podrían estar infraestimados.
El cribado de cáncer de pulmón con tomografía computarizada tiene un gran impacto económico y organizativoUn programa de cribado de cáncer de pulmón con TC para fumadores tendría un impacto económico significativo. Hay un elevado número de sujetos para ser cribados en un programa de estas características que deberían ser localizados y contactados. Esto no sería fácil, ya que para localizarlos se deberían usar las historias clínicas47. No existen bases de datos de fumadores activos o exfumadores, y la fiabilidad de las historias clínicas para localizarlos es discutible. Dado el elevado número de sujetos en riesgo, se necesitarían tomógrafos dedicados exclusivamente al programa de cribado, con radiólogos, técnicos y auxiliares asignados a cada unidad de cribado. Estas unidades deberían trabajar a doble turno para aumentar su eficiencia y, por tanto, duplicar el personal por tomógrafo. Una TC cuesta sobre 366,32€48, a lo que se debería añadir el coste de pruebas complementarias cuando hay un resultado positivo (añadiendo el coste de la tomografía, el personal y las necesidades preparatorias de las pruebas y la pérdida de productividad laboral incurrida a causa de las citas)47.
Para una población hipotética de un millón de personas mayores de 18años en la que solo se cribasen sujetos de 50 a 75años (por ejemplo, el 35% de la población), con una prevalencia de tabaquismo del 25%, y que en torno al 90% de los fumadores hubiesen consumido más de 20 paquetes-año, el número de sujetos cribados sería 1.000.000×0,35×0,25×0,9=78.750 (el 7,8% de toda la población mayor de 18 años). Solo el coste de las pruebas de cribado, asumiendo 300€ por prueba, sería de un total de 23.625.000€. Aplicando los resultados del estudio NLST, en la primera ronda habría 21.499 (27,3%) resultados positivos que necesitarían un examen posterior. De estos resultados positivos, el 3,6% serían confirmados como cánceres pulmonares y el resto serían falsos positivos. Se detectarían por lo tanto 774 casos. El coste de un falso positivo en un varón se ha estimado en 1.171$ en un año49. En una segunda ronda de cribado el número de cánceres detectados probablemente disminuiría, ya que se han descartado los cánceres prevalentes pero se mantiene el coste del programa de cribado (con una posible reducción de los falsos positivos). Algunos estudios sobre coste-efectividad favorecen el cribado de cáncer de pulmón50, pero sus estimaciones se basan en el estudio I-ELCAP, que ha obtenido los mejores resultados de entre todos los estudios publicados pero que presenta muchas limitaciones51,52.
Otros aspectosHay una gran variabilidad en cuanto a las características de los estudios sobre cribado de cáncer de pulmón (tabla 5). Respecto a la periodicidad del cribado, existe consenso en que un año es el intervalo ideal, pero hay gran variabilidad en la edad de comienzo y finalización del cribado. Otro factor que influye en el número de lesiones positivas es la prevalencia de tabaquismo en los diferentes estudios. Algunos estudios incluyen a individuos que nunca han fumado8,14, en los que la probabilidad de resultados positivos es baja y, aún más importante, las características de los fumadores varían entre las poblaciones cribadas (tabla 5). Muchos estudios utilizan simplemente los paquetes-año para incluir a los fumadores, sin considerar que el tiempo que transcurre desde el abandono del tabaco reduce la posibilidad de desarrollar cáncer de pulmón. Existen grandes diferencias en la edad de los sujetos cribados: mientras algunos estudios comienzan el cribado a los 4029, otros comienzan a los 6017,24. Muchos estudios no especifican un límite de edad para el cribado, incluso aunque la expectativa de vida de una persona que va a ser cribada con TC debería ser al menos de 10años39.
Edad, características de los fumadores e intervalos de cribado en los estudios revisados
| Estudio | Edad (rango) | Características de los fumadores | Intervalo de cribado |
| NLST10 | 55-74 | ≥ 30 paquetes-año. Los exfumadores debían haber abandonado el tabaco en los 15 años previos | 1 año |
| Henschke et al. (I-ELCAP)29 | ≥ 40 | Fumadores, exfumadores o nunca fumadores expuestos a tabaquismo pasivo o expuestos ocupacionalmente a carcinógenos pulmonares | 7-18 meses |
| Henschke et al. (ELCAP)17,18 | ≥ 60 | Tabaquismo ≥ 10 paquetes-año. Adecuados para cirugía torácica | 6-18 meses |
| Tockman et al.25 | ≥ 45 | Fumadores y exfumadores de ≥ 30 paquetes-año con obstrucción moderada en la espirometría (FEV1/FVC < 70%) | n/d |
| Infante et al.24 | 60-74 | Fumadores o exfumadores de al menos 20 paquetes-año | 1 año |
| Wilson et al.20 | 50-79 | Fumadores o exfumadores de al menos 37,5 paquetes-añp. < 10 años desde el abandono del tabaco | 1 año |
| Swensen et al.19 | 50-85 | Fumadores o exfumadores. < 10 años desde el abandono del tabaco | 1 año |
| NY-ELCAP27 | ≥ 60 | Historia tabáquica ≥ 10 paquetes-año. Adecuados para cirugía torácica | 7-18 meses |
| Pastorino et al.21 | ≥ 50 | Fumadores o exfumadores de al menos 20 paquetes-año | 1 año |
| Lopes Pegna et al.22 | 55-69 | Al menos 20 paquetes-año en los últimos 10 años | 1 año |
| Gohagan et al.23 | 55-74 | Fumadores o exfumadores de 30 paquetes-año. Los exfumadores debían haber dejado el tabaco en los últimos 10 años. | 1 año |
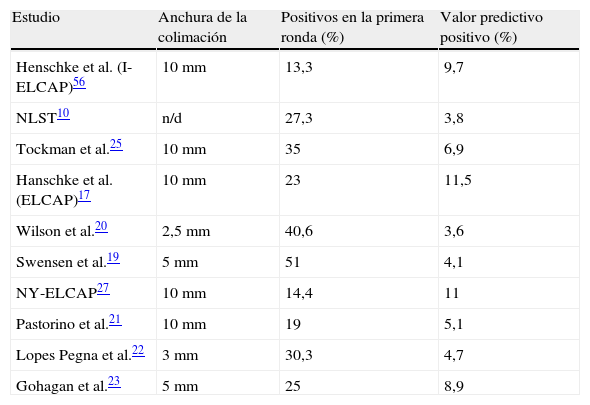
La anchura de los cortes de la tomografía es especialmente importante. Cuanto más fina sea la colimación, más nódulos se localizarán. La mayoría de estudios incluyen cortes de 10mm10,17,21,27, y los nódulos de menor diámetro es menos probable que sean detectados. Los estudios que empleen cortes más finos detectarán más nódulos, lo que implicará más exploraciones posteriores y también una dosis mayor de radiación. Parece razonable que el intervalo de cribado debería ampliarse cuando se usen cortes más finos o acortarse cuando se use peor resolución. En la tabla 6 puede observarse que los estudios con cortes más finos tienen la mayor prevalencia de nódulos positivos20,22 y el valor predictivo positivo más bajo en la primera ronda. Por último, la probabilidad de resultados positivos también dependerá de las características subyacentes de la población. Así, en áreas en las que exista una mayor prevalencia de tuberculosis o de enfermedades respiratorias, la probabilidad de hallazgos positivos es elevada.
Anchura de la colimación, positivos en la primera ronda y valor predictivo positivo
| Estudio | Anchura de la colimación | Positivos en la primera ronda (%) | Valor predictivo positivo (%) |
| Henschke et al. (I-ELCAP)56 | 10 mm | 13,3 | 9,7 |
| NLST10 | n/d | 27,3 | 3,8 |
| Tockman et al.25 | 10 mm | 35 | 6,9 |
| Hanschke et al. (ELCAP)17 | 10 mm | 23 | 11,5 |
| Wilson et al.20 | 2,5 mm | 40,6 | 3,6 |
| Swensen et al.19 | 5 mm | 51 | 4,1 |
| NY-ELCAP27 | 10 mm | 14,4 | 11 |
| Pastorino et al.21 | 10 mm | 19 | 5,1 |
| Lopes Pegna et al.22 | 3 mm | 30,3 | 4,7 |
| Gohagan et al.23 | 5 mm | 25 | 8,9 |
Finalmente, muchos estudios han detectado una frecuencia relativamente elevada de cánceres de intervalo. Respecto al número total de cánceres encontrados en las rondas de incidencia, los casos de cáncer de intervalo son el 6,829, el 5,919 o el 6,8%10. Estos hallazgos apoyan la hipótesis de Bach de un modelo bipartito para el cáncer de pulmón16.
Contextualización de los resultados y propuestas de acciónLos resultados observados para el cribado de cáncer de pulmón con TC muestran muchas limitaciones. La principal es un valor predictivo positivo extremadamente bajo, lo que significa un número muy elevado de falsos positivos. Los falsos positivos exponen a los individuos a tratamientos innecesarios y nocivos, e incluso a la muerte. Aunque se espera que un programa de cribado poblacional tenga un bajo valor predictivo positivo, ya que el valor predictivo negativo es el parámetro clave, los resultados para el cáncer de pulmón parecen poco aceptables. Es más, la aproximación diagnóstica a un nódulo positivo implica un cierto riesgo de morbilidad. Algunos nódulos se localizan en zonas anatómicas que no son accesibles mediante broncoscopia o punción transtorácica percutánea (biopsia o citología), y la única forma de conocer la naturaleza del nódulo es un procedimiento quirúrgico. Los nuevos procedimiento diagnósticos facilitan el acceso a estos nódulos53, pero aún existen áreas inaccesibles. Puede haber metástasis incluso cuando el tumor primario es pequeño. Los tumores localizados centralmente o en las vías respiratorias no se detectan fácilmente con una tomografía de cribado54. El valor predictivo positivo estimado del 5% debe ser confrontado con un 2% de posibilidades de someterse a una cirugía innecesaria. Las muertes evitadas deberían contraponerse con los efectos de la radiación más la ansiedad más las cirugías innecesarias y los costes directos e indirectos.
La opción razonable es, a pesar de los resultados del NLST y de otros estudios con resultados prometedores como el I-ELCAP, no recomendar el cribado de cáncer de pulmón con TC. Es mejor aunar esfuerzos para que los profesionales sanitarios estén alerta sobre la sintomatología del cáncer pulmonar, aumentando su entrenamiento y concienciando a los fumadores del riesgo que tienen de desarrollar cáncer pulmonar. Deberían dedicarse más recursos al consejo antitabáquico y a políticas de salud pública con el objetivo de evitar el inicio de consumo de tabaco en los jóvenes. Todo esto no debe impedir el desarrollo de nuevos estudios que definan en qué subgrupos de sujetos la tomografía de cribado sería coste-efectiva. Estos subgrupos podrían delimitarse por la cantidad de tabaco fumada en la vida (elevada), por el grupo de edad, por la coexistencia de factores de riesgo (riesgo de cáncer de pulmón de origen laboral, exposición a concentraciones elevadas de radón) y por la presencia de otras enfermedades respiratorias o, alternativamente, realizando un cribado oportunista en individuos seleccionados de acuerdo con sus características individuales. Como se ha publicado recientemente, se necesita un cambio en las políticas de cribado55, y esto es particularmente importante en el cáncer de pulmón, donde en la actualidad se impone una reflexión profunda. El American College of Chest Physicians y la American Thoracic Society van a activar guías de práctica clínica sugiriendo un cribado anual con LDCT para los fumadores de más de 30paquetes-año con una edad entre 50 y 7412años, aunque con claras advertencias. Quizá la más importante es que la LDCT no debe ser ofertada fuera de un proceso organizado. Es necesario fomentar un debate reflexivo con todos los profesionales implicados (neumólogos, oncólogos, radiólogos, cirujanos torácicos, epidemiólogos, gestores y pacientes) antes de introducir un cribado poblacional desorganizado que beneficiaría a unos pocos individuos mientras podría ser perjudicial para muchos más, incluyendo las organizaciones sanitarias.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.