Los músculos respiratorios de los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) se ven sometidos a un trabajo incrementado, que deriva de los cambios mecánicos que se producen en su sistema respiratorio. Además, estos cambios tienen como consecuencia una serie de modificaciones estructurales y funcionales en los propios músculos. Por un lado, disminuyen su fuerza y resistencia, lo que se conoce como disfunción muscular, de modo que se vuelven más sensibles al fracaso mecánico. Por otra parte, puede producirse una lesión celular, acompañada de elementos inflamatorios y de reparación. En última instancia, parece claro que se produce una remodelación del músculo, con cambios en su fenotipo fibrilar y en otros de sus componentes1. Recientemente nuestro grupo ha descrito un aumento de las concentraciones locales de determinadas citocinas proinflamatorias en los músculos intercostal externo y diafragma de los pacientes con EPOC2,3. Sin embargo, el papel de estas sustancias y su interrelación con otros procesos sigue siendo una incógnita2,4. Experimentalmente, se sabe que algunas citocinas, como el factor de necrosis tumoral alfa (TNF-α) y la interleucina (IL) 6, pueden favorecer la proteólisis y la disrupción fibrilar, además de condicionar directamente alteraciones contráctiles5,6. Sin embargo, también se ha observado que la síntesis de estas citocinas y la de sus receptores aumenta tras incrementar el trabajo del músculo y/o inducir lesión muscular7–9, y que su ausencia o bloqueo evita una correcta reparación10–12. Ésta depende de la formación de nuevo músculo (miogénesis), que en los vertebrados adultos se realiza por medio de la activación de las células satélite, reguladas a su vez por vías señalizadoras en las que aparecen como claves los genes de Paired box 7 (Pax7), M-Caderina y Mio-D, junto a los de otros factores de regulación miógena13. Nuestra hipótesis es que determinadas citocinas y sus receptores intervienen en la reparación muscular de los pacientes con EPOC, por lo que el incremento local de su producción resultaría en última instancia beneficioso3. En consecuencia, el objetivo del presente trabajo ha sido evaluar la expresión muscular de los genes de citocinas seleccionadas y su relación con la lesión celular y con la expresión de factores miógenos (programas de reparación) en este tipo de pacientes.
Pacientes y métodosPacientesEl tamaño de la muestra se calculó sobre la base de estudios anteriores de nuestro grupo2,4. Se incluyó a un total de 25 pacientes con EPOC grave en fase estable, atendidos en las consultas externas de nuestro servicio. El diagnóstico de EPOC grave-muy grave se basó en los criterios de la Global Initiative for Chronic Obstructive Lung Disease (GOLD: volumen espiratorio forzado en el primer segundo/capacidad vital forzada<70%, volumen espiratorio forzado en el primer segundo<50% de los valores de referencia, con una prueba broncodilatadora estándar negativa)14. La estabilidad se definió como la ausencia de cambios en la semiología y/o la medicación en los 3 meses precedentes al estudio. Para evitar posibles interferencias con otros factores asociados, se excluyó a los pacientes con insuficiencia respiratoria crónica (presión arterial de oxígeno<60 mmHg en reposo), desnutrición (índice de masa corporal<20 kg/m2 y/o índice de masa magra<18 kg/m2), problemas cardiovasculares o neuromusculares, tratamiento con fármacos con efectos potenciales sobre la estructura o función musculares, y pacientes incluidos en programas de rehabilitación o con dificultades para una movilidad normal. El estudio, de tipo transversal, se concibió de acuerdo con los principios de la World Medical Association y fue aprobado por el comitéético de nuestra institución. Todos los pacientes firmaron el consentimiento informado para participar en el estudio.
Evaluación funcional pulmonar y estudio nutricional. Se realizaron una espirometría forzada con prueba broncodilatadora, determinación de volúmenes pulmonares y resistencia de la vía aérea (pletismografía corporal), medición de la transferencia del monóxido de carbono y gasometría arterial, según técnicas estándar y utilizando valores de referencia apropiados para la población local15–17. La evaluación nutricional incluyó el cálculo del índice de masa corporal (antropometría) y del índice de masa magra (bioimpedancia eléctrica).
Función muscular inspiratoria. Se evaluaron la fuerza y la resistencia de los músculos respiratorios. La primera se evaluó mediante la determinación de la presión inspiratoria máxima, en maniobra estática desde volumen residual, y empleando también valores de referencia para población local18. La resistencia se valoró determinando la presión inspiratoria máxima sostenible (PIMS) y el tiempo de aguante ante una carga submáxima, para lo cual se utilizó la prueba de cargas umbrales según el método descrito con detalle en trabajos anteriores19. Brevemente, en la primera parte de la prueba los pacientes respiraron contra resistencias inspiratorias incrementales (8 cmH2O cada 2 min) de tipo umbral hasta el fracaso. La máxima presión alcanzada se definió como PIMS. En la segunda parte de la prueba, los pacientes respiraron frente a una carga submáxima mantenida equivalente al 80% de la PIMS, también hasta el fracaso. El tiempo en que se mantuvo el esfuerzo ventilatorio se definió como tiempo de aguante ante una carga submáxima.
Biopsias del músculo intercostalLas muestras de músculo se obtuvieron según la técnica descrita pormenorizadamente con anterioridad19. De forma breve, tras anestesia local con lidocaína se practicó una incisión horizontal, de unos 2 cm, a la altura del sexto espacio intercostal y de la línea axilar anterior, bajo el límite inferior del músculo pectoral. La muestra se extrajo con tijeras, en dirección paralela a las fibras, tras lo cual se procedió a la sutura por planos. Una porción de la muestra se congeló rápidamente en nitrógeno líquido y se almacenó a –70 °C, mientras que otra porción se incluyó en parafina.
Evaluación de la lesión celularLa muestra parafinada se cortó en secciones de 3 μm y se tiñó con hematoxilina-eosina. Se procedió entonces a la determinación por microscopia óptica (Olympus BX61, Olympus Life and Material Science Europe GMBH, Hamburgo, Alemania) de la proporción de músculo anormal, siguiendo el método de recuento de puntos con gradilla20, adaptado a muestras parafinadas. El área de músculo anormal, considerada un buen reflejo del grado de lesión estructural, se definió como el porcentaje de puntos en que se identificaron los criterios estandarizados de alteración estructural respecto del número total de puntos evaluados. Brevemente dichos criterios fueron: núcleos internalizados, núcleos detectables en el espacio intersticial, depósitos de lipofuscina, fibras pequeñas con ángulos oblicuos o citoplasma basófilo, fibras que contenían material necrótico, y vasos20. Se utilizaron como referencias de normalidad las recogidas en la literatura médica20–22.
Presencia de células inflamatoriasSe obtuvieron nuevas secciones de 3 μm de la muestra parafinada, que se sometieron a procedimientos inmunohistoquímicos estándar utilizando anticuerpos monoclonales específicos para células inflamatorias; en concreto, el anti-CD45 (marcador genérico leucocitario) y el anti-CD68 (marcador específico de monocitos/macrófagos), clones PG-M1 2B11 y PD7/26 (Dako Cytomation, Carpinteria, California, EE.UU.). De forma breve, las secciones se montaron en portaobjetos pretratados con poli-L-lisina, tras lo cual se procedió a su desparafinado y rehidratación. La reactividad ante los anticuerpos primarios se detectó mediante el método tradicional de avidina-biotina-inmunoperoxidasa (equipo LSAB+HRP, Dako Cytomation Inc., Carpinteria, California, EE.UU.). El anticuerpo primario se omitió en los controles negativos. La positividad para CD45 y/o CD68, valorada por microscopia óptica con digitalización de la imagen, se expresa en forma de células positivas por milímetro cuadrado. Se utilizaron como referencias de normalidad las recogidas en la bibliografía20,22–24.
Expresión de los genes seleccionadosSe utilizó la técnica de reacción en cadena de la polimerasa en tiempo real, por sus características de precisión cuantitativa. Se evaluaron los siguientes 12 genes mediante la determinación de sus transcriptomas (ARN mensajero) en el músculo:
- Citocinas: TNF-α y sus 2 receptores (TNFR1 y TNFR2), IL-1β, IL-6 e IL-10.
- Marcador de células leucocitarias: integrina panleucocitaria CD18.
- Marcadores de lesión o estrés celular: isoformas no adultas de las cadenas pesadas de miosina, tanto embrionaria (MyHC-emb) como perinatal (MyHC-peri).
- Genes ligados a la miogénesis: Pax7, M-Caderina y Mio-D.
Los detalles sobre la realización de la técnica se han descrito con detalle en otra publicación2. De forma muy breve, se extrajo el ARN (método del TRIzol, Life Technologies, Frederick, Maryland, EE.UU.), para a continuación sintetizar el ADN complementario (GeneAmp PCR system 2400, Perkin Elmer, Richmond, California, EE.UU.). Tras la transcripción inversa se efectuaron las reacciones de PCR —sistema de detección de secuencias ABI PRISM 7900HT y análisis Taqman (Assays-on-Demand Gene Expression Products, Applied Biosystems, Foster City, California, EE.UU.— (tabla 1). Las muestras se procesaron siempre por triplicado. Como gen control endógeno (housekeeping) se utilizó el de la β2-microglobulina, por su gran estabilidad en el músculo25. Los datos se analizaron con el programa Sequence Detector, versión 2.1 (SDS 2.1), utilizando el método comparativo estándar para cuantificación relativa (CT)2,26.
Tabla 1. Secuencia de las sondas utilizadas en cada caso para la técnica de reacción en cadena de la polimerasa en tiempo real
| Gen | Identificación del ensayo | Secuencia de la sonda (5′-3′) | Acceso Genbank |
| Citocinas y receptores | |||
| IL-1β | Hs00174097_m1 | TATGGAGCAACAAGTGGTGTTCTCC | NM_000576 |
| IL-6 | Hs00174131_m1 | ATTCAATGAGGAGACTTGCCTGGTG | NM_000600 |
| IL-10 | Hs00174086_m1 | GCCTTTAATAAGCTCCAAGAGAAAG | NM_000572 |
| TNF-α | Hs00174128_m1 | ATGTTGTAGCAAACCCTCAAGCTGA | NM_000594 |
| TNFR1 | Hs00533560_m1 | CCTGCTGCTGCCACTGGTGCTCCTG | NM_001065 |
| TNFR2 | Hs00153550_m1 | GAAGCCAAGGTGCCTCACTTGCCTG | NM_001066 |
| Miogénesis-reparación | |||
| Pax7 | Hs00242962_m1 | CTGGGCGACAAAGGGAACCGGCTGG | NM_002584 |
| M-Caderina | Hs00170504_m1 | GACTGATCGCTTCAGGCTAAGAGCG | NM_004933 |
| Mio-D | Hs00159528_m1 | GGCGCCCAGCGAACCCAGGCCCGGG | NM_002478 |
| Lesión-estrés cellular | |||
| MyHC-emb | Hs00159463_m1 | ACAACAGGACCCTGGTGGTCAAACC | NM_002470 |
| MyHC-peri | Hs00267293_m1 | GATGTTGCAAAGGAGAGAAGCACTT | NM_002472 |
| Marcador panleucocitario | |||
| CD18 | Hs01051742_m1 | GTGGATGAGAGCCGAGAGTGTGTGG | NM-000211 |
| Control endógeno (housekeeping) | |||
| β2-microglobulina | Hs99999907_m1 | AGTGGGATCGAGACATGTAAGCAGC | NM_004048 |
CD18: integrina panleucocitaria; IL: interleucina; MyHC-emb: isoforma embrionaria de las cadenas pesadas de miosina; MyHC-peri: isoforma perinatal de las cadenas pesadas de miosina; Pax7: Paired box gene; TNF-α: factor de necrosis tumoral alfa; TNFR1 y TNFR2: receptores 1 y 2, respectivamente, del TNF-α.
Análisis estadístico
Los datos se expresan como media±desviación estándar. El grado de relación entre las variables cuantitativas se ha evaluado mediante el coeficiente de correlación de Pearson. Se estableció la significación estadística en un valor de p=0,05.
ResultadosCaracterísticas clínicas y funcionalesLas características de los pacientes, su estado nutricional, los datos de función pulmonar y función muscular inspiratoria se exponen en la tabla 2. De forma breve, los pacientes mostraron una antropometría y composición corporal dentro de la normalidad, con una función pulmonar en la que destacaba la importante obstrucción al flujo aéreo, con hiperinsuflación pulmonar, reducción de la transferencia del monóxido de carbono e hipoxemia ligera en reposo, sin hipercapnia. La función muscular inspiratoria se hallaba afectada, con disminución tanto de la fuerza como de la resistencia.
Tabla 2. Características de los pacientes
| Datos generales y evaluación nutricional | |
| Edad (años) | 67±6 |
| IMC (kg/m2) | 26,4±3,9 |
| IMM (kg/m2) | 19,8±1,3 |
| Función pulmonar | |
| FEV1 (% ref.) | 31±10 |
| FEV1/FVC (%) | 43±9 |
| RV/TLC (%) | 65±10 |
| DLco (% ref.) | 57±16 |
| PaO2 (mmHg) | 72±9 |
| PaCO2 (mmHg) | 42,2±3,1 |
| Función muscular inspiratoria | |
| PIM (% ref.) | 61±21 |
| PIMS (cmH2O) | −45±13 (VNL >−55) |
| Tlim (min) | 12,4±6,6 (VNL >15) |
Los datos se presentan como media±desviación estándar. DLCO: transferencia del monóxido de carbono; FEV 1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IMC: índice de masa corporal; IMM: índice de masa magra; PaCO 2: presión parcial de anhídrido carbónico en sangre arterial; PaO 2: presión parcial de oxígeno en sangre arterial; PIM: presión inspiratoria máxima; PIMS: presión inspiratoria máxima sostenible; RV: volumen residual; TLC: capacidad pulmonar total; Tlim: tiempo de aguante inspiratorio; VNL: valores normales en nuestro laboratorio.
Daño muscular y presencia de células inflamatorias
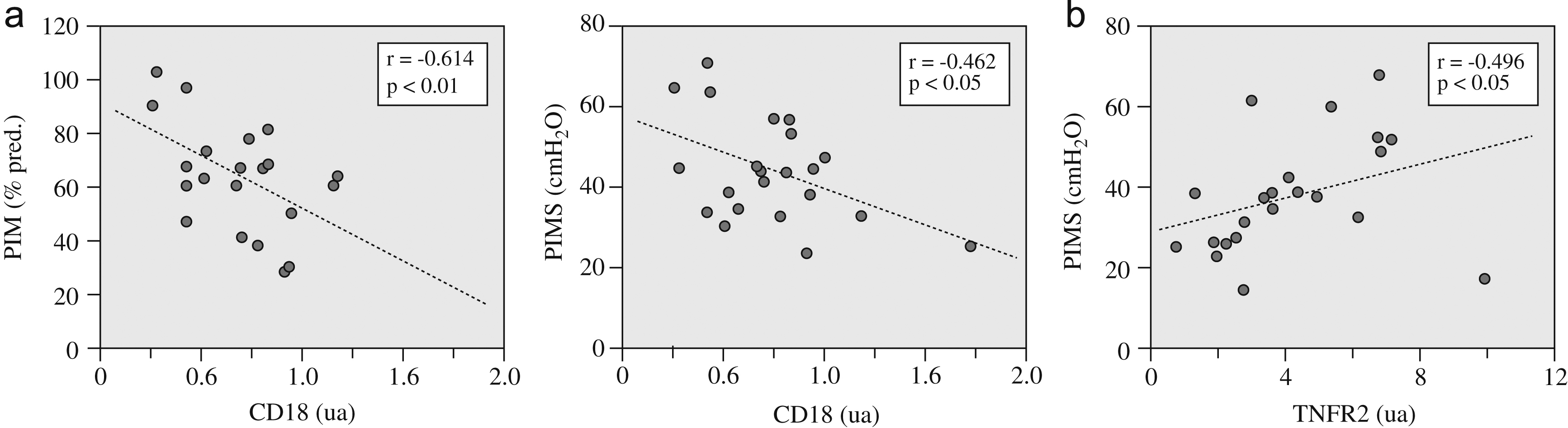
Los signos de lesión fueron discretos (media±desviación estándar: 1,38±1,09% de músculo anormal), fundamentalmente a expensas de la presencia de núcleos internalizados. Respecto a las células inflamatorias, su número era también relativamente bajo (2,38±2,32 mm2), con una ligera tendencia a guardar una relación inversa con la función muscular inspiratoria. Dicha relación inversa sí resultó significativa para la expresión del marcador genético panleucocitario CD18, tanto con la fuerza como con la resistencia de los músculos inspiratorios (fig. 1a).
Figura 1. a) Relaciones entre la fuerza —representada por la presión inspiratoria máxima (PIM)— y la resistencia —expresada por la PIM sostenible (PIMS)— de los músculos inspiratorios y la expresión del marcador leucocitario (CD18), y b) relación entre la resistencia muscular y la expresión del receptor 2 del factor de necrosis tumoral alfa (TNFR2). ua: unidades arbitrarias.
Expresión de genes relacionados con las citocinas y la miogénesis
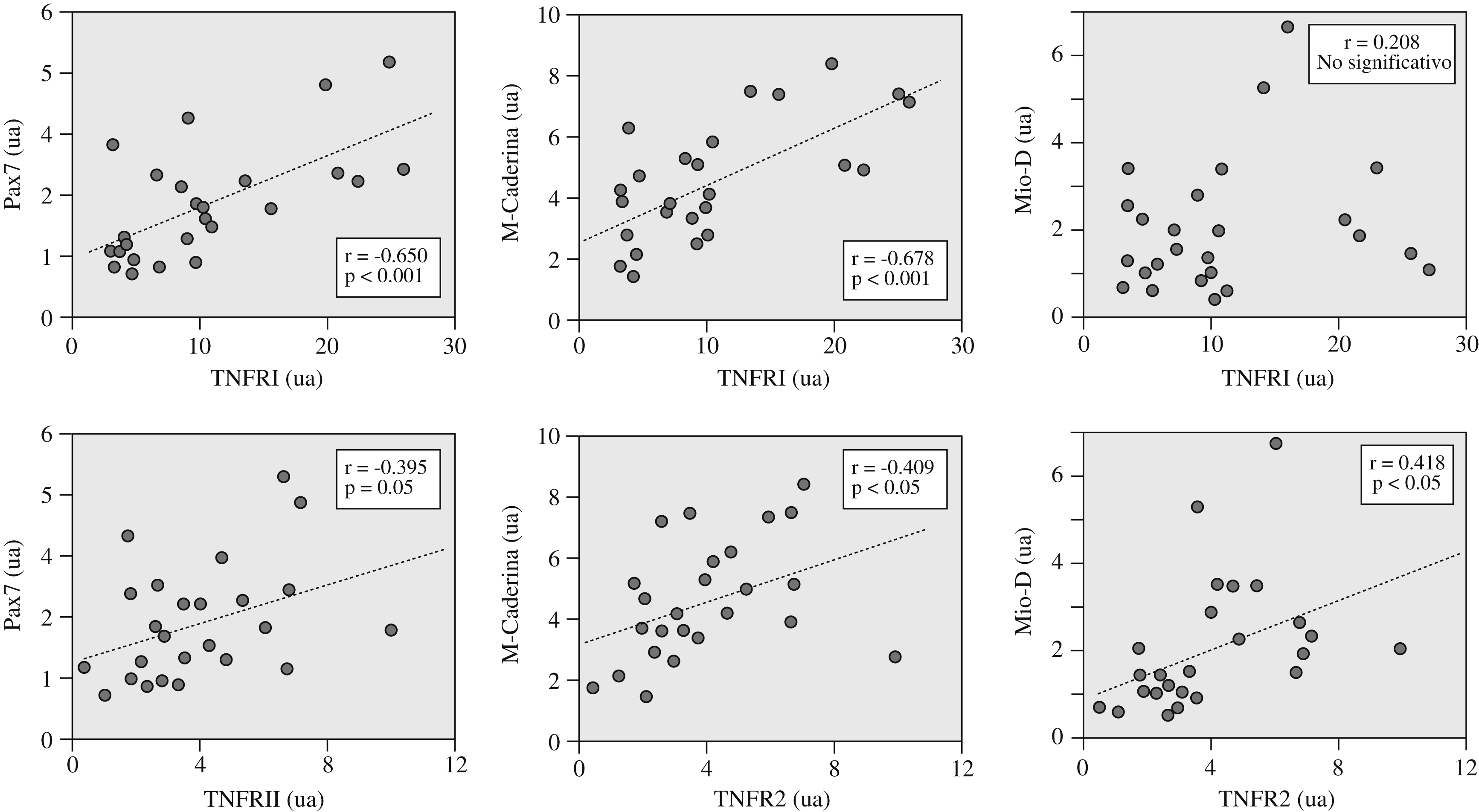
La expresión de las diversas citocinas inflamatorias no mostró relaciones significativas con las variables funcionales. Por el contrario, la del receptor TNFR2 sí se relacionaba directamente con la resistencia de los músculos inspiratorios (fig. 1b). Por su parte, la expresión de los 2 receptores de TNF-α se relacionó directamente tanto entre sí (tabla 3) como con la de las diversas moléculas seleccionadas de los programas de reparación/miogenia (fig. 2 y tabla 3).
Figura 2. Relaciones directas observadas entre la expresión de los 2 receptores del factor de necrosis tumoral alfa (TNFR1 y TNFR2) y las diversas moléculas ligadas a los programas de reparación/miogénesis (Pax7, M-Caderina y Mio-D). NS: no significativo; ua: unidades arbitrarias.
Tabla 3. Correlaciones entre las diversas variables biológicas
| TNFR1 (ua) | TNFR2 (ua) | IL-1β (ua) | IL-6 (ua) | Músculo anormal (%) | MyHC-emb (ua) | MyHC-peri (ua) | Pax7 (ua) | M-Caderina (ua) | Mio-D (ua) | |
| TNF-α (ua) | r=−0,049 p=0,815 | r=0,356 p=0,08 | r=–0,12 p=0,563 | r=–0,13 p=0,536 | r=0,518 p=0,01 | r=0,189 p=0,365 | r=0,192 p=0,359 | r=0,160 p=0,445 | r=0,121 p=0,565 | r=0,104 p=0,621 |
| TNFR1 (ua) | r=0,456 p<0,05 | r=0,147 p=0,484 | r=0,054 p=0,796 | r=0,139 p=0,517 | r=0,004 p=0,986 | r=0,033 p=0,876 | r=0,650 p<0,001 | r=0,678 p<0,001 | r=0,208 p=0,318 | |
| TNFR2 (ua) | r=0,295 p=0,152 | r=0,364 p=0,07 | r=0,111 p=0,604 | r=0,278 p=0,178 | r=0,272 p=0,188 | r=0,395 p=0,05 | r=0,409 p<0,05 | r=0,418 p<0,05 | ||
| IL-1β (ua) | r=0,559 p<0,01 | r=−0,04 p=0,838 | r=−0,38 p=0,06 | r=−0,18 p=0,385 | r=−0,15 p=0,479 | r=−0,33 p=0,107 | r=−0,09 p=0,677 | |||
| IL-6 (ua) | r=0,140 p=0,514 | r=−0,04 p=0,857 | r=−0,09 p=0,647 | r=−0,03 p=0,880 | r=−0,19 p=0,364 | r=−0,09 p=0,660 | ||||
| Músculo anormal (%) | r=0,079 p=0,715 | r=0,016 p=0,942 | r=0,015 p=0,944 | r=0,177 p=0,407 | r=0,299 p=0,155 | |||||
| MyHC-emb (ua) | r=0,773 p<0,001 | r=0,196 p=0,349 | r=0,402 p<0,05 | r=0,138 p=0,511 | ||||||
| MyHC-peri (ua) | r=−0,04 p=0,861 | r=0,373 p=0,06 | r=0,319 p=0,121 | |||||||
| Pax7 (ua) | r=0,661 p<0,001 | r=0,200 p=0,338 | ||||||||
| M-Caderina (ua) | r=0,553 p<0,01 |
ua: unidades arbitrarias; resto de abreviaturas en tabla 1.
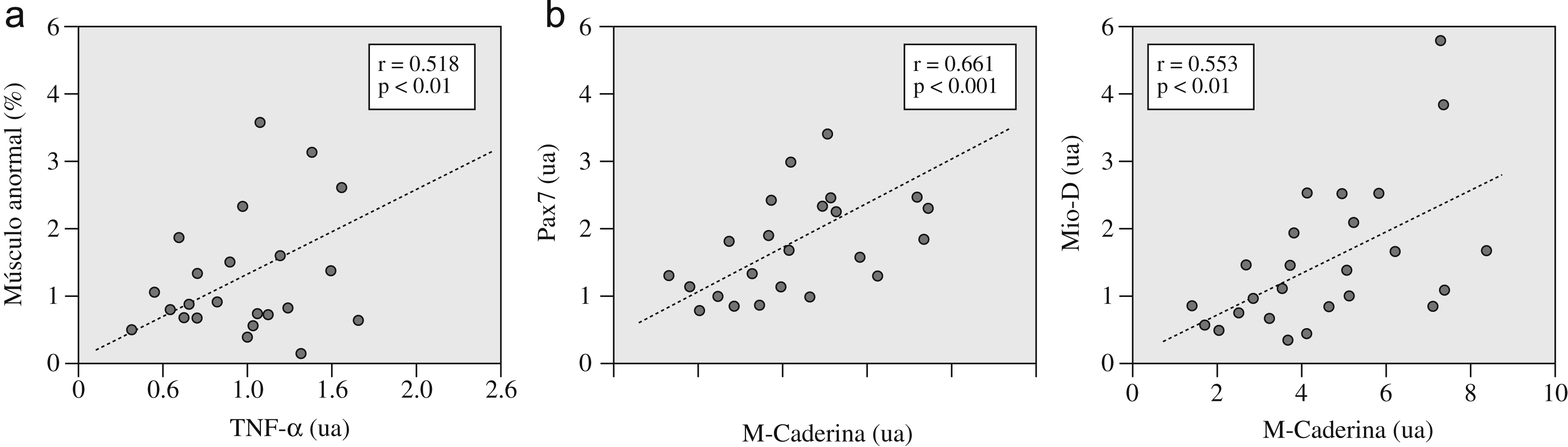
Respecto de las relaciones entre la expresión de citocinas y la presencia de lesión, la de TNF-α se relacionó directamente tanto con el daño general (fig. 3a y tabla 3) como con la presencia específica de núcleos intracelulares (r=0,575, p<0,01). También se observó una relación directa (tabla 3) de la expresión de los marcadores genéticos de daño tanto entre sí (MyHC-emb y MyHC-peri) como con los marcadores de regeneración (p. ej., M-Caderina con MyHC-emb y con MyHC-peri). Además, estos últimos mostraban una relación interna directa (p. ej., M-Caderina con Pax7 y con Mio-D) (fig. 3b y tabla 3).
Figura 3. a) Relaciones entre la expresión del factor de necrosis tumoral alfa (TNF-α) y la proporción de músculo anormal (índice de lesión muscular), y b) relaciones internas entre diversos marcadores de activación miógena: M-Caderina con Pax7 y con Mio-D. ua: unidades arbitrarias.
Discusión
El hallazgo fundamental de este trabajo son las estrechas relaciones observadas en la expresión de 2 grupos de genes aparentemente dispares en su función —los relacionados con la actividad de las citocinas y aquéllos ligados a los programas de miogénesis/reparación—, en los músculos respiratorios de pacientes con EPOC. Además se confirman la lesión de la estructura muscular y la relativa ausencia de células inflamatorias.
La observación de un pequeño porcentaje de músculo con signos de lesión20–22 corrobora hallazgos anteriores de nuestro grupo. En estos trabajos previos, en los que se utilizaron otras técnicas histológicas, también se observaron alteraciones estructurales en diferentes músculos respiratorios de los pacientes con EPOC2,27. Los resultados del presente estudio coinciden igualmente con nuestras observaciones previas en modelos animales, según las cuales el aumento de cargas ventilatorias puede inducir lesión muscular28,29.
Este trabajo también amplía hallazgos anteriores de nuestro grupo sobre la presencia de citocinas en los músculos. Por un lado, la expresión de estas sustancias y de sus receptores, en ausencia de un número significativo de células inflamatorias20,22–24, hace probable un origen mayoritariamente muscular. Hoy día está claro que las fibras son capaces de sintetizar diversas citocinas, que actuarían de forma autocrina/paracrina30–32. Sin embargo, no puede descartarse totalmente una síntesis por parte de otras estirpes celulares, como las células sanguíneas. El papel de las citocinas en los músculos no está todavía claro. Se sabe que promueven la pérdida de proteínas y que ejercen una acción nociva directa sobre la contracción5,6. Por otra parte, su aparición tras ejercicios intensos y/o lesión musclar7–9 invita a pensar que desempeñan un papel relevante en la reparación. En el mismo sentido, estudios recientes han demostrado que la ausencia de receptores de TNF-α condiciona una reparación muscular defectuosa10,11, ya que su activación resulta imprescindible para la diferenciación miógena. Nuestros resultados, que muestran una relación estrecha entre la expresión de los receptores del TNF-α y la de factores miógenos en los músculos intercostales de los pacientes con EPOC, parecen apuntar en esta última dirección. Similar interpretación puede darse a la relación directa observada entre la expresión de dichos receptores y la función muscular2,4. Todo ello apunta a que las citocinas locales desempeñan un papel relevante en la reparación y preservación funcional del músculo.
El mecanismo de estimulación de la síntesis de citocinas en los músculos respiratorios no está todavía claro, pero probablemente dependa de la actividad previa, presencia de lesión celular y/o apoptosis7,9,33,34. En este sentido, se ha observado la sobreexpresión de estas sustancias en el diafragma de ratas sometidas a cargas respiratorias aumentadas9 o a enfisema experimental34.
En cuanto a las limitaciones del estudio, éste se ha centrado en explorar las relaciones de los diversos fenómenos biológicos en pacientes con EPOC. No se ha realizado una comparación con un grupo control fundamentalmente por 2 razones. En primer lugar, porque el objetivo específico del estudio era explorar las relaciones entre el daño muscular, la expresión de citocinas y la activación de programas de reparación en el músculo de los propios pacientes. Esto, unido a la relativa agresividad del procedimiento, no justificaría la inclusión de personas sanas. En segundo lugar, porque nuestro grupo ya ha publicado estudios en que se realiza la comparación con un grupo control2,3 y se dispone de valores que pueden utilizarse como referencia20–24. Por último, en las personas sanas y en circunstancias normales, los programas de reparación muscular permanecen relativamente inactivados.
Por otra parte, se decidió analizar el intercostal externo, que no se considera el principal músculo inspiratorio, debido a nuestro deseo de excluir cualquier comorbilidad. Es conocido que las muestras de diafragma se obtienen habitualmente de personas a quienes se realizan intervenciones quirúrgicas por enfermedad grave asociada.
Por último, es cierto que la técnica utilizada para valorar la expresión de los genes (PCR en tiempo real) no permite asegurar su origen celular. Sin embargo, dicha técnica es la más adecuada para el objetivo principal del presente trabajo, que era evaluar cuantitativamente su expresión.
En resumen, este trabajo confirma la presencia de lesión celular, aunque de escasa cuantía, en el músculo intercostal externo de pacientes con EPOC, al tiempo que demuestra concentraciones bajas de células inflamatorias y una estrecha relación entre la expresión de los receptores de TNF-α y la activación de programas de miogénesis. Esto último induce a pensar que dicha citocina desempeña un papel relevante en la reparación y remodelación de los músculos respiratorios de los pacientes con EPOC.
FinanciaciónEstudio financiado parcialmente por QLRT-2000-00417 y QLRT-2001-02285 (Comisión Europea), SAF 2001-0426 (Plan Nacional I+D), RTIC C03/11 (Red RESPIRA-ISCIII) y CB06/06/0043 (CibeRes, ISCIII).
Autor para correspondencia.
Joaquim Gea
Dirección: jgea@imim.es