en los pacientes con enfermedad pulmonar obstructiva crónica (EPOC), las cifras de la enzima lactatodeshidrogenasa (LDH) en los músculos esqueléticos son normales o tienen cierta tendencia a aumentar; cuando dichos pacientes hacen ejercicio, los valores se elevan más rápidamente que en personas sin la enfermedad. Es probable que las concentraciones de las isoenzimas 4 y 5 de la LDH puedan estar aumentadas en estos pacientes, por lo que se han determinado las isoenzimas de la LDH en el músculo periférico de pacientes con EPOC.
Pacientes y métodose ha estudiado a 18 pacientes con EPOC y a 10 personas sanas no fumadoras. Se les realizaron pruebas de función pulmonar, la prueba de la marcha de 6min y biopsia del músculo cuádriceps para medir tanto la LDH total como las isoenzimas de la LDH por electroforesis en gel de agarosa, así como para clasificar los tipos de fibras.
Resultadoslas concentraciones de LDH total (media±error estándar: 130±30 frente a 152±50μmol/min/g) y sus isoenzimas fueron similares en controles y pacientes. Un subgrupo de 5 pacientes mostró un aumento de las isoenzimas LDH1, LDH2 y LDH3, con disminución de la LDH5; estos pacientes eran mujeres y tenían menor saturación de oxígeno. El valor de la LDH5 se relacionó directamente con la prueba de la marcha de 6min y la saturación de oxígeno. El porcentaje de fibras IIA mostró una correlación directa con la concentración de LDH3 y LDH4, y las fibras IIX se relacionaron inversamente con la LDH3.
Conclusióna partir de las concentraciones de las isoenzimas de la LDH se pudo identificar a un subgrupo de pacientes con una concentración mayor de las isoenzimas cardíacas y menor de las musculares, lo que eventualmente podría representar una adaptación que favorezca el metabolismo aeróbico.
In patients with chronic obstructive pulmonary disease (COPD), lactate dehydrogenase (LDH) levels in skeletal muscles are normal or tend to be elevated; on exercise, these levels increase more rapidly than in individuals without COPD. As it is likely that concentrations of LDH isozymes LDH4 and LDH5 are elevated in such patients, we measured those isozymes in peripheral muscle of patients with COPD.
Patients and MethodsEighteen patients with COPD and 10 healthy nonsmokers were included in the study. Spirometry and the 6-minute walk test were performed, and a biopsy of the quadriceps muscle was taken to measure levels of both total LDH and LDH isozymes by agarose gel electrophoresis and to classify the types of muscle fibers.
ResultsControls and patients had similar concentrations of total LDH (mean [SE], 130 [30]μmol/min/g vs 152 [50]μmol/min/g, respectively) and LDH isozymes. A subgroup of 5 patients showed increased levels of isozymes LDH1, LDH2, and LDH3, with decreased LDH5 levels; these patients were women and had a lower oxygen saturation. The LDH5 level was directly correlated with the 6-minute walk test and oxygen saturation. The percentage of type IIA fibers correlated directly with LDH3 and LDH4 concentrations whereas type IIX fibers were inversely correlated with LDH3 concentration.
ConclusionMeasurement of LDH isozyme concentrations enabled a subgroup of patients to be identified with a higher concentration of cardiac isoenzymes and lower concentration of muscle isoenzymes, a situation which might indicate adaptation that favors aerobic metabolism.
La enzima lactatodeshidrogenasa (LDH) es un tetrámero de 2 polipéptidos llamados M (por “músculo”) y H (por “heart”, “corazón”). Estas unidades se combinan para formar 5 isoenzimas: 4H para la LDH1; 3H y una M para la LDH2; 2H y 2M para la LDH3; una H y 3M para la LDH4, y 4M para la LDH5 . LDH1 y LDH2 predominan en el corazón y se cree que favorecen la formación de piruvato a partir de lactato, mientras que LDH4 y LDH5 predominan en el hígado y el músculo, donde es posible que se revierta la reacción hacia la formación de lactato1.
Las fibras del músculo esquelético del tipo I tienen menor cantidad de LDH que las fibras tipo II, pero la concentración relativa de las isoenzimas LDH1 y LDH2 es mayor en las primeras que en las segundas, en las que predominan las isoenzimas LDH4 y LDH52. Varios trabajos han comunicado un aumento de la proporción de fibras tipo II en pacientes con enfermedad pulmonar obstructiva crónica (EPOC)3, lo cual indica que podría haber un aumento de las isoenzimas LDH4 y LDH5. Diversos estudios han encontrado una disminución de la actividad de las enzimas oxidativas en los pacientes con EPOC comparados con personas sanas4–6. La actividad de las enzimas oxidativas citrato sintetasa y β-hidroxiacil-coenzima A deshidrogenasa se encuentra generalmente disminuida en estos pacientes. Sin embargo, el análisis de la actividad de la enzima glucolítica (LDH) en el músculo esquelético ha mostrado resultados contradictorios. Algunos estudios han comunicado concentraciones totales de LDH similares en pacientes con EPOC y personas sanas6,7, mientras que otros señalan una tendencia a que sean mayores en la EPOC4. Por otra parte, en pacientes con EPOC se han descrito concentraciones mayores de LDH en el músculo cuádriceps de aquellos que desarrollaron fatiga contráctil, comparados con los que no la desarrollaron8. Algunos autores describen la producción temprana de ácido láctico durante el esfuerzo en pacientes con EPOC6,9.
No tenemos información sobre estudios en que se hayan evaluado las isoenzimas de la LDH en el músculo esquelético de pacientes con EPOC, ni en los afectados de otras enfermedades crónicas como la insuficiencia cardíaca. El objetivo del presente trabajo ha sido medir las concentraciones de LDH y sus isoenzimas en el vasto lateral del músculo cuádriceps de pacientes con EPOC y compararlas con las de personas sanas, así como evaluar si las isoenzimas de la LDH se relacionan con la proporción de los tipos de fibras musculares, los valores espirométricos, la saturación de oxígeno (SaO2) y la capacidad funcional medida a través de la marcha de 6min (M6M).
Pacientes y métodoSe ha estudiado a 18 pacientes procedentes del Servicio de Neumonología del Hospital Universitario de Caracas con diagnóstico de EPOC moderada a grave. El grupo control estuvo formado por 10 sujetos sanos no fumadores de similar grupo etario. Todos los pacientes y los controles firmaron el consentimiento después de que se les hubiera informado de los procedimientos que se les iban a realizar. El protocolo fue aprobado por el Comité de Ética de la institución.
El diagnóstico de EPOC se realizó siguiendo las recomendaciones de la American Thoracic Society/European Respiratory Society10. En el momento de entrar en el estudio los pacientes se encontraban clínicamente estables, recibían un tratamiento broncodilatador adecuado (agonista β2, anticolinérgicos, teofilina y esteroides inhalados) y no utilizaban de forma regular esteroides sistémicos.
Los criterios de inclusión de los pacientes fueron los siguientes: se seleccionó a aquellos que tras la administración de broncodilatadores no presentaron respuesta significativa, definida como aumento del volumen espiratorio forzado en el primer segundo (FEV1) mayor de 12% y 200ml. Se excluyó a los pacientes con comorbilidades como insuficiencia cardíaca congestiva, diabetes mellitus, cardiopatía isquémica, enfermedad vascular periférica y problemas neuromusculares. Tanto los pacientes como los controles eran mestizos y declararon llevar un estilo de vida sedentario.
Función pulmonarLa función pulmonar en reposo se evaluó con un espirómetro (MedGraphics CardiO2 System, Saint Paul, Minnesota, EE.UU.). Los valores de la capacidad vital forzada (FVC), FEV1 y FEV1/FVC se calcularon siguiendo las recomendaciones de la American Thoracic Society11. Los valores normales se tomaron de fuentes de referencia12.
Marcha de 6minLa M6M se llevó a cabo en un pasillo sin estorbos de 22m de largo. La prueba se estandarizó siguiendo las recomendaciones internacionales13. Se realizaron 2 pruebas, separadas por un período de 30min. Se dieron las indicaciones pertinentes a los pacientes y se les animó a caminar enérgicamente durante un período de 6min, en el curso de los cuales se les permitía descansar si era necesario. Durante la prueba se midió, además de la distancia recorrida en el tiempo preestablecido, la SaO2 con un oxímetro de pulso (Respironics Inc., Model 950 Oximeter, Kennesaw, Georgia, EE.UU.). También se determinaron, tanto en reposo como a máximo esfuerzo, la frecuencia cardíaca y la intensidad de la disnea utilizando la escala de Borg14. La distancia recorrida se midió en metros y para el análisis se escogió la máxima distancia alcanzada en ambas pruebas. La distancia teórica que cada paciente debería caminar se calculó con la ecuación de Enright y Sherill, según la validación de Cote et al15, y se expresó el porcentaje que la medición real representa respecto a lo esperado teóricamente.
Biopsia muscularSe tomaron muestras del vasto lateral del músculo cuádriceps con la aguja de Bergström16, previa antisepsia y anestesia local con lidocaína al 2%. El sitio seleccionado se encontraba a media distancia entre el trocánter mayor y la rótula, y en la parte superficial del músculo. Parte de la muestra se embebió en OCT y se congeló en isopentano enfriado con nitrógeno líquido. La otra parte se congeló directamente en nitrógeno líquido. Ambas muestras se guardaron a −70°C hasta su procesamiento. Para la clasificación de las fibras musculares se usó la primera muestra, en la que se practicaron cortes seriados de 10μm en un crióstato a −20°C. La reacción de la adenosintrifosfatasa se llevó a cabo a varios pH de preincubación (10,3; 4,6, y 4,37)17. Con la otra parte de la muestra se preparó un homogeneizado en solución amortiguadora de fosfato de potasio. Una parte del homogeneizado se utilizó para medir la actividad de la LDH por métodos fluorométricos18, y el resultado se expresó en μmoles/min/g de tejido húmedo; la otra parte se usó para la determinación de las isoenzimas por electroforesis en gel de agarosa (Helena Titan Gel LD, Helena Laboratorios, Beaumont, Texas. EE.UU.), siguiendo las instrucciones de los fabricantes.
Análisis estadísticoLos resultados se expresan como promedio±error estándar. Las diferencias entre los distintos grupos se evaluaron con la prueba no paramétrica de la U de Mann-Whitney, debido al tamaño de la muestra y porque la distribución de algunos parámetros no era normal, lo que se comprobó con la prueba de Kolmogorov-Smirnov. Para determinar la relación de las isoenzimas de LDH con las características antropométricas, la función pulmonar, la M6M y el tipo de fibras se utilizó la correlación de Spearman. El programa estadístico utilizado para el análisis fue Statistica (Statsoft, Inc., Tulsa, Oklahoma, EE.UU.). Se aceptó un nivel de significación estadística con un valor de probabilidad <0,05.
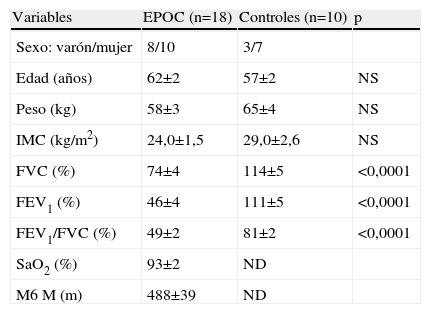
ResultadosLos valores promedios±error estándar de las características físicas, la función pulmonar, la SaO2 y la M6M se muestran en la tabla 1. Los datos de la función pulmonar indican que los pacientes tenían una obstrucción grave al flujo aéreo (FEV1/FVC: 49±2%; FEV1: 46±4%).
Características antropométricas y funcionales en pacientes con EPOC y en el grupo control
| Variables | EPOC (n=18) | Controles (n=10) | p |
| Sexo: varón/mujer | 8/10 | 3/7 | |
| Edad (años) | 62±2 | 57±2 | NS |
| Peso (kg) | 58±3 | 65±4 | NS |
| IMC (kg/m2) | 24,0±1,5 | 29,0±2,6 | NS |
| FVC (%) | 74±4 | 114±5 | <0,0001 |
| FEV1 (%) | 46±4 | 111±5 | <0,0001 |
| FEV1/FVC (%) | 49±2 | 81±2 | <0,0001 |
| SaO2 (%) | 93±2 | ND | |
| M6M (m) | 488±39 | ND |
Los valores se expresan como media±error estándar.
FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IMC: índice de masa corporal; M6M: distancia recorrida en la marcha de 6min; ND: no determinado; NS: no significativo; SaO2: saturación de oxígeno en reposo.
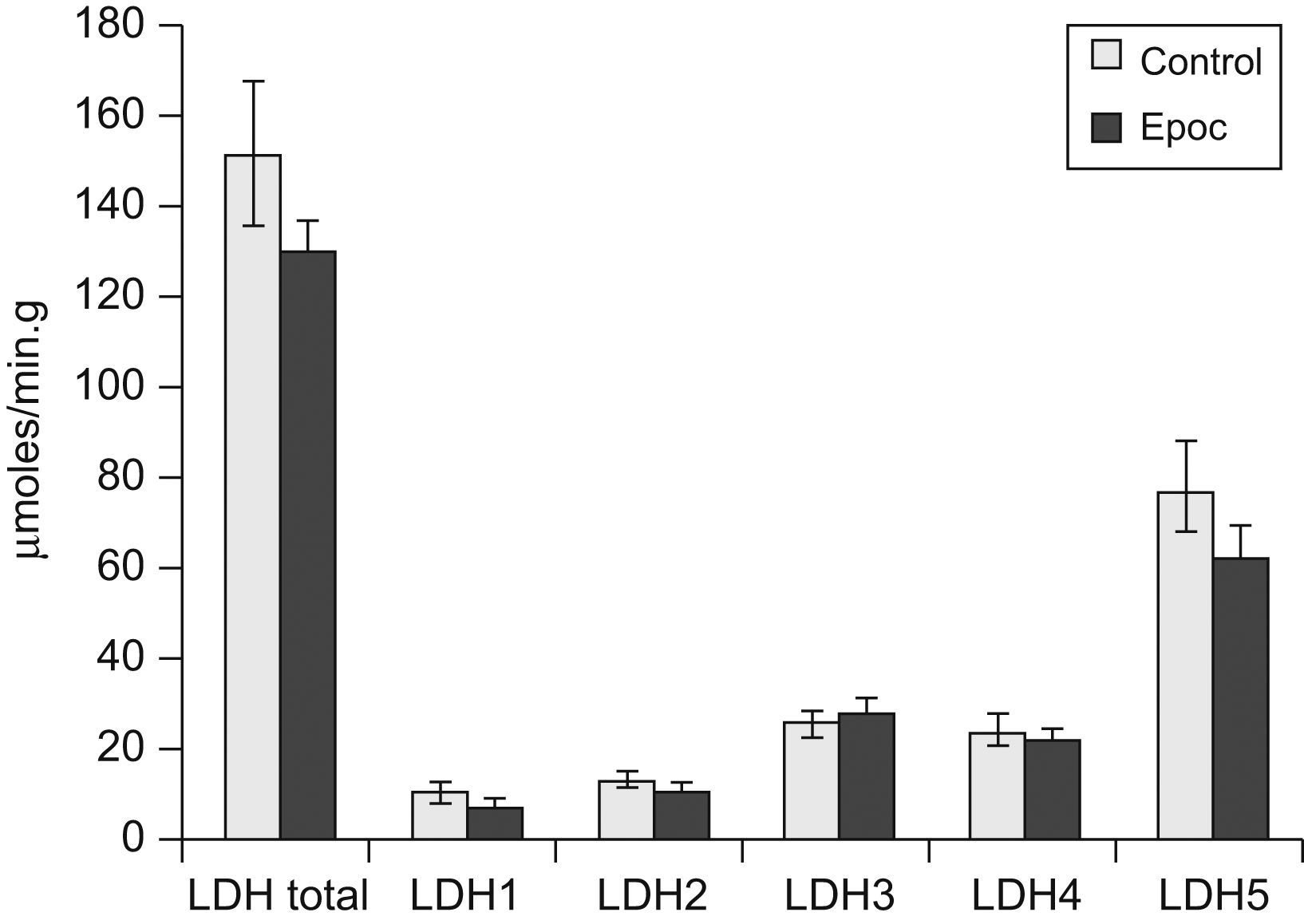
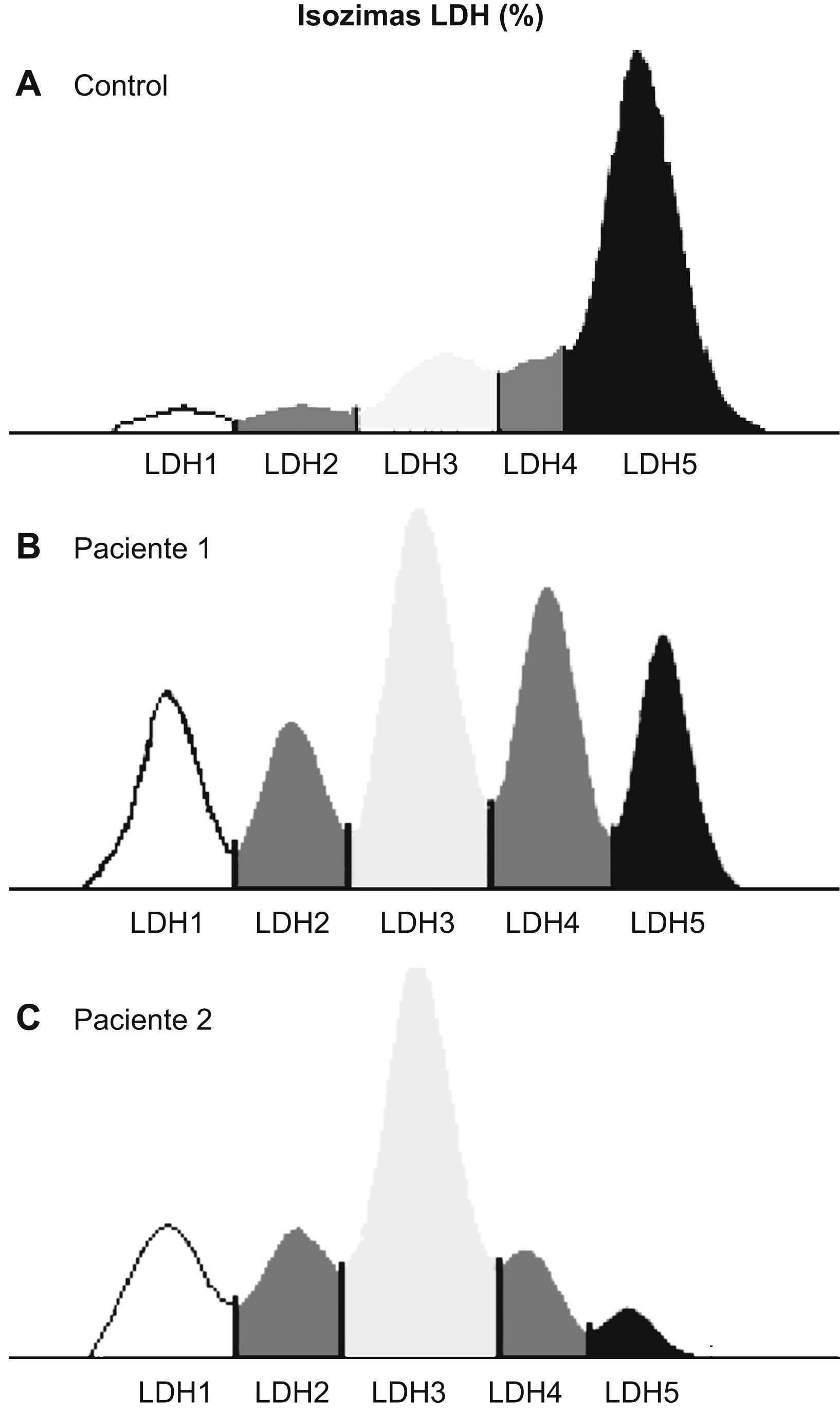
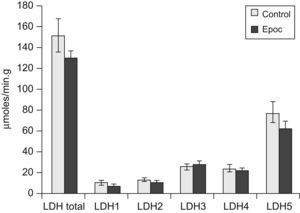
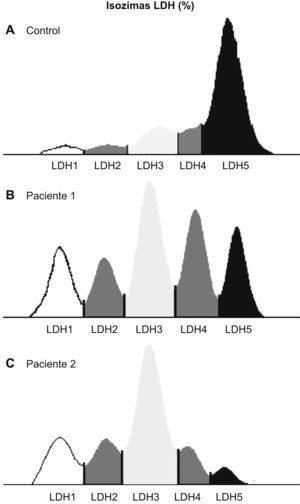
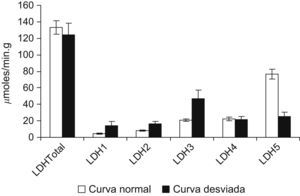
El valor de la LDH total (130±30 frente a 152±50μmol/min/g de tejido húmedo) y las concentraciones de las distintas isoenzimas (fig. 1), así como su distribución porcentual, fueron similares en pacientes y controles. Los pacientes no presentaron diferencias en la proporción de los tipos de fibra comparados con el grupo control (tipo I: un 44±2 frente a un 48±2%; tipo IIA: un 37±2 frente a un 32±4%; tipo IIX: un 19±3 frente a un 20±4%). Al observar las curvas de proporción de las isoenzimas, 5 pacientes tenían una distribución diferente, mientras que 13 presentaban curvas similares a las de los controles. En la figura 2 se muestran los resultados de la lectura densitométrica de la electroforesis en gel de agarosa del extracto muscular de un sujeto control (fig. 2A), y las correspondientes a 2 pacientes que mostraron curvas distintas de las de los controles (fig. 2B y C). Al tratar de caracterizar a los 5 pacientes con patrón de curva desviado, se encontró que, si bien el total de la enzima LDH fue similar al resto de los pacientes, el valor de las isoenzimas era diferente, con disminución de la LDH5 y aumento de las LDH3, LDH2 y LDH1 (fig. 3).
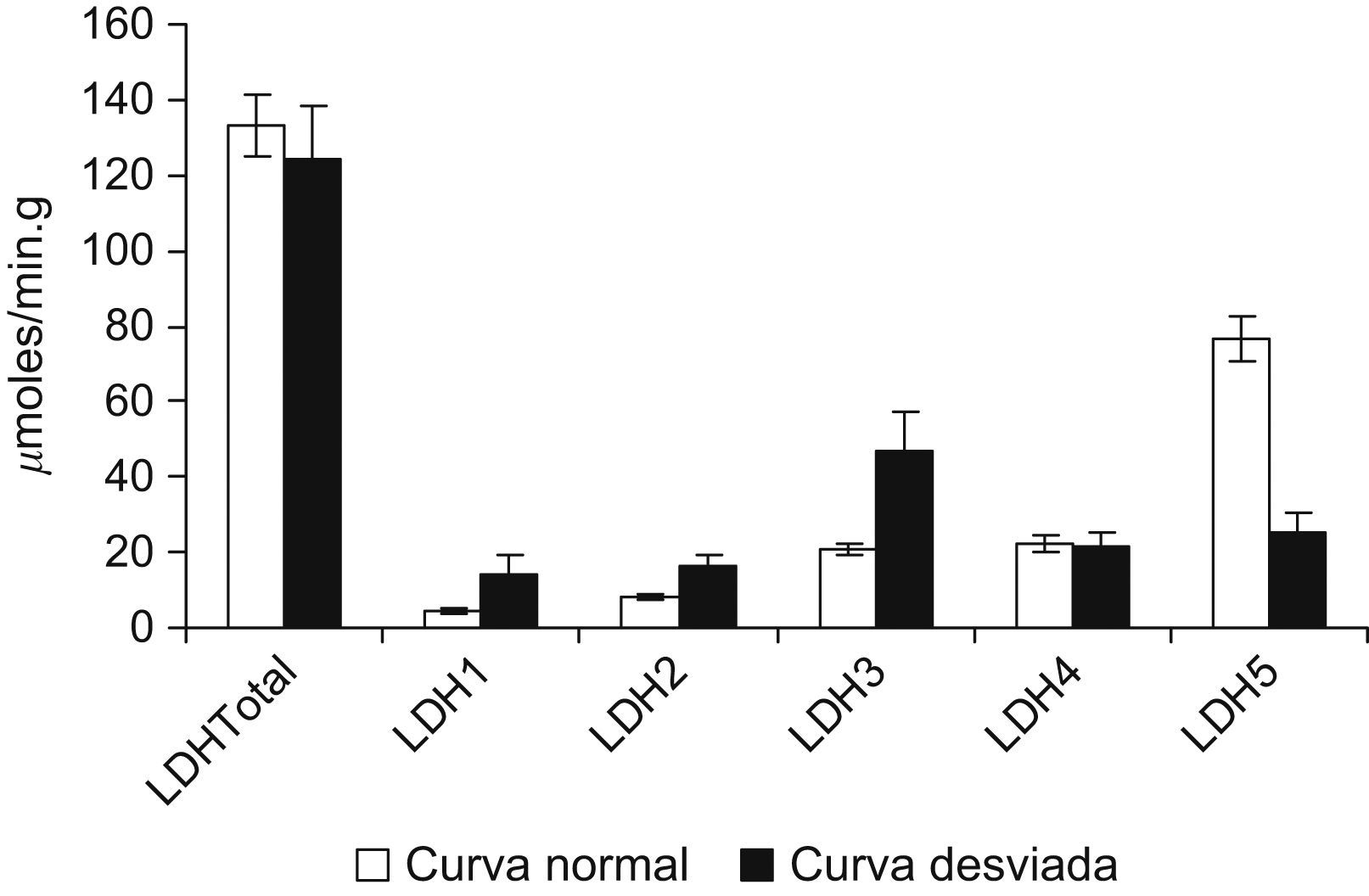
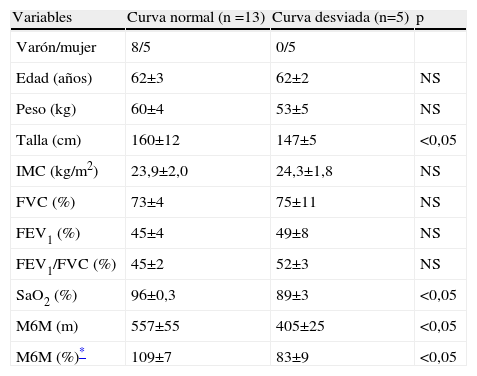
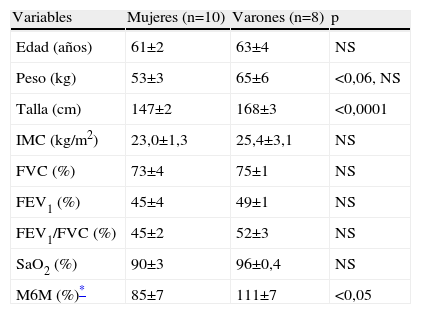
En la tabla 2 se exponen las características antropométricas y funcionales de los pacientes con curva de isoenzimas de LDH normal y desviada. La comparación de dichas características mostró que el grupo de pacientes con la curva desviada estaba formado sólo por mujeres, y probablemente por esta razón la talla y la distancia recorrida en la M6M eran significativamente menores que las de los pacientes con curva normal. Asimismo presentaban una SaO2 menor que los de curva normal. En el grupo de curva desviada, la proporción de fibras IIA fue mayor que en el de curva normal (un 48±2 frente al 34±2%), mientras que la de fibras IIX fue menor (un 4±2 frente al 22±3%). Como todos los pacientes con patrón de curva desviado eran mujeres, se analizaron las diferencias por sexo. En la tabla 3 se observa que las mujeres, como era de esperar, tenían menor estatura y caminaban una distancia menor que los varones. Su distribución de las isoenzimas LDH3 y LDH5 fue diferente de la de los varones (35,2±6 frente a 19,2±2μmol/min/g; p<0,01, y 47,4±8 frente a 81,1±9μmol/min/g; p<0,05, respectivamente). A pesar del pequeño número, se compararon las 5 mujeres que tenían el patrón desviado de la curva de isoenzimas con el resto de las mujeres con patrón normal, y se observó que igualmente tenían cantidades de LDH3 y LDH5 diferentes: aquéllas con curva desviada tenían mayor valor de LDH3 (46,7±11 frente a 23,6±2μmol/min/g; p<0,03) y menor concentración de LDH5 (25,0±3 frente a 70,0±6μmol/min/g; p<0,01) que las mujeres con curva normal. Las mujeres con curva desviada mostraron tendencia a tener menor porcentaje de fibras IIX. Sin embargo, la M6M fue igual entre ellas.
Características antropométricas y funcionales en los pacientes con EPOC, según tuvieran la curva de isoenzimas de lactatodeshidrogenasa normal o desviada
| Variables | Curva normal (n =13) | Curva desviada (n=5) | p |
| Varón/mujer | 8/5 | 0/5 | |
| Edad (años) | 62±3 | 62±2 | NS |
| Peso (kg) | 60±4 | 53±5 | NS |
| Talla (cm) | 160±12 | 147±5 | <0,05 |
| IMC (kg/m2) | 23,9±2,0 | 24,3±1,8 | NS |
| FVC (%) | 73±4 | 75±11 | NS |
| FEV1 (%) | 45±4 | 49±8 | NS |
| FEV1/FVC (%) | 45±2 | 52±3 | NS |
| SaO2 (%) | 96±0,3 | 89±3 | <0,05 |
| M6M (m) | 557±55 | 405±25 | <0,05 |
| M6M (%)* | 109±7 | 83±9 | <0,05 |
Valores expresados como media±error estándar.
FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IMC: índice de masa corporal; M6M: distancia recorrida en la marcha de 6min; NS: no significativo; SaO2: saturación de oxígeno en reposo.
Características antropométricas y funcionales en los pacientes con EPOC según el sexo
| Variables | Mujeres (n=10) | Varones (n=8) | p |
| Edad (años) | 61±2 | 63±4 | NS |
| Peso (kg) | 53±3 | 65±6 | <0,06, NS |
| Talla (cm) | 147±2 | 168±3 | <0,0001 |
| IMC (kg/m2) | 23,0±1,3 | 25,4±3,1 | NS |
| FVC (%) | 73±4 | 75±1 | NS |
| FEV1 (%) | 45±4 | 49±1 | NS |
| FEV1/FVC (%) | 45±2 | 52±3 | NS |
| SaO2 (%) | 90±3 | 96±0,4 | NS |
| M6M (%)* | 85±7 | 111±7 | <0,05 |
Valores expresados como media±error estándar.
FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IMC: índice de masa corporal; M6M: distancia recorrida en la marcha de 6min; NS: no significativo; SaO2: saturación de oxígeno en reposo.
En los pacientes, la M6M guardó una relación directa con la concentración de la isoenzima LDH5 (r=0,70; p<0,02) e inversa con el valor de la LDH3 (r=−0,63; p<0,05). La SaO2 en reposo mostró una relación inversa con la proporción de las isoenzimas LDH1, LDH2 y LDH3 (r=−0,61 y p<0,05; r=−0,64 y p<0,05; r=−0,68 y p<0,05, respectivamente) y directa con la LDH5 (r=0,66; p<0,05). La concentración de LDH5 también se encontró directamente relacionada con la SaO2 en reposo (r=0,84; p<0,002).
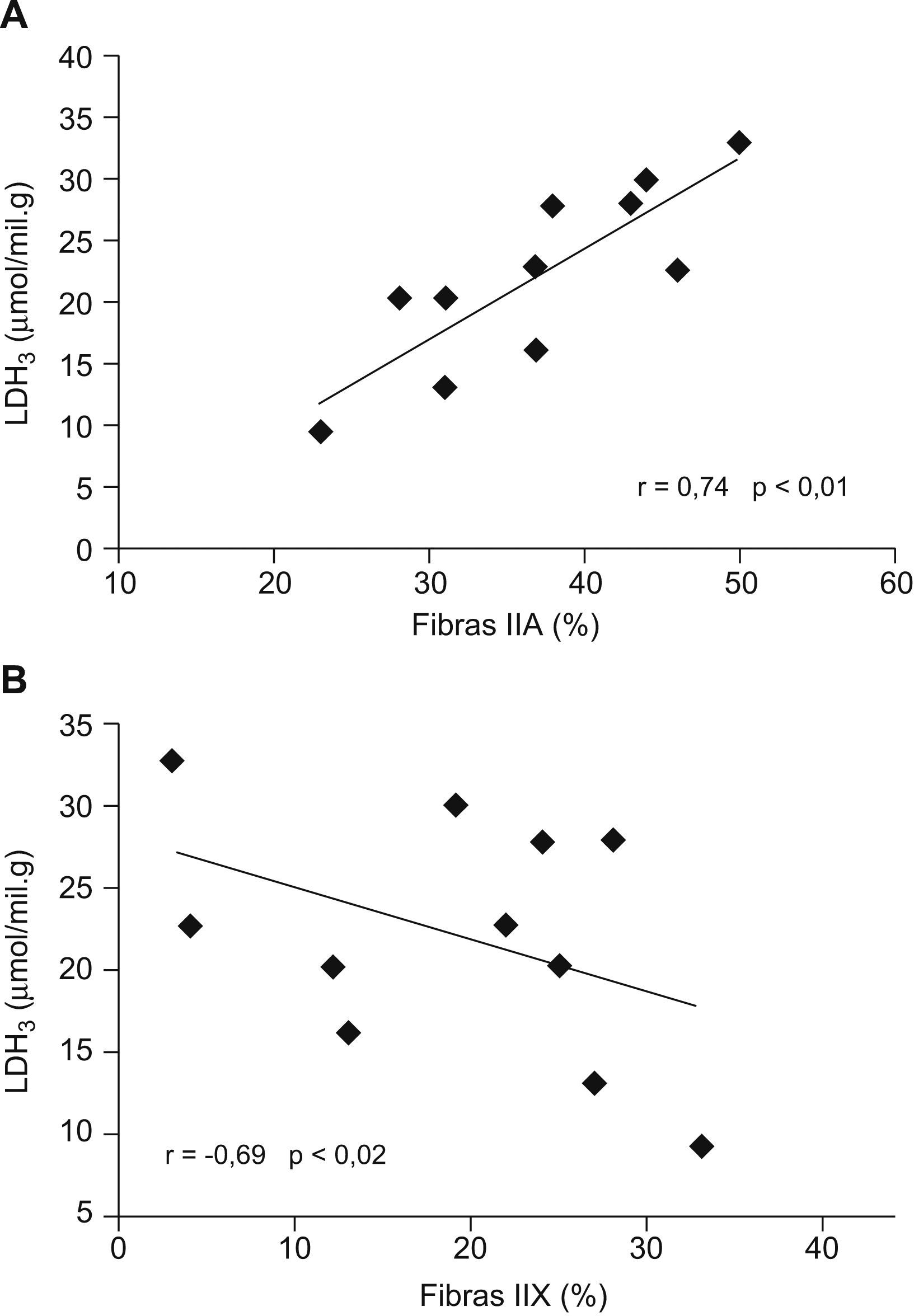
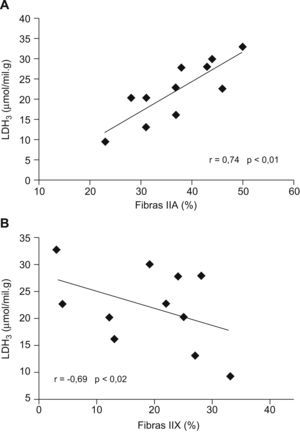
En la figura 4 se muestran las correlaciones entre los porcentajes de los tipos de fibras musculares y la concentración de la isoenzima LDH3 en los pacientes con EPOC. La proporción de fibras tipo IIA tuvo una correlación significativa directa con los valores de las isoenzimas LDH3 (fig. 4A) y LDH4 (esta última no se muestra; r=0,65; p<0,03), y el porcentaje de fibras IIX tuvo una correlación significativa inversa con el valor de LDH3 (fig. 4B). Asimismo se encontró una correlación inversa entre la proporción de fibras IIA y la proporción de la isoenzima LDH5 (r=−0,62; p<0,05), además de una tendencia a la relación directa entre el porcentaje de fibras IIX y la proporción de la isoenzima LDH5 (r=0,57; p<0,07).
A: correlación directa entre la proporción de fibras IIA y la concentración de la isoenzima de la lactatodeshidrogenasa (LDH) LDH3 en el músculo vasto lateral de pacientes con EPOC. B: correlación entre la proporción de fibras IIX y el valor de la isoenzima LDH3 en el músculo vasto lateral de pacientes con EPOC.
Según nuestro conocimiento, ésta es la primera medición de las isoenzimas de la LDH en el músculo esquelético de pacientes con EPOC. Los hallazgos más relevantes han sido: a) concentraciones semejantes de LDH total en pacientes y controles; b) valores y proporciones similares de las isoenzimas de la LDH en los pacientes con EPOC y en los controles; c) en este grupo particular de pacientes con EPOC no se han encontrado diferencias en los porcentajes de los tipos de fibras musculares esqueléticas al compararlo con el grupo control; d) un grupo de pacientes se diferenció del resto por presentar una menor proporción y valor de LDH5, con aumento de las formas cardíacas, subgrupo que se caracterizó por ser de sexo femenino y tener menor SaO2 en reposo que los pacientes con curva normal, y e) las mujeres han presentado concentraciones mayores de isoenzima LDH3 y menores de LDH5 que los varones.
En el presente estudio las concentraciones de LDH fueron similares entre pacientes con EPOC y controles, lo que coincide con los hallazgos comunicados en pacientes con EPOC de ligera a moderada intensidad (FEV1: 65±8%)7 o de FEV1 similar al grupo estudiado por nosotros (40±9%)6. La tendencia a presentar valores más altos de LDH se ha descrito en pacientes con EPOC de mayor gravedad (FEV1: 25%)4. Estos resultados podrían indicar un incremento de los valores de LDH total en el músculo periférico a medida que progresa la gravedad de la enfermedad.
La distribución de los tipos de fibras no mostró diferencias entre los pacientes con EPOC y los controles, lo que difiere de lo publicado acerca de esta enfermedad, en la que se ha descrito un aumento de la proporción de fibras de tipo II3,19,20. Esto quizá pueda deberse a que la obstrucción al flujo aéreo de los pacientes aquí estudiados (FEV1: 46±15%) no era tan intensa como la de la muestra de otros estudios, en los que el FEV1 era del 37±11%19 y del 32±9%20. En los pacientes con EPOC se ha descrito un proceso de transformación de las fibras en el sentido del tipo I hacia el IIX21. Es posible que en los pacientes con EPOC moderada esta transformación no haya alcanzado un alto grado. Por otra parte, en el grupo control estudiado en el presente trabajo, quizá debido al reducido número de sujetos, la proporción de fibras IIX fue mayor que la que normalmente se encuentra en sujetos controles. El hecho de no haber encontrado diferencias en la proporción de los tipos de fibras entre pacientes y controles está en concordancia con la similitud de la concentración de la LDH y de las isoenzimas en ambos grupos.
Llama la atención que se haya encontrado una correlación inversa entre las proporciones de las fibras IIA y la isoenzima LDH5, relación que se invierte con el valor de las isoenzimas LDH4 y LDH3, lo que induce a pensar que, a medida que aumentan las fibras con mayor capacidad glucolítica, la LDH se desplaza hacia formas con predominio del polipéptido muscular. Se ha descrito que la subunidad M de la LDH predomina en las fibras tipo II22,23. No hemos encontrado en la literatura médica estudios previos que hayan analizado la distribución de isoenzimas de la LDH en los tipos de fibras IIA y IIX. En cuanto a la relación entre el porcentaje de las fibras tipo I y las isoenzimas con predominio de la subunidad H, que es lo que se ha descrito en personas sanas22,23, no la hemos encontrado en los pacientes con EPOC.
En ratones sometidos a hipoxia ligera, la proporción de las isoenzimas de LDH se ha encontrado desplazada hacia las formas LDH1 y LDH2 en varios tejidos, mientras que la LDH5 estuvo disminuida24. Además, en ratas sometidas a hipoxia hipobárica producida por la altura, el gen de la LDH muscular no mostró regulación al alza25. Los hallazgos del presente estudio indican que en el grupo de pacientes que tuvieron la curva de isoenzimas desviada es posible que la hipoxia, manifestada por una SaO2 menor, se relacione con el aumento de la proporción de las isoenzimas LDH1, LDH2 y LDH3, como parece indicarlo la correlación encontrada entre estos parámetros. Es atractivo pensar que la desviación de la curva hacia las isoformas H podría permitir que la LDH funcione en la dirección lactato-piruvato, lo que favorecería la captación del lactato y su oxidación. En un estudio sobre la captación y la liberación de lactato marcado con carbono-14 realizado en conejos26, se encontró que la liberación neta de lactato era mayor en el músculo con predominio de fibras tipo IIb, y mínima en la preparación formada mayoritariamente por fibras tipo I. La existencia de una lanzadera de lactato (lactate-shuttle) que conduzca, en condiciones oxidativas, a la formación de piruvato a partir de lactato sigue siendo objeto de discusión2,27; sin embargo, el desplazamiento de la distribución de LDH hacia las isoenzimas LDH1, LDH2 y LDH3 quizá sea una ventaja para los pacientes que lo presentan, bien por razones genéticas, bien porque sea el resultado de un mecanismo adaptativo para compensar la hipoxia, lo que eventualmente les permitiría hacer un mejor uso del lactato al revertir la reacción en el sentido lactato-piruvato.
Las mujeres presentaron cifras mayores de LDH3 y concentraciones menores de LDH5 que los varones, así como una mayor proporción de fibras IIA. Sin embargo, en el grupo con curva desviada estas características se encontraban aún más acentuadas, ya sea por razones genéticas o adaptativas.
En conclusión, los pacientes con EPOC presentaron concentraciones y proporciones de las isoenzimas de LDH similares a los controles. Sin embargo, un subgrupo de los pacientes mostró una disminución tanto de la proporción como de las concentraciones de la LDH5, con aumento de las LDH1, LDH2 y LDH3, coincidiendo con un aumento de la proporción de las fibras musculares de tipo IIA. Es posible que este cambio tenga relación con un estado de hipoxia moderada, más acusado en este subgrupo de pacientes, y eventualmente podría representar una forma de adaptación que permita un menor grado de conversión hacia el metabolismo anaeróbico.