Además de la fibrosis pulmonar idiopática (FPI), otras enfermedades pulmonares intersticiales difusas (EPID) desarrollan fibrosis pulmonar, lo cual ocurre en una proporción variable en función de la entidad. Este componente fibrótico puede progresar a pesar de las medidas terapéuticas adoptadas, lo que se conoce como fibrosis pulmonar progresiva (FPP). En este contexto, la FPP no es una entidad per se sino una condición clínica o comportamiento común que pueden desarrollar diferentes EPID fibrosantes, la cual compromete el pronóstico del paciente. La FPP se identifica por criterios de empeoramiento clínico, fisiológico y/o radiológico durante el seguimiento del paciente. Ensayos clínicos aleatorizados en pacientes con FPI o EPID no-FPI progresiva han demostrado que el tratamiento con medicamentos anti-fibróticos, sea nintedanib o pirfenidona, enlentece su progresión. Actualmente, se abre una nueva era en el manejo clínico de este subgrupo de pacientes y una ventana de oportunidad para investigar incógnitas aún existentes.
In addition to idiopathic pulmonary fibrosis (IPF), other diffuse interstitial lung diseases (ILD) are also associated with pulmonary fibrosis and occur in a variable proportion of patients, depending on the entity. The name given to this fibrotic component, that may progress despite treatment, is progressive pulmonary fibrosis (PPF). In this context, PPF is not an entity per se but a common clinical condition or behavior that may occur in association with different types of fibrosing diffuse ILDs, compromising patient prognosis. PPF is identified from worsening clinical, physiological, and/or radiological criteria during patient follow-up. Randomized clinical trials in patients with IPF or progressive non-IPF ILD have shown that treatment with antifibrotic drugs, either nintedanib or pirfenidone, slows progression. We are seeing the start of a new era in the clinical management of this subgroup of patients, offering the perfect opportunity for exploring still uncharted territories.
La fibrosis pulmonar es la consecuencia de la acumulación descontrolada de matriz extracelular en el parénquima pulmonar que dificulta el intercambio de gases1–6. Cuando esta alteración afecta progresivamente a más unidades alvéolo-intersticiales, el pulmón pierde su estructura y función, lo que lleva a insuficiencia respiratoria y muerte1. El componente fibrótico está siempre presente en la fibrosis pulmonar idiopática (FPI), enfermedad provocada por una respuesta epitelial aberrante, pero aparece en una proporción variable en otras enfermedades pulmonares intersticiales difusas (EPID) como consecuencia de la falta de control de la respuesta inflamatoria exagerada durante el desarrollo de la enfermedad7. La existencia del componente fibrótico pulmonar se puede sospechar al identificar ciertas características clínicas y funcionales, signos radiológicos y/o histológicos específicos5–12 (tabla 1). Ante un paciente con EPID fibrótica las principales opciones diagnósticas son, además de la FPI: 1) neumonitis por hipersensibilidad fibrótica (NHf), 2) EPID fibrótica asociada a enfermedad autoinmune sistémica (EAS), principalmente artritis reumatoide y esclerosis sistémica; 3) EPID asociadas a la exposición de polvos inorgánicos (neumoconiosis), como la asbestosis; 4) neumonía intersticial no específica fibrótica (NINEf); 5) EPID no clasificable (EPIDnc)5–12. Aunque menos frecuentemente, otras EPID pueden presentar fibrosis pulmonar o evolucionar a ella (fig. 1). Para un diagnóstico de certeza y tratamiento óptimo inicial de cualquier EPID fibrótica, resulta indispensable la evaluación multidisciplinar con el análisis de los patrones radiológicos (± histológicos), y la evaluación rigurosa de causas o asociaciones mediante una anamnesis detallada y pruebas serológicas exhaustivas1. Si a pesar de ello la probabilidad o confianza diagnóstica no supera el 50% para una entidad específica, o no es posible realizar un diagnóstico provisional a través de las exploraciones necesarias por el estado clínico del paciente, el caso se cataloga como EPIDnc fibrótica, esto es, a una neumopatía intersticial difusa fibrótica que no se puede clasificar en ninguna entidad específica de acuerdo con las herramientas actuales utilizadas para el diagnóstico13.
Signos asociados a la existencia de fibrosis pulmonar
| Clínica | Crepitantes tipo velcro bibasalesAgregación familiar |
| PFRs | Disminución de la CVF y/o TLCRelación VEF1/CVF>0,8 (en ausencia de obesidad, alteración de caja torácica o enfermedad neuromuscular) |
| TCAR tórax | Reticulación o engrosamiento septal (no nodular)Bronquiolectasias traccionalesPanalizaciónReducción del volumen pulmonar (asociado a alguno de los signos previos) |
| Biopsia pulmonar | Depósito de colágenaMicropanalizaciónFocos fibroblásticos |
Los signos clínicos que alertan sobre la posible existencia de fibrosis pulmonar o EPID fibrosante ante un paciente con disnea de esfuerzo progresiva y patrón intersticial en la radiografía de tórax son la existencia de otros familiares afectos de fibrosis pulmonar (agregación familiar), la auscultación de crepitantes secos tipo velcro, deterioro de la CVF, TLC o ambas, así como coeficiente VEF1/CVF>0.8 (en ausencia de otras causas que puedan alterar estas variables como obesidad, malformaciones de caja torácica, engrosamiento pleural o enfermedades neuromusculares). Una vez se realiza la tomografía computarizada de alta resolución (TCAR) de tórax, la observación de engrosamiento septal, bronquiectasias de tracción, bronquioloectasias o panalización, lo que se suele asociar con reducción del volumen pulmonar. Entre estos signos, la panalización ha demostrado ser un cambio radiológico irreversible. Aunque las imágenes de la TCAR tórax son altamente sensibles, el engrosamiento de septos y las bronquiectasias traccionales se pueden observar en procesos inflamatorios. En casos en los que esté indicado y sea posible realizar biopsia pulmonar, la observación de desestructuración del parénquima con depósito de colágena define la existencia de fibrosis, y en algunos casos se puede observar micropanalización y focos fibroblásticos. La histología confirma la existencia de fibrosis pulmonar.
CVF: capacidad vital forzada; PFRs: pruebas funcionales respiratorias; TCAR: tomografía computarizada de alta resolución; TLC: capacidad pulmonar total; VEF1: volumen espiratorio forzado en un segundo.
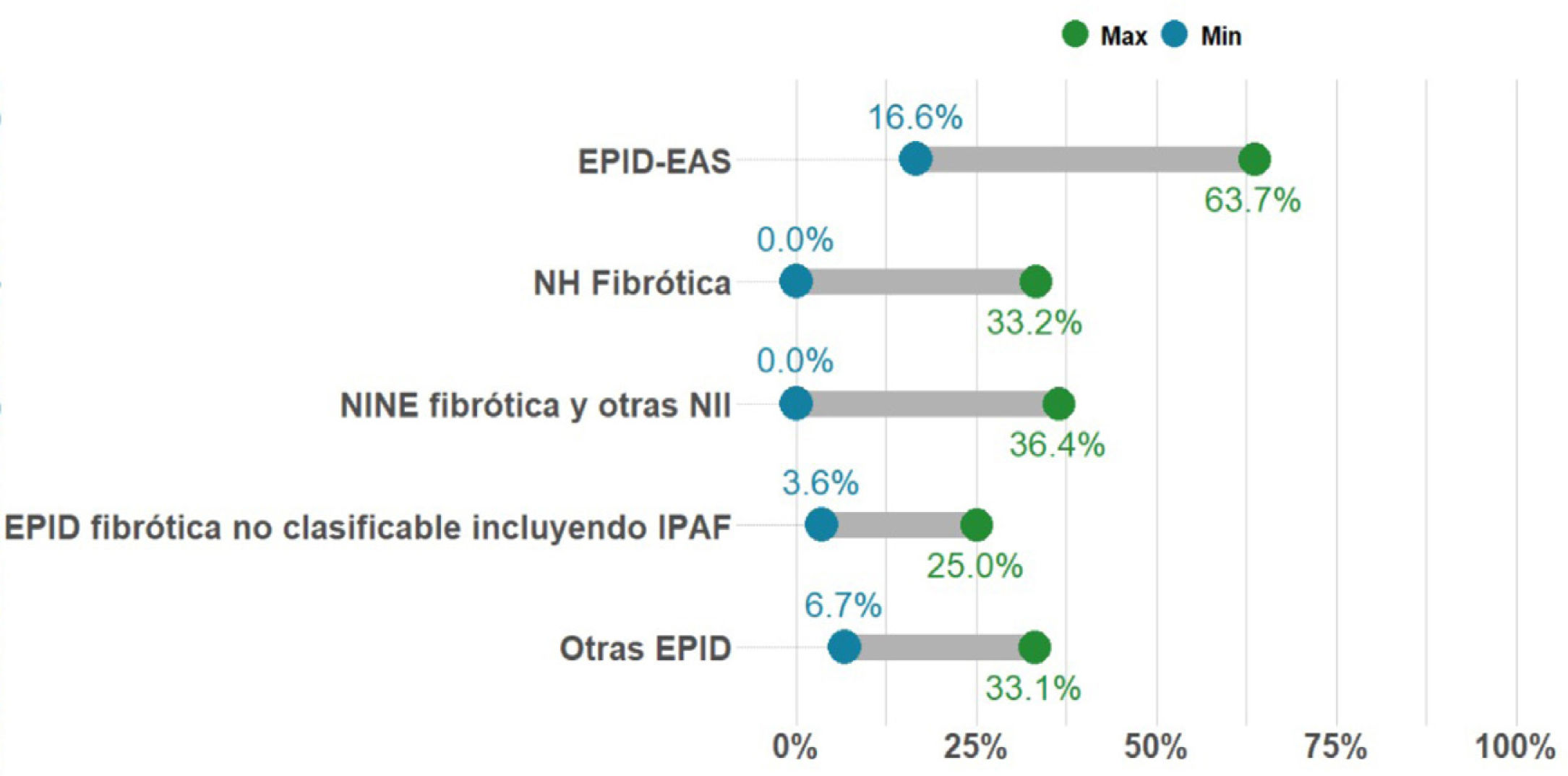
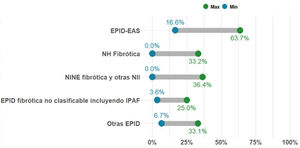
Porcentaje de casos con EPID no-FPI que presentan fibrosis pulmonar progresiva. La proporción de pacientes con EPID fibrótica en una unidad multidisciplinar EPID es variable. Sin embargo, la entidad más frecuente es la fibrosis pulmonar idiopática (FPI), que és además siempre progresiva por naturaleza. En la presente gráfica se resume el rango de los porcentajes publicado hasta la actualidad en pacientes con diferentes tipos de EPID fibrótica no-FPI que progresan, entre las que se encuentra la neumonitis por hipersensibilidad fibrosante o crónica (NHf), las formas fibróticas de EPID asociada a enfermedad autoinmune sistémica (EPID-EAS), la neumonía intersticial no específica idiopática fibrosante (NINEf) y la EPID no clasificable. En el grupo de otras EPID que presentan fibrosis pulmonar progresiva destacan neumoconiosis (incluido asbestosis), sarcoidosis fibrosante, fibrosis pulmonar asociada a tabaco, y fibroelastosis pleuropulmonar. Otras entidades que pueden presentar esta característica, pero con menor frecuencia son neumonía organizativa criptogénica (NOC), neumonía intersticial aguda (NIA), neumonía intersticial inducida por fármacos o tras infección respiratoria (incluyendo COVID-19), o formas fibróticas de histiocitosis pulmonar de células de Langerhans (HPCL). Finalmente, las EPID monogénicas o hereditarias, todas ellas ultra-raras, pueden comenzar con fibrosis pulmonar entre los 20-50 años, progresar, y frecuentemente asociar alteraciones en otros órganos o sistemas.
Gracias a los avances en el estudio genético de las últimas 2 décadas se han identificado variantes genéticas que incrementan el riesgo o que, incluso por sí solas, pueden causar el desarrollo de fibrosis pulmonar (entre otras afectaciones orgánicas o tisulares) y que pueden heredarse, por lo que con frecuencia se presentan en un contexto familiar14. Entre ellas destacan el síndrome de Hermansky-Pudlak (albinismo y fibrosis pulmonar), síndromes teloméricos (disqueratosis congénita, enfermedades hematológicas y hepáticas, signos de envejecimiento prematuro, cáncer y fibrosis pulmonar), y aquellas provocadas por defectos del surfactante (enfermedad respiratoria en edad temprana, infecciones por déficit inmune, cáncer, proteinosis alveolar y fibrosis pulmonar).
Concepto 2: fibrosis pulmonar progresivaEn los últimos años se han utilizado diferentes términos para referirse a aquellos pacientes con EPID que presentan empeoramiento y progresión del componente fibrótico pulmonar; tales como EPID fibrótica progresiva, fenotipo fibrosante progresivo o fibrosis pulmonar progresiva (FPP). Consideramos que el término FPP sería el más apropiado ya que, de forma directa y simple, engloba la definición completa de esta condición, sin entrar en las posibles discrepancias científicas que el término «fenotipo» puede asociar. La FPP es una característica clínica evolutiva común para diferentes tipos de EPID fibrótica, no es pues un diagnóstico o entidad clínica per se5–14. Engloba a pacientes con FPI, el prototipo de FPP, pero también otras EPID fibróticas no-FPI que progresan a pesar del tratamiento instaurado en función del origen. El porcentaje de pacientes que presentan FPP para cada EPID fibrótica se desconoce, pero recientes estudios basados en estimaciones reportan gran variabilidad (2,2-28%), siendo más frecuente en EPIDnc fibrótica y menos común en sarcoidosis fibrosante7,12 (fig. 1). En la práctica clínica, nos referiremos a pacientes que presentan una EPID determinada que cumple criterios de FPP (p. ej.; paciente con NHf que cumple criterios de fibrosis pulmonar progresiva).
La FPI es progresiva e irreversible por naturaleza, con una supervivencia media estimada de 4-5 años desde el diagnóstico1. Tras más de 3 décadas de investigación traslacional, ha habido grandes avances en el conocimiento y manejo de esta enfermedad entre los que destacan1–4:
- 1)
Identificación de mecanismos fibrogénicos susceptibles de ser regulados in vitro e in vivo, y desarrollo de nuevos fármacos que actúan sobre estos mecanismos patogénicos para inhibir la fibrosis2. Actualmente existen 2 fármacos anti-fibróticos indicados y aprobados para estos pacientes, nintedanib y pirfenidona, los cuales demostraron beneficio en ensayos clínicos controlados1.
- 2)
Mejoras en el manejo clínico, incluyendo diagnóstico de certeza, identificación de factores de mal pronóstico, optimización del seguimiento y tratamiento integral1.
La FPP en EPID no-FPI comparte rasgos clínicos, pronósticos e incluso patogénicos con la FPI, por lo que muchos de los avances conseguidos en FPI se han aplicado a la FPP no-FPI9–13. De esta forma, los criterios de progresión de la fibrosis pulmonar, inicialmente evaluados y establecidos para FPI (descenso de la capacidad vital forzada [CVF] y difusión pulmonar de monóxido de carbono [DLCO], incremento de los signos fibróticos en la TCAR de tórax) también se han utilizado desde hace años en la práctica clínica para identificar progresión en otras EPID no-FPI5,6,8. La disminución de la CVF es un criterio de progresión y predictor de mortalidad validado en FPI y en otras EPID fibróticas, como la NHf10 y EPID fibrótica asociada a artritis reumatoide o esclerosis sistémica11.
Un estudio que comparó la evolución de pacientes en la rama placebo de los ensayos clínicos INPULSIS (pacientes con FPI) e INBUILD (pacientes con EPID fibróticas no-FPI en progresión) demostró que la tasa de caída anual de la CVF era muy similar (−221,0ml/año y−192,9ml/año, respectivamente; p=0,19), así como la proporción de pacientes que presentó deterioro >10 o >5% de la CVF a los 12 meses11. En este contexto, entidades como la NHf, EPID-EAS, la NINEf, entre otras, con potencial para mejorar o estabilizarse con el manejo apropiado, pueden presentar FPP a pesar del tratamiento anti-inflamatorio, inmunosupresor o eliminación del agente causal5–10 (fig. 1). La mitad de los pacientes con FPP incluidos en el ensayo clínico INBUILD presentaban NHf o FP-EAS.
La progresión de la fibrosis pulmonar o FPP puede evidenciarse en cualquier momento; puede observarse desde el diagnóstico, o bien el paciente puede presentar un curso estable o con cierta mejoría, y meses o años más tarde presentar progresión.
Aunque los criterios definitorios son motivo de debate en estos momentos y requerirán un consenso internacional, en términos generales la FPP se identifica cuando el paciente presenta como mínimo 2 de los siguientes cambios:
- 1)
Empeoramiento de los síntomas respiratorios (tos/disnea), sin otra causa o disfunción añadida.
- 2)
Disminución del 5-10% en la capacidad vital forzada (CVF, % absoluto) y/o disminución de ≥10% en la difusión pulmonar de monóxido de carbono (DLCO, % absoluto).
- 3)
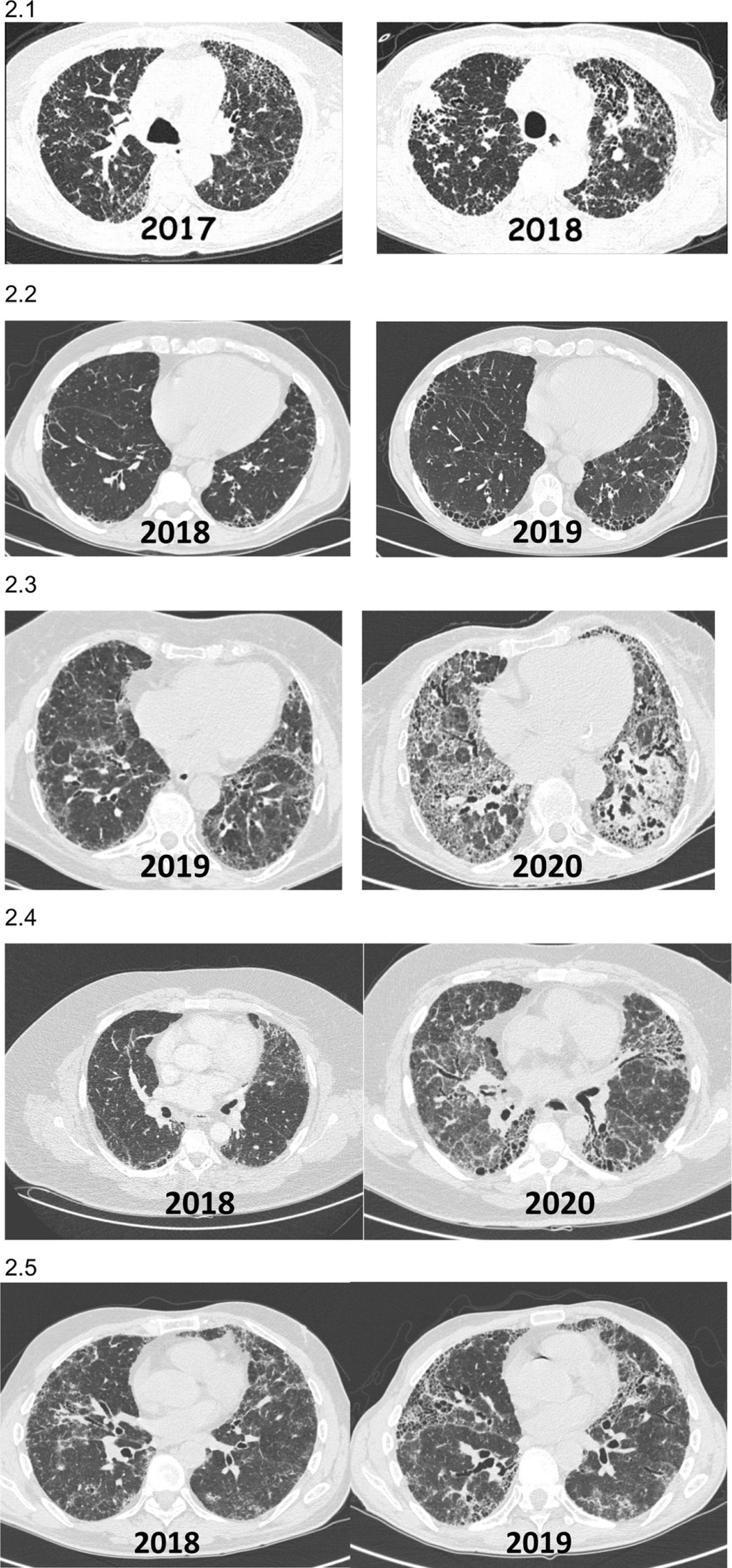
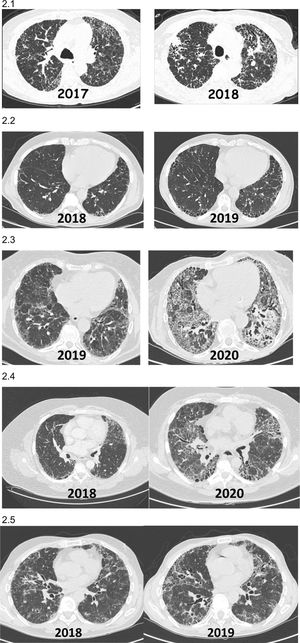
Incremento de las imágenes radiológicas fibrosantes y/o aparición de imágenes que previamente no existían (fig. 2).
Figura 2.Ejemplos radiológicos (TCAR tórax) de pacientes con EPID fibrótica no-FPI que presentan FPP durante el evolutivo clínico. 2.1) Paciente con neumonitis por hipersensibilidad diagnosticada en el 2017 que mostró al año una importante progresión de sus lesiones tomográficas y reducción funcional pulmonar. 2.2) Paciente con artritis reumatoidea asociado a EPID fibrótica (NIU) diagnosticada en el 2018 con progresión de la fibrosis en las tomografías al año, con incremento de síntomas respiratorios a pesar de encontrarse en remisión articular con metotrexate+abatacept. 2.3) Paciente con síndrome de Sjögren asociado a EPID fibrótica diagnosticada en el 2019 con progresión de las lesiones en la tomografía y disminución de función respiratoria al año a pesar de micofenolato mofetil+prednisona. 2.4) Paciente con fibrosis pulmonar secundaria a EPID no clasificable que presenta progresión de la fibrosis a los 24 meses del diagnóstico 2.5) Paciente con neumonitis por hipersensibilidad crónica fibrosante que empeora clínica y radiológicamente a pesar de evitar exposición, tratamiento corticoideo y micofenolato, tras 12 meses del diagnóstico.
(0.78MB).
El período de seguimiento en el que estos cambios deben objetivarse para determinar FPP no está claramente establecido, y puede ser variable. En la mayoría de los casos el empeoramiento se consigna a los 6-12 meses, pero se debe resaltar que antes de este periodo puede existir progresión fibrótica. Lo importante es identificar este evento lo antes posible.
Mecanismos patogénicos de la fibrosis pulmonar progresivaLos mecanismos celulares y moleculares involucrados en la progresión de la fibrosis pulmonar siguen siendo motivo de investigación. Independientemente del origen o causa de la fibrosis pulmonar, una vez se establece y progresa, este fenómeno se retroalimenta y puede avanzar a pesar de atacar o evitar los factores inductores15,16. Existen varios factores de riesgo ambientales y del huésped que podrían tener un papel relevante17–30. Estudios iniciales sugieren que los niveles de contaminación del aire podrían contribuir en la progresión de estas enfermedades, aunque sigue sin conocerse a través de qué mecanismo36. Entre los factores intrínsecos al paciente destacan las alteraciones genéticas y los mecanismos asociados al envejecimiento acelerado17,19–29. El envejecimiento es un proceso biológico complejo caracterizado por múltiples alteraciones incluyendo inestabilidad genómica, senescencia celular, acortamiento de los telómeros, disfunción mitocondrial y reprogramación epigenética entre otras19. Varios de estos mecanismos han sido descritos en diferentes EPID fibróticas y se asocian a progresión de fibrosis2,20,21. Un reciente estudio experimental ha demostrado que la senescencia de células epiteliales alveolares tipo II es suficiente para iniciar FPP con alteraciones patológicas similares a la neumonía intersticial usual (NIU)22. El desarrollo de senescencia también se ha descrito en fibroblastos, lo que podría contribuir en la resistencia de estas células a la apoptosis y en otras características pro-fibróticas23,24. A través de una novedosa técnica de secuenciación de RNA en células individuales (single-cell RNA seq) se ha demostrado que en FPP aparecen subpoblaciones activadas de células epiteliales, fibroblastos y macrófagos con perfil profibrótico que podrían favorecer el punto de «no retorno» y la progresión irreversible en estas enfermedades25–27. Finalmente, numerosos estudios han demostrado que la rigidez de la matriz extracelular acumulada en los sitios de lesión desempeña un papel crítico en la progresión28,29. Esta matriz rígida, estimula la actividad de los fibroblastos a través de retroalimentación positiva incluyendo la activación y liberación de TGFβ, el cual, a su vez, activa varias vías de señalización, estimulando la expresión de genes pro-fibróticos, resultando un circuito profibrótico progresivo28–30.
Manejo de la fibrosis pulmonar progresivaFactores de riesgoIdentificar factores predictivos de FPP sigue siendo objeto de intensa investigación. En el momento del diagnóstico de la EPID no existen características que permitan identificar con precisión quién va a presentar FPP. Sin embargo, existen algunos rasgos clínicos y biológicos que se han asociado a un incremento de riesgo de progresión como son el tabaquismo activo, la presencia de un patrón de NIU radiológico o histológico, así como la existencia de agregación familiar en la historia clínica o la disfunción telomérica17,31–42.
El patrón de NIU consistente engloba la presencia de engrosamiento reticular de distribución subpleural, bronquiectasias de tracción y panalización, con mayor predominio en los lóbulos inferiores y escaso o ausente vidrio deslustrado1. Este patrón radiológico es característico en FPI, pero también se puede identificar en otras EPID fibróticas1. En casos con artritis reumatoide se ha demostrado que los pacientes que presentan NIU tienen más probabilidad de progresión y muerte31,32. Un estudio reciente que evaluó 1.330 pacientes con EPID fibrótica de diferente etiología, incluyendo NHf, EPID-EAS, FPI y EPIDnc, demostró que la existencia de panalización, presente en el 42,0, 41,9, 37,6 y 28,6%, respectivamente, se asociaba mayor mortalidad33. Por otro lado, hace algunos años se sugirió que la abundancia de focos fibroblásticos en la biopsia pulmonar, que son característicos en la NIU, pero también se pueden identificar en otros patrones histológicos como la NHf, podría ser un factor pronóstico34. Sin embargo, este hallazgo no ha sido rigurosamente confirmado35.
Se entiende como agregación familiar o fibrosis pulmonar familiar la existencia de 2 o más pacientes con fibrosis pulmonar en la misma familia, lo que se asocia con mayor probabilidad de alteraciones genéticas, disfunción telomérica y posibilidad de herencia de la enfermedad36. Los telómeros son complejos nucleoprotéicos localizados en los extremos cromosómicos que se acortan con cada división celular y su acortamiento progresivo se asocia con procesos de envejecimiento36–40. El acortamiento telomérico acelerado o prematuro contribuye al desarrollo de enfermedades degenerativas como la FPI36–38. Una reducción severa de la longitud telomérica se correlaciona con peor pronóstico en FPI, pero también en EPID no clasificable con rasgos autoinmunes (IPAF), EPID-EAS y NHf36–42. Además, la presencia de mutaciones en genes de telomerasa en pacientes con diferentes EPID fibróticas se correlaciona con un incremento de la mortalidad independiente de la etiología de la enfermedad de base38. En este contexto, un estudio reciente ha demostrado que pacientes con EPID fibrótica no-FPI y agregación familiar presentan una supervivencia similar a los pacientes con FPI, la cual es significativamente peor que en casos con EPID fibrótica no-FPI esporádicos17.
Biomarcadores séricos en fibrosis pulmonar progresivaActualmente solo somos capaces de identificar FPP durante el seguimiento, de forma que hay que esperar meses para diagnosticar la existencia de progresión de la enfermedad con la realización y comparación de las exploraciones funcionales y radiológicas pertinentes5. En este contexto, urge contar con biomarcadores que permitan reconocer que el paciente empeora de su fibrosis pulmonar justo en el momento que esto ocurre o, incluso, predecir aquellos casos con mayor riesgo al diagnóstico30. Datos analizados de cohortes de pacientes con FPP, la mayoría retrospectivas, con un número limitado de pacientes y sin validación amplia, han sugerido algunos marcadores séricos que podrían ser de ayuda para identificar pacientes con EPID fibrótica no-FPI con mayor riesgo de progresión (tabla 2)43–50. Un estudio reciente objetivó que los niveles séricos de Krebs von den Lungen-6 (KL-6), una glicoproteína localizada en las células del epitelio alveolar, se encuentran significativamente elevados en pacientes con diferentes EPID fibrosantes que presentan FPP y sugirió que un valor basal de KL-6≥800U/ml podría ser un indicador de riesgo independiente47. Otro estudio que evaluó pacientes con EPID asociada a esclerodermia también mostró mayor progresión funcional respiratoria en pacientes con valores elevados de KL-648. Por otro lado, niveles séricos de glicoproteína 4 del epidídimo (HE4) por encima de 238pmol/l se han asociado mayor mortalidad49. Asimismo, se han identificado niveles séricos bajos del receptor soluble de los productos finales de glicación (sRAGE) en NHf y FPI, lo que asocia mayor lesión epitelial alveolar y mayor progresión50.
Marcadores séricos evaluados que han demostrado alguna asociación con variables de progresión de fibrosis pulmonar
| Biomarcadores séricos | EPID evaluada | |
|---|---|---|
| Disfunción epitelial | KL-6 | NINE, NHf, EPID-EAS |
| SP-A, SP-D, YKL-40 | EPID-EAS | |
| sRAGE | NHf | |
| Remodelación MEC | MMP-7, periostina | NHf, NINEf |
| MMP-12, TIMP-1, CCL16, tenascina-C, PLAUR | Esclerodermia | |
| CA19-9, CA125, VCAM1 | EPID-EAS, NH, sarcoidosis | |
| Disregulación respuesta inmune | S100A9 | NINE |
| CCL2, CCL18, CXCL4, CXCL10, CX3CL1, IL6, IL2, PCR | Esclerodermia | |
| CXCL13 | EPID-EAS, NHf | |
| Anti-MX1 | NINE | |
| Chitotriosidasa | Sarcoidosis | |
| Glicoproteína | ||
| Miscelánea | HE4 | FPP |
CA19.9 y CA125: marcadores tumorales inespecíficos; CCL: ligando de chemoquina; CXCL: ligando de chemoquina CXC; EPID: enfermedad pulmonar intersticial difusa; FP-EAS: fibrosis pulmonar asociada a enfermedad autoinmune sistémica; FPP: fibrosis pulmonar progresiva; HE4: glicoproteína 4 del epidídimo; IL: interleucina; KL-6: Krebs von den Lungen-6; MEC: matriz extracelular; MMP: metaloproteinasa; MX1: Myxovirus 1; NHf: neumonitis por hipersensibilidad fibrosante; NINE: neumonía intersticial no específica; PCR: proteína C reactiva; PLAUR: receptor soluble del activador del plasminógeno uroquinasa; SP-A y SP-D: proteína del surfactante-A y D; sRAGE: receptor soluble de los productos finales de glicación; S100A9: proteína A9 de unión al calcio S100; TIMP: inhibidor tisular de MMP; VCAM1: proteína 1 de adhesión celular vascular; YKL-40: proteína 1 similar a la chitinasa-3.
Sin embargo, actualmente sigue sin existir un biomarcador sérico para el que se haya aprobado su uso clínico en FPP. Las actuales iniciativas y estudios multicéntricos internacionales en marcha darán robustez y validación a biomarcadores séricos que permitan identificar tempranamente o incluso predecir progresión biológica de la fibrosis pulmonar antes de observar progresión funcional o radiológica.
Tratamiento farmacológicoEl manejo de la FPP representa un desafío clínico al ser la principal causa de muerte en estos pacientes. Es importante señalar que el tratamiento debe abordar a los pacientes de forma integral, teniendo en cuenta diferentes factores asociados al pronóstico (comorbilidades, estado físico y mental, vacunación y medidas de protección frente a infecciones respiratorias), así como las necesidades nutricionales y sociales, además del tratamiento farmacológico dirigido específicamente al proceso fibrótico2,6. Hasta la pasada década, la FPI no tenía tratamiento farmacológico2. El ensayo clínico PANTHER había confirmado que la terapia empírica con corticosteroides a dosis elevadas e inmunosupresores, utilizados previamente y durante años, no solo no era beneficioso, sino que además asociaba mayor morbimortalidad51. Por otro lado, 2 fármacos anti-fibróticos, pirfenidona y nintedanib, demostraron frenar significativamente el deterioro de la CVF a los 12 meses a través de ensayos clínicos y metaanálisis, y obtuvieron la indicación para esta enfermedad52,53. Nintedanib es un potente inhibidor tirosin-cinasa que reduce la síntesis de mediadores profibróticos como el factor de crecimiento fibroblástico (FGF), el derivado de plaquetas (PDGF) y el vascular endotelial (VEGF). Pirfenidona inhibe la producción de colágena y factores de crecimiento pro-fibróticos como el transformador-beta (TGF-beta) y el PDGF52,53.
Posteriormente, se investigó la eficacia y seguridad de estos fármacos en pacientes con EPID fibrótica no-FPI que presentaban progresión a pesar de las medidas terapéuticas previamente adoptadas de acuerdo a la etiología del padecimiento. En este contexto, el ensayo clínico fase III INBUILD, randomizado (1:1), doble ciego, con nintedanib 150mg/12h, evaluó 663 pacientes con EPID fibrótica no-FPI, de diferentes continentes y etnias, que habían progresado en cualquier momento dentro de los 24 meses anteriores a la inclusión54. Los pacientes fueron estratificados en función de la existencia de patrón NIU radiológico. Nintedanib demostró una disminución significativa de la progresión a los 12 meses, de acuerdo a la tasa anual de reducción de la CVF, tanto en la población global (−80,8ml con nintedanib versus−187,8ml con placebo) como en el subgrupo con NIU radiológica (−82,9ml con nintedanib versus−211,1ml con placebo). Posteriores análisis post hoc de los resultados en función del tipo de EPID diagnosticada, observaron que este enlentecimiento de la progresión. aunque variable, era independiente del tipo de EPID fibrótica evaluada55. Por otro lado, la eficacia y la seguridad de pirfenidona ha sido también investigada en EPID fibrótica no-FPI progresiva56,57. Un ensayo clínico fase II randomizado, que incluyó 253 pacientes con EPID no clasificable progresiva, evaluó el efecto de pirfenidona a los 6 meses56. Aunque el objetivo principal, cambio de la CVF (ml) medida a través de un espirómetro domiciliario, no mostró diferencias significativas, tanto el deterioro de la CVF% como de la DLCO% medidos en el hospital (objetivos secundarios) sí fueron significativamente menores en el grupo que recibió pirfenidona56. Por otro lado, aunque el ensayo clínico randomizado fase IIb RELIEF finalizó precozmente, finalmente evaluó 127 pacientes con NHf, FP-EAS, asbestosis o NINEf que cumplían criterios de FPP, y mostró menor deterioro de la CVF en el grupo que recibió pirfenidona (p=0,043), y este efecto se mantuvo en cada una de las EPID analizadas57. Por lo tanto, en FPP, tanto FPI como EPID fibrótica no-FPI, el tratamiento anti-fibrótico reduce su progresión. En cuanto al manejo farmacológico de comorbilidades, un porcentaje no despreciable de pacientes con FPP desarrollan hipertensión arterial pulmonar (HAP), lo que se asocia a disminución en la calidad de vida y mortalidad temprana58. En este contexto, un reciente ensayo clínico aleatorizado, incluyendo 326 pacientes con fibrosis pulmonar y HAP severa, evaluó el efecto de treprostinil inhalado (análogo de la prostaciclina)59. La inhalación de treprostinil durante 16 semanas mejoró la capacidad de ejercicio (metros caminados en el test de marcha de 6min), y disminuyó el riesgo de empeoramiento clínico y exacerbaciones59.
En la actualidad existen varios ensayos clínicos planeados o en curso con diferentes fármacos en combinación terapéutica para FPP (tabla 3)60.
Ensayos clínicos en curso o planeados para pacientes con fibrosis pulmonar progresiva
| Ensayo clínico (identificador) | Enfermedad | Medicamento en investigación | Objetivo primario |
|---|---|---|---|
| NCT02958917 | NH fibrótica | Pirfenidona | Cambio en la CVF en un año |
| PirFS-NCT03260556 | Sarcoidosis fibrótica | Pirfenidona | Cambio en la CVF en un año |
| NCT03820726 | Varias EPID | Nintedanib | Incidencia de efectos adversos (extensión de INBUILD) |
| NCT03385668 (PIRFENIVAS) | EPID asociada a anti-MPO | Pirfenidona | Cambio en la CVF en un año |
| NCT03856853 | EPID-SSc | Pirfenidona | Cambio en la CVF en un año |
| NCT03857854 | EPID-Dm | Pirfenidona | Cambio en la CVF en un año |
| NCT03313180 | EPID-SSc | Nintedanib | Incidencia de los efectos adversos |
| NCT02808871 (TRAIL 1) | EPID-AR | Pirfenidona | Cambio en la CVF o muerte |
| NCT03221257 (SLS III) | EPID-SSc | Pirfenidona y micofenolato | Cambio en la CVF en 18 meses |
| NCT04193592 (PEARL) | Hermansky-Pudlak | Pirfenidona | Reducción de la CVF>10% a 6 y 12 meses |
| NCT04325217 | EPID-SSc | Nintedanib | Incidencia de los efectos adversos |
| NCT04161014 (NiPPS) | Neumoconiosis | Nintedanib | Cambio en el VEF1 hasta 36 meses |
AR: artritis reumatoide; CVF: capacidad vital forzada; Dm: dermatomiositis; EPID: enfermedad pulmonar intersticial difusa; MPO: mieloperoxidasa; SSc: escleroderma; VEF1: volumen espiratorio forzado en un segundo.
La FPP es una característica o comportamiento evolutivo que puede ocurrir en diferentes EPID fibróticas, la cual se identifica durante el seguimiento del paciente con la evaluación de criterios respiratorios, clínicos, fisiológicos y radiológicos. Realizar el diagnóstico preciso de la etiología de la EPID fibrótica es fundamental para optimizar la aproximación terapéutica inicial. La identificación de FPP durante el seguimiento conlleva un abordaje anti-fibrótico con el objetivo de enlentecer la progresión (fases leves-moderadas) o proceder a trasplante pulmonar en casos avanzados cuando esta opción sea viable.