La experiencia europea en relación con el cribado de cáncer de pulmón con tomografía de baja dosis de radiación (TBDR) es amplia. Sin embargo, la evidencia sobre la experiencia en España es limitada. Nuestro objetivo es presentar los resultados del programa de cribado de cáncer de pulmón más largo de España.
MétodosEl Programa Internacional de Detección Precoz de Cáncer de Pulmón con TBDR de Pamplona (P-IELCAP) viene reclutando individuos de manera activa desde el año 2000 siguiendo el protocolo IELCAP. Se incluyen individuos ≥40 años de edad, fumadores o exfumadores (consumo acumulado ≥10 paquetes-año). Los resultados se comparan con los de otros estudios europeos.
ResultadosUn total de 2.989 participantes fueron reclutados hasta marzo de 2014 (73% varones), realizando una mediana de 2 (IQR 1-3) rondas de cribado por individuo. Se detectaron 60 cánceres de pulmón en 53 participantes (73% en estadioi). Adenocarcinoma fue el tipo histológico más frecuente. La proporción de prevalencia e incidencia de cáncer de pulmón fue del 1,0 y del 1,4%, respectivamente, con una tasa de detección anual de 0,41. La tasa de supervivencia a 10años de los pacientes con cáncer de pulmón fue del 70%. La enfermedad pulmonar obstructiva crónica y el enfisema son importantes factores de riesgo para desarrollar cáncer de pulmón.
ConclusionesLa experiencia del programa de cribado de cáncer de pulmón más largo de España es comparable con lo descrito en el resto de Europa y confirma la viabilidad y la eficacia del cribado mediante TBDR.
European experience regarding lung cancer screening using low-dose chest CT (LDCT) is available. However, there is limited data on the Spanish experience in this matter. Our aim is to present the results from the longest ongoing screening program in Spain.
MethodologyThe Pamplona International Early Lung Cancer Detection Program (P-IELCAP) is actively screening participants for lung cancer using LDCT since year 2000 following the IELCAP protocol, including spirometric assessments. Men and women, ≥40years of age, current or former smokers with a tobacco history of ≥10pack-years are included. Results are compared to those from other European trials.
ResultsA total of 2989 participants were screened until March 2014 (73% male). A median of 2 (IQR 1-3) annual screening rounds were performed. Sixty lung cancers were detected in 53 participants (73% in StageI). Adenocarcinoma was the most frequent. The lung cancer prevalence and incidence proportion was 1.0% and 1.4%, respectively, with an annual detection rate of 0.41. The estimated 10-year survival rate among individuals with lung cancer was 70%. Chronic obstructive pulmonary disease and emphysema are important lung cancer predictors.
ConclusionsThe experience in Spain's longest lung cancer screening program is comparable to what has been described in the rest of Europe, and confirms the feasibility and efficacy of lung cancer screening using LDCT.
Los estudios de cribado de cáncer de pulmón con tomografía torácica de baja dosis de radiación (TBDR) comenzaron hace casi 2 décadas, cuyos resultados sugirieron que el cribado era útil para detectar casos de cáncer de pulmón en fases tempranas1-4. El Programa Internacional de Detección Precoz de Cáncer de Pulmón (I-ELCAP), un ensayo que incluyó a más de 30.000 sujetos para participar en un programa de cribado con TBDR, encontró que el 85% de sus casos de cáncer de pulmón se encontraban en estadio clínicoi, con una tasa estimada de supervivencia a 10años del 88%5. Posteriormente, los resultados del National Lung Screening Trial (NLST) mostraron una reducción significativa de la mortalidad específica por cáncer de pulmón en el grupo de cribado con TBDR6. Estos estudios alentaron al grupo de trabajo estadounidense United States Preventive Task Force (USPSTF) a recomendar el cribado con TBDR para el cáncer de pulmón7.
La experiencia europea en cribado de cáncer de pulmón es muy importante. Resultados iniciales de una cohorte alemana fueron publicados en 2002 y, más tarde, en 2012 el ensayo Lung Cancer Screening Intervention (LUSI)2,8. Otros países europeos, como los Países Bajos9, Bélgica9, Francia10, Dinamarca11 e Italia12,13, con los estudios NEderlands Leuvens longkanker Screenings ONderzoek (NELSON)9, DEPISCAN10, Danish Lung Cancer Screening Trial (DLCST)11, Detection and Screening of Early Lung Cancer by Novel Imaging Technology and Molecular Essays (DANTE)12 e ITALUNG13, respectivamente, también han sido activos en este terreno.
Hasta hace poco, antes que el Instituto Oncológico de Valencia (IVO) se uniera como sede de I-ELCAP y empezara a reunir participantes para dicho estudio, la experiencia en España se limitaba a un único centro en Pamplona donde se realizaba cribado de cáncer de pulmón de forma activa desde el año 2000, también como parte de I-ELCAP5. Los datos preliminares de nuestros primeros años de cribado ya se han descrito con anterioridad, aunque se centraban en el valor del enfisema y la enfermedad pulmonar obstructiva crónica (EPOC) como factores de riesgo para el cáncer de pulmón, así como el uso de la tomografía por emisión de positrones (PET) con F-18-fluorodeoxiglucosa14,15. Con más de una década de experiencia y el doble de pacientes cribados y cánceres diagnosticados, re-analizamos toda nuestra cohorte para describir los resultados del programa activo de cribado de cáncer de pulmón más largo de España.
Materiales y métodosParticipantesLos sujetos considerados para el estudio pertenecen al Programa Internacional de Detección Precoz de Cáncer de Pulmón con TBDR de Pamplona (P-IELCAP), en España, y fueron reclutados entre septiembre de 2000 y abril de 2014, como parte del I-ELCAP5. Detalles específicos sobre el reclutamiento de sujetos, las características de la TBDR, el protocolo de detección de cáncer de pulmón, la evaluación de enfisema y obstrucción al flujo aéreo, han sido detallados anteriormente14,16. En síntesis, incluimos varones y mujeres, de 40años o más, fumadores o exfumadores con historial de tabaquismo de ≥10 paquetes-año, sin síntomas de cáncer de pulmón. A diferencia de nuestro estudio anterior, ampliamos nuestros datos basales e incluimos estado de tabaquismo (fumador o exfumador), índice de masa corporal (IMC, calculado dividiendo el peso del sujeto en kilos por el cuadrado de su altura en metros), antecedentes familiares del cáncer de pulmón (presente o ausente) y tiempo desde que han dejado de fumar en años.
A cada participante se le realizó una TBDR y una espirometría al inicio del estudio y en la visita de revisión al año o antes, conforme al protocolo del I-ELCAP16. A aquellos sujetos con un TBDR negativo (sin nódulos pulmonares o con nódulos no calcificados <5mm) se les programaba una visita anual. Para los resultados positivos (nódulo no calcificado ≥5mm) se precisaron estudios diagnósticos adicionales, incluyendo cualquiera de los siguientes, en función del tamaño y las características del nódulo: PET, antibióticos, repetición de la TBDR a los 3meses, punción-aspiración por aguja fina o biopsia quirúrgica16. A los sujetos cuyas pruebas no sugirieron ni confirmaron neoplasia maligna se les invitó a continuar con el cribado anual. También se realizó el seguimiento anual a los participantes diagnosticados con cáncer de pulmón. No hubo límites en cuanto al número de rondas de cribado. El enfisema se midió cualitativamente y la obstrucción al flujo aéreo se estableció según las recomendaciones de la Global initiative for chronic Obstructive Lung Disease (GOLD) (relación de volumen respiratorio forzado en el primer segundo/capacidad vital forzada [VEF1/CVF]<70%)17. La Comisión de Ética de la Universidad de Navarra aprobó el protocolo del ensayo y todos los sujetos firmaron un consentimiento informado antes de su inclusión.
Análisis de datosLos datos cuantitativos con distribución normal se muestran como promedio ±desviación estándar (DE) y los datos que no siguen una distribución normal se muestran como mediana y rango intercuartil (IQR). Los datos categóricos se describieron mediante frecuencias relativas. Los datos de fiabilidad interlector y coeficiente κ para la evaluación visual del enfisema mediante TBDR, se mencionan en nuestro estudio anterior14.
Las proporciones de prevalencia e incidencia de cáncer de pulmón se calcularon en función de si el diagnóstico se realizó con el TBDR basal o en alguna de las rondas de seguimiento, respectivamente. Los cálculos se basaron en el número de sujetos a los que se les diagnosticó cáncer de pulmón. Al dividir la tasa de incidencia entre la mediana del tiempo de seguimiento, se obtuvo la tasa de detección anual de cáncer de pulmón. El inverso de éste último estimó el número de personas que habría que cribar en un año para detectar un caso de cáncer de pulmón (NND)18.
Se empleó el método de riesgos proporcionales de Cox para evaluar el riesgo de desarrollar cáncer de pulmón respecto a diversas variables, con especial énfasis en EPOC y enfisema. Las variables empleadas para ajustar el análisis multifactorial incluyeron edad, sexo, paquetes-año de tabaquismo, IMC, antecedentes familiares de cáncer de pulmón y si era fumador al inicio del estudio.
Se revisaron las historias clínicas para obtener los datos de mortalidad de los pacientes con cáncer de pulmón y se elaboró una curva de supervivencia de Kaplan-Meier.
Se consideró estadísticamente significativo un valor p inferior a 0,05. Todos los análisis estadísticos se realizaron mediante SPSS Statistics 20.0 para Windows (IBM, Chicago, IL, EE.UU.).
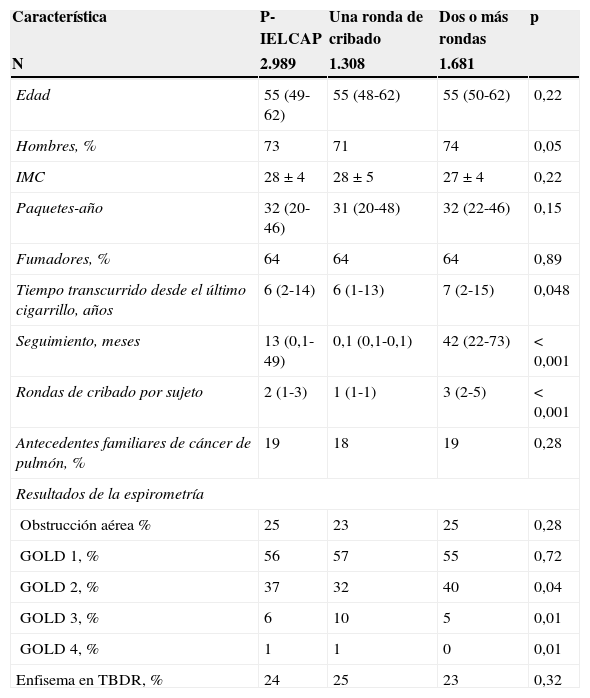
ResultadosSe incluyó a un total de 2.989 sujetos en el programa de cribado. En la tabla 1 se enumeran sus características iniciales. Los participantes fueron predominantemente varones (73%), con una mediana de edad de 55años (49-62). La mayoría eran fumadores en el momento de inicio del estudio, con un historial de tabaquismo de 32 (20-46) paquetes-año. El 25% de la población estudiada presentaba EPOC, de los cuales el 93% tenían enfermedad leve o moderada (grados GOLD1 o 2) y el 24%, signos de enfisema en la TBDR inicial. Más de la mitad de la muestra participó en 2 o más rondas de cribado. No hubo diferencias significativas en las características iniciales entre los participantes que intervinieron en una, y dos o más rondas, excepto por lo que respecta a la distribución de la gravedad de la EPOC (tabla 1). Aquellos participantes adherentes al estudio tuvieron una mediana de seguimiento de 42 (22-73) meses y 3 (2-5) rondas de cribado.
Características iniciales de la población del estudio
| Característica | P-IELCAP | Una ronda de cribado | Dos o más rondas | p |
|---|---|---|---|---|
| N | 2.989 | 1.308 | 1.681 | |
| Edad | 55 (49-62) | 55 (48-62) | 55 (50-62) | 0,22 |
| Hombres, % | 73 | 71 | 74 | 0,05 |
| IMC | 28±4 | 28±5 | 27±4 | 0,22 |
| Paquetes-año | 32 (20-46) | 31 (20-48) | 32 (22-46) | 0,15 |
| Fumadores, % | 64 | 64 | 64 | 0,89 |
| Tiempo transcurrido desde el último cigarrillo, años | 6 (2-14) | 6 (1-13) | 7 (2-15) | 0,048 |
| Seguimiento, meses | 13 (0,1-49) | 0,1 (0,1-0,1) | 42 (22-73) | < 0,001 |
| Rondas de cribado por sujeto | 2 (1-3) | 1 (1-1) | 3 (2-5) | < 0,001 |
| Antecedentes familiares de cáncer de pulmón, % | 19 | 18 | 19 | 0,28 |
| Resultados de la espirometría | ||||
| Obstrucción aérea % | 25 | 23 | 25 | 0,28 |
| GOLD 1, % | 56 | 57 | 55 | 0,72 |
| GOLD 2, % | 37 | 32 | 40 | 0,04 |
| GOLD 3, % | 6 | 10 | 5 | 0,01 |
| GOLD 4, % | 1 | 1 | 0 | 0,01 |
| Enfisema en TBDR, % | 24 | 25 | 23 | 0,32 |
GOLD: Global initiative for chronic Obstructive Lung Disease; IMC: índice de masa corporal; P-IELCAP: Programa Internacional de Detección Precoz de Cáncer de Pulmón con TBDR de Pamplona; TBDR: tomografía computarizada torácica de baja dosis de radiación.
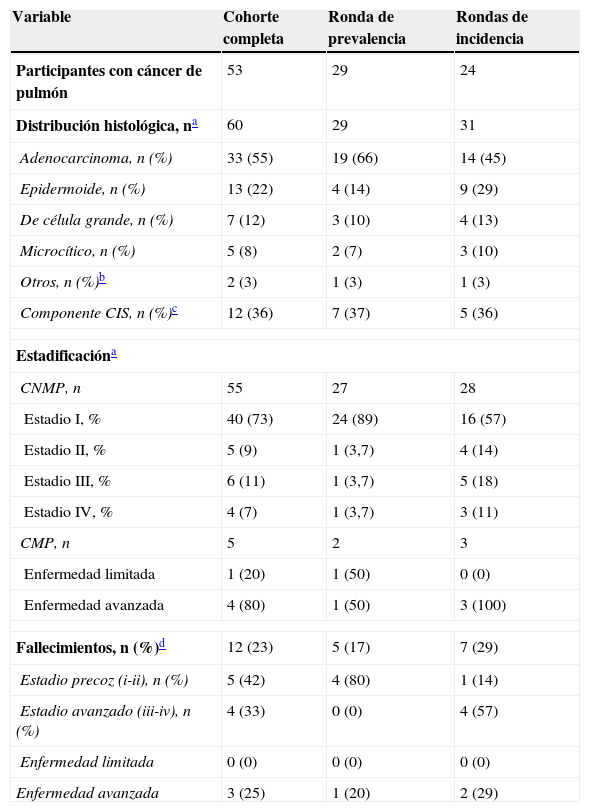
Se diagnosticó a un total de 53 participantes con cáncer de pulmón: 29 en la primera ronda de cribado (1,0% de proporción de prevalencia) y 24 en las siguientes rondas (1,4% de proporción de incidencia). Tras la ronda inicial de cribado, la tasa de detección anual de cáncer de pulmón fue 0,41 y el número estimado de sujetos necesarios cribar en un año para detectar un cáncer de pulmón fue 245. Se detectaron 2 tumores sincrónicos en un participante en su octava ronda anual de cribado (carcinoma epidermoide y adenocarcinoma) y se diagnosticó un segundo cáncer de pulmón en 6 sujetos con cáncer de pulmón prevalente en una de las visitas de seguimiento (tumor metacrónico). La diferencia entre los 2 diagnósticos fue 48 (34-75) meses. Todos los tumores metacrónicos presentaron el mismo patrón histológico y estadio que el primer tumor, excepto 2 casos, donde se detectó un estadio más avanzado en el segundo cáncer. De las 60 muestras disponibles, la gran mayoría de cánceres de pulmón fueron carcinomas no microcíticos de pulmón (CNMP), de los cuales el 55% fueron adenocarcinomas, seguidos por los carcinomas epidermoides (22%). Más de un tercio de los adenocarcinomas identificados presentaban un componente de carcinoma in situ. El 82% de los cánceres se encontraban en fase precoz (estadiosi y ii) y el 7%, en estadioiv. De los 5 casos de carcinoma microcítico de pulmón (CMP), 4 fueron enfermedad avanzada. En la tabla 2 se muestran las características de los casos de cáncer de pulmón de toda nuestra cohorte, y estratificada por ronda de cribado.
Características de los diagnósticos de cáncer de pulmón
| Variable | Cohorte completa | Ronda de prevalencia | Rondas de incidencia |
|---|---|---|---|
| Participantes con cáncer de pulmón | 53 | 29 | 24 |
| Distribución histológica, na | 60 | 29 | 31 |
| Adenocarcinoma, n (%) | 33 (55) | 19 (66) | 14 (45) |
| Epidermoide, n (%) | 13 (22) | 4 (14) | 9 (29) |
| De célula grande, n (%) | 7 (12) | 3 (10) | 4 (13) |
| Microcítico, n (%) | 5 (8) | 2 (7) | 3 (10) |
| Otros, n (%)b | 2 (3) | 1 (3) | 1 (3) |
| Componente CIS, n (%)c | 12 (36) | 7 (37) | 5 (36) |
| Estadificacióna | |||
| CNMP, n | 55 | 27 | 28 |
| Estadio I, % | 40 (73) | 24 (89) | 16 (57) |
| Estadio II, % | 5 (9) | 1 (3,7) | 4 (14) |
| Estadio III, % | 6 (11) | 1 (3,7) | 5 (18) |
| Estadio IV, % | 4 (7) | 1 (3,7) | 3 (11) |
| CMP, n | 5 | 2 | 3 |
| Enfermedad limitada | 1 (20) | 1 (50) | 0 (0) |
| Enfermedad avanzada | 4 (80) | 1 (50) | 3 (100) |
| Fallecimientos, n (%)d | 12 (23) | 5 (17) | 7 (29) |
| Estadio precoz (i-ii), n (%) | 5 (42) | 4 (80) | 1 (14) |
| Estadio avanzado (iii-iv), n (%) | 4 (33) | 0 (0) | 4 (57) |
| Enfermedad limitada | 0 (0) | 0 (0) | 0 (0) |
| Enfermedad avanzada | 3 (25) | 1 (20) | 2 (29) |
CIS: carcinoma in situ; CMP: carcinoma microcítico de pulmón; CNMP: carcinoma no microcítico de pulmón.
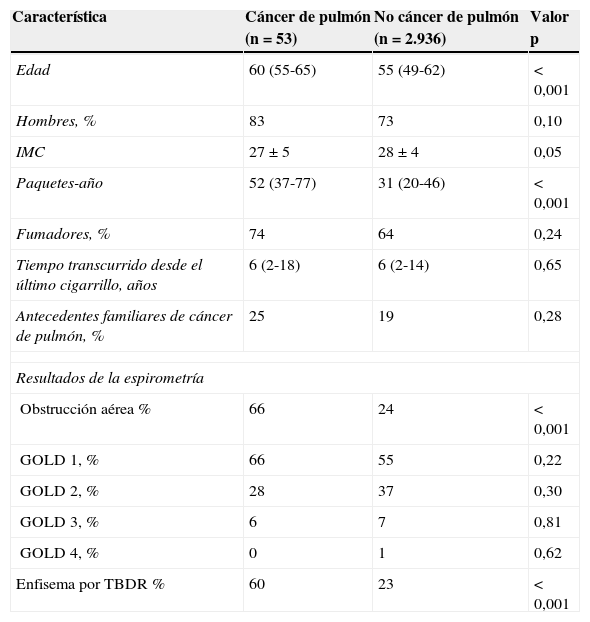
Las diferencias entre los sujetos con y sin cáncer de pulmón figuran en la tabla 3. Los sujetos con cáncer de pulmón eran significativamente mayores (5años de diferencia, p<0,001), tenían un historial de tabaquismo mayor (diferencia de 20 paquetes-año, p<0,001) con una proporción significativamente mayor de obstrucción aérea y enfisema. También se observó una peor función pulmonar expresada como menor VEF1% predicho (VEF1%p) y menor relación VEF1/CVF en los participantes que desarrollaron cáncer de pulmón.
Diferencias en las características iniciales entre los sujetos con y sin cáncer de pulmón
| Característica | Cáncer de pulmón (n=53) | No cáncer de pulmón (n=2.936) | Valor p |
|---|---|---|---|
| Edad | 60 (55-65) | 55 (49-62) | < 0,001 |
| Hombres, % | 83 | 73 | 0,10 |
| IMC | 27±5 | 28±4 | 0,05 |
| Paquetes-año | 52 (37-77) | 31 (20-46) | < 0,001 |
| Fumadores, % | 74 | 64 | 0,24 |
| Tiempo transcurrido desde el último cigarrillo, años | 6 (2-18) | 6 (2-14) | 0,65 |
| Antecedentes familiares de cáncer de pulmón, % | 25 | 19 | 0,28 |
| Resultados de la espirometría | |||
| Obstrucción aérea % | 66 | 24 | < 0,001 |
| GOLD 1, % | 66 | 55 | 0,22 |
| GOLD 2, % | 28 | 37 | 0,30 |
| GOLD 3, % | 6 | 7 | 0,81 |
| GOLD 4, % | 0 | 1 | 0,62 |
| Enfisema por TBDR % | 60 | 23 | < 0,001 |
GOLD: Global initiative for chronic Obstructive Lung Disease; IMC: índice de masa corporal; TBDR: tomografía computarizada torácica de baja dosis de radiación.
Los datos se expresan como promedio±desviación estándar (DE) o mediana (rango intercuartil, RIC).
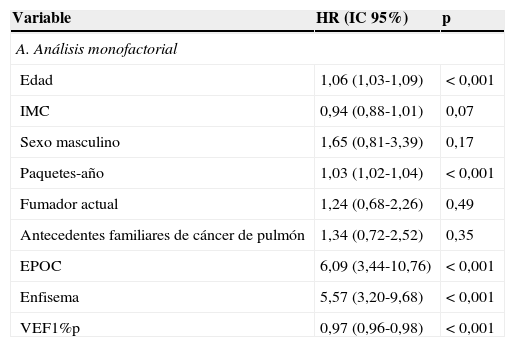
En la tabla 4A se muestran los resultados del análisis monofactorial. Se halló una asociación significativa entre cáncer de pulmón y edad, número de paquetes-año, EPOC, enfisema y volumen espiratorio forzado en el primer segundo como porcentaje del predicho (VEF1%p). En el análisis multifactorial, tras ajustarlo por edad, sexo y paquetes-año (modelo1), la EPOC y el enfisema fueron factores de riesgo significativos para el cáncer de pulmón (HR 4,52; IC95%: 2,50-8,18, p<0,001; HR 4,52; IC95%: 2,56-7,95, p<0,001, respectivamente). Después de añadir el IMC, la condición de fumador al inicio del estudio y los antecedentes familiares de cáncer de pulmón al modelo anterior, el riesgo se atenuó ligeramente, sin que fuera menos significativo. En el modelo3, donde se incluyeron EPOC y enfisema en un modelo único, ambos siguieron siendo factores de riesgo significativos: HR 3,41; IC95%: 1,85-6,29, p<0,001, y HR 3,26; IC95%: 1,82-5,85, p<0,001 para EPOC y enfisema, respectivamente (tabla 4B).
Análisis de regresión monofactorial y multifactorial de Cox para evaluar el riesgo de cáncer de pulmón
| Variable | HR (IC 95%) | p |
|---|---|---|
| A. Análisis monofactorial | ||
| Edad | 1,06 (1,03-1,09) | < 0,001 |
| IMC | 0,94 (0,88-1,01) | 0,07 |
| Sexo masculino | 1,65 (0,81-3,39) | 0,17 |
| Paquetes-año | 1,03 (1,02-1,04) | < 0,001 |
| Fumador actual | 1,24 (0,68-2,26) | 0,49 |
| Antecedentes familiares de cáncer de pulmón | 1,34 (0,72-2,52) | 0,35 |
| EPOC | 6,09 (3,44-10,76) | < 0,001 |
| Enfisema | 5,57 (3,20-9,68) | < 0,001 |
| VEF1%p | 0,97 (0,96-0,98) | < 0,001 |
| Variable | Modelo 1HR (IC 95%) | Modelo 2HR (IC 95%) | Modelo 3HR (IC 95%) |
|---|---|---|---|
| B. Análisis multifactorial | |||
| EPOC | 4,52 (2,50-8,18) | 4,42 (2,44-7,99) | 3,41 (1,85-6,29) |
| Enfisema | 4,52 (2,56-7,95) | 4,20 (2,37-7,44) | 3,26 (1,82-5,85) |
EPOC: enfermedad pulmonar obstructiva crónica; VEF1%p: volumen espiratorio forzado en el primer segundo como % del predicho; IMC: índice de masa corporal; HR: hazard ratio..
Modelos de adaptación. Modelo 1: edad, sexo, paquetes-año de tabaquismo. Modelo 2: edad, sexo, paquetes-año, IMC, ser fumador actual y antecedentes familiares de cáncer de pulmón. Modelo 3: edad, sexo, paquetes-año, EPOC y enfisema.
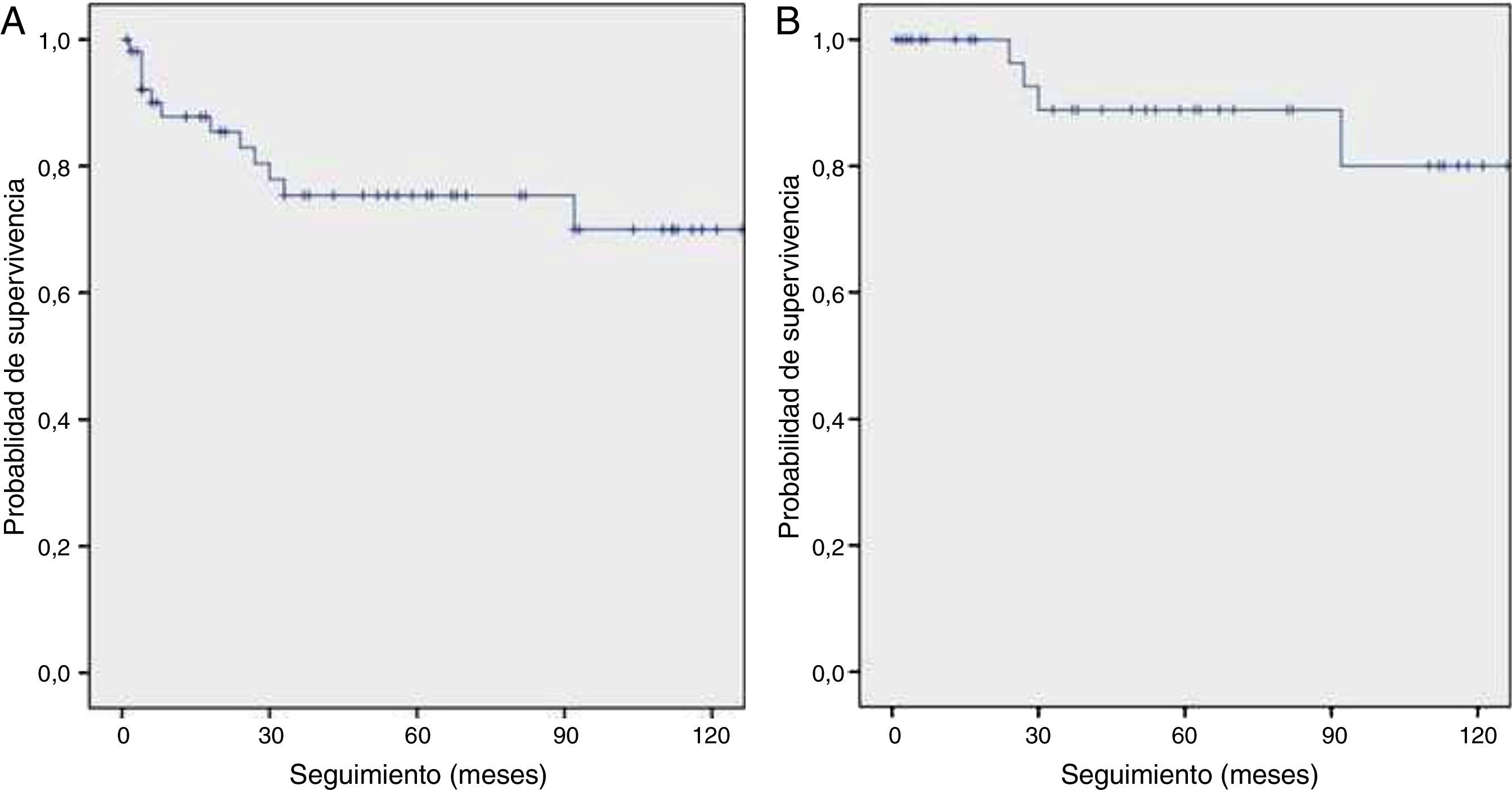
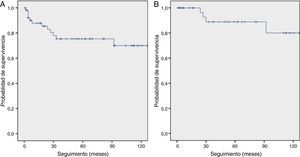
Fallecieron 12 pacientes diagnosticados con cáncer de pulmón (23%). La mayoría (58%) presentaba enfermedad avanzada (cáncer de pulmón en estadiosiii-iv o enfermedad avanzada en CMP). La tasa de supervivencia a 10años entre los 53 sujetos con cáncer de pulmón fue del 70%. Si consideramos solo a los sujetos con cáncer de pulmón en estadioi, la tasa de supervivencia a 10años mejoró hasta el 80%. El promedio de supervivencia fue 110 (IC95%: 93-127) meses y 127 (IC95%: 111-143) meses para todos los sujetos diagnosticados con cáncer de pulmón y los que tenían enfermedad en estadioi, respectivamente (fig. 1).
DiscusiónEste estudio presenta la experiencia del programa de cribado de cáncer de pulmón con TBDR más largo de España y contribuye a la experiencia europea en este asunto.
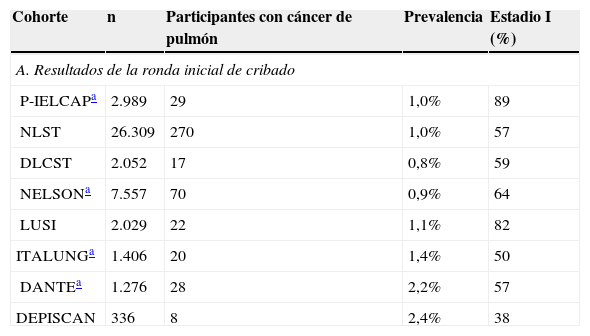
Nuestros resultados son comparables con lo publicado en otros países en cuanto a prevalencia, incidencia, histología y estadificación del cáncer de pulmón. Si consideramos únicamente la ronda inicial de cribado, nuestra proporción de prevalencia de cáncer de pulmón fue del 1,0%. Si bien en el ensayo NLST de Estados Unidos la prevalencia fue del 1,0%19, en Europa estas tasas variaron ampliamente en los estudios: del 0,8% en el DLCST hasta el 2,4% en el DEPISCAN10,11 (tabla 5A). El P-IELCAP tuvo la mayor proporción de cánceres de pulmón en estadioi en la ronda inicial de cribado, con una diferencia media del 30% respecto al resto de estudios. Tan solo el ensayo LUSI mostró resultados similares a los nuestros, probablemente porque su evaluación también se basa en el ELCAP, lo que destaca el valor de aplicar un protocolo estándar1,8. Los criterios de inclusión de cada estudio podrían explicar las diferencias en las proporciones de prevalencia en comparación con otras cohortes. Por ejemplo, el P-IELCAP reclutó a participantes más jóvenes con menor umbral de historial de tabaquismo que los empleados en otros estudios.
Diferencias en las proporciones de prevalencia e incidencia de cáncer de pulmón entre estudios
| Cohorte | n | Participantes con cáncer de pulmón | Prevalencia | Estadio I (%) |
|---|---|---|---|---|
| A. Resultados de la ronda inicial de cribado | ||||
| P-IELCAPa | 2.989 | 29 | 1,0% | 89 |
| NLST | 26.309 | 270 | 1,0% | 57 |
| DLCST | 2.052 | 17 | 0,8% | 59 |
| NELSONa | 7.557 | 70 | 0,9% | 64 |
| LUSI | 2.029 | 22 | 1,1% | 82 |
| ITALUNGa | 1.406 | 20 | 1,4% | 50 |
| DANTEa | 1.276 | 28 | 2,2% | 57 |
| DEPISCAN | 336 | 8 | 2,4% | 38 |
| Cohorte | n | Participantes con cáncer de pulmón | Incidencia | Duración (años) | Tasa de detección anual | Estadio I (%) |
|---|---|---|---|---|---|---|
| B. Resultados de la segunda y/o siguientes rondas de cribado | ||||||
| P-IELCAPa | 1681 | 24 | 1,4% | 3,5 | 0,41 | 57 |
| NLST | 24715 | 379 | 1,5% | 6,5 | 0,24 | 65 |
| DLCST | 1976 | 52 | 2,6% | 4 | 0,66 | 73 |
| NELSONa | 7294 | 130 | 1,8% | 4 | 0,45 | 74b |
| ITALUNGa | 1263 | 18 | 1,4% | 4 | 0,36 | 76 |
| DANTEa | 1114 | 32 | 2,9% | 2,81 | 1,02 | 53 |
| LUSI | ND | ND | ND | ND | ND | ND |
| DEPISCAN | ND | ND | ND | ND | ND | ND |
DANTE: Detection and Screening of Early Lung Cancer by Novel Imaging Technology and Molecular Essays; DLCST: Danish Lung Cancer Screening Trial; LUSI: German Lung Cancer Screening Intervention Trial; ND: datos no disponibles para el cálculo; NELSON: NEderlands Leuvens longkanker Screenings ONderzoek; NLST: National Lung Screening Trial; P-IELCAP: Programa Internacional de Detección Precoz de Cáncer de Pulmón con TBDR de Pamplona.
Al considerar los diagnósticos de cáncer de pulmón en los cribados anuales, la proporción de incidencia del P-IELCAP fue del 1,4% (tabla 5B). Este resultado fue comparable al del ITALUNG (1,4%), pero mucho menor que el observado en el DLCST (2,6%) y el DANTE (2,9%)20-22. Al ajustar las proporciones de incidencia con la duración de cada estudio (tasa de detección anual), los resultados fueron más homogéneos. La tasa de detección anual del P-IELCAP (0,41) fue comparable a los resultados de los ensayos NELSON (0,45) e ITALUNG (0,36)20,23, mientras que la diferencia respecto al DLCST se atenuó levemente21. Las diferencias entre los estudios podrían deberse a los criterios de inclusión de cada ensayo, los métodos de reclutamiento (como invitaciones por correo masivo empleados en otros estudios), el protocolo de TBDR (colimación y espesor del corte), número de rondas de cribado e intervalo entre cada ronda, protocolo de evaluación de nódulo/cáncer pulmonar (diámetro o volumen del nódulo o tiempo de duplicación del nódulo), entre otros. Las características inherentes de los participantes respecto a la zona geográfica a la que pertenecen también podrían afectar los resultados.
El adenocarcinoma fue el patrón histológico más frecuente hallado en nuestro estudio, en consonancia con las observaciones de otras cohortes de cribado8,10,19-21.
La proporción de cánceres de pulmón en estadioi detectados en las rondas de incidencia se redujo significativamente en el P-IELCAP (del 89 al 57%). En cuanto a los estudios europeos mencionados, solo el ensayo DANTE mostró un comportamiento similar, pero no de la misma envergadura22. Sin embargo, esta tendencia también se ha identificado en otros estudios24, como el Lung Screening Study (53 al 25%)25, el Pittsburgh Lung Screening Study (58 al 37%)26 y un estudio de Swensen et al. (71% a 50%)27. La propoción de cánceres en estadioi hallada en las rondas de incidencia del P-IELCAP (57%) está en línea con otras series, como DANTE (53%) y NLST (65%)22,28.
Tal y como ya se ha explicado, el P-IELCAP fue uno de los muchos centros que participó en el I-ELCAP, y una parte de nuestra cohorte se incluyó en el artículo de 2006 donde se reunió a más de 30.000 participantes de centros en Norteamérica, Europa y Asia5. Con solo una fracción de participantes de este último (11%), los resultados del P-IELCAP concordaron con los del I-ELCAP, especialmente en la ronda inicial de cribado (1,3% de prevalencia y 85% de cáncer de pulmón en estadioi en el I-ELCAP, en comparación con el 1% de prevalencia y el 89% de cáncer de pulmón en estadioi en el P-IELCAP). No obstante, se hallaron algunas diferencias en las rondas de incidencia, ya que aunque la proporción de incidencia fue mucho menor en el I-ELCAP (0,3% vs.1,4% en el P-IELCAP), I-ELCAP mantuvo una alta tasa de detección de cáncer de pulmón en estadioi (86% vs. 57% en el P-IELCAP). A pesar de esta diferencia, las tasas de supervivencia a 10años en pacientes con patología en estadioi fueron comparables en ambos estudios (80% en P-IELCAP y 88% en I-ELCAP, respectivamente) (fig. 1B)5.
Estos resultados muestran que el cribado de cáncer de pulmón con TBDR en un centro español resulta viable y efectivo. Sin embargo, este estudio se realizó en un centro privado y podría no ser totalmente reproducible en instituciones públicas en un país donde predomina la asistencia sanitaria pública. En esas circunstancias, el uso de recursos y los costes podrían suponer limitaciones importantes. En cuanto a la rentabilidad, un análisis actuarial de una población de alto riesgo en Estados Unidos sugirió que ofrecer cribado de cáncer de pulmón como prestación de un seguro salvaría vidas a un coste relativamente bajo29. Un aspecto claro y fundado en la mayoría de protocolos es que el cribado debería realizarse en centros médicos con equipos multidisciplinares y centrándose en población de alto riesgo30,31.
Nuestro estudio confirma además el valor de la EPOC y el enfisema como factores de riesgo importantes para el cáncer de pulmón en los programas de cribado. Ninguno de los estudios europeos aquí citados ha realizado esta evaluación. En cualquier caso, el NLST y el Pittsburgh Lung Screening Study (PLuSS) han confirmado el valor del enfisema a la hora de seleccionar a pacientes de alto riesgo32,33. Esta observación se confirma además, al medir la densidad de incidencia de cáncer de pulmón, donde la EPOC y el enfisema triplican los valores de la cohorte original (23 y 21 cánceres de pulmón por 1.000 personas/año, respectivamente, al compararlo con la cohorte completa, 7 cánceres de pulmón por 1.000 personas/año). Resulta interesante que si un sujeto presentaba tanto EPOC como enfisema, la densidad de incidencia era máxima (39 cánceres de pulmón por 1.000 personas/año). Entre los pacientes con EPOC, la mayoría de diagnósticos de cáncer de pulmón se realizaron en sujetos con patología leve (33 casos en pacientes GOLD1 y 2, mientras que solo se detectaron 2 cánceres de pulmón en pacientes con EPOC severo). Nuestros resultados coinciden con los de la cohorte de BODE, donde también se observó un incremento del riesgo en los casos de enfermedad leve34,35. Sin embargo, contrasta con los datos del PLuSS, donde los pacientes con EPOC grave presentaban un riesgo significativamente mayor de sufrir cáncer de pulmón32. En los 2 últimos decenios, los estudios han sido coherentes al describir la relación entre la EPOC y el cáncer de pulmón, e incluso se ha confirmado su importancia en un entorno de cribado de cáncer de pulmón14,32,36,37. Otros factores, como el tiempo transcurrido entre el diagnóstico de EPOC y la aparición del cáncer de pulmón, también han mostrado una fuerte asociación38.
Nuestro estudio tiene algunas limitaciones. En primer lugar, el P-IELCAP es un ensayo de cribado monocéntrico de grupo único de estudio, de modo que las comparaciones con los ensayos aleatorizados que se mencionan deben interpretarse con cautela. Dichos estudios se eligieron con el fin de comparar la experiencia española con la de otros países europeos. De fuera de Europa, solo se incluyeron los resultados del ensayo NLST porque son una referencia en este campo6. En segundo lugar, la adherencia al cribado en nuestro estudio fue baja: solo el 56% de los participantes intervinieron en, al menos, una segunda ronda de cribado, en comparación con la adherencia superior al 90% observada en la mayoría de los ensayos citados. Esta sería una limitación importante si comparásemos los resultados globales. Creemos que minimizamos esta limitación al medir las proporciones de prevalencia e incidencia independientemente, con los participantes que intervinieron en una y dos o más rondas de cribado, respectivamente. De este modo, el grupo de adherencia fue comparable con los demás ensayos en cuanto a seguimiento y número de rondas de cribado. Ya hemos analizado previamente la cuestión de la baja adherencia en nuestro programa de cribado. Descubrimos que variaba en función del sexo, la distancia al centro de referencia, la motivación del participante y la percepción del riesgo, entre otros39. En tercer lugar, es probable que exista un sesgo de selección, sobre todo un efecto de voluntario sano. Esto último ya ha sido descrito con detenimiento por Dominioni et al.40 en un entorno de cribado radiológico de cáncer de pulmón, donde los participantes del grupo de intervención tuvieron mayor mortalidad por cáncer de pulmón que el grupo control. En nuestro estudio, aunque no hubo diferencias significativas en la función pulmonar inicial (FEV1%p) entre los que intervinieron en una o más rondas de cribado, en el subgrupo de pacientes con EPOC los casos más leves fueron los que mejor habían cumplido el calendario de consultas programadas. No tratamos el tema del sobrediagnóstico en este estudio porque no hay grupo control. No obstante, la reducción significativa de la mortalidad por cáncer de pulmón en el NLST demuestra que el sobrediagnóstico no resulta limitante6. En último lugar, en cuanto a posibles procedimientos innecesarios o falsos positivos, nos referimos al estudio I-ELCAP original, donde el 92% de las biopsias (492 de 535) realizadas tras una TBDR positiva conllevó un diagnóstico de neoplasia maligna5.
Concluimos que la experiencia del programa de cribado de cáncer de pulmón más largo de España es comparable con lo descrito en el resto de Europa, y confirma la viabilidad y la eficacia de este programa, empleando la TBDR. La EPOC y el enfisema son factores de riesgo importantes para el cáncer de pulmón y deberían tenerse en cuenta a la hora de seleccionar a los sujetos de alto riesgo para los programas de cribado.
FinanciaciónEste trabajo ha sido financiado parcialmente con una beca (RD12/0036/0062) de la Red Temática de Investigación Cooperativa en Cáncer (RTICC), Instituto de Salud CarlosIII (ISCIII), Ministerio Español de Economía y Competitividad y el Fondo Europeo de Desarrollo Regional (FEDER) «Una manera de hacer Europa». Proyectos FIS: PI04/2404, PI07/0792, PI10/01652, PI11/01626.
Contribuciones al estudioDiseño: PSS, JB, JPdT, AC, ABA, AV, JCP, MDL, MJGV, LMS, JG, GB, JJZ; Análisis e interpretación: PSS, JPdT, LMS, JJZ; Redacción del artículo en cuanto a contenido intelectual importante: PSS, JPdT, LMS, JJZ.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.