El esputo inducido es un método no invasivo para estudiar la inflamación pulmonar.
ObjetivosEstudiar la inflamación pulmonar mediante el análisis de muestras de esputo inducido en pacientes con esclerosis sistémica y afección pulmonar, y determinar si existe correlación con las alteraciones de la función pulmonar observadas en estos pacientes.
MétodosSe incluyeron 25 pacientes con esclerosis sistémica (20 mujeres). Los pacientes fueron clasificados en 3 grupos, considerando el tipo de afección pulmonar: grupo 1, enfermedad pulmonar intersticial difusa (n=10); grupo 2, hipertensión arterial pulmonar (n=7), y grupo 3, pacientes con esclerosis sistémica sin afección pulmonar (n=8). A todos los pacientes se les realizó un estudio completo de función pulmonar y se obtuvieron muestras de esputo inducido. El recuento celular diferencial en las muestras de esputo se realizó mediante microscopia óptica.
ResultadosEl porcentaje medio de neutrófilos en esputo inducido fue del 85, del 71 y del 75% para los grupos 1, 2 y 3, respectivamente. Se observó una correlación negativa significativa entre el recuento celular total en esputo inducido y la DLCO en los grupos 1 y 3 (r=–0,733, p=0,016; y r=–0,893, p=0,007, respectivamente). Esta correlación negativa no se observó en el grupo 2.
ConclusionesEn todos los pacientes con esclerosis sistémica incluidos en el estudio se detectó inflamación pulmonar, a pesar de la presencia o no de signos documentados de afección pulmonar. Este hallazgo sugiere que el esputo inducido podría ser una técnica útil para detectar anomalías tempranas indicativas de afección pulmonar subclínica en pacientes con esclerosis sistémica.
Induced sputum is a non-invasive method for studying pulmonary inflammation.
ObjectivesTo assess pulmonary inflammation by analysis of induced sputum specimens in patients with systemic sclerosis and lung involvement, and to determine whether there is a correlation with the pulmonary function alterations in these patients.
MethodsTwenty-five patients with systemic sclerosis were included (20 women). Patients were divided into 3 groups according to the type of lung involvement: group 1, diffuse interstitial lung disease (n=10); group 2, those with pulmonary arterial hypertension (n=7), and group 3, patients with systemic sclerosis without lung involvement (n=8). All patients underwent a complete lung function study. Induced sputum samples were obtained and differential cell count was performed by optic microscopy.
ResultsThe mean percentage of sputum neutrophils was 85%, 71%, and 75% for groups 1, 2, and 3, respectively. A significant negative correlation between sputum total cell count and DLCO was seen in group 1 and group 3 (r=–0.733, P=.016; and r=–0.893, P=.007, respectively). This negative correlation was not observed in group 2.
ConclusionsPulmonary inflammation was present in all patients with systemic sclerosis included in the study, regardless of the presence of documented signs of pulmonary involvement. This finding suggests that induced sputum could be helpful for detecting early abnormalities indicative of subclinical pulmonary involvement in patients with systemic sclerosis.
La prevalencia de fibrosis pulmonar en la esclerosis sistémica (ES) varía entre el 25 y el 90%, dependiendo del método utilizado para detectar enfermedad pulmonar intersticial difusa (EPID)1. La fibrosis pulmonar se asocia a una mayor mortalidad en pacientes con ES2-6 y actualmente es la principal causa de muerte en esta población7. Por tanto, es necesario un diagnóstico preciso y temprano de afección pulmonar para evitar la progresión hacia la fibrosis.
La primera manifestación del proceso fibrótico pulmonar que tiene lugar en la ES es la alveolitis. Esta alveolitis fibrosante puede ser detectada mediante pruebas de función pulmonar y tomografía axial computarizada de alta resolución (TACAR)8-10. Evaluar la función pulmonar es la única práctica ampliamente disponible para determinar si la enfermedad es lo suficientemente grave como para justificar una intervención terapéutica inmediata. El TACAR es la herramienta más sensible y específica para identificar fibrosis pulmonar en ES, pero los resultados no son necesariamente indicativos de EPID clínicamente relevante8,9,11.
Las muestras de lavado broncoalveolar (LBA) de pacientes con ES y con EPID muestran elevados recuentos de granulocitos, concretamente neutrófilos y eosinófilos10,12,13, pero no existe la suficiente evidencia para recomendar la realización del LBA para evaluar la actividad de la enfermedad o la probabilidad de respuesta al tratamiento14. Además, el LBA es una técnica diagnóstica invasiva, lo que la hace poco útil como método de seguimiento en el tiempo de la inflamación pulmonar.
El esputo inducido (EI) es una técnica diagnóstica no invasiva utilizada para estudiar los tipos celulares y diferentes marcadores inflamatorios de las vías respiratorias15. Este método ha sido ampliamente utilizado para evaluar la inflamación pulmonar en el asma16-18 y en la EPOC18. Se ha demostrado que el EI puede ser también utilizado para estudiar EPID, específicamente sarcoidosis19 o síndrome de Sjögren20. Sin embargo, según nuestro conocimiento, existen en la literatura escasos trabajos que evalúen el uso potencial del EI para el estudio de la afección pulmonar asociada a la ES21,22. La patogénesis de la ES incluye una activación inflamatoria que se considera que desempeña un papel significativo en la enfermedad. Además, la demostración de este proceso inflamatorio podría ser importante para el diagnóstico, el tratamiento y la progresión de esta entidad10.
El objetivo del presente estudio ha sido determinar el perfil celular inflamatorio en el EI de pacientes con ES, evaluar la utilidad clínica de los hallazgos obtenidos y analizar si los resultados del análisis del EI se correlacionan con los parámetros de función pulmonar en estos pacientes.
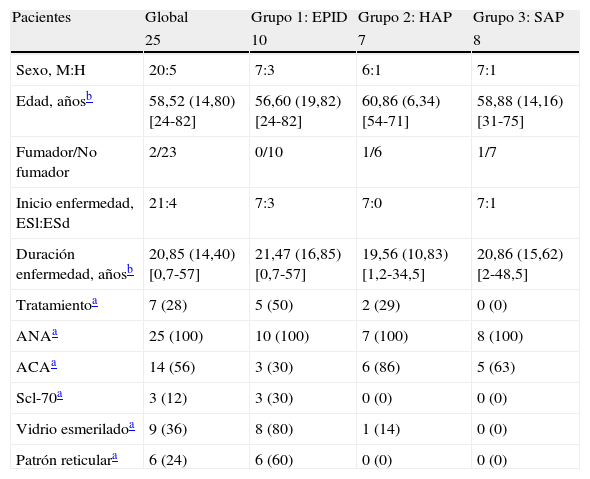
Material y métodosPoblación de estudioEstudio transversal que incluyó 25 pacientes caucásicos con ES (20 mujeres) que acudieron consecutivamente a la Unidad de Esclerodermia del Departamento de Medicina Interna de nuestro hospital entre los años 2006 y 2009 con inmunología compatible23. El estudio fue aprobado por el Comité Ético para Investigación Clínica del hospital, y todos los pacientes firmaron un consentimiento por escrito para participar en el estudio. La edad media fue de 58,52±14,80 años (rango: 24-82 años) y la duración media de la enfermedad, calculada desde el inicio del primer síntoma de Raynaud, fue de 20,85±14,40 años (rango: 0,7-57). Veintiún pacientes tenían ES limitada y 4, ES difusa. Todos los pacientes tenían anticuerpos antinucleares (ANA) positivos, 14 pacientes presentaron además anticuerpos anticentrómero (ACA) positivos y 3, anticuerpos antiScl-70 positivos. En el momento de la inclusión, 4 pacientes estaban siendo tratados con fármacos inmunosupresores (uno azatioprina y 3 micofenolato sódico) y 3 eran tratados con bosentán (tabla 1). Los criterios de exclusión para la participación en el estudio fueron la presencia de otras enfermedades respiratorias inflamatorias (tales como asma, EPOC y sarcoidosis) y/o infección de las vías respiratorias presente durante el mes previo a la obtención de la muestra de EI.
Variables demográficas y características basales de los pacientes incluidos en el estudio
| Pacientes | Global | Grupo 1: EPID | Grupo 2: HAP | Grupo 3: SAP |
| 25 | 10 | 7 | 8 | |
| Sexo, M:H | 20:5 | 7:3 | 6:1 | 7:1 |
| Edad, añosb | 58,52 (14,80) [24-82] | 56,60 (19,82) [24-82] | 60,86 (6,34) [54-71] | 58,88 (14,16) [31-75] |
| Fumador/No fumador | 2/23 | 0/10 | 1/6 | 1/7 |
| Inicio enfermedad, ESl:ESd | 21:4 | 7:3 | 7:0 | 7:1 |
| Duración enfermedad, añosb | 20,85 (14,40) [0,7-57] | 21,47 (16,85) [0,7-57] | 19,56 (10,83) [1,2-34,5] | 20,86 (15,62) [2-48,5] |
| Tratamientoa | 7 (28) | 5 (50) | 2 (29) | 0 (0) |
| ANAa | 25 (100) | 10 (100) | 7 (100) | 8 (100) |
| ACAa | 14 (56) | 3 (30) | 6 (86) | 5 (63) |
| Scl-70a | 3 (12) | 3 (30) | 0 (0) | 0 (0) |
| Vidrio esmeriladoa | 9 (36) | 8 (80) | 1 (14) | 0 (0) |
| Patrón reticulara | 6 (24) | 6 (60) | 0 (0) | 0 (0) |
ACA: anticuerpos anticentrómero; ANA: anticuerpos antinucleares; EPID: enfermedad pulmonar intersticial difusa; ESd: esclerosis sistémica difusa; ESl: esclerosis sistémica limitada; HAP: hipertensión arterial pulmonar; SAP: sin afección pulmonar.
La población de estudio se dividió en 3 grupos, basándose en la afección pulmonar: el grupo 1 incluía pacientes con EPID (n=10); el grupo 2, pacientes con hipertensión arterial pulmonar (HAP) (n=7), y el grupo 3, pacientes sin afección pulmonar (SAP) (n=8). La presencia de EPID y HAP fue establecida previamente a la realización del estudio. La EPID fue definida de acuerdo con los siguientes criterios: un patrón respiratorio restrictivo en las pruebas de función pulmonar y/o evidencia radiológica de enfermedad intersticial en radiografía de tórax o TACAR. La HAP fue determinada por ecocardiografía Doppler (presión arterial pulmonar [PAP] sistólica>40mmHg)23 o mediante cateterismo cardíaco (PAP media>25mmHg).
En todos los pacientes incluidos en el estudio se realizó un estudio completo de función pulmonar, una gasometría arterial, la prueba de marcha de 6 min (PM6M) y la inducción de esputo.
Pruebas de función pulmonarLas pruebas de función pulmonar se realizaron utilizando el equipo MasterLab (MasterLab, Jaegger, Alemania) y se siguieron las recomendaciones de las sociedades respiratorias europea y americana (ERS y ATS) para su realización24,25. Los volúmenes pulmonares estáticos se registraron mediante pletismografía25, y la capacidad de difusión del monóxido de carbono (DLCO) fue medida utilizando el método de la respiración única26. Para el análisis de la espirometría se utilizaron los valores teóricos propuestos para la población mediterránea27, y los valores teóricos para los volúmenes pulmonares estáticos y la DLCO fueron los establecidos por la ERS y la ATS25.
El patrón ventilatorio restrictivo se definió como una capacidad pulmonar total (CPT)<80% del valor teórico28. El patrón ventilatorio obstructivo se definió sobre la base del ratio volumen espiratorio forzado en el primer segundo (FEV1)/capacidad vital forzada (FVC)<70%, junto con un FEV1<80% del valor teórico28. La presencia concomitante de criterios funcionales característicos de ambos patrones se definió como un patrón ventilatorio mixto. La DLCO se consideró disminuida si presentaba valores<80% del valor teórico28.
Gasometría arterialLas muestras para gasometría arterial se obtuvieron según las recomendaciones de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR)29. Tras la administración de anestesia local, se realizó la punción de la arteria radial con una aguja heparinizada. Las muestras fueron procesadas inmediatamente utilizando un co-oxímetro IL 682 (Instrumentation Laboratories, Lexington, MA, EE. UU.).
Prueba de marcha de 6 minLa PM6M se realizó siguiendo las recomendaciones de la ATS30. Para el análisis de los resultados se registraron la desaturación y la distancia total recorrida en metros durante la PM6M.
Obtención y procesado de las muestras de esputo inducidoLa inducción y el procesado del esputo se realizaron siguiendo el método descrito por Pizzichini et al.15, haciendo inhalar al paciente concentraciones crecientes de suero salino hipertónico (3, 4 y 5%). Las muestras de esputo fueron analizadas dentro de las 2h siguientes a su obtención15.
Para el procesado de la muestras de esputo se seleccionaron los tapones de moco, que fueron depositados en un tubo de Eppendorf y pesados. La muestra fue tratada con un volumen de solución fresca de dithiotreitol (DTT) equivalente a 4 veces por cada miligramo de esputo obtenido y se dejó en agitación durante 10 min para su homogenización. Posteriormente se añadió un volumen de PBS equivalente a 4 veces por cada miligramo de esputo, y la muestra fue agitada durante 5 min más. Una pequeña porción (15μl) fue utilizada para realizar el recuento celular total de leucocitos en fresco (en cámara de Neubauer) y determinar la viabilidad celular por el método de exclusión del azul de tripano. El resto de la muestra se centrifugó y se decantó para separar el sobrenadante del sedimento celular. Con el sedimento se obtuvieron preparaciones que fueron teñidas con May-Grünwald-Giemsa para realizar el recuento diferencial contando 500 células no escamosas y expresando el resultado como porcentaje del total de células no escamosas presentes en las muestras. En todas las muestras de esputo se determinó el contenido celular cuantitativo de células totales expresado como células/ml.
Análisis estadísticoLas diferencias entre los grupos estudiados fueron analizadas mediante el test de Kruskal-Wallis. Un valor de p<0,05 fue considerado como significativo. Para evaluar correlaciones entre los subtipos celulares en el EI y los parámetros de función pulmonar se utilizó el coeficiente de correlación de Spearman. Para realizar los diferentes análisis estadísticos se utilizó el programa SPSS (versión 13.0) para Windows (SPSS, Inc, Chicago, IL).
ResultadosDatos demográficos y características basalesEn la tabla 1 se muestran los datos demográficos y las características basales de la población de estudio.
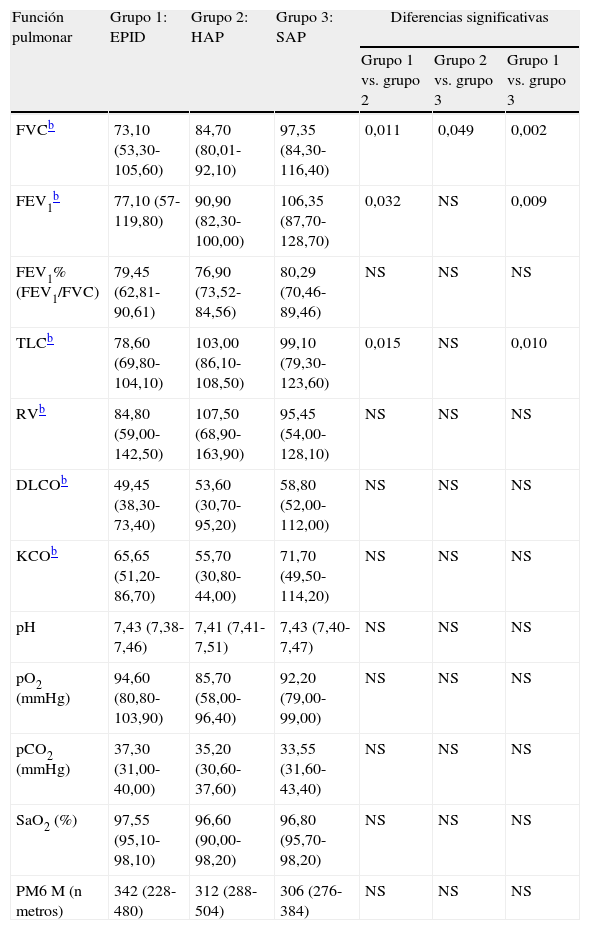
Estudios de función pulmonarEn la tabla 2 se resumen los datos de función pulmonar de los pacientes estudiados. Se encontraron diferencias significativas en los valores de FVC entre los tres grupos de estudio. Los valores de FEV1 fueron también significativamente diferentes entre el grupo 1 y los grupos 2 y 3 (p=0,032 y p=0,009, respectivamente). Además, se obtuvieron diferencias significativas en los valores de TLC entre el grupo 1 y los grupos 2 y 3 (p=0,015 y p=0,010, respectivamente).
Valores de los parámetros estudiados de función pulmonara
| Función pulmonar | Grupo 1: EPID | Grupo 2: HAP | Grupo 3: SAP | Diferencias significativas | ||
| Grupo 1 vs. grupo 2 | Grupo 2 vs. grupo 3 | Grupo 1 vs. grupo 3 | ||||
| FVCb | 73,10 (53,30-105,60) | 84,70 (80,01-92,10) | 97,35 (84,30-116,40) | 0,011 | 0,049 | 0,002 |
| FEV1b | 77,10 (57-119,80) | 90,90 (82,30-100,00) | 106,35 (87,70-128,70) | 0,032 | NS | 0,009 |
| FEV1% (FEV1/FVC) | 79,45 (62,81-90,61) | 76,90 (73,52-84,56) | 80,29 (70,46-89,46) | NS | NS | NS |
| TLCb | 78,60 (69,80-104,10) | 103,00 (86,10-108,50) | 99,10 (79,30-123,60) | 0,015 | NS | 0,010 |
| RVb | 84,80 (59,00-142,50) | 107,50 (68,90-163,90) | 95,45 (54,00-128,10) | NS | NS | NS |
| DLCOb | 49,45 (38,30-73,40) | 53,60 (30,70-95,20) | 58,80 (52,00-112,00) | NS | NS | NS |
| KCOb | 65,65 (51,20-86,70) | 55,70 (30,80-44,00) | 71,70 (49,50-114,20) | NS | NS | NS |
| pH | 7,43 (7,38-7,46) | 7,41 (7,41-7,51) | 7,43 (7,40-7,47) | NS | NS | NS |
| pO2 (mmHg) | 94,60 (80,80-103,90) | 85,70 (58,00-96,40) | 92,20 (79,00-99,00) | NS | NS | NS |
| pCO2 (mmHg) | 37,30 (31,00-40,00) | 35,20 (30,60-37,60) | 33,55 (31,60-43,40) | NS | NS | NS |
| SaO2 (%) | 97,55 (95,10-98,10) | 96,60 (90,00-98,20) | 96,80 (95,70-98,20) | NS | NS | NS |
| PM6M (n metros) | 342 (228-480) | 312 (288-504) | 306 (276-384) | NS | NS | NS |
DLCO: capacidad de difusión del monóxido de carbono; EPID: enfermedad pulmonar intersticial difusa; FEV1: volumen espiratorio forzado en el primer segundo; FEV1%: relación FEV1/FVC expresada como porcentaje; FVC: capacidad vital forzada; HAP: hipertensión arterial pulmonar; KCO: DLCO/volumen alveolar; NS: no significativa; PM6M: prueba de marcha de 6 minutos; RV: volumen residual; SAP: sin afección pulmonar; TLC: capacidad pulmonar total.
Ocho pacientes del grupo 1 mostraron alteraciones ventilatorias: 7 pacientes presentaron un trastorno ventilatorio restrictivo y un paciente mostró un trastorno obstructivo. En los restantes 17 pacientes (2 del grupo 1 y todos los pacientes de los grupos 2 y 3), la espirometría y los resultados de pletismografía fueron normales. Los valores de DLCO fueron inferiores al 80% del valor teórico en todos los pacientes excepto en 3 (uno del grupo 2 y dos del grupo 3), que presentaron valores normales. La distancia total caminada durante la PM6M fue de <300m en 3 pacientes del grupo 1, 2 pacientes del grupo 2 y 3 pacientes del grupo 3. En estos últimos tres pacientes los valores inferiores encontrados en la PM6M se debieron a afección osteomuscular. La pO2 fue <80mmHg en un paciente del grupo 2 y en un paciente del grupo 3.
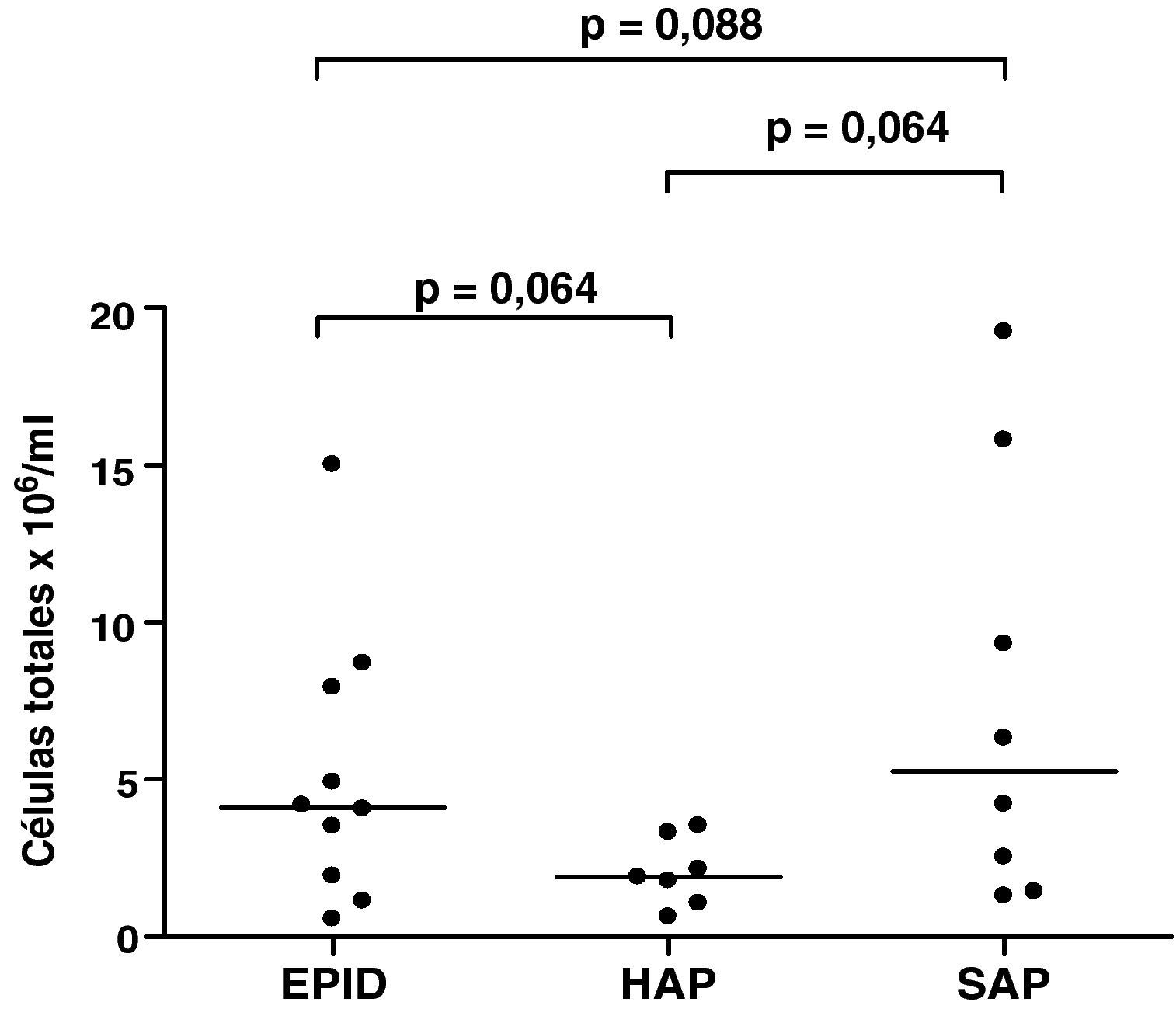
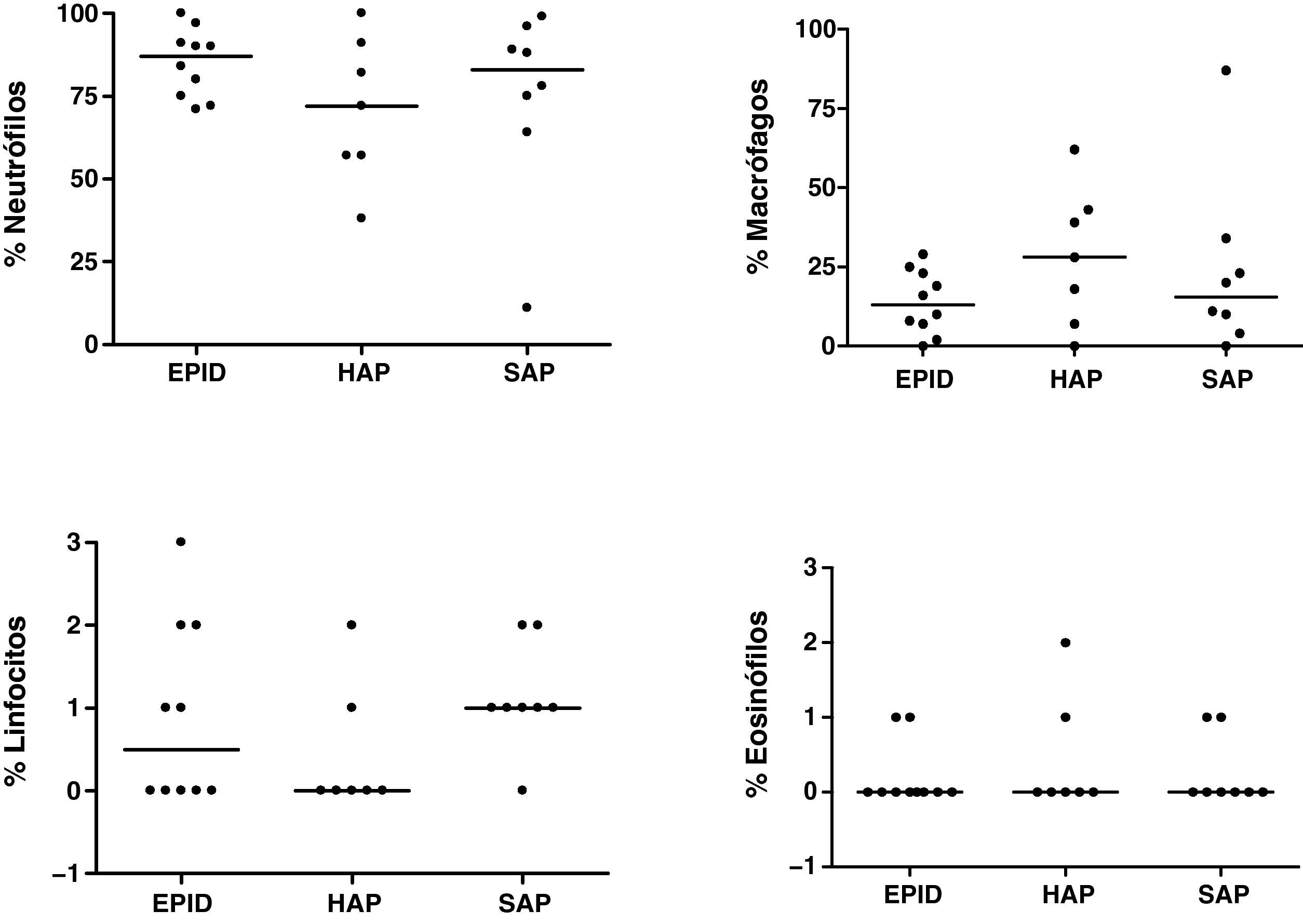
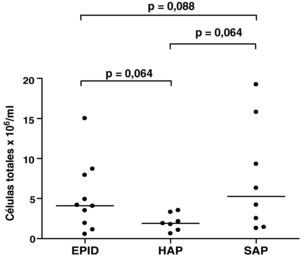
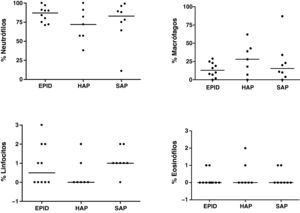
Esputo inducidoEn todos los pacientes la inducción del esputo fue bien tolerada y no se observaron efectos adversos. Las muestras analizadas presentaron un porcentaje medio de viabilidad (rango) de 77% (60-96), del 81% (73-87) y del 80% (64-94) para los grupos 1, 2 y 3, respectivamente. El recuento total y diferencial (%) en el EI de los pacientes estudiados se muestra en las figuras 1 y 2, respectivamente. Se encontraron diferencias en el recuento total de células entre los tres grupos estudiados, aunque no alcanzaron significación estadística (fig. 1). Se encontró una correlación negativa entre el número total de células en el EI y la DLCO en los pacientes con EPID y SAP (r=–0,733, p=0,016; y r=–0,893, p=0,007, respectivamente). Esta correlación negativa no se observó en el grupo de pacientes con HAP. El porcentaje medio de neutrófilos en el EI fue del 85, del 71 y del 75% para los grupos 1, 2 y 3, respectivamente (fig. 2). No se encontraron diferencias significativas en el recuento diferencial entre los tres grupos estudiados.
DiscusiónEl presente estudio evalúa el perfil celular y la utilidad clínica del análisis del EI en pacientes con ES, con y sin afección pulmonar. Asimismo, investiga si los hallazgos obtenidos en el análisis del EI se correlacionan con las alteraciones pulmonares encontradas en esta patología. La observación más relevante del estudio es el elevado porcentaje de neutrófilos encontrado en el esputo de los pacientes con ES, independientemente de que tengan afección pulmonar o no, y la correlación negativa entre el número total de células en el EI y la DLCO en los pacientes con EPID y SAP.
El LBA ha sido utilizado para el diagnóstico precoz de la afección pulmonar en ES. Sin embargo, se trata de una técnica invasiva no adecuada para el seguimiento en el tiempo de la patología. Una alternativa son los análisis citológicos en el EI, ya que se trata de un método no invasivo que permite detectar inflamación pulmonar31,32. Sin embargo, a pesar de que se han utilizado diversos criterios para definir el patrón del LBA en la ES, incluyendo la presencia de eosinofilia, neutrofilia y/o linfocitosis33, estos criterios no han sido definidos para muestras de EI.
En el presente estudio se ha encontrado un elevado porcentaje de neutrófilos en los pacientes con ES en comparación con los individuos sanos34,35. Estos resultados son similares a los obtenidos en dos recientes estudios de Damjanov et al.21 y Vatrella et al.22, que observan un incremento significativo de neutrófilos y un bajo porcentaje de macrófagos en el EI de pacientes con ES y con afección pulmonar. Sin embargo, en el estudio de Yilmaz et al.36 los autores encuentran en el EI un elevado porcentaje de macrófagos y linfocitos y un descenso en el porcentaje de neutrófilos en pacientes con ES. Asimismo, estos autores observan que existe una correlación entre el perfil celular en el EI y en el LBA en los pacientes estudiados. En este sentido existe disparidad entre los datos obtenidos en diferentes estudios, y Damjanov et al.21, así como Fireman y Lerman32, observan que el perfil celular en el LBA no se correlaciona con el obtenido en el EI en los pacientes con ES, concluyendo que no es posible hacer comparaciones entre ambos tipos de muestra. Esta disparidad entre los datos obtenidos en diferentes estudios podría deberse a que el LBA proporciona información sobre la vía aérea distal y los espacios alveolares, que son ricos en macrófagos, mientras que el EI es indicativo de la vía aérea superior y media, que presenta abundantes neutrófilos21,32.
En el presente estudio, el elevado porcentaje de neutrófilos hallado en el grupo de pacientes que no presenta evidencias de afección pulmonar podría sugerir la hipótesis de que tal vez exista un proceso inflamatorio pulmonar subclínico en la ES. De hecho, existen evidencias de que, efectivamente, en los pacientes con ES se produce una inflamación subclínica. En este sentido, Ferri et al.37 encontraron características de EPID en autopsias de pacientes con ES. Sin embargo, la EPID clínicamente significativa se da en menos del 50% de los pacientes con ES. Además, varios autores han observado que los estudios en el LBA presentan generalmente anomalías en pacientes con ES sin afección pulmonar12,14. El significado clínico de esta inflamación subclínica latente, tanto en el LBA como en el EI, no se conoce. En relación con la evolución de la celularidad en el LBA, estudios recientes han demostrado que no predice la subsecuente evolución de la enfermedad, ni la respuesta al tratamiento inmunosupresor10,33. Sin duda, la inflamación pulmonar es la que inicia y mantiene el proceso fibrótico, por lo que el tratamiento con fármacos inmunosupresores es el que está indicado en enfermos con EPID14. Sin embargo, tanto la decisión de iniciar tratamiento como la valoración de la respuesta a este no se realizan en función de la inflamación detectada en el LBA, sino por la repercusión funcional respiratoria y/o la extensión de la EPID detectada en el TACAR. En este sentido, algunos autores han sugerido que en los pacientes con inflamación latente se deberían realizar exámenes radiológicos y espirometrías periódicas, y considerar el inicio de terapia inmunosupresora cuando se observaran alteraciones en estos parámetros10.
Además de la inflamación latente encontrada en las muestras de EI de estos pacientes, la mayoría de ellos (88%) presentan una alteración temprana de la DLCO. A pesar de que los pacientes con EPID y HAP presentan un descenso de la DLCO, esta debería ser menos frecuente en los pacientes con ES sin afección pulmonar38,39. Según diversos autores, existe la posibilidad de encontrar descensos en la DLCO en un 2-40% de los pacientes sin alteración pulmonar40-42, aunque el significado de este descenso también es controvertido en cuanto a su utilidad para predecir la evolución de la enfermedad hacia EPID o HAP. En la mayor serie publicada hasta la fecha, que incluye 152 pacientes con alteraciones de la difusión y sin afección pulmonar, el 27% de los casos desarrollan EPID leve durante el seguimiento, con valores de FVC entre el 70 y el 80% del valor esperado, y el 7% desarrollan HAP38. En la presente serie se observan descensos de la difusión en todos los pacientes con EPID, en todos los pacientes con HAP excepto en uno de ellos, y en 6 de los 8 pacientes del grupo SAP. En este último grupo de pacientes existen varios factores que podrían explicar este descenso de la DLCO. El tabaco es una causa potencial, pero solo uno de los pacientes con ES y SAP era fumador. La anemia puede también contribuir al descenso de la DLCO26, pero ninguno de los pacientes de este grupo mostró valores anormales de hemoglobina. A pesar de que es mucho menos probable, no podemos excluir un posible incremento del CO endógeno, que ha sido observado en condiciones que implican un elevado metabolismo, como la ES, o en las alteraciones de la microcirculación pulmonar, también presentes en esta patología43. En este sentido, considerando la inflamación pulmonar latente observada en el grupo de pacientes sin afección pulmonar, es posible que el descenso de la DLCO esté relacionado con este factor. La correlación inversa hallada entre el número de células totales en las muestras de EI y los valores de DLCO apoyan esta idea. Esta hipótesis se ve reforzada por el hecho de que esta correlación fue también encontrada en el grupo de pacientes con EPID, pero no en los pacientes con HAP, que además mostraron menor (aunque no significativo) número de células totales (fig. 1). Algunos autores han sugerido que un descenso de la difusión por debajo del 50% del valor teórico o un cociente FVC/DLCO mayor de 1,4 podría indicar progresión hacia HAP y un peor pronóstico38,39. En el presente estudio, ninguno de los pacientes del grupo SAP tenía un descenso de la difusión por debajo del 50% del valor teórico. Este hecho, junto con los valores de celularidad en el EI, podría sugerir que los enfermos con DLCO baja y un aumento de neutrófilos en el EI presentan un riesgo mayor de progresión hacia EPID más que hacia una afección vascular.
El estudio presenta algunas limitaciones, como el escaso número de pacientes, que hacen necesarios futuros estudios con un mayor tamaño muestral para confirmar estas hipótesis. Además, no se dispone de grupo control. Sin embargo, diversos estudios han investigado los valores normales de celularidad en el EI, por lo que estos resultados pueden ser utilizados para realizar comparaciones35,44, como se ha hecho en el presente estudio. Otra limitación es el hecho de no disponer de seguimiento de los pacientes con ES sin afección pulmonar, lo que hace que la relación entre el incremento de neutrófilos en el EI y el descenso de la DLCO sea discutible.
En conclusión, en el presente estudio se observa inflamación pulmonar en todos los pacientes con ES, independientemente de la presencia o no de afección pulmonar. Este hallazgo sugiere que el EI podría ser útil para detectar de forma precoz una afección pulmonar subclínica en los pacientes con ES. Además, el análisis del EI podría ser útil como herramienta para diferenciar entre los pacientes con ES con valores descendidos de DLCO e inflamación neutrofílica en el EI cuya progresión podría ser hacia EPID, y aquellos con un recuento celular diferencial normal en el EI cuya progresión podría ser hacia HAP. Son necesarios futuros estudios de seguimiento, con un mayor número de pacientes, para confirmar los hallazgos del presente estudio y definir con mayor exactitud el papel del EI en esta patología.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.